Steatosi Epatica non Alcolica
Descrizione istopatologica e ultrastrutturale
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica dell'Università della Campania "Luigi Vanvitelli"
La steatosi epatica è data da un accumulo di trigliceridi e di esteri di colesterolo nel citoplasma degli epatociti, depositati per un eccessivo o un anormale metabolismo (Expert Rev. Mol. Med. 2016; 18:e14).
La etiopatogenesi della steatosi epatica non alcolica (NAFLD: Nonalcoholic Fatty Liver Disease) è indotta da numerosi fattori, spesso tra loro interattivi; tra questi sono da segnalare la dieta, l’obesità, le dislipidemie, l’insulina resistenza, la epatite cronica da virus C, la nutrizione parenterale totale, le complicanze di interventi chirurgici su il pancreas e sul tenue,raramente nella gravidanza, un eccesso di lipolisi del tessuto adiposo e di altri depositi di grasso oppure a nuovi processi di lipogenesi (J. Clin. Invest. 2005; 115: 1343-1351) (Obes. Surg. 2009; 19: 608-616) (World J. Gastroenterol. 2016;22(4):1664-1673). ).
Al di là dei fattori causali dianzi ricordati, l’accumulo di lipidi negli epatociti è la risultante delle seguenti alterazioni metaboliche:
- - Decremento della beta-ossidazione degli acidi grassi
- - Un incremento della sintesi degli acidi grassi
- - Un incremento della lipolisi da mobilizzazione degli acidi grassi dal tessuto adiposo o da altri organi
- - Inibizione di VLDL (Very low-density lipoprotein). (Free Radic Biol. Med. 2008; 44(7): 1259-1272).
Al microscopio luce la steatosi epatica viene distinta in forma micro-vescicolare, macro-vescicolare e mista. Tale distinzione è basata su il diametro delle vescicole e su le alterazioni che gli epatociti subiscono in tale evento morfologico.
Il danno maggiore si rileva nei casi di steatosi macro-vescicolare per la presenza di una sola vescicola occupante l’intera area citoplasmatica con il nucleo spostato alla periferia, a ridosso della membrana citoplasmatica. Il progressivo aumento volumetrico di questi depositi lipidici può provocare la rottura della membrana citoplasmatica dell’epatocita e reiezione del contenuto negli spazi interstiziali. Tali eventi attivano una risposta flogistica reattiva con partecipazione anche di macrofagi e di fibroblasti con capacità evolutive verso la formazione di tralci fibrillari e di lipogranulomi.
Commisti ad epatociti steatosici si repertano altri elementi affetti da degenerazione balloniforme. Gli epatociti in tal modo coinvolti appaiono molto voluminosi, hanno forma globosa e un ampio citoplasma iperchiaro, quasi diafano, il quale contiene scarso materiale amorfo e filamentoso. Questo reperto morfopatologico è dovuto ad alterazioni del citoscheletro e in particolare alla frammentazione della citocheratina 8 e 18. (Pathology 2001; 223: 388-398) (Human Pathol. 2004; 35: 196-199).
La distinzione morfologica riguardante il diametro delle vescicole steatosiche non rimane fine a se stessa, ma è correlata ai meccanismi etiopatogenetici che hanno attivato tale processo degenerativo; a tale fine sono state elaborati elenchi nei quali si rapporta il diametro delle vescicole steatosiche a quadri morbosi e ai loro fattori scatenanti (G.C. KANEL Pathology of liver Diseases, Wiley,2017).
Da quanto è codificato in letteratura, i reperti morfologici non consentono una diagnosi differenziale tra la steatosi-steatoepatite da cause non alcoliche da quelle alcoliche; per pervenire a una diagnosi di certezza è necessario avvalersi anche dei dati clinico-anamnestici e degli accertamenti metabolici (Mitchell e Szabo in Schiff’s Diseaser of the Liver,Wiley Blackwell,2018) (Tiniakos,Anstee,Burt in MacSween’s Pathology of the Liver Elsevier 2018).
La NAFLD è nel maggior numero dei casi di tipo macrovescicolare con focolai presenti in prevalenza nella zona 3 o nelle zone 2 e 3; nelle forme gravi il danno steatosico acquisisce caratteri estesi all’intero lobulo convenzionale.
La esistenza di NAFLD caratterizzata solo da micro vescicole negli epatociti è stata valutata come variante severa e progressiva verso la steatoepatite (J Hepatology 2011;55:654-659).
La NAFLD si presenta al microscopio luce quale processo patologico circoscritto agli epatociti, senza coinvolgimenti delle strutture mesenchimali,vascolari,e senza la partecipazione di elementi della flogosi; l’assenza di queste modificazioni consentono una agevole diagnosi differenziale dalla steatoepatite .
Tuttavia, in diversi casi di NAFLD si evidenziano lesioni aggiuntive quali una lieve flogosi a livello degli spazi portali, la presenza di infiltrati linfocitari attorno agli epatociti steatosici, una attivazione delle cellule di Kupffer,la formazione di micro-lipogranulomi,la comparsa di epatociti balloniformi; questi reperti non consentono di modificare la diagnosi di steatosi semplice, ma devono essere considerati come dati indicativi di un processo progressivo evolvente verso la steatoepatite (Gastroenterology 1999;116:1413-1419) (J.Hepatology 2013;59:550-556).
Al microscopio elettronico, si osservano nel citosol degli epatociti gocce lipidiche di varie dimensioni a contatto con gli organelli, i quali appaiono in vario grado modificati e danneggiati. Tali reperti riguardano principalmente il reticolo endoplasmico e i mitocondri.
Il reticolo endoplasmico per azioni di lipotossicità mostra i caratteri dell’ER-stress con dilatazione delle cisterne ergastoplasmiche ricolme di materiale amorfo, frammentazione delle membrane e una loro disposizione disordinata nel citosol (Prog. Lipid. Res. 2013; 52: 165-174).
I mitocondri sul piano morfologico sono aumentati di volume e spesso acquistano i caratteri dei megamitocondri, e quasi sempre sono privi di creste,contengono inclusioni paracristalline o membrane multi- lamellari.
A queste alterazioni, si associano molteplici disfunzioni tra le quali si riportano un aumento del ROS (Reactive oxygen species), diverse alterazioni con riduzione e mutazione del DNA mitocondriale, alcune modificazioni con decremento della beta-ossidazione, una riduzione dei processi di fosforilazione ossidativa, e una riduzione della capacità respiratoria (JAMA1999;282:1659-1664) (Hepatology 2003; 38: 999-1007) (J. Hepatology 2005; 42: 928-940) (World J. Gastroenterol 2008; 14: 193-199) (Alcohol Clin.Exp.Res.2007;31:554-560)(Liver Int.2012;32(7):1079-1092).
I lipidi non sono distribuiti nel citosol come singole molecole, ma si ritrovano ad essere aggregati in modo da formare gocce lipidiche (lipid droplets). Ciascuna goccia è costituita da gruppi di molecole di trigliceridi ed esteri di colesterolo avvolte da un monostrato di fosfolipidi (J. Biol. Chem. 2012; 287: 2273-2279) (Exp. Cell. Res 2016; 340(2): 187-192).
Queste gocce lipidiche si formano nelle cisterne del reticolo endoplasmico mediante enzimi finalizzati alla loro formazione e dopo una fase di maturazione si staccano dal reticolo endoplasmico e si riversano nel citosol (Ann. Rev. Cell. Dev. Biol. 2017; 33: 491-510) (Int Rev. Cell Mol. Biol. 2018; 337: 83-110).
La loro integrità è protetta da proteine che le avviluppano e tra queste sono particolarmente importanti le perilipine (indicate con un numero progressivo da 1 a 5) e le FSP27 e HJG2 (J. Physiol Biochem 2011; 67(4): 629-636).
Queste gocce sono considerate organelli con un proprio ciclo biologico; hanno un inizio biogenetico nelle cisterne del reticolo endoplasmico, una fase di maturazione ,e infine la fase finale della lipolisi (Curr. Opin. Cell. Biol. 2015; 33: 119-124).
Le gocce lipidiche sono a contatto con gli organelli intra-citoplasmatici con i quali avvengono scambi molecolari; questi scambi sono funzionali soprattutto con i mitocondri regolando il passaggio di molecole di lipidi ai mitocondri a livello dei quali si ha la beta-ossidazione degli acidi grassi. (Trend Endocrinol. Metab. 2011; 22: 197-203)(Curr Opin Cell Biol 2015; 35: 91-97).
Queste gocce lipidiche sono dinamiche, si modificano attraverso processi di fissione e soprattutto di fusione; in questo seconda possibilità, per fusione tra gocce contigue si costituiscono aggregati molto voluminosi che comprimono gli organelli intracitoplasmatici e dissociano la trama filamentosa del citoscheletro. (Biochem. Biophys. Acta 2017; 1862: 1197-1204)(Int Rev. Cell. Mol. Biol. 2018; 337: 83-110).
La presenza di numerose gocce lipidiche nel citoplasma degli epatociti determinano la perdita della omeostasi cellulare, innescano disequilibri metabolici, possono essere causa di stress ossidativo, e provocare la morte cellulare (Am. J. Physiol. Gastrointest. Liver Physiol. 2006; 290: G852-G858). (J. Clin Endocrinol Metab. 2015; 100: 304-337) (Sem. Liver. Dis. 2019; 39(3): 283-290).).
Il processo di lipolisi si realizza attraverso due percorsi, tra loro complementari; uno si avvale del meccanismo enzimatico delle lipasi, l’altro utilizza il processo biologico dell’autofagia. (Autophagy, 2009; 5: 866-867) (Nature; 2009; 458: 1131-1135).
Il primo,indicato con il termine di lipolisi, avviene mediante le lipasi che inducono la lisi dei trigliceridi in acidi grassi liberi e glicerolo (Biochem. Biophys Acta 2000; 1483: 37-57).
Il secondo, denominato lipofagia, si svolge mediante i meccanismi dell’autofagia selettiva; in tale processo le gocce lipidiche sono identificate come substrato e sono sottoposte alla degradazione lisosomiale; i focolai di autofagia si attivano a seconda delle necessità metaboliche delle cellule o delle quantità di gocce lipidiche presenti nel citosol (Cell Death Differ. 2013; 20(1): 3-11) (Ann Rev. Nutr. 2015; 35: 215-237).
La diagnostica della steatosi epatica si avvale anche di valutazioni semiquantitative degli epatociti danneggiati; in letteratura viene riportata la suddivisione delle steatosi in lieve,moderata e severa mediante il numero degli epatociti cinvolti:
Steatosi grado 0: da 0 a 5 epatociti interessati
Steatosi grado 1: da 5 al 33% di epatociti interessati
Steatosi grado 2: da 33 al 66 % di epatociti interessati
Steatosi grado 3: oltre il 66% di epatociti interessati (World J. Gastroenterol 2016; 22(4): 1664-1673).
La steatosi di grado 3 è data dal coinvolgimento in modo diffuso dell’intero lobulo epatico convenzionale e spesso è associata a piccoli foci di flogosi a livello portale o perivenulare con eventuale co-presenza di micro lipogranulomi. (World J. Gastroenterol 2010; 16(42): 5286-5296).
REPERTI
I reperti presi in esame si riferiscono a casi di steatosi semplice non indotta da alcol (NALFD); le descrizioni riportate sono state elaborate su materiale osservato al microscopio luce e al microscopio elettronico a trasmissione.
Nelle forme gravi, qui di seguito documentate, la steatosi si manifesta in modo diffuso ed è caratterizzata soprattutto da grosse vescicole. In tali reperti, gli epatociti sono globosi, mostrano un citoplasma occupato da una unica grossa vescicola ed evidenziano un nucleo marginato a ridosso della membrana cellulare.
Fig.1 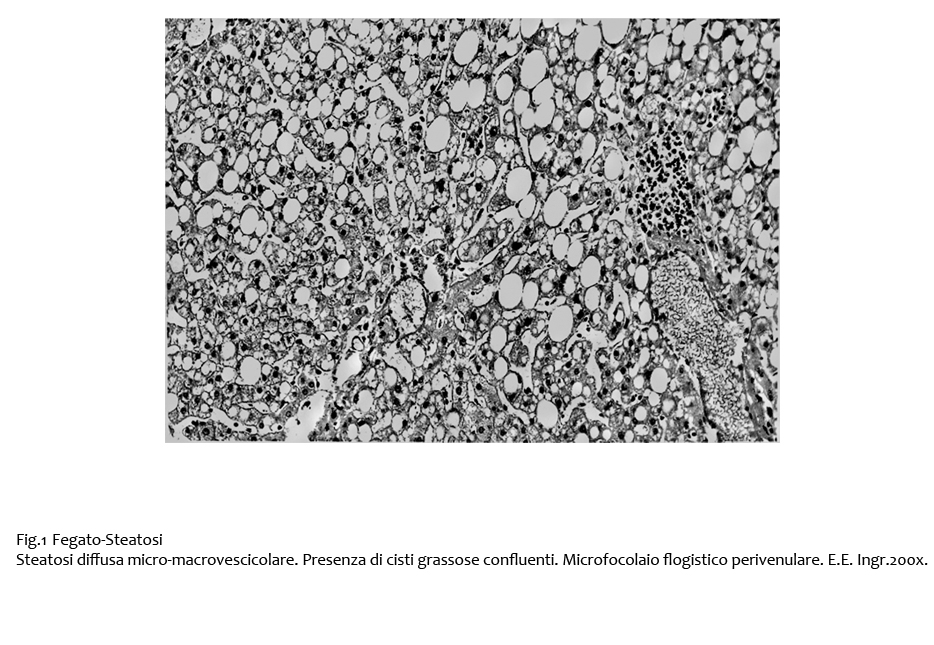
Per un progressivo accrescimento delle macrovescicole si ha rottura della membrana cellulare degli epatociti e sversamento del contenuto lipidico negli spazi interstiziali; contestualmente si ha una riduzione del letto sinusoidale. Presenza di elementi della flogosi a contatto con macrovescicole e cisti.
Fig.2  Fig.3
Fig.3 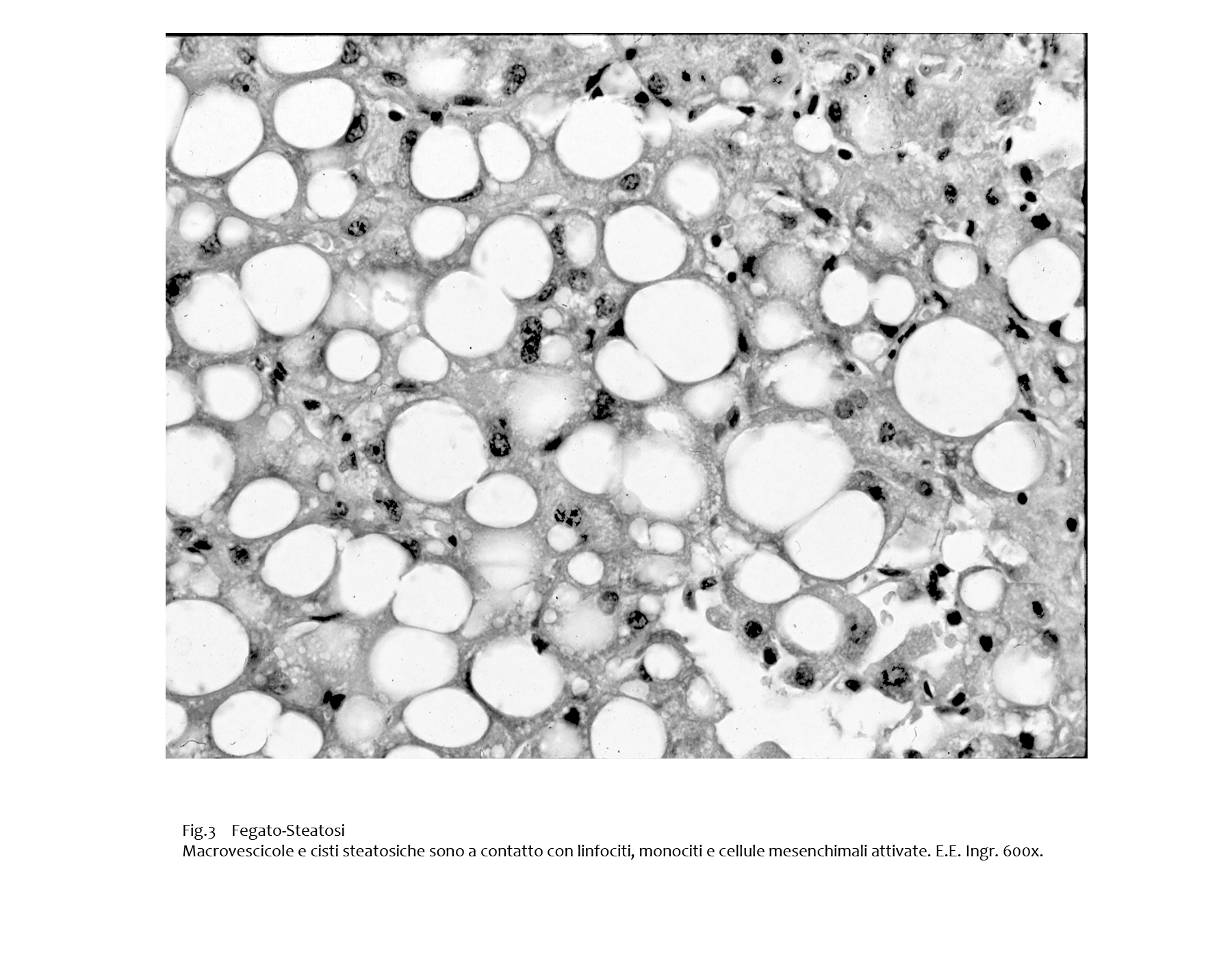
Maggiori dettagli possono essere acquisiti se si effettuano osservazioni su sezioni semifini di campioni fissati con osmio. In tali casi, gli epatociti steatosici mostrano un citoplasma compatto, omogeneo, debolmente osmiofilo, quale espressione del materiale lipidico.
Fig.4 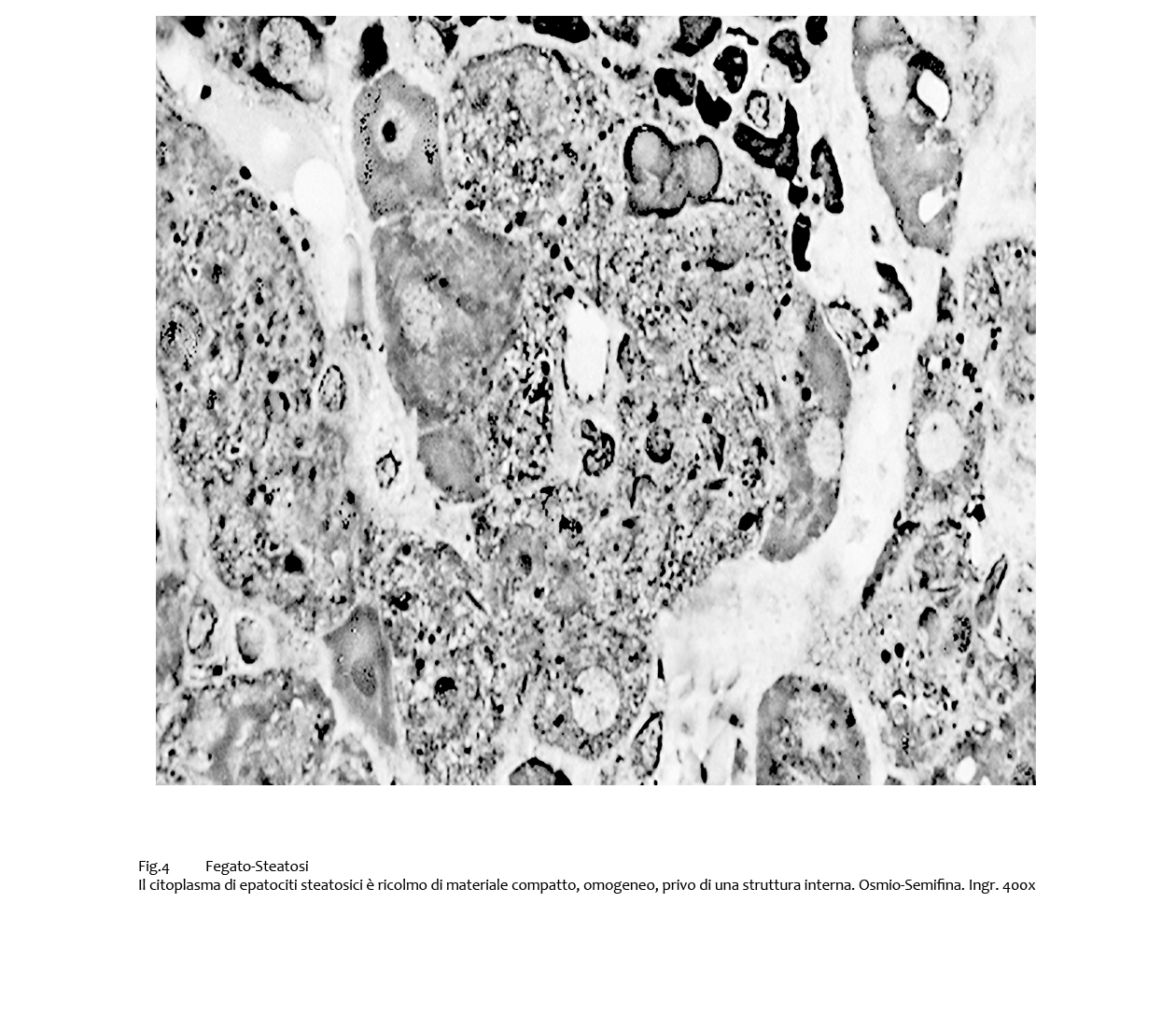
Nei casi in cui gli epatociti sono disposti in modo pluristratificato per processi iperplastico-proliferativi, l’aumentata volumetria degli epatociti da steatosi riduce ulteriormente il letto sinusoidale e provoca una iperplasia delle cellule di Kupffer e delle cellule stellate.
Fig.5 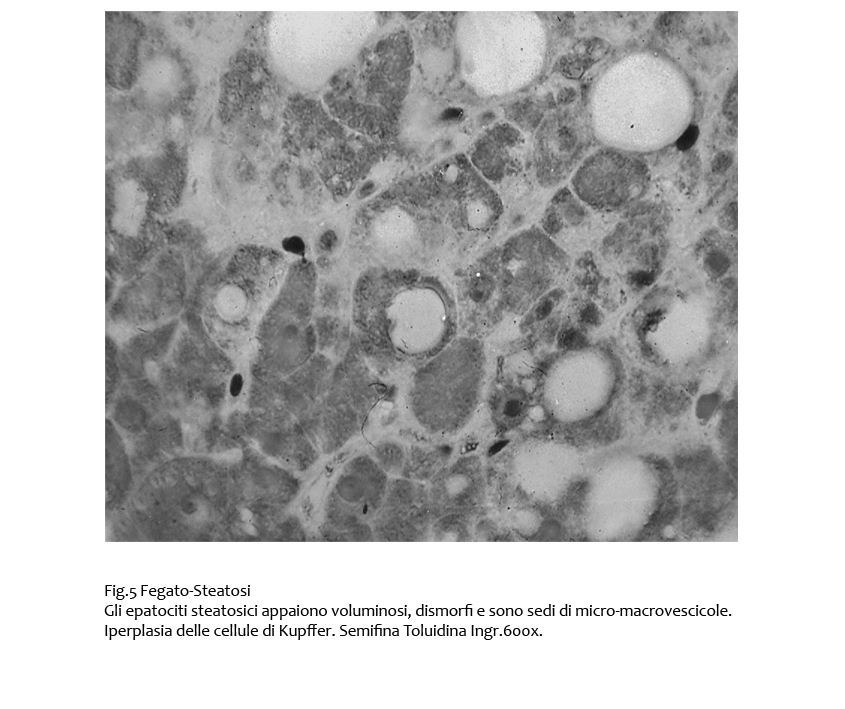 Fig.6
Fig.6 
Le aree di iperplasia sono caratterizzate anche da epatoci con citoplasma globalmente vacuolizzato.
Fig.7 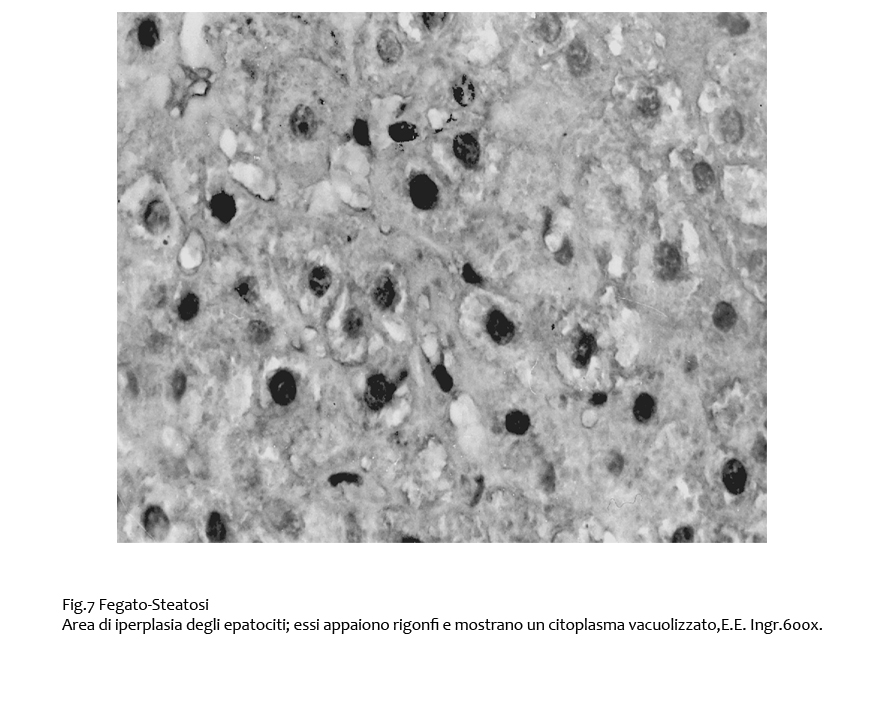
Frequentemente il processo di steatosi si associa a microfocolai di degenerazione balloniforme degli epatociti; questi appaiono aumentati di volume, hanno forma globosa e sono forniti di un ampio citoplasma iperchiaro contenente un nucleo in posizione centrale e numerosi filamenti disposti in modo disordinato e spesso frammentato.
Fig.8 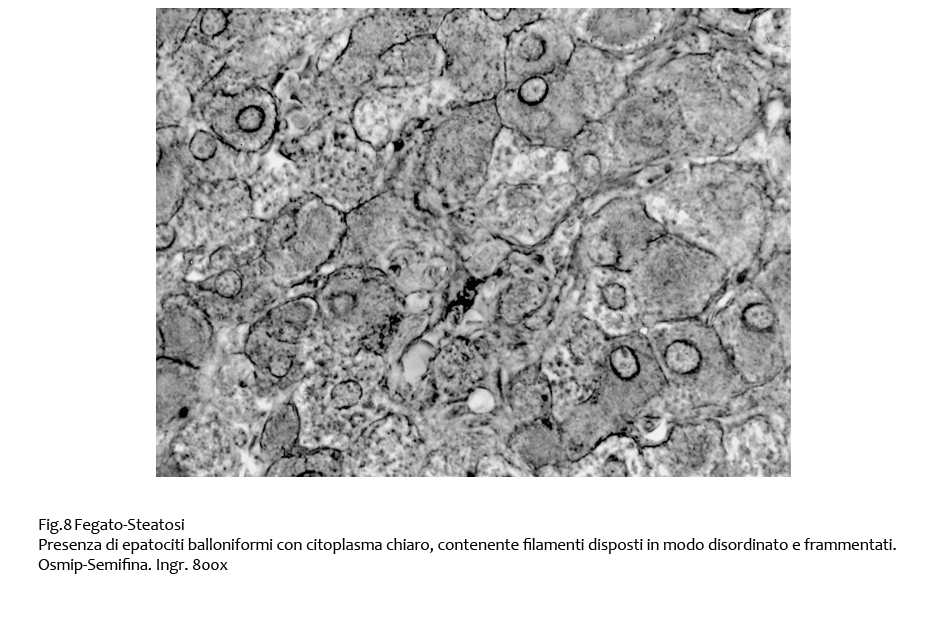
I cumuli di materiale lipidico raccolto nel citosol inducono una risposta infiammatoria espressa da mononucleati che si raccolgono attorno a tali focolai; questa risposta rappresenta l’inizio dei complessi processi che caratterizzano il passaggio dalla semplice steatosi alla steatoepatite.
Fig.9 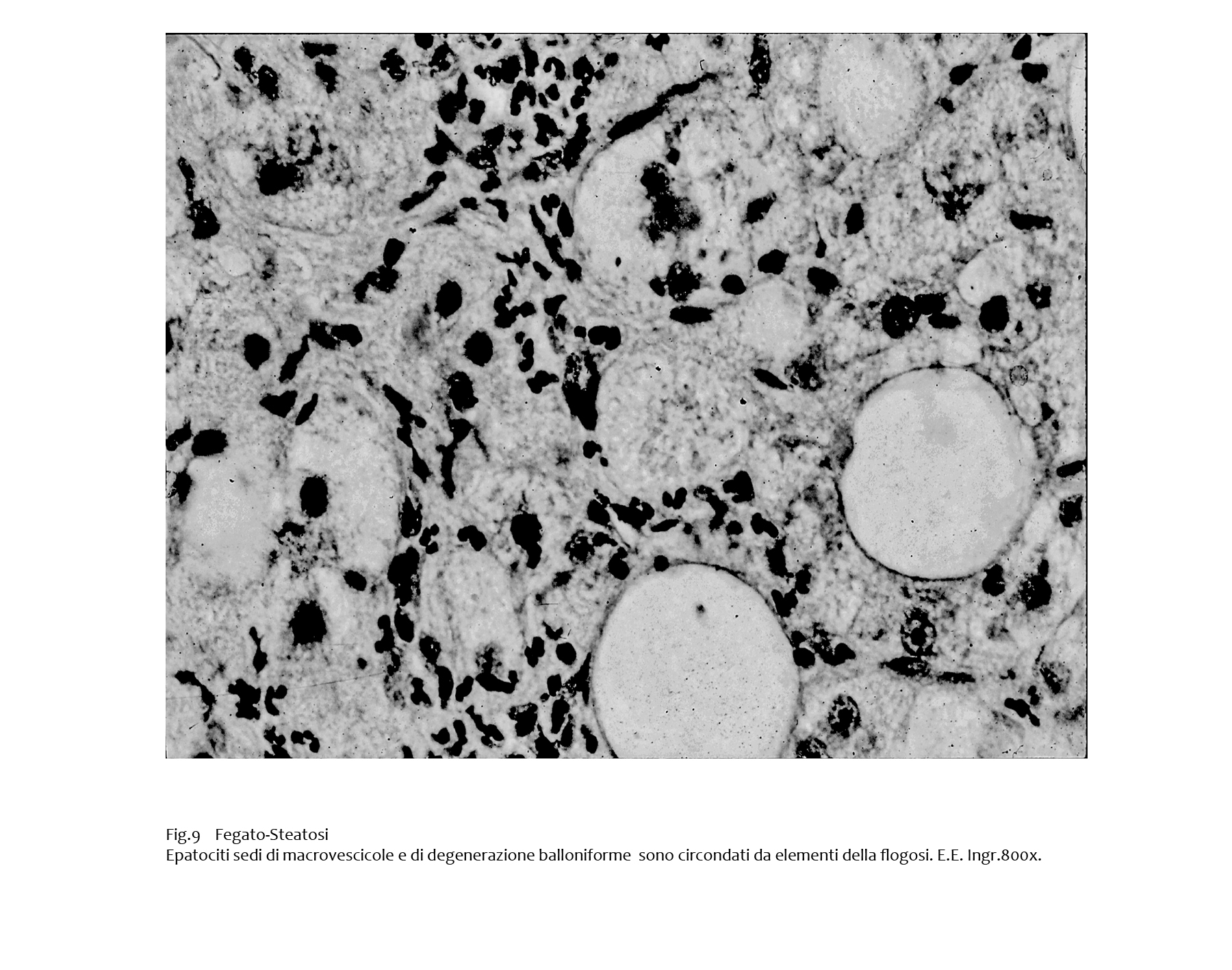
Al microscopio elettronico gli epatociti steatosici mostrano, su un fondo occupato in modo diffuso fa gocce lipidiche e vescicole tra loro confluenti, alterazioni dei mitocondri, dell’ergastoplasma, del citoscheletro e presenza di focolai di autofagia.
In molti epatociti il citoplasma è occupato da quote elevate di materiale lipidico con notevole riduzioni degli organelli intracitoplasmatici rappresentati da pochi mitocondri vacuolizzati o in lisi, e da frammenti di reticolo endoplasmico.
Fig.10 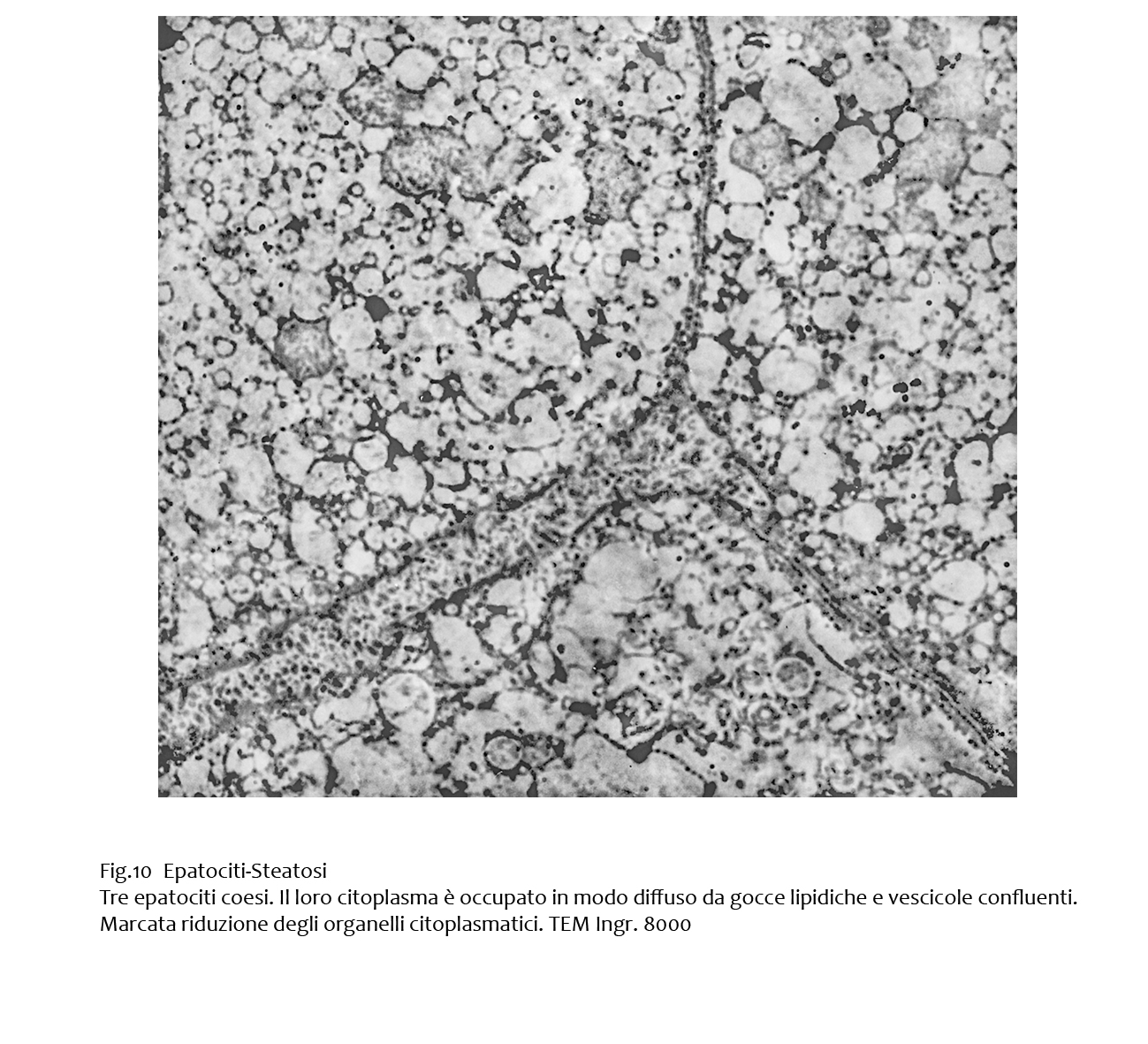
In epatociti con steatosi meno grave si repertano mitocondri ancora conservati ma aumentati di volume e privi di creste; essi sono a mutuo contatto con un elevato numero di macro e microvescicole.
Fig.11 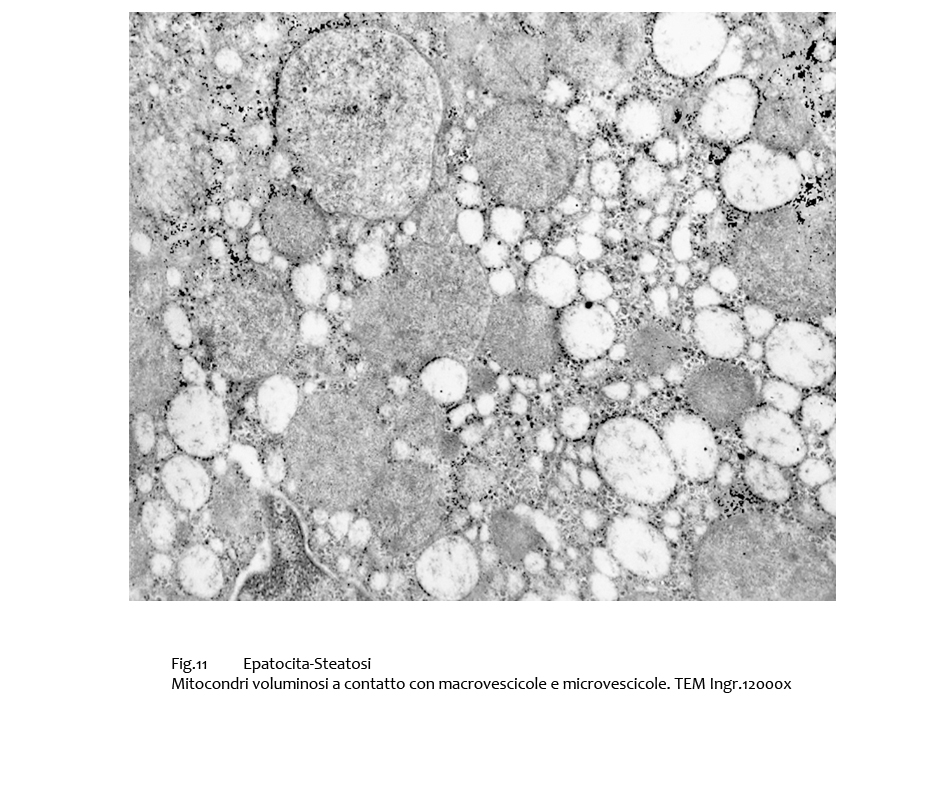 Fig.11bis
Fig.11bis 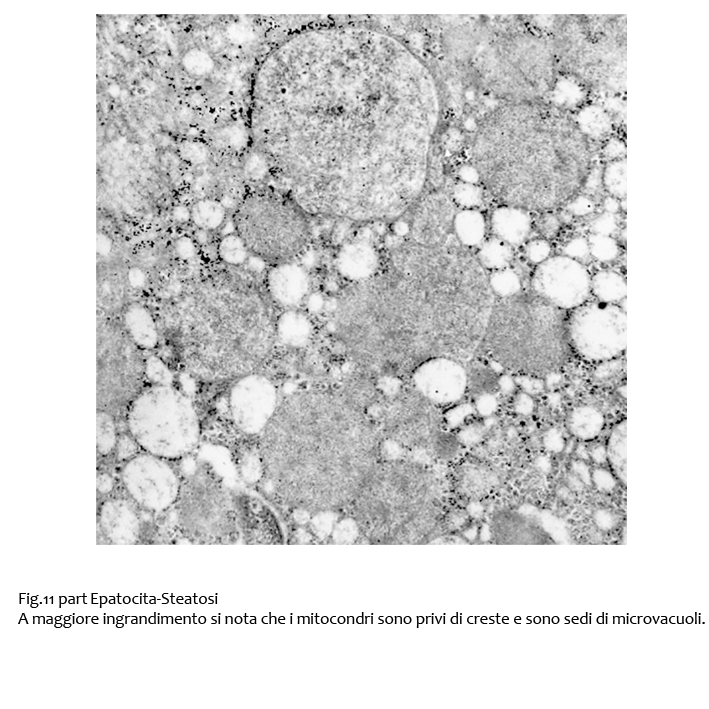
Non mancano epatociti destrutturati con ampie lacune del citosol occupate da materiale amorfo associate a pochi mitocondri e a frammenti di reticolo endoplasmico.
Fig.12 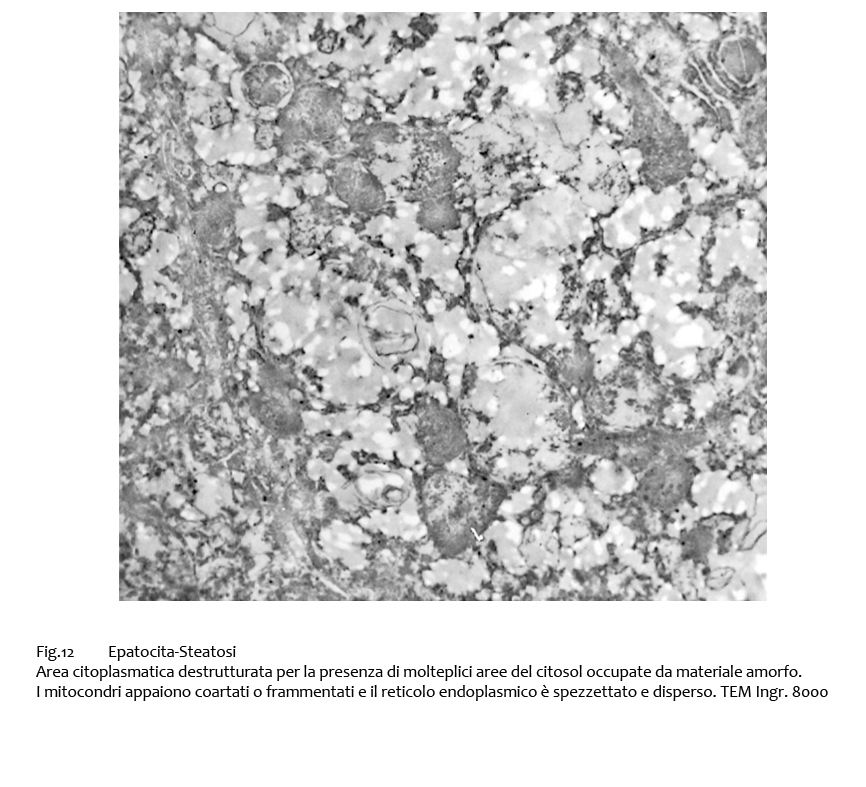
L’ergastoplasma è gravemente compromesso nei processi di steatosi; esso appare con cisterne dilatate, oppure è ridotto a frammenti dispersi nel citosol; a fronte di questi processi regressivi è possibile repertare foci costituiti da sottili lamine parallele, riferibili ad ergastoplasma in formazione; tali reperti si associano alla presenza di mitocondri coartati e destrutturati.
Fig.13 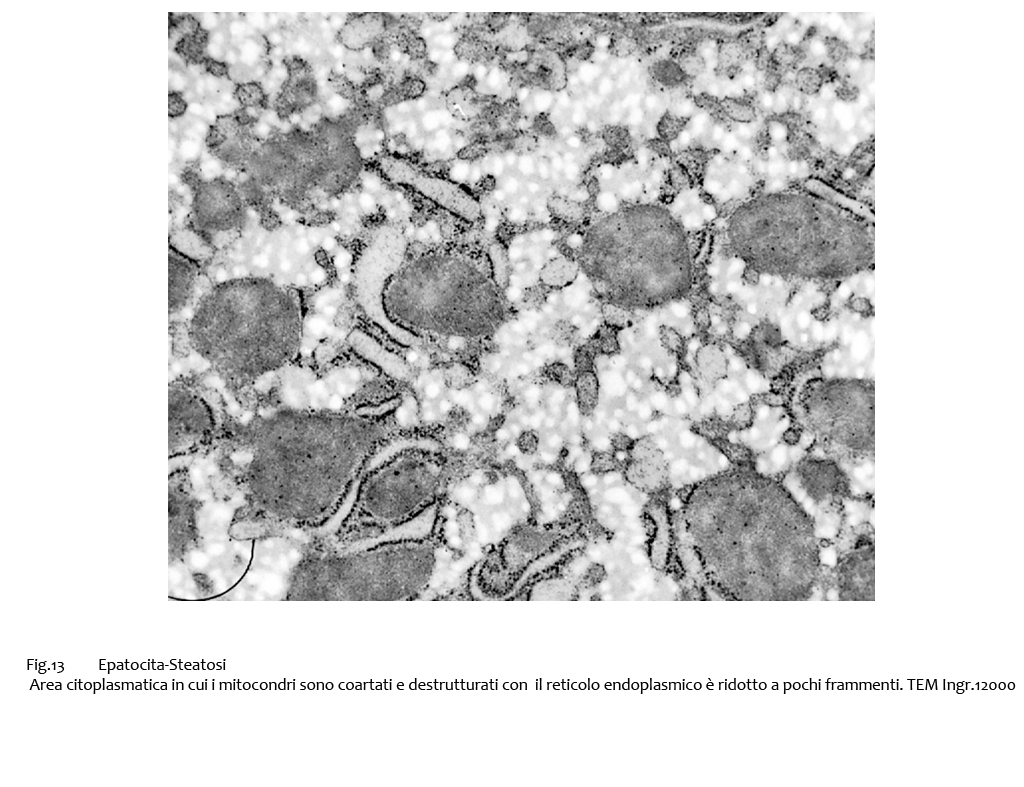 Fig.14
Fig.14 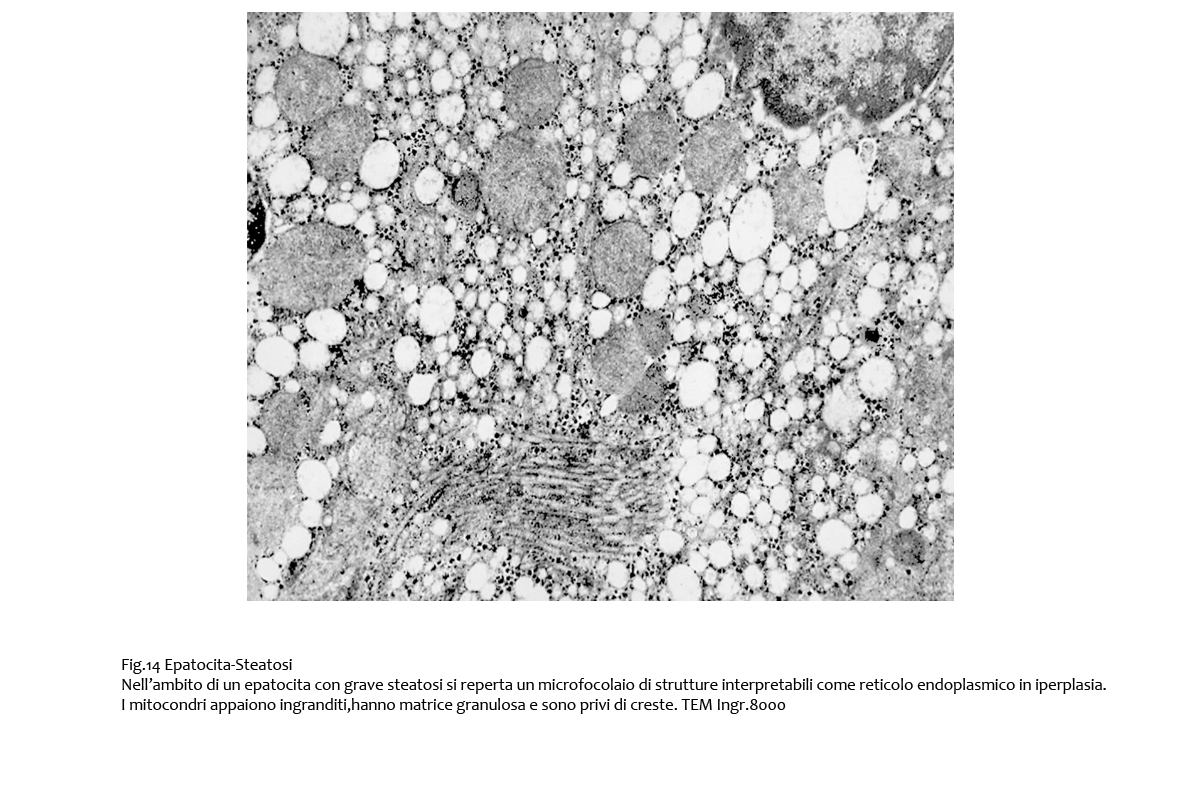 Fig.14bis
Fig.14bis 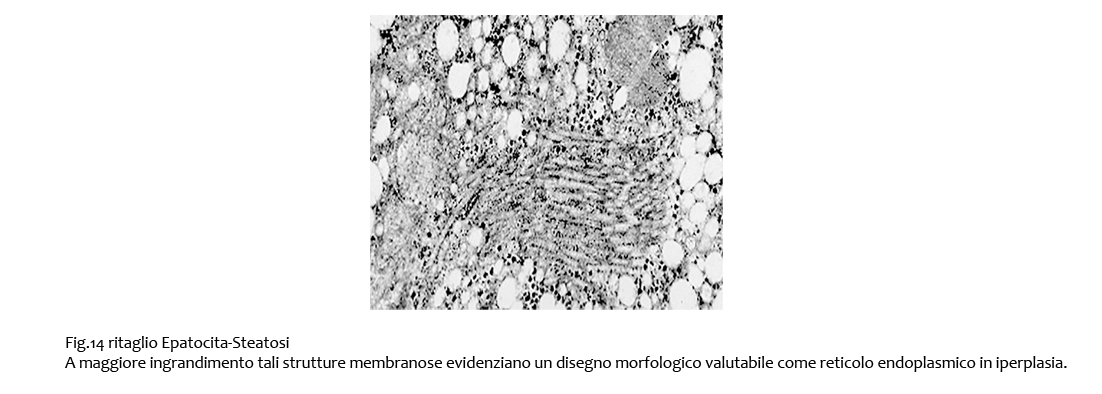
Frequentemente, gli epatociti steatosici sono solcati a tutto campo da fibrille; queste si presentano come substrutture singole e ramificate o come filamenti riuniti in fascetti di diverso spessore.
Fig.15 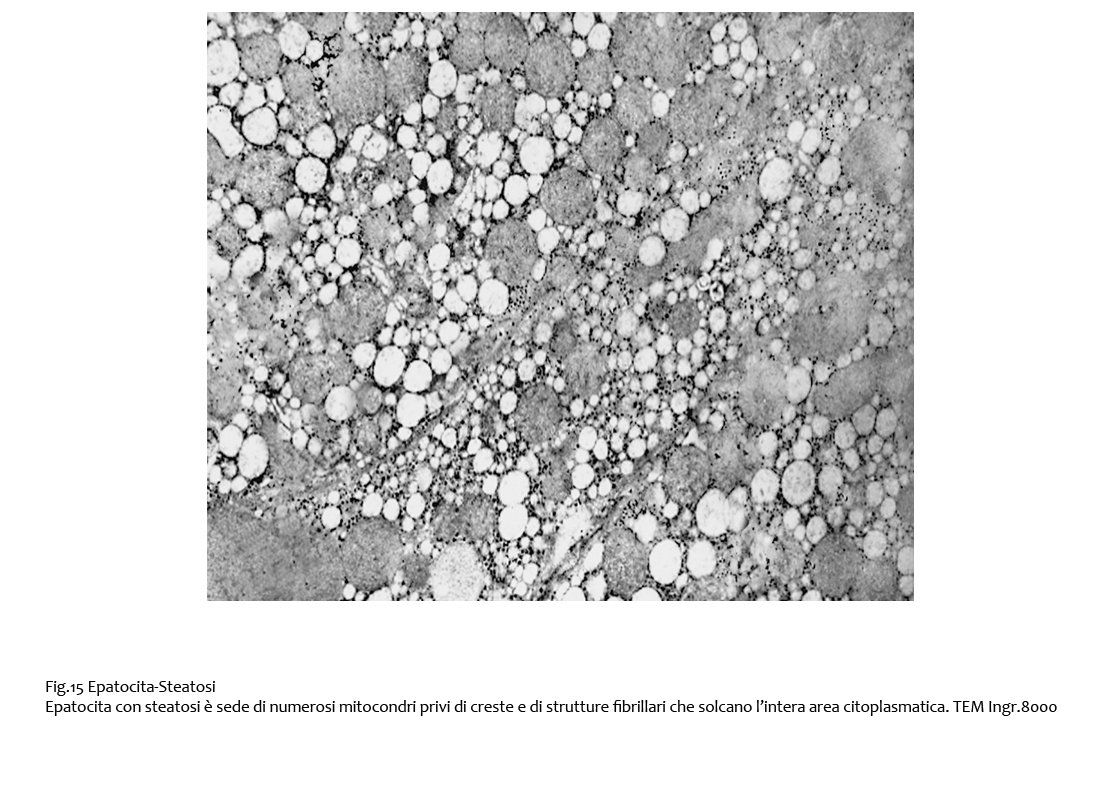 Fig.16
Fig.16 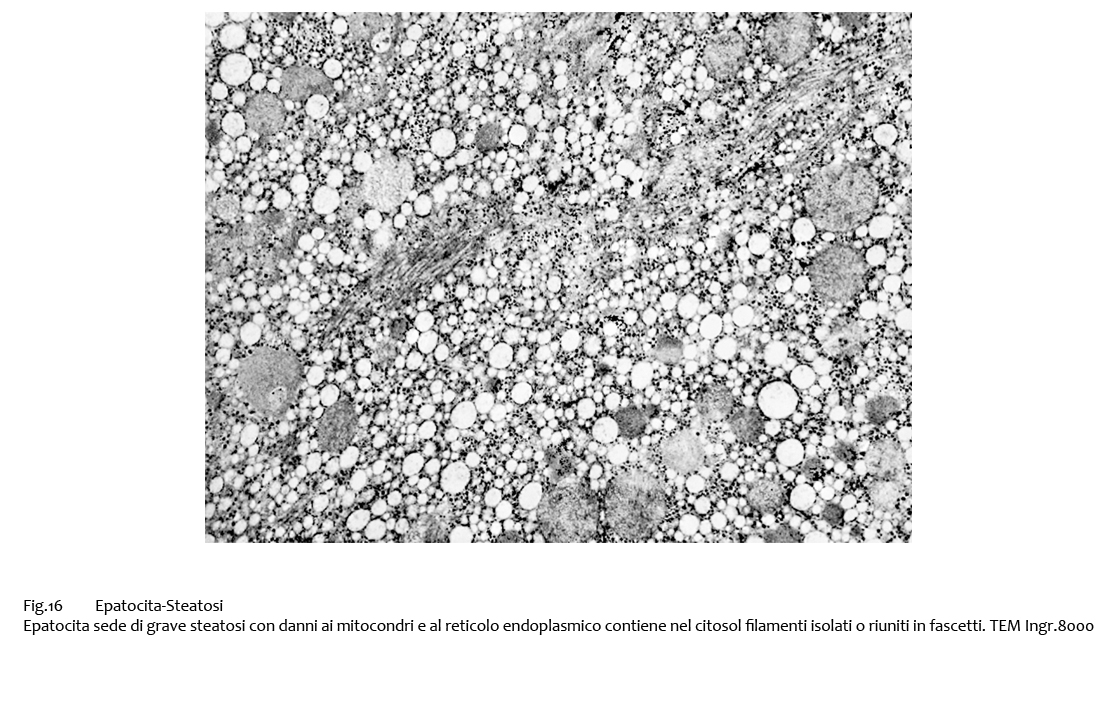 Fig.16bis
Fig.16bis 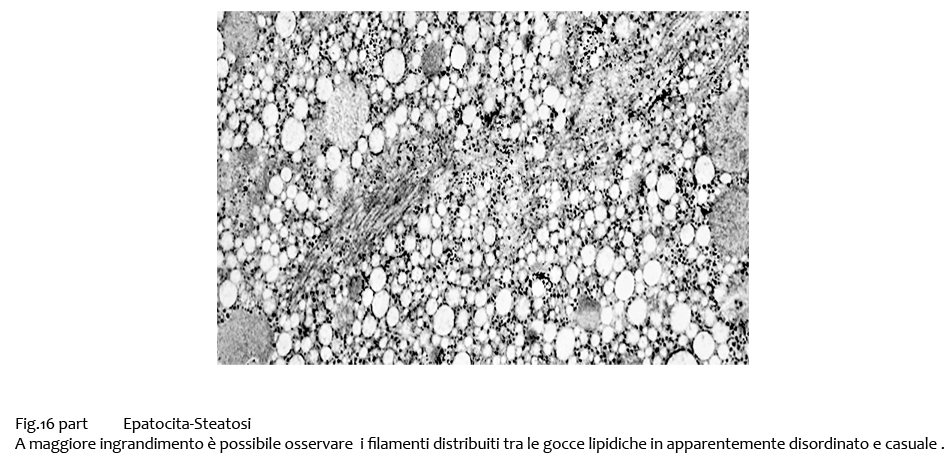
Fasci di fibrille di maggiore spessore sono evidenziabili lungo la fascia periferica degli epatociti, a ridosso della membrana citoplasmatica. In alcuni campi queste substrutture si ramificano proiettandosi nelle zone interne del citosplasma; esse appaiono ispessite, compatte, omogenee; nel loro contesto si evidenziano microvacuoli e materiale granuloso.
Fig.17 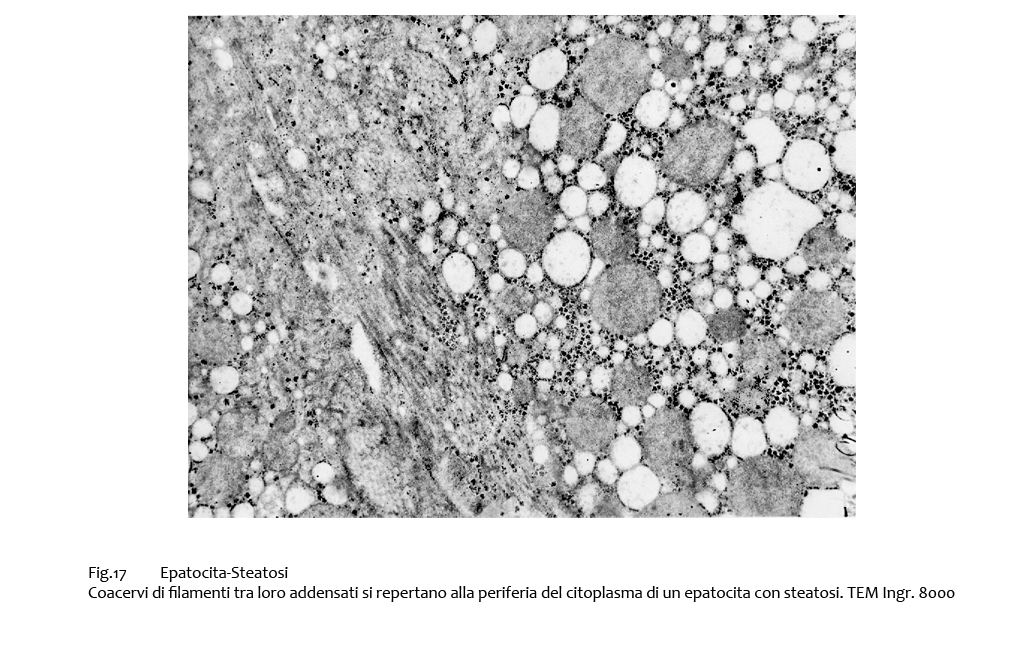 Fig.17bis
Fig.17bis 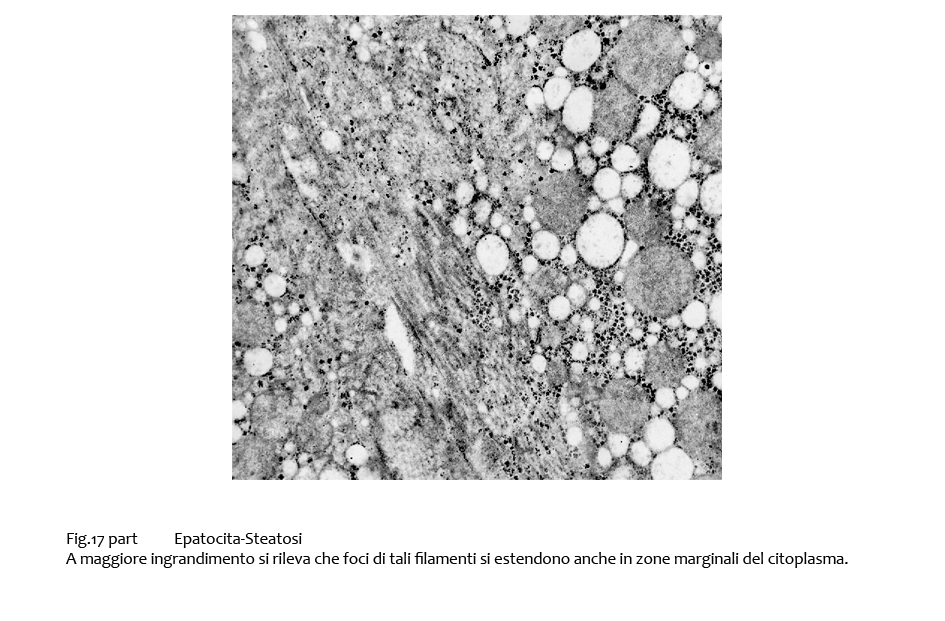
Fig.18 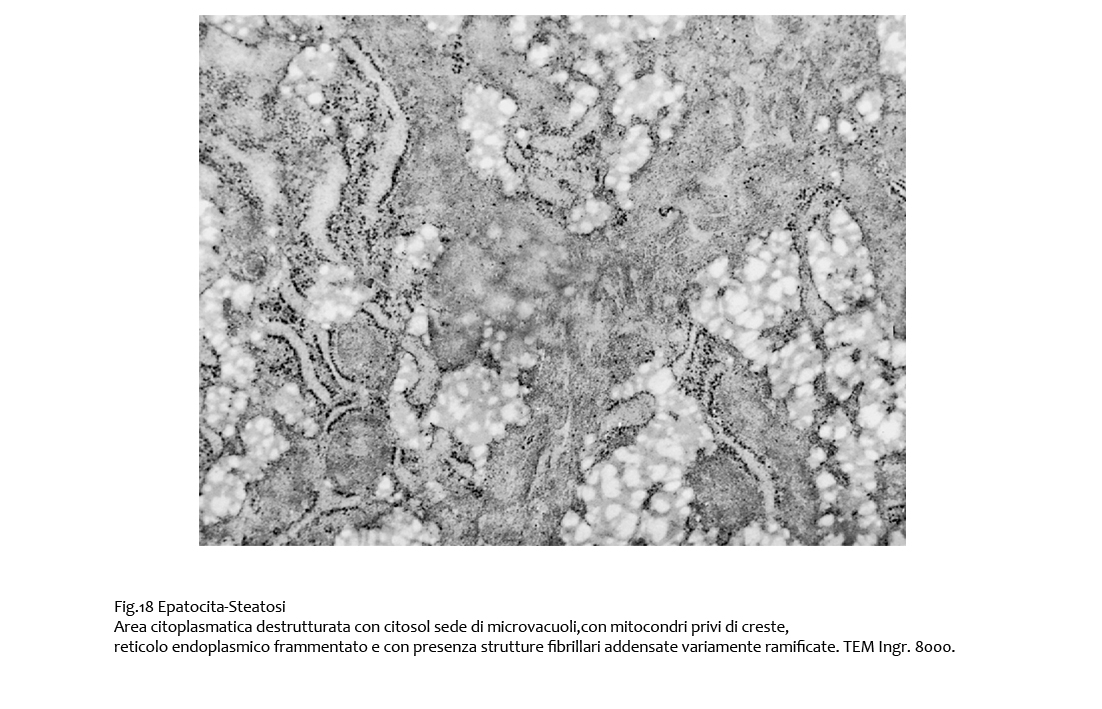 Fig.18bis
Fig.18bis 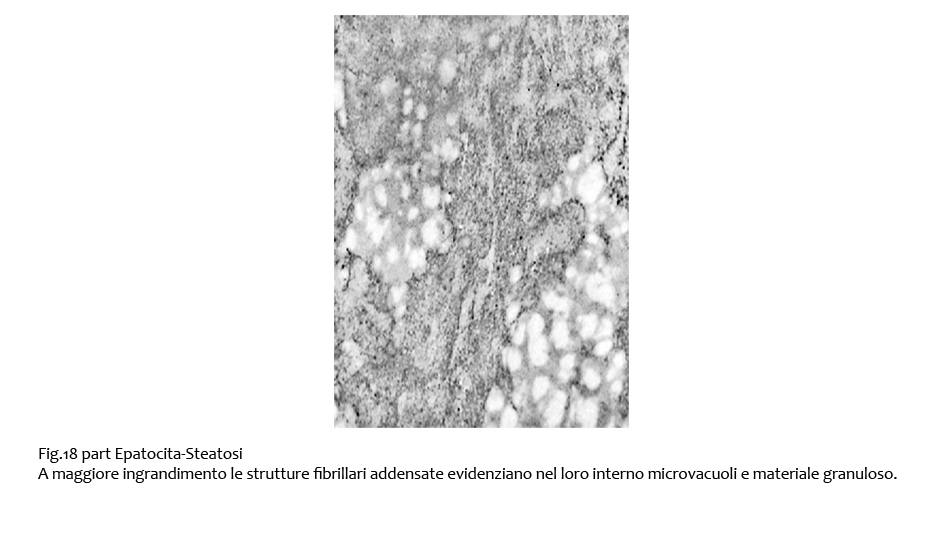
Non è infrequente il riscontro di focolai di autofagia; essi sono riconoscibili per il loro contorno a doppia membrana e per la presenza nell’interno di un cargo che in questi casi è rappresentato da materiale lipidico, da organelli e sostanze amorfe.
Fig.19 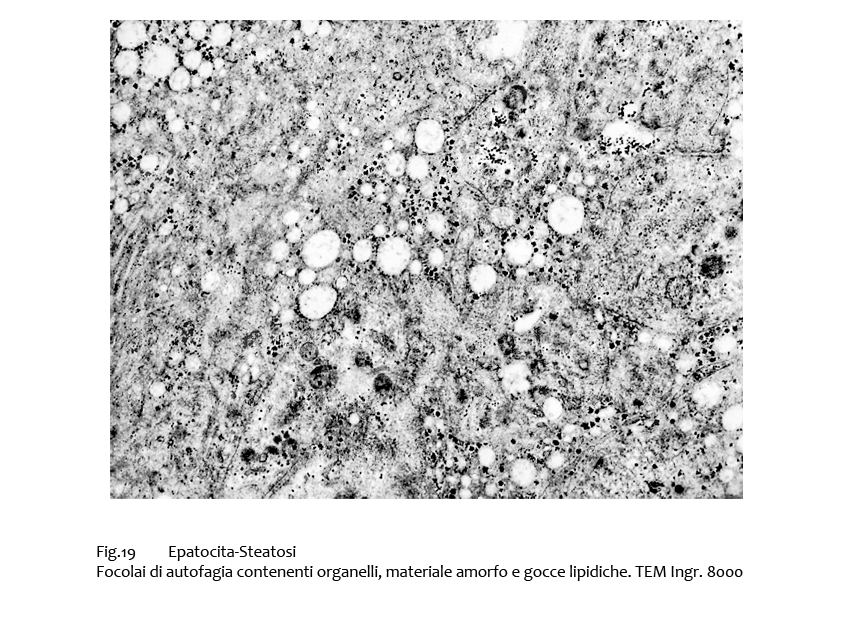 Fig.19bis
Fig.19bis 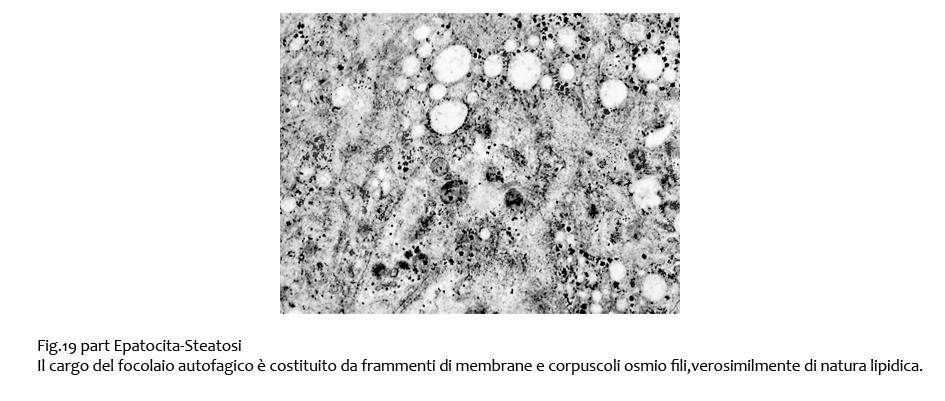
COMMENTO
La morfopatologia della steatosi epatica,mediante indagini con il microscopio luce e con quello elettronico,ha fornito significative informazioni circa la patogenesi e la diagnostica di questa patologia.
I reperti istopatologici della steatosi-steatoepatite rappresentano la base comune di un danno di tipo degenerativo-flogistico cronico indotto da numerosi fattori e cofattori variamenti integrati.
Come esempio,si ricorda la difficoltà a livello istopatologico di differenziare i quadri della steatosi-steatoepatite non alcolica da quella indotta dall’alcol,in quanto i caratteri delle lesioni e la sequenza evolutiva dei processi sono similari con rischio di errori senza l’acquisizione di notizie clinico-anamnestiche,
Mediante la istopatologia è stato tracciata e identificata la continuità nella progressione dalla steatosi semplice (evento reversibile) alla steatoepatite (evento irreversibile) per poi evolvere verso la fibrosi e verso la cirrosi con il rischio dell’epato carcinoma.
In molti casi di steatosi epatica si riscontra la presenza di micro focolai di flogosi linfo-monocitaria a livello degli spazi portali, a ridosso delle venule centro lobulari,o attorno agli epatociti sedi di macrovescicole,come la presenza di micro focolai di epatociti balloniformi; questi reperti non eludono la diagnosi steatosi,ma devono essere annotati come segni di un processo evolutivo verso la steatoepatite.
La microscopia elettronica ha documentato i gravi danni indotti dalla lipotossicità a carico dei mitocondri,del reticolo endoplasmico e del citoscheletro; queste lesioni riguardono il sistema energetico (mitocondri),quello della sintesi metabolica (reticolo endoplasmico),e quello riguardante l’impalcatura cellulare che garantisce e favorisce il movimento delle molecole (citoscheletro). Ha,inoltre,evidenziato la presenza di focolai di autofagia a sostegno del meccanismo di lipofagia che integra quello della lipolisi enzimatica nei processi di demolizione delle molecole lipidiche.
