Fegato: Steatosi e Steatoepatiti non alcoliche
(Descrizioni istopatologiche)
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica dell'Università della Campania "Luigi Vanvitelli"
L’acronimo NAFLD (Non alcoholic Fatty Liver Disease) indica un insieme di lesioni le quali si manifestano secondo quadri anatomo-clinici diversi, aventi come comune denominatore, l’assenza dell’uso-abuso di alcool.
Questi processi anatomo-clinici passano da una steatosi semplice a una steatoepatite la quale può evolvere in cirrosi e complicarsi in un carcinoma epatocellulare (World J. Gastroenterology 2008; 14(26): 4120-4126).
In occidente,la NAFLD è la più frequente tra le malattie croniche del fegato; secondo dati statistici è in crescita ed è considerata una patologia multisistemica poiché aumenta il rischio del diabete tipo 2, delle malattie cardiovascolari - ipertensive e di nefropatie croniche (J. Hepatol. 2015; 62: 547-564) (Internist (Berlin) 2019; 60 (2): 128-132).
I quadri dianzi citati della NAFLD hanno una continuità progressivo-evolutiva con un ritmo di sviluppo variabile, ma che può essere condizionato da altre patologie epatiche co-esistenti.
Il profilo anatomo-clinico della NAFLD varia in rapporto all’età; infatti, in letteratura, si tracciano linee differenziali tra le forme che colpiscono gli adulti e quelle che sono di interesse pediatrico. Spesso questa patologia è clinicamente silente e si appalesa solo quando le lesioni epatiche sono altamente evolute o addirittura nella fase cirrotica.
In letteratura, si sottolinea che le alterazioni metaboliche correlate ai vari quadri anatomo-clinici dianzi ricordati abbiano il loro punto di riferimento in disfunzioni mitocondriali indotte da uno stato di stress ossidativo, già presente nelle varie fasi precliniche della steatosi epatocitaria (World J. Gastroenterol 2018; 24 (16): 1748-1765).
I caratteri istopatologici della NAFLD sono stati ben definiti, e qui di seguito si procederà a una breve,sintetica, descrizione morfologica della steatosi e della steatoepatite:
La steatosi è rappresentata da un abnorme accumulo di lipidi nel citoplasma degli epatociti. Secondo criteri morfologici si distinguono due tipi di steatosi: la steatosi microvescicolare e la steatosi macrovescicolare. Questa distinzione viene contraddetta da reperti di steatosi mista, cioè formata da micro e macro vescicole.
Una valutazione semiquantitativa richiede che, per una corretta diagnosi di steatosi, il numero degli epatociti coinvolti debba essere superiore al 5% (Drug Metab. Rev. 2017; 49(2): 197-211) (World J. Gastroenterol. 2018; 24(27): 2974-2983).
Una valutazione circa la gravità del processo steatosico richiede una distinzione in forme lievi, moderate e severe.
I processi di steatosi, abitualmente, si manifestano nelle fasi iniziali a livello della zona 3 del lobulo convenzionale; nel corso evolutivo del processo morboso acquisiscono caratteri pan-lobulari.
Nelle fasi iniziali le steatosi possono essere reversibili, nelle fasi croniche diventa irreversibile con rischio del passaggio in forme di steatoepatite (Histopathology 2006; 49: 450-456).
Accanto a steatosi epatocitarie semplici, si repertano casi caratterizzati da steatosi con componente flogistica; questa componente è costituita da infiltrati di linfociti a ridosso di epatociti steatosici. Tale reperto riguarda soprattutto la steatosi macrovescicolare severa.
In casi di steatosi macrovescicolare severe, i globi lipidici progressivamente si accrescono fino a provocare la rottura della membrana plasmatica degli epatociti e riversarsi negli spazi interstiziali.
In risposta a tali eventi si attivano processi flogistici cronici sostenuti da linfociti e monociti formando spesso focolai di lipogranulomi. Ciascuno di essi è costituito da un’area centrale occupata da materiale lipidico circondata da un alone di elementi linfo-macrofagici (World J. Hepatol. 2017; 9 (16): 715-726). Questi reperti non sono da considerare come quadri di steatopatite, bensì come lesioni indicative di un processo evolutivo che può trasformarsi in steatoepatite.
La steatoepatite è una forma di patologia epatica composita ed evolutiva; in essa sono coinvolti non solo gli epatociti ma anche tutte le componenti cellulari mesenchimali del parenchima epatico.
La diagnosi di steatoepatite non alcolica richiede la esclusione di altre forme di patologia epatica, quali quelle da etanolo, quelle indotte da farmaci, quelle provocate da agenti virali e non ultime le patologie da deficienza di alfa-1 antitripsina e la malattia di Wilson (World J. Gastroenterol 2014; 20(42): 15539-15548).
Il quadro morfopatologico della steatoepatite è ben definito; esso è rappresentato da processi degenerativo-necrotici e flogistico-fibrotici. I primi (processi degenerativo-necrotici) sono costituiti da steatosi, degenerazione balloniforme, corpi di Mallory-Denk, disfunzioni mitocondriali, apoptosi, necrosi.
I secondi (processi flogistico-fibrotici) sono sostenuti da linfociti, monociti e in misura ridotta da neutrofi, eosinofili e plasmacellule. Il processo di fibrosi è indotto non solo dalla flogosi ma è potenziato anche dalla entità dei focolai di necrosi di apoptosi e dei lipogranulomi. Il riscontro del processo di fibrosi ha valore come stadiazione del quadro morboso, ed è indicativo della progressione della malattia (Histopathology 2006; 49: 450-465).
E’ stato accertato che le lesioni che definiscono il quadro della steatoepatite possono stabilizzarsi, rimanendo immodificate nel tempo, oppure evolvere con velocità diverse verso la cirrosi e il carcinoma epatocellulare. (J. Hepatol 2013; 59: 550-556).
Tra le varie alterazioni della steatoepatite, quella caratterizzante e definitoria è considerata la degenerazione balloniforme degli epatocit(Hepatology 2006; 44: 865-873) (Hepatology 2011; 54: 344-353).
All’esame ultrastrutturale, il citoplasma degli epatociti balloniformi nella steatoepatite contiene microgocce lipidiche, dilatazione delle cisterne del reticolo endoplasmico, alterazioni dei microtubuli, perdite dei filamenti intermedi, destrutturazione e frammentazione del citoscheletro associata a grave riduzione delle citocheratine 8\18. (Am. J. Gastroenterol 2006; 101: 1677-1678) (World J. Hepatology 2007; 9 (16): 715-732) (J.Hepatology 2008;48:821-828).
I corpi di Mallory-Denk, presenti in essi si formano per interazione di gocce lipidiche con fibrille frammentate del citoscheletro e contengono ubiquitina, p62, e citocheratine 8/18 (J. Hepatology 2000; 32: 689-702) ( Am.J.Pathol.2002;160:255-265) (Histopathology 2006; 49: 450-465).
Le cellule di Kupffer svolgono ruoli importanti nel processo di steatoepatite. Esse partecipano alla regolazione dei depositi di lipidi nelle cellule mesenchimali e svolgono attività induttive nei processi della flogosi e delle attività macrofagiche (World J. Hepatol 2017; 9 (16): 715-732).
Mediante il rilascio di citochine fibrogeniche(come la interleuchina 10, il fattore beta di crescita e le chemochine) sono attivate le cellule del sistema immunitario le quali partecipano assieme alle cellule stellate e ai fibroblasti e ad altre cellule della flogosi, ai processi di fibrosi (Gut 2005; 54: 303-306) (J.Hepatol 2017;66 (6):1300-1312).
Nei processi di steatoepatite il polo sinusoidale è gravemente compromesso con ripercussioni su i livelli di perfusione ematica. Gli endoteli sinusoidali sono deprivati delle finestre e subiscono un processo di capillarizzazione e perdono la capacità di secernere molecole che regolano la vasodilatazione in situazioni di stress, ma rilasciano mediatori che contribuiscono alla recrudescenza della flogosi e della fibrosi (J. Hepatol 2019; 70 (16): 1278-1291)
Anche le cellule stellate sono attivate e partecipano ai processi di flogosi intervenendo nella regolazione della microcircolazione sinusoidale e stimolando la fibrosi perisinusoidale mediante mediatori fibrogeniche (The Anatomical Record 2008; 291: 684-692).
Nello sviluppo della fibrosi, si formano tralci formati da fibre collagene, fibroblasti e cellule della flogosi; si repertano tralci rettilinei “a ponte” (vena centrale – vena centrale; spazio portale-spazio portale; vena centrale-spazio portale) e ancora tralci arcuati tendenti a delimitare zone di parenchima epatico. La comparsa di questi processi fibrotici è strettamente correlata alla estensione e al numero dei focolai necrotico-degenerativi e alla gravità del processo flogistico intralobulare. Essi si estendono anche a livello degli spazi portali e delle vene centrolobulari con la medesima configurazione citologica e componente fibrotica (Int J. Mol Sci 2016; 17: 17-25) (Int.J.Med.Sci.;17:97-104).
Nei casi di steatoepatiti con un quadro istopatologico “incompleto”non è possibile elaborare una diagnosi di certezza, pertanto si considerano i reperti quali forme di steatoepatite “borderline” (Hepatology 2011; 54: 344-353).
La steatoepatite in età pediatrica ha caratteri distintivi rispetto alla forma dell’adulto. I reperti istopatologici della steatoepatite in età pediatrica sono divisibili in due sottotipi: il primo è simile a quello riscontrato in soggetti adulti. Il secondo si distingue per assenza o presenza minima di epatociti balloniformi mentre prevale la steatosi macrovescicolare associata a flogosi portale. Rimane incerta la conoscenza di queste differenze; esse possono essere collegate a meccanismi patogenetici diversi oppure essere considerate come manifestazioni fenotipiche transeunti che evolveranno verso le forme dell’adulto (Hepatology 2005; 42: 641-649)(Pedriatrics 2006;118:1388-1393). (Hepatology 2009; 50 (4): 1282-1293).
Anche per la steatoepatite si applicano,mediante criteri semiquantitativi,con valutazioni riguardanti la gravità e la stadiazione del processo morboso;per la complessità delle lesioni,tra loro interattive si applica la procedura secondo la classificazione di Brunt (Am.J.Gastroenterol.1999;94:2467-2474).
La diagnosi differenziale tra steatoepatite non alcoliche e quelle alcoliche richiede una valutazione anamnestica e clinica. I reperti istopatologici sono similari, differiscono per la presenza nella steatoepatite alcolica di una colestasi canalicolare, di un elevato numero di corpi di Mallory-Denk e una maggior gravità dei processi necrotico-flogistici (Hepatol. Res. 2005; 33: 110-115) (Eur. J. Gastroenterol Hepatol. 2010; 22: 643-650).
La patogenesi della steatosi e della steatoepatite è multifattoriale e non ancora è stata in tutti gli aspetti chiarita.Tra questi molteplici fattori rimane molto evidente l’associazione di tali lesioni con l’obesità, il diabete tipo 2, l’insulino-resistenza e altre sindrome metaboliche (World J. Gastroenterol. 2018; 24 (16): 1748-1765).
La patogenesi della steatosi è indotta da un accumulo di lipidi nel fegato i quali derivano sia da una dieta ipercalorica sia da un processo di lipolisi del tessuto adiposo extraepatico come forma di una nuova lipogenesi (J. Clinic Invest. 2005;115:1343-1351).
La patogenesi della steatoepatite è molto più complessa per la presenza, accanto a uno stato di steatosi severa, la attivazione di citochine pro-infiammatorie,di citochine epatotossiche,di adipochine, di uno stato di stress ossidativo,e di disfunzioni mitocondriali associate a un incremento della perossidasi dei lipidi, della tossicità degli acidi grassi,e degli elementi della flogosi (Pediatrics 2006; 118: 1388-1393) World J.Gastroenterol. 2008;14(26):4120-4126) (J.Hepatol. 2010;53:372-384) (Eur. J. Pediatr. 2014;173:131-139).
La presenza di citochine e chemiochine provocano il rilascio di molecole tra loro associate, indicate con l’acronimo DAMP (Damage Associated Molecular Pattern), le quali promuovono lesioni epatocitarie, incrementi flogistici e processi fibrogenici (Gastroenterology 2014; 765-783). Assieme alle citochine è presente l’adipometina atta a stimolare le cellule immunitarie, a promuovere l’attività di fagocitosi dei macrofagi e favorire la fibrogenesi (Nat. Rev Immunol 2004; 4: 371-379) (Hepatology 2005; 42: 1339-1348) (Gastroenterol Hepatol 2007; 22 (Suppl.1): S87-S92).
Il processo di lipotossicità provoca lesioni progressive mitocondriali e del reticolo endoplasmico fino all’apoptosi. In associazione a queste lesioni regressive si attivano recettori quali: il TFN, FLAS, TRAIL che inducono processi infiammatori con arrivo di monociti, di T. linfociti e con attivazione delle cellule di Kupffer (Hepatology 2013; S9 (3): 583-594) (Hepatology Res. 2016; 46 (10): 977-984).
Nella progressione dalla steatosi semplice alla steatopatite lo stress ossidativo svolga un ruolo importante per il coinvolgimento della perossidasi dei lipidi accumulati negli epatociti. Tale processo assieme allo stress ossidativo è correlato alla disfunzione mitocondriale e all’aumento del ROS (Semin. Liver Dis. 2001; 21: 27:41) (J. Hepatology 2005; 42: 928-940).
Sono ancora poco noti i fattori patogenetici che intervengono nella progressione dallo stato di epatosteatite a quello di cirrosi. Su tale problema si prendono in considerazione la flogosi, la lipotossicità, lo stress ossidativo, i focolai di necro-flogosi, il numero delle cellule macrofagiche, la presenza di fibroblasti e il rilascio di citochine e adipochine fibrogeniche (Int.J.Mol.Sci. 2018;19(7):E2034,doi 10.3390 19072034).
Accanto ai fenomeni di lipogenesi e di lipotossicità, in questi ultimi anni è stata rivolta l’attenzione alla influenza esercitata dalla flora batterica intestinale su il parenchima epatico.Una disbiosi della flora intestinale può danneggiare la integrità della barriera enterica con danni a livello degli epiteli e in particolare delle giunzioni inter-epiteliali. Attraverso tali varchi passano in modo abnorme batteri, endotossine ed altro, capaci di indurre alterazioni degenerativo-flogistiche del parenchima epatico (Nature 2012; 489: 220-230) (World J. Gastroenterol 2014; 20: 15518-15531) (Gatsroenterology 2016; 15: 733-746) (Gut 2017; 66: 180-190).
Sono stati presi in considerazione anche la partecipazione di fattori genetici . E’ stato accertato che il gene PNPLA3, localizzato sul cromosoma 22 è un fattore concausale nel determinare la gravità della steatoepatite, nell’indurre una evoluzione fibrotica e nel rischio di una trasformazione carcinomatosa (J. Lipid Res 2009; 50: 2111-2116) (Mol. Carcinog 2013; 52: 139-147) (Nat Genet 2008; 40: 1461-1465). Si afferma,inoltre, la esistenza di una predisposizione genetica alla comparsa della steatosi e steatoepatite (Hepatology 2004; 40: 1387-1395) (Nat. Rev Gastroenterol Hepatol 2013; 10: 686-690). Si fa riferimento a varianti di fattori genetici nei transporters di lipidi localizzati nel reticolo endoplasmico e nel compartimento ER/Golgi, varianti capaci di incrementare i depositi di trigliceridi nel fegato (Hepatology 2015; 61: 506-514) (Drug Metab. Rev. 2017; 49 (2): 197-211).
A conclusione dell’elenco circa i fattori causali e concausali dianzi ricordati,è possibile avanzare l’ipotesi secondo la quale la NAFLD rappresenti una espressione clinica-biochimica-metabolica-morfologica unitaria indotta da fattori plurimi agenti in modo diverso a seconda dei casi.
Dopo tale inquadramento di tale patologia, il discorso viene centrato su la descrizione istopatologica della steatosi e della steatoepatite, sottolineando i salienti caratteri della loro istopatogenesi.
REPERTI DI ISTOPATOLOGIA
Questa descrizione istopatologia delle steatosi si avvale di due parametri di lettura. Il primo si riferisce alle dimensioni delle vescicole lipidiche (microvescicole, macrovescicole), il secondo prende in considerazione la gravità della steatosi mediante una valutazione semiquantitativa delle vescicole; in tale modo si possono distinguere le steatosi in lievi, moderate e severe.
Se si incrociano i dati ricavati dai suddetti parametri è possibile mettere in evidenza con maggiore facilità la correlazione tra gravità della steatosi e danno della microstruttura degli epatociti. L’applicazione di questo criterio procedurale ha consentito di evidenziare i seguenti reperti:
- Le steatosi microvescicolari di lieve grado sono caratterizzate da microvescicole disperse nel citoplasma; la presenza di tali microvescicole non modifica l’assetto della cellula e il nucleo conserva la sua posizione centrale. La presenza di queste microvescicole spesso è apprezzabile con difficoltà, poiché sono coperte da fenomeni degenerativi di tipo idropico-vacuolare. Questa difficoltà può essere superata utilizzando sezioni semifini colorate con acido osmico.
Fig.1 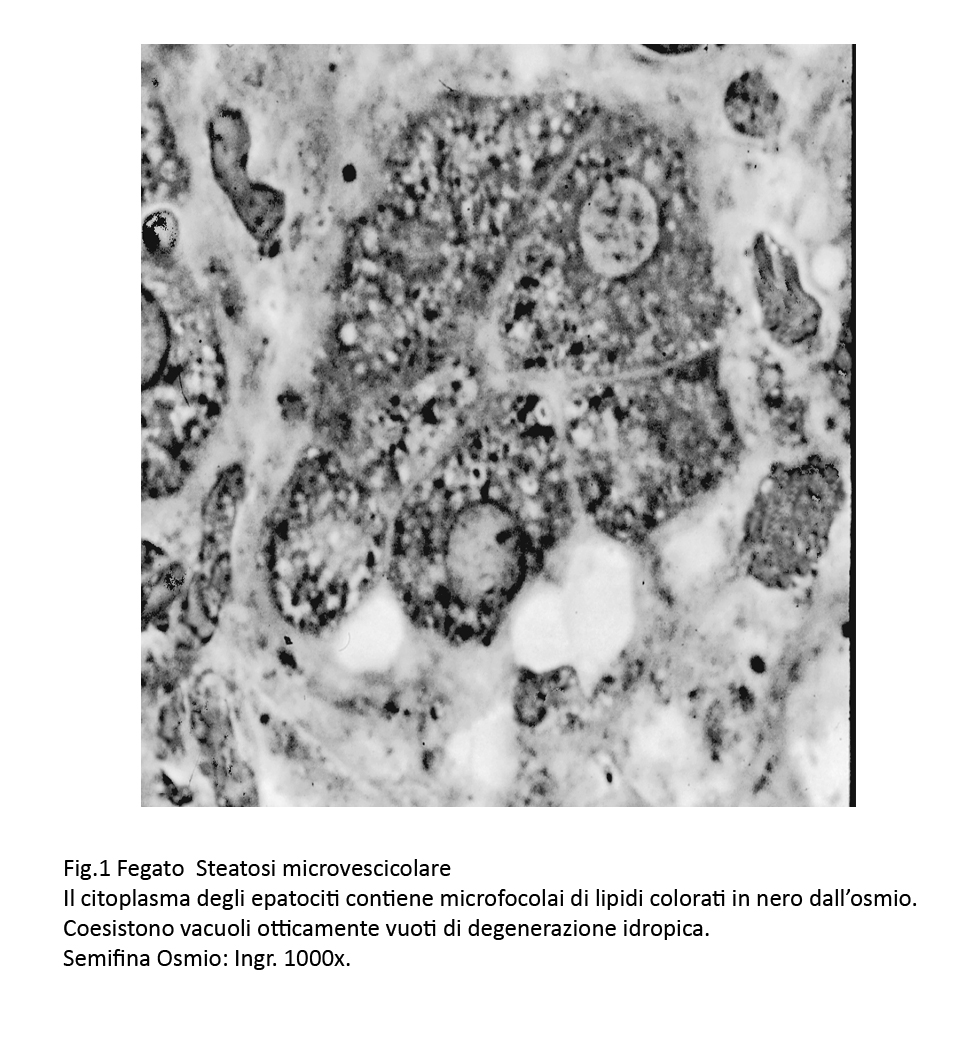
- Le steatosi micro vescicolari di grado moderato e severo acquisiscono, quasi sempre, i caratteri di steatosi mista per la co-esistenza di macrovescicole. Essa si caratterizza per la presenza di gocce lipidiche nel citoplasma di numerosi epatociti . La microarchitettura delle lamine epatiche si dispone spazialmente in modo tortuoso e in alcune zone appaiono bistratificate. I sinusoidi sono beanti e contengono cellule di Kupffer contenenti microvescicole lipidiche; gli spazi di Disse sono slargati e sono in parte occupati da cellule stellate ipertrofiche.
Fig.2 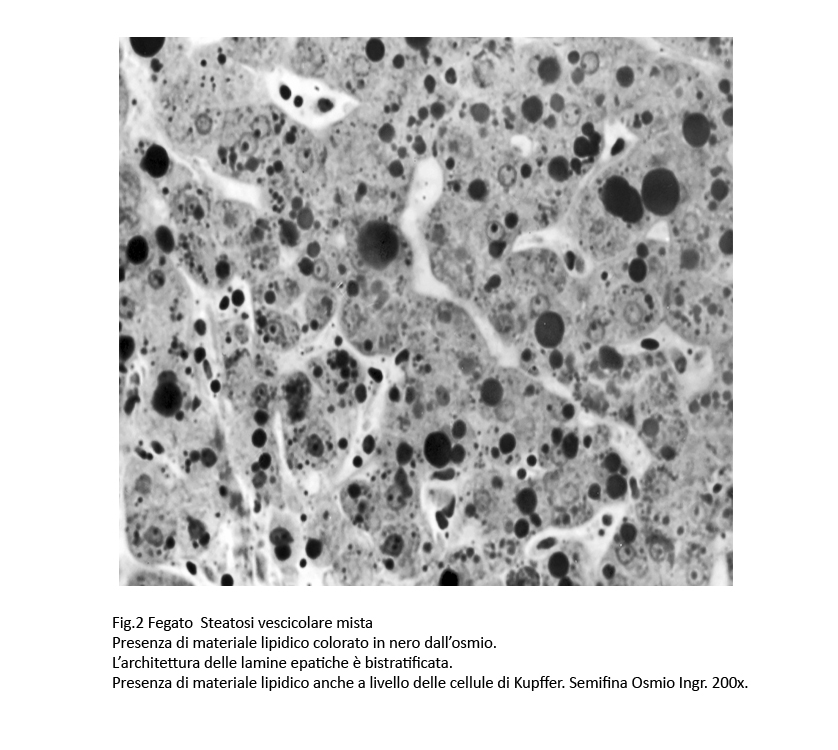 Fig.2bis
Fig.2bis 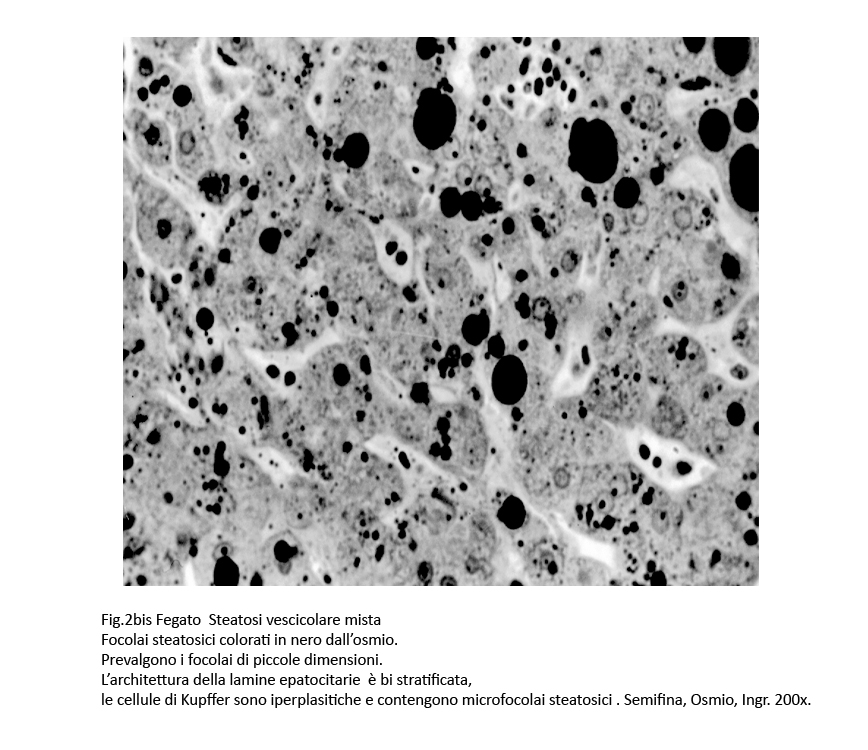
La steatosi macrovescicolare è facilmente riconoscibile per la dimensione delle vescicole e viene distinta anch’essa sul piano semiquantitativo nei gradi di lieve, moderato e severo.
- La steatosi macrovescicolare di lieve entità è caratterizzata da grosse vescicole che occupano l’intero citoplasma, marginando il nucleo a ridosso della membrana plasmatica. Alcune vescicole occupano l’intero corpo cellulare, fino a distendere oltre misura la membrana plasmatica,e provocare la rottura della stessa con rilascio del contenuto lipidico negli interstizi. Questo processo di steatosi modifica la architettura delle lamine epatiche;queste appaiono bistratificate o pluristratificate e sono costeggiate da sinusoidi zonalmente capillarizzati con cellule di Kupffer iperplastiche.
Fig.3 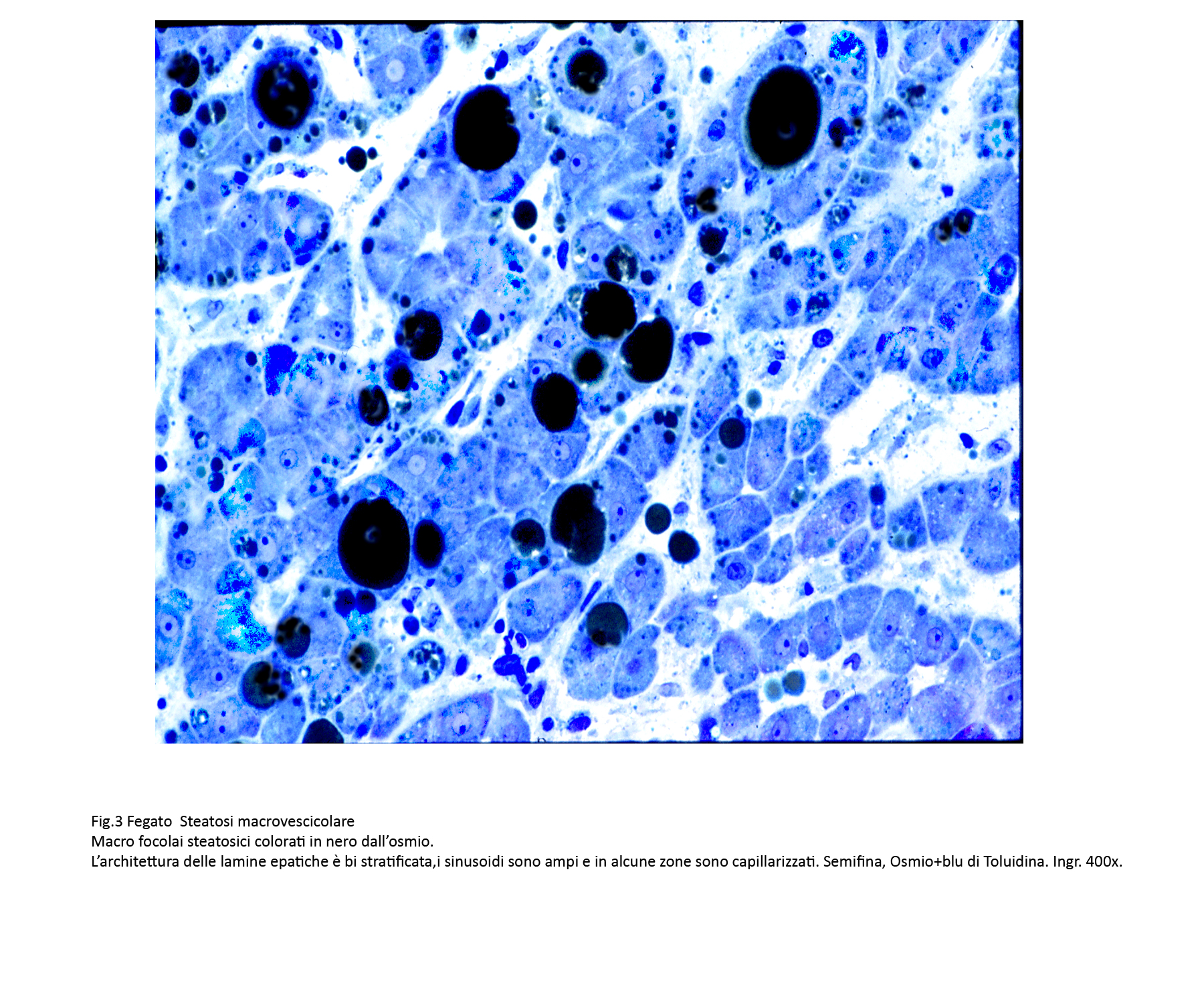 Fig.3bis
Fig.3bis 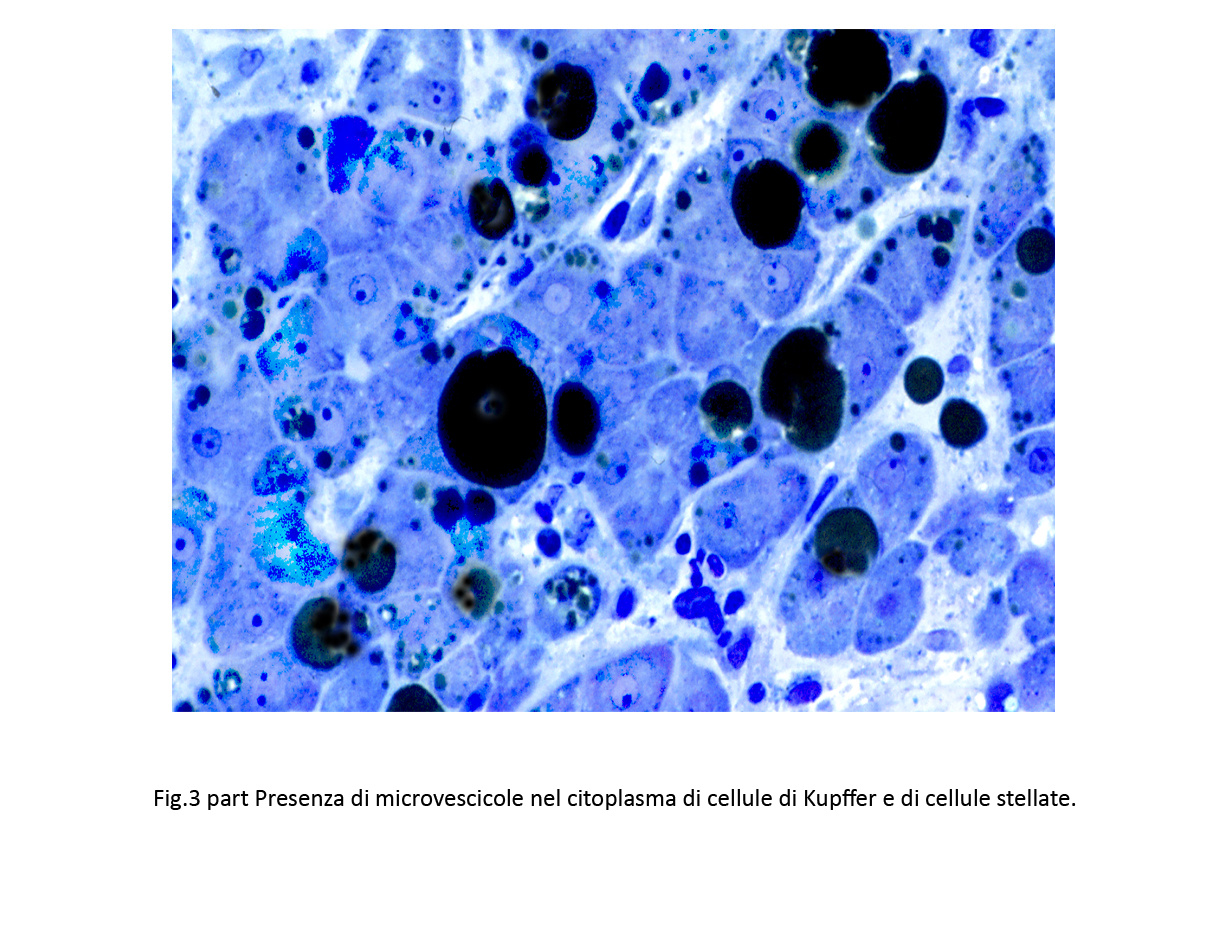
Fig.4 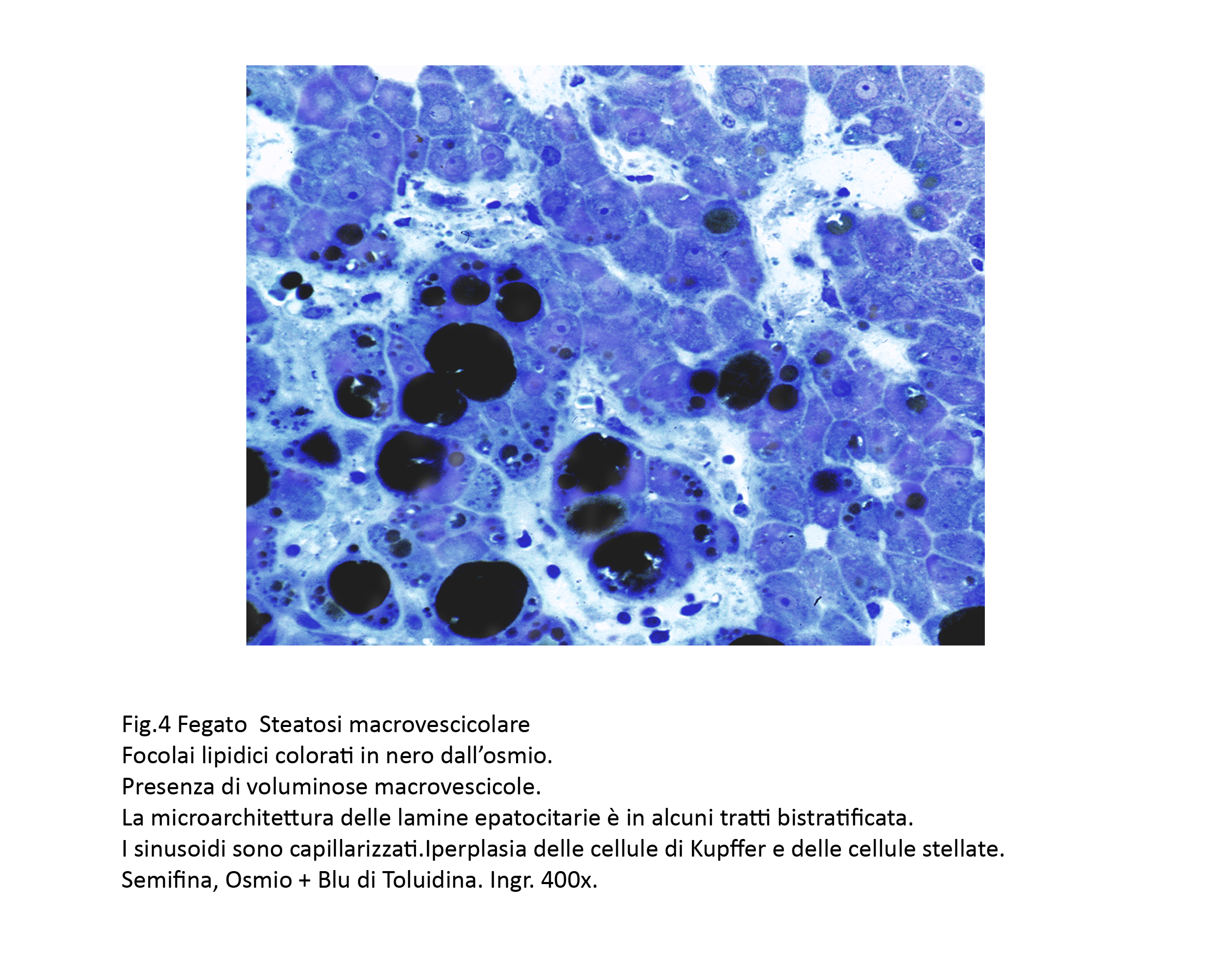 Fig.5
Fig.5 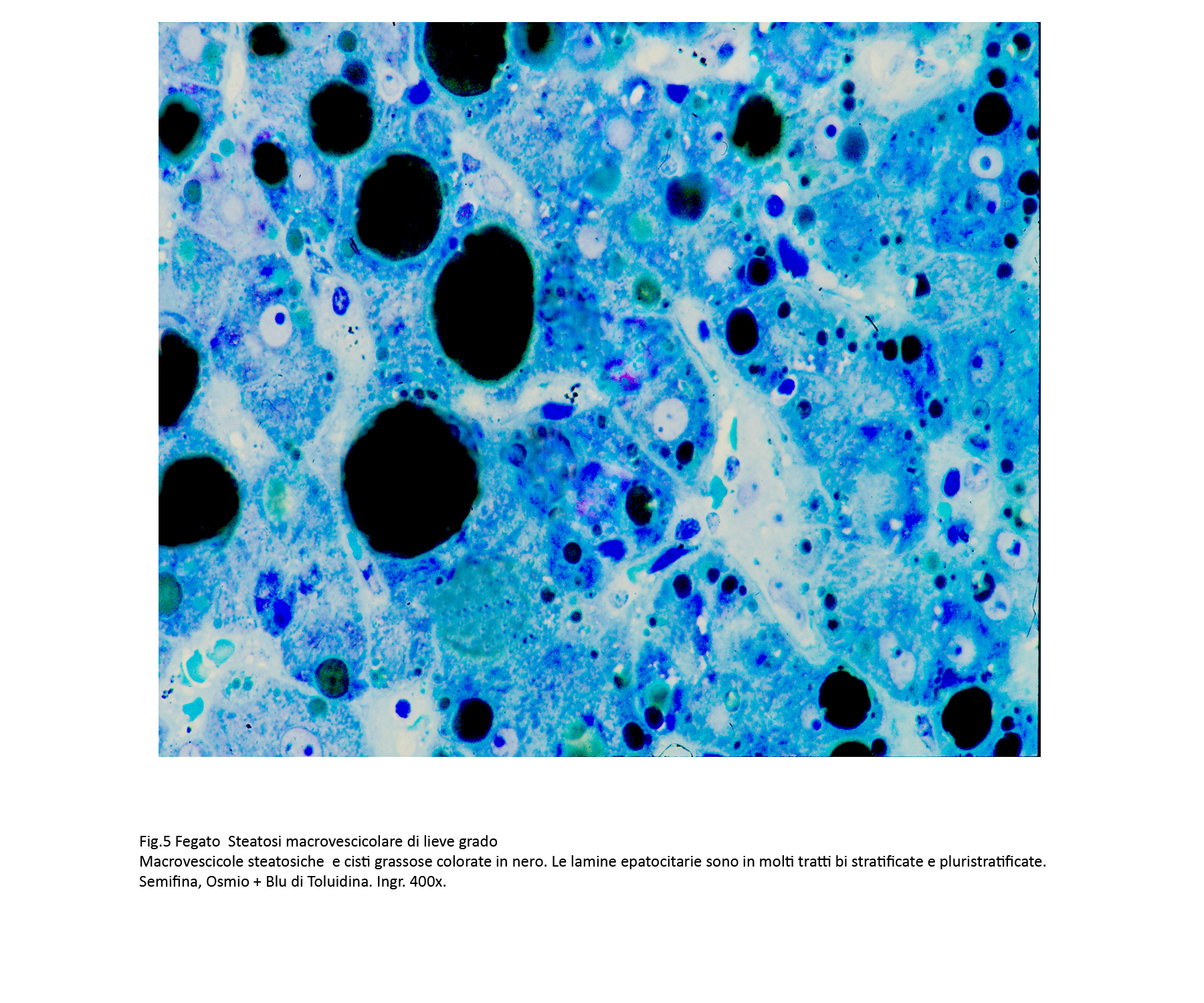
4) La steatosi macrovescicolare di grado moderato si esprime con un alto numero di macrovescicole;esse sono molto voluminose fino ad acquisire i caratteri di cisti grassose;in tali condizioni gli epatociti sono notevolmente ingranditi,il citosol è ridotto o scomparso e il nucleo è marginato a ridosso della membrana plasmatica. Macrovescicole presenti in epatociti contigui tendono per rottura delle rispettive membrane plasmatiche a fondersi in una unica cisti grassosa. Accanto a epatociti con macrovescicole si repertano epatociti con micro vescicole ed altri con citoplasma diradato,iperchiaro contenente materiale filamentoso.
Le lamine epatocitarie sono ispessite per un aumento volumetrico degli epatociti e frequentemente sono bi stratificate o pluristratificate; queste modificazioni sono causa della perdita del rapporto fisiologico tra epatociti-sinusoidi causando gravi processi dismetabolici.
Fig.6 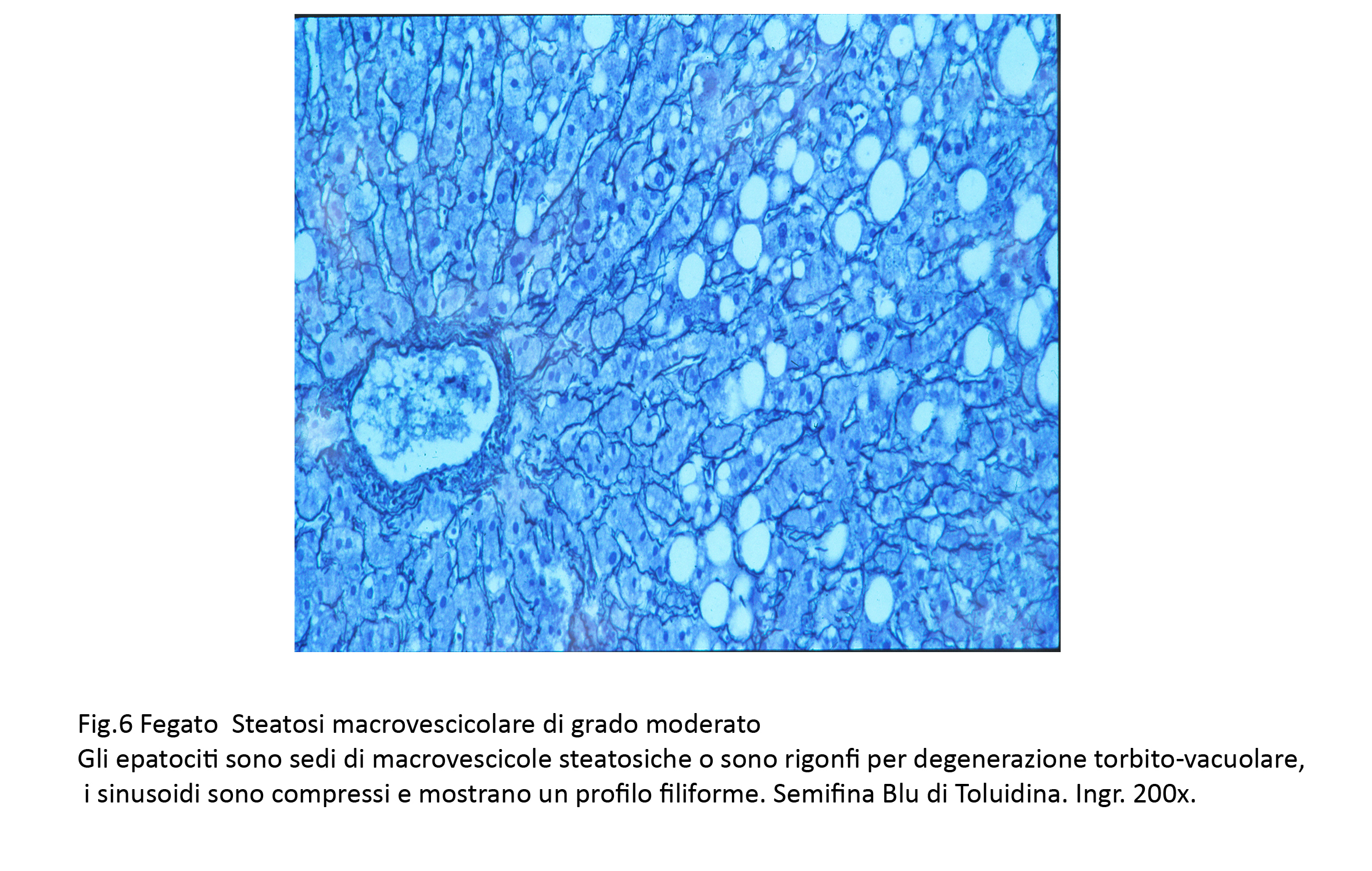 Fig.6bis
Fig.6bis 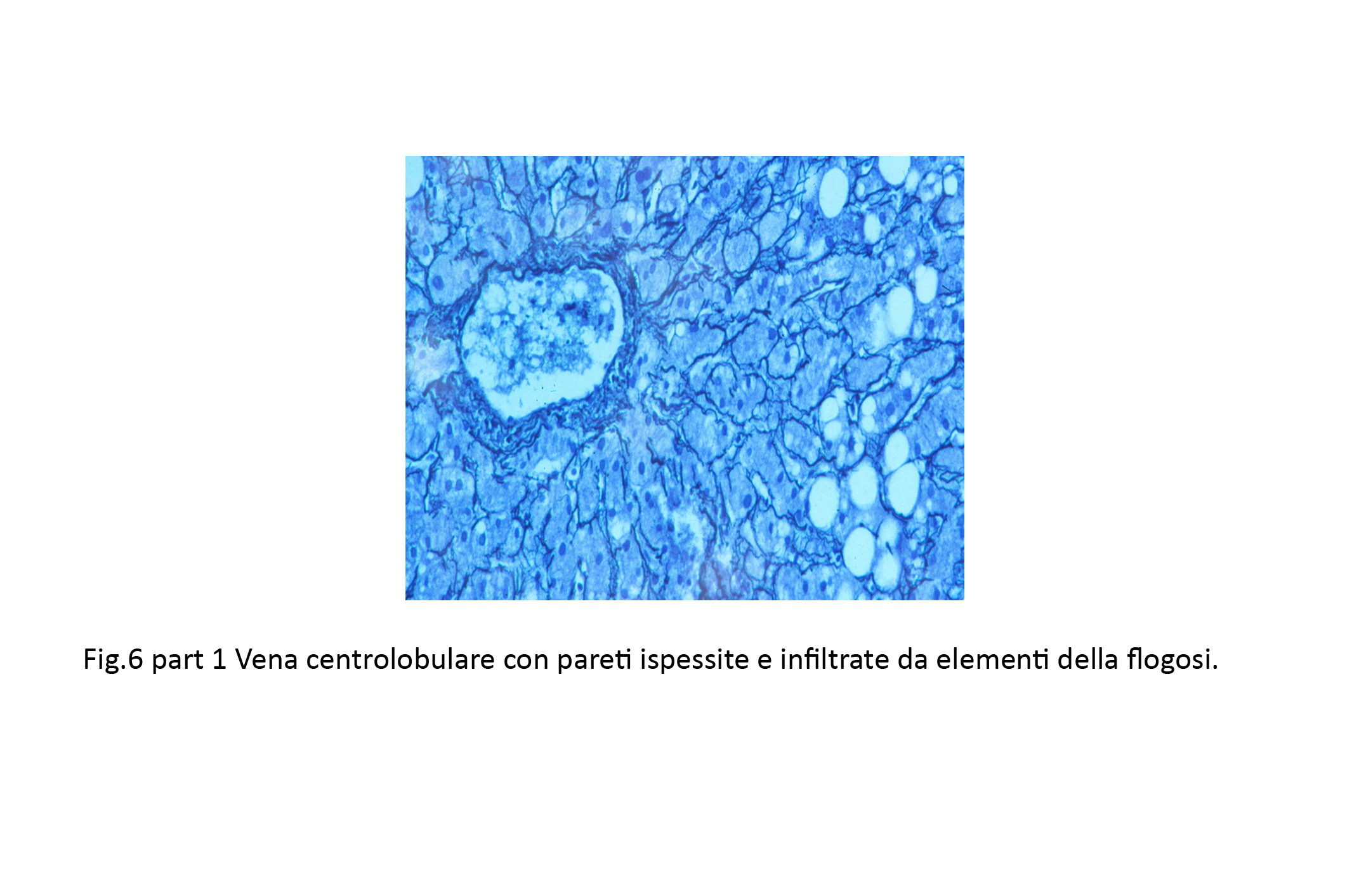 Fig.6ter
Fig.6ter 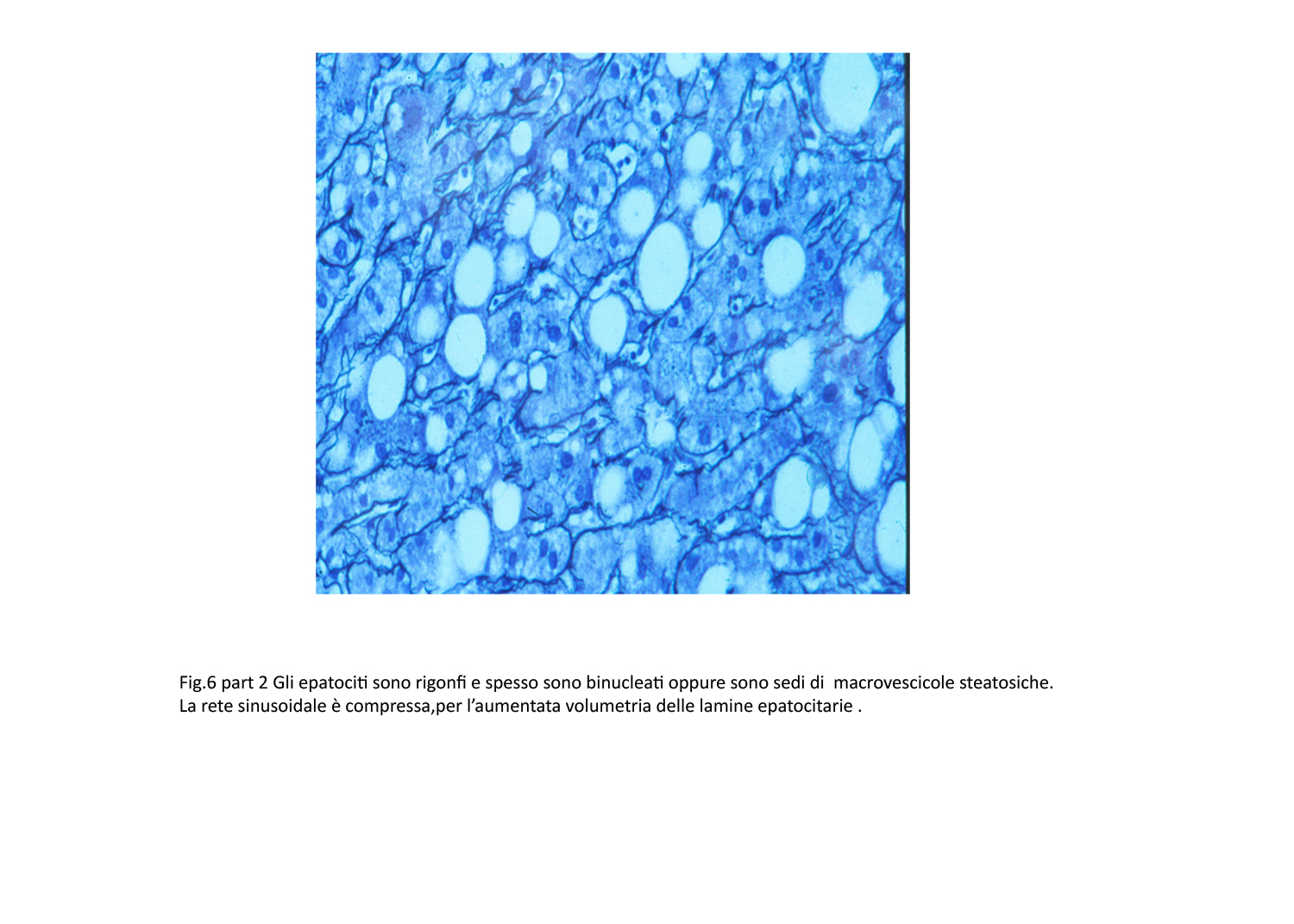
Fig.7 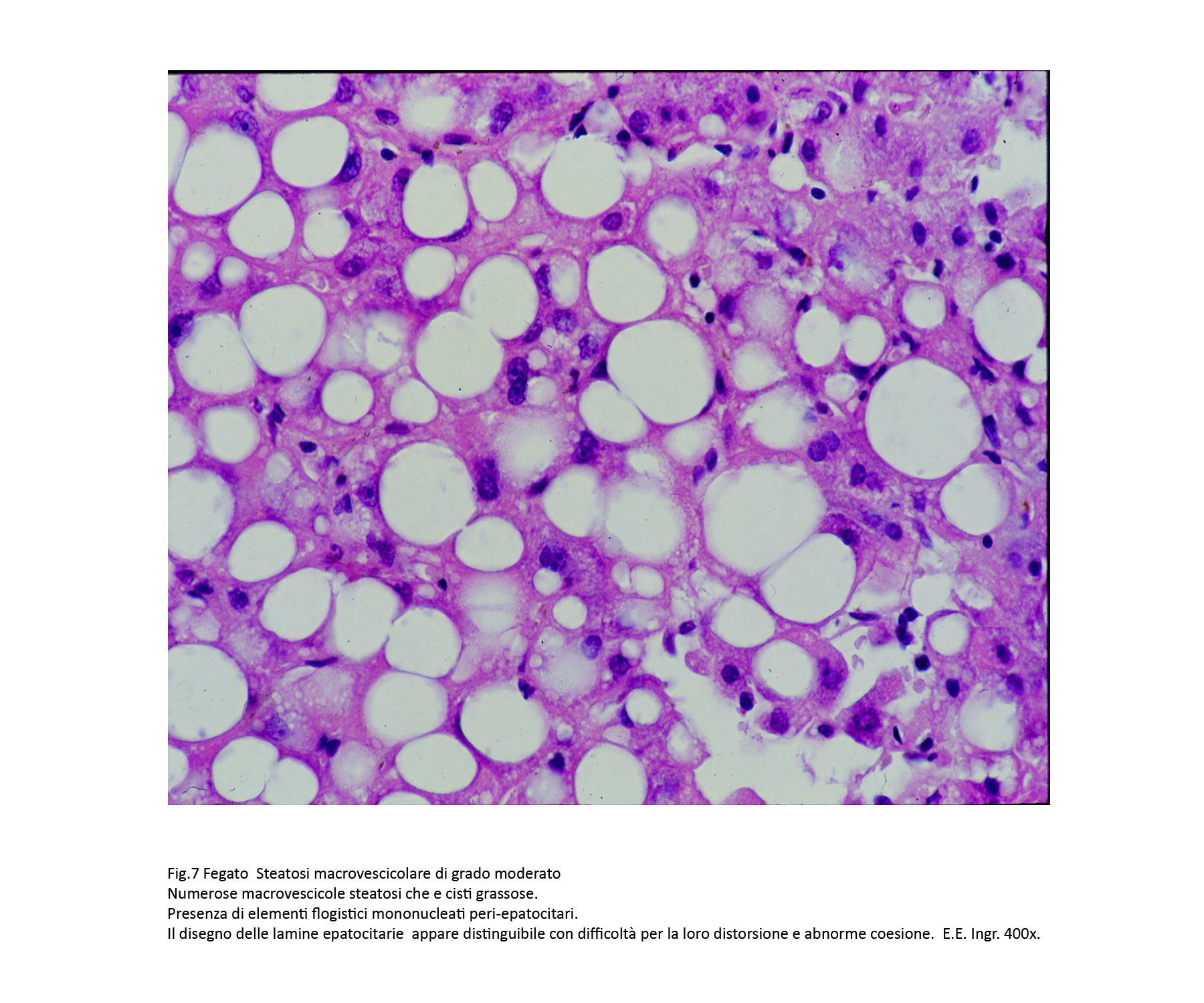 Fig.7bis
Fig.7bis 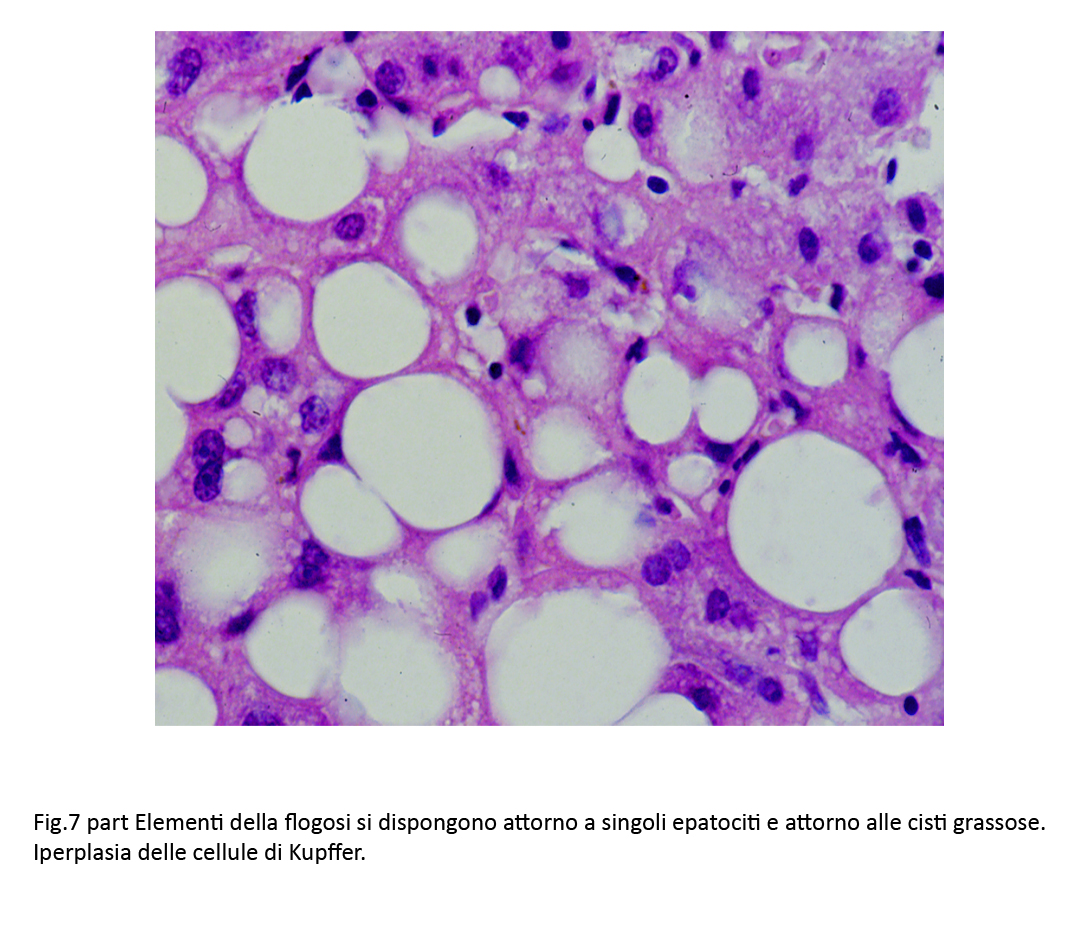 Fig.8
Fig.8 
L’incidenza maggiore del processo steatosico è a livello della zona 3 e in tale area si repertano anche epatociti rigonfi con citoscheletro frammentato e in parte coagulato.
Fig.9 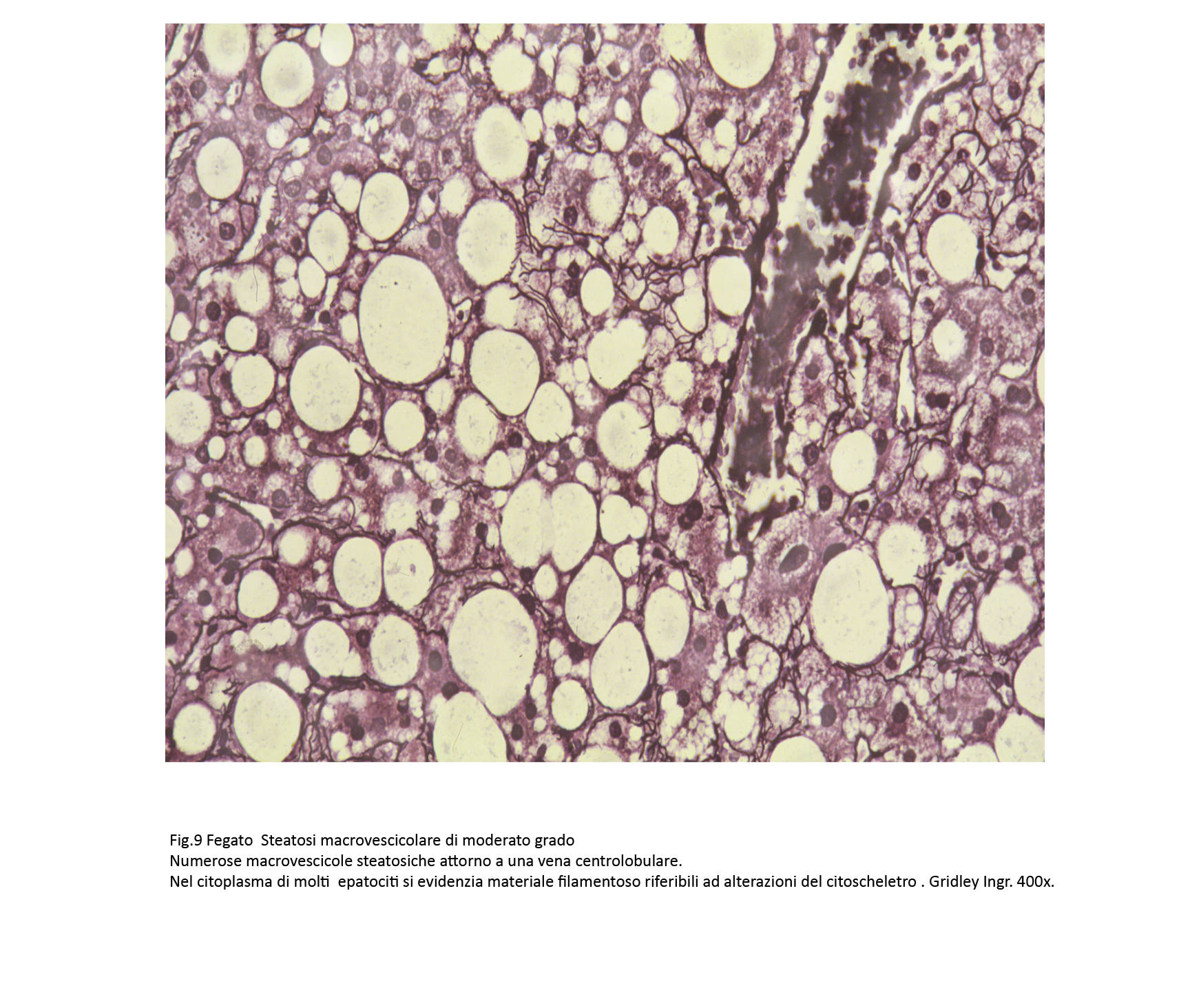 Fig.9bis
Fig.9bis 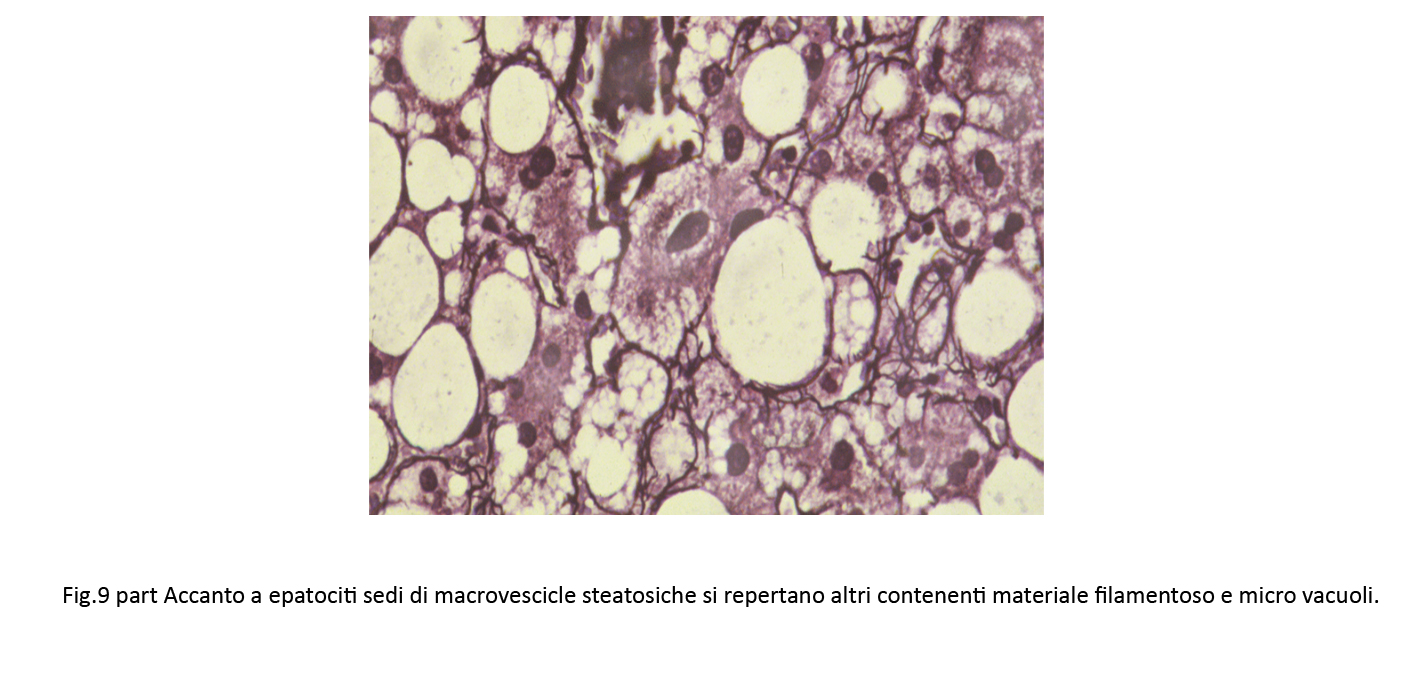
Fig.10 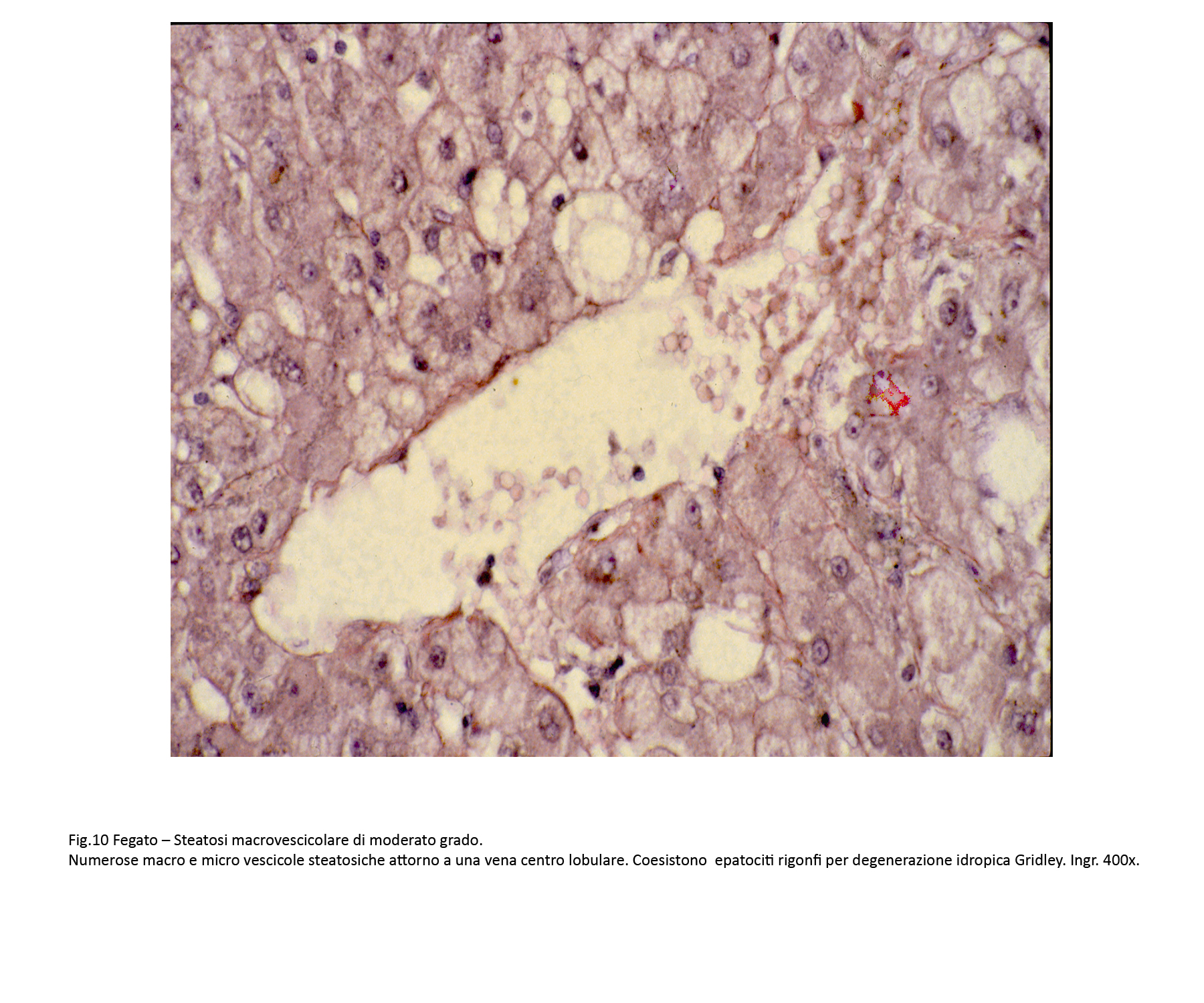
I focolai di steatosi macrovescicolare presenti a livello portale e periportale si associano a focolai di flogosi e/o di fibrosi, processi questi verosimilmente indipendenti dalla steatosi.
Fig.11 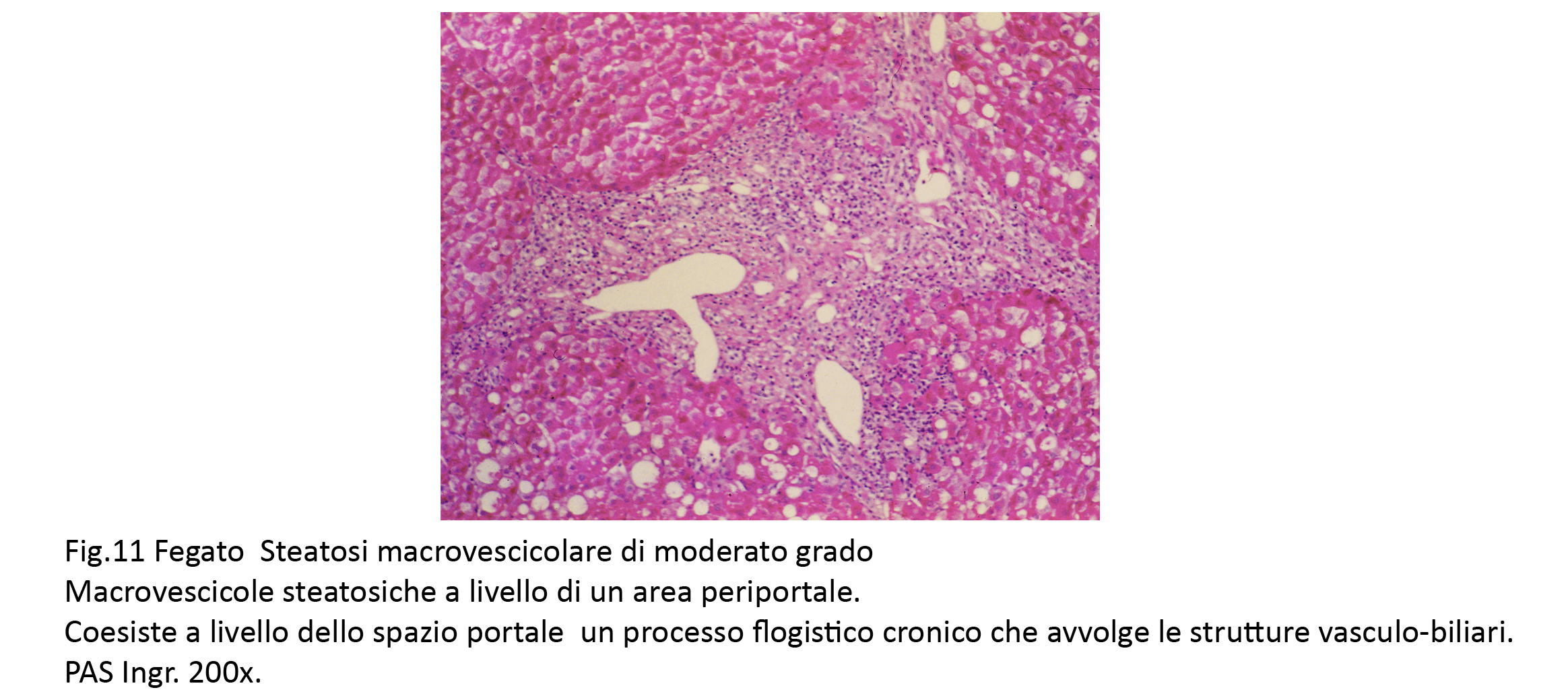
Attorno agli epatociti sede di macrovescicole si sono formate filiere monostratificate di elementi flogistici mononucleati e di elementi macrofagici.
Di particolare interesse sono le alterazioni a livello del polo sinusoidale;queste,in breve,sono costituite dalla capillarizzazione dei sinusoidi, da un ampliamento degli spazi di Disse con cellule stellate attivate e da un coinvolgimento attivo delle cellule di Kupffer per la presenza nel loro citoplasma di numerose gocce di lipidi.
Fig.12 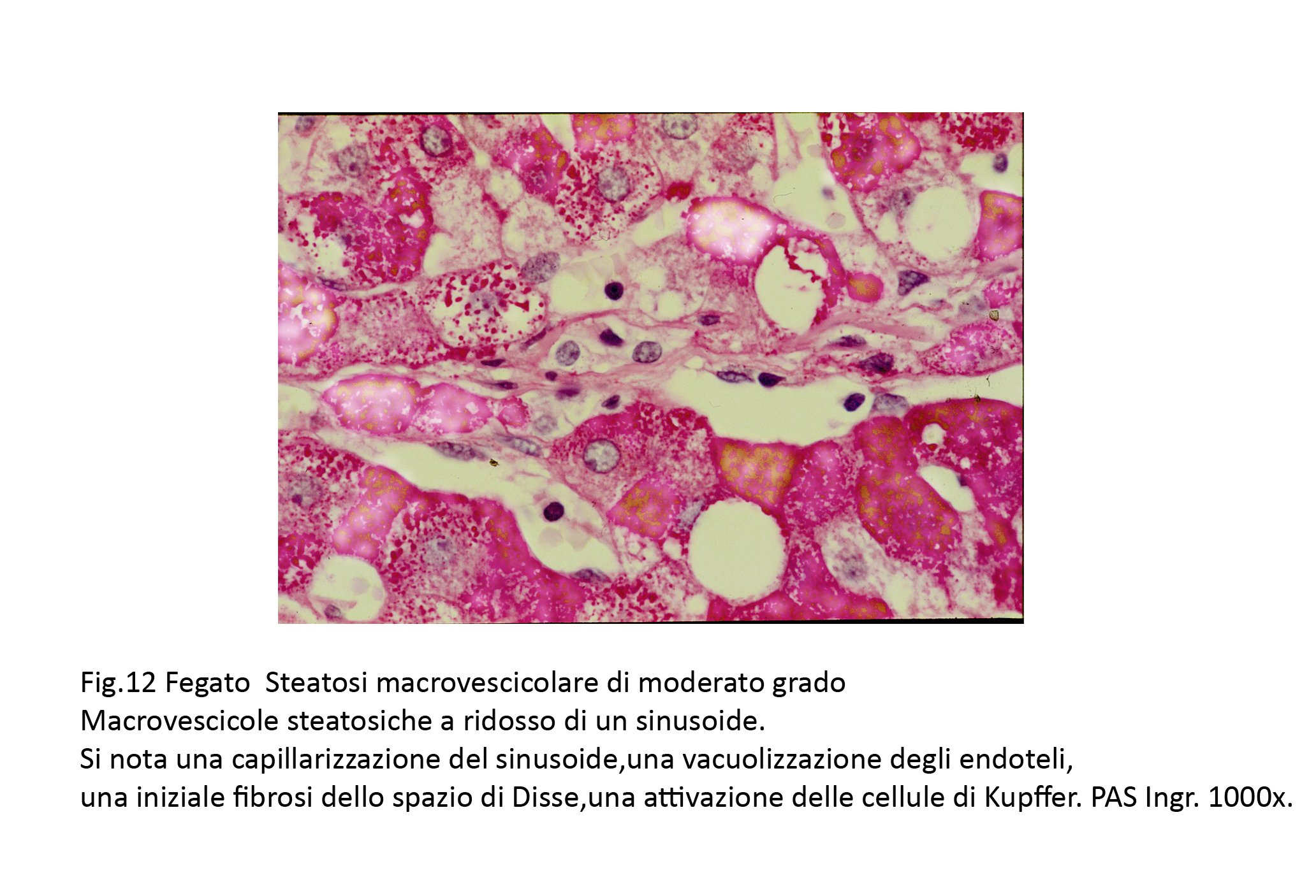
STEATOEPATITE
La steatoepatite è una lesione epatica composita in quanto è costituita da processi degenerativi, flogistici e fibrotici.
La descrizione di tale patologia richiede l’analisi morfologica di ciascuno di questi processi per poi esprimere un giudizio di sintesi.
La “lesione base” è rappresentata da una steatosi macrovescicolare severa degli epatociti che appaiono occupati in modo globale da questi depositi con marginazione del nucleo. Spesso, il progressivo aumento volumetrico di queste vescicole provoca la rottura della membrana plasmatica con deiscenza negli spazi interstiziali del suo contenuto. Infatti, non è raro repertare in tali spazi grosse cisti grassose o materiale lipidico disperso.
A differenza delle semplici steatosi, in questo quadro patologico vi è la presenza di processi flogistici cronici. Essi sono costituiti in prevalenza da linfociti, monociti, cellule macrofagiche e un esiguo numero di neutrofili. Questi elementi si ritrovano attorno a singoli epatociti, o in piccoli aggregati raccolti negli interstizi, o ancora in microgranulomi attorno a materiale lipidico (lipogranulomi).
Fig.15 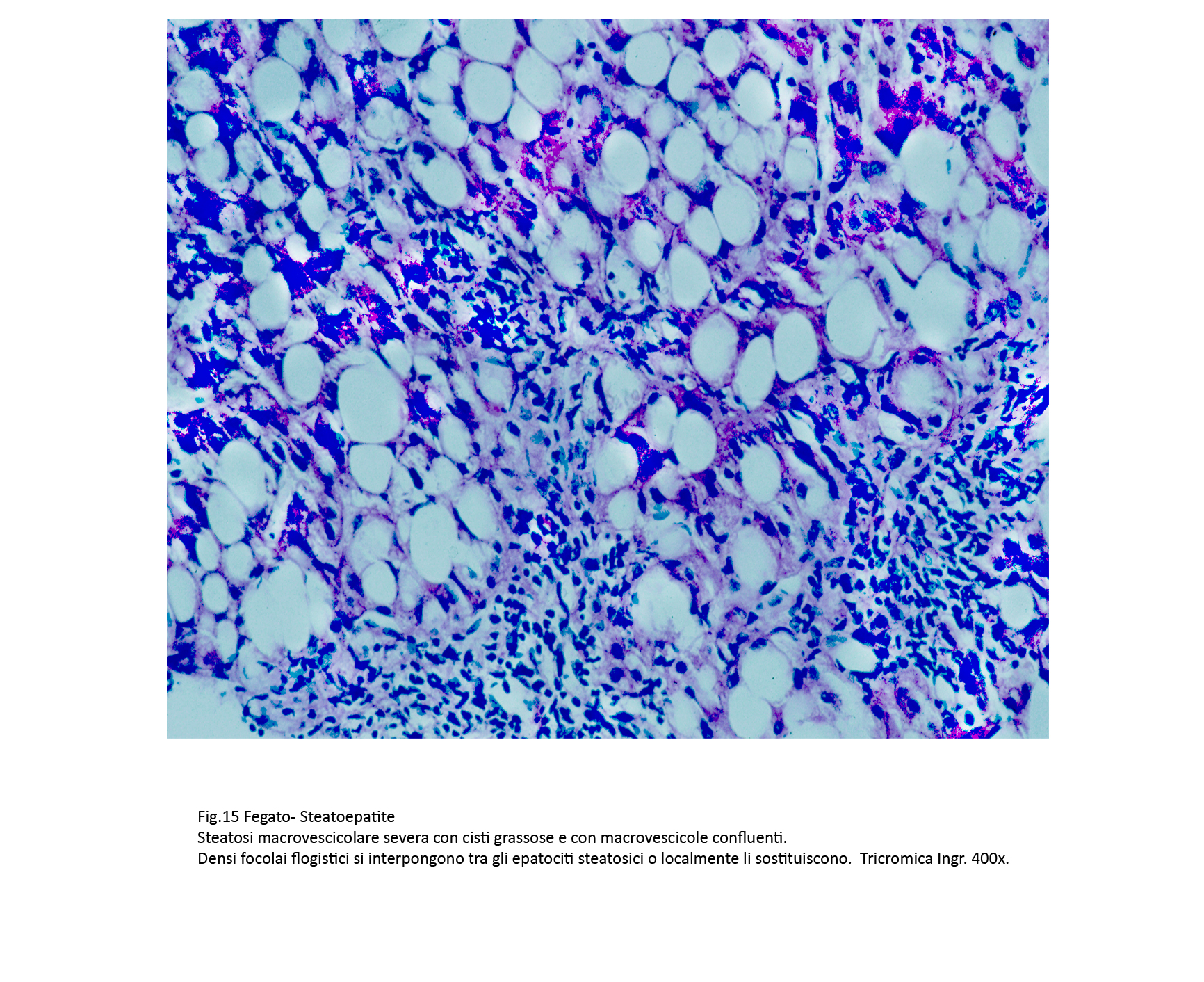 Fig.16
Fig.16 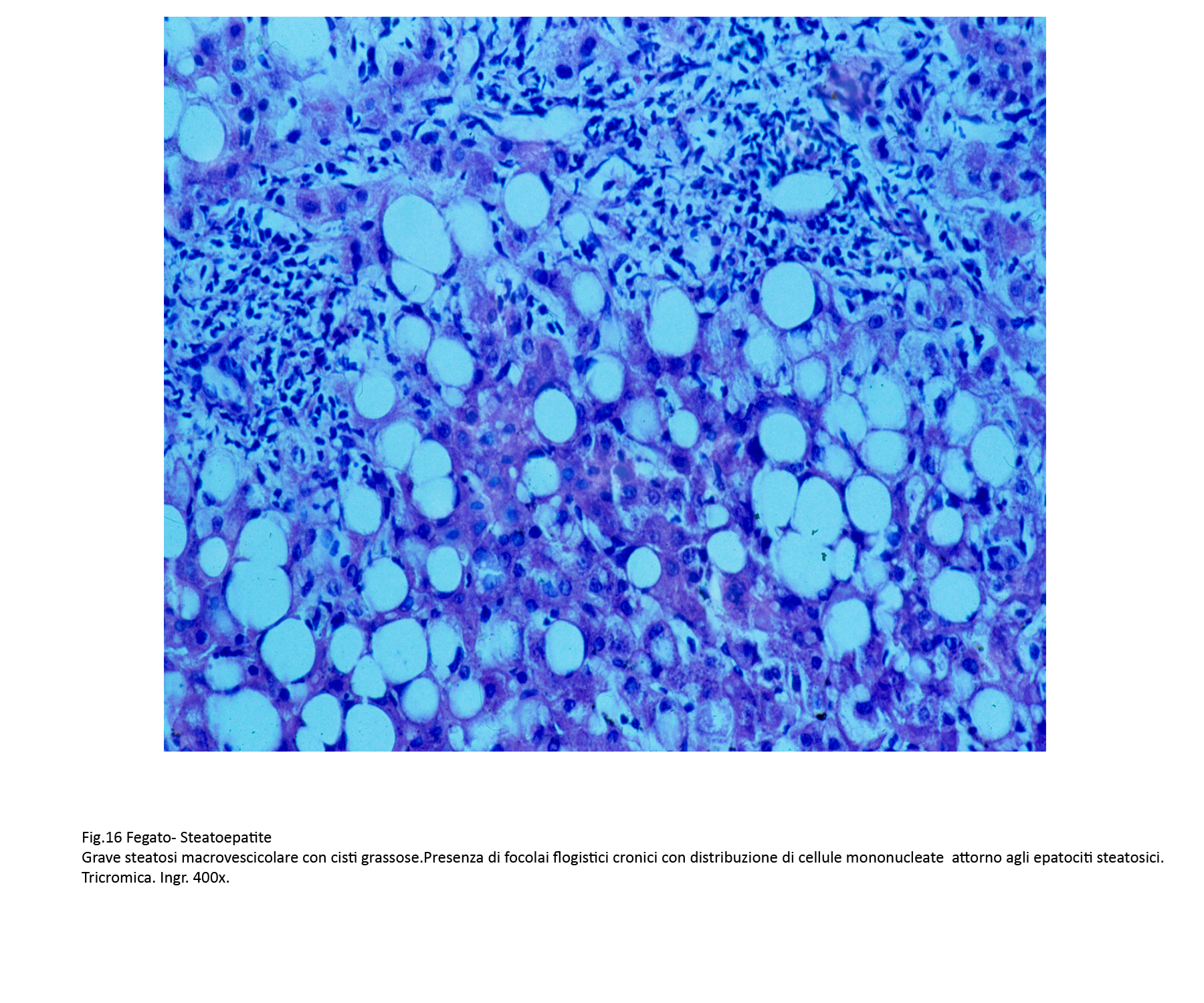 Fig.16bis
Fig.16bis 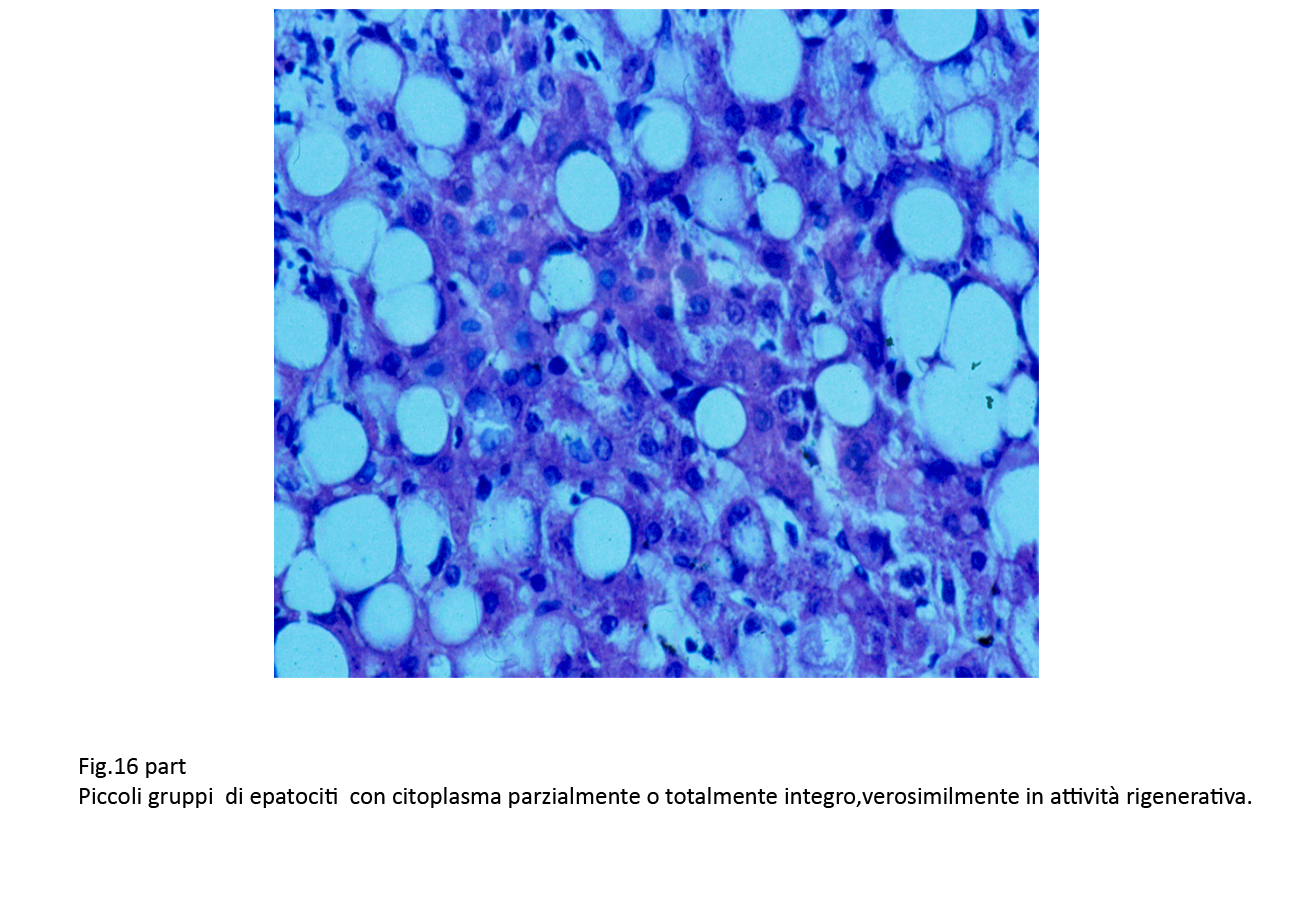
Fig.17 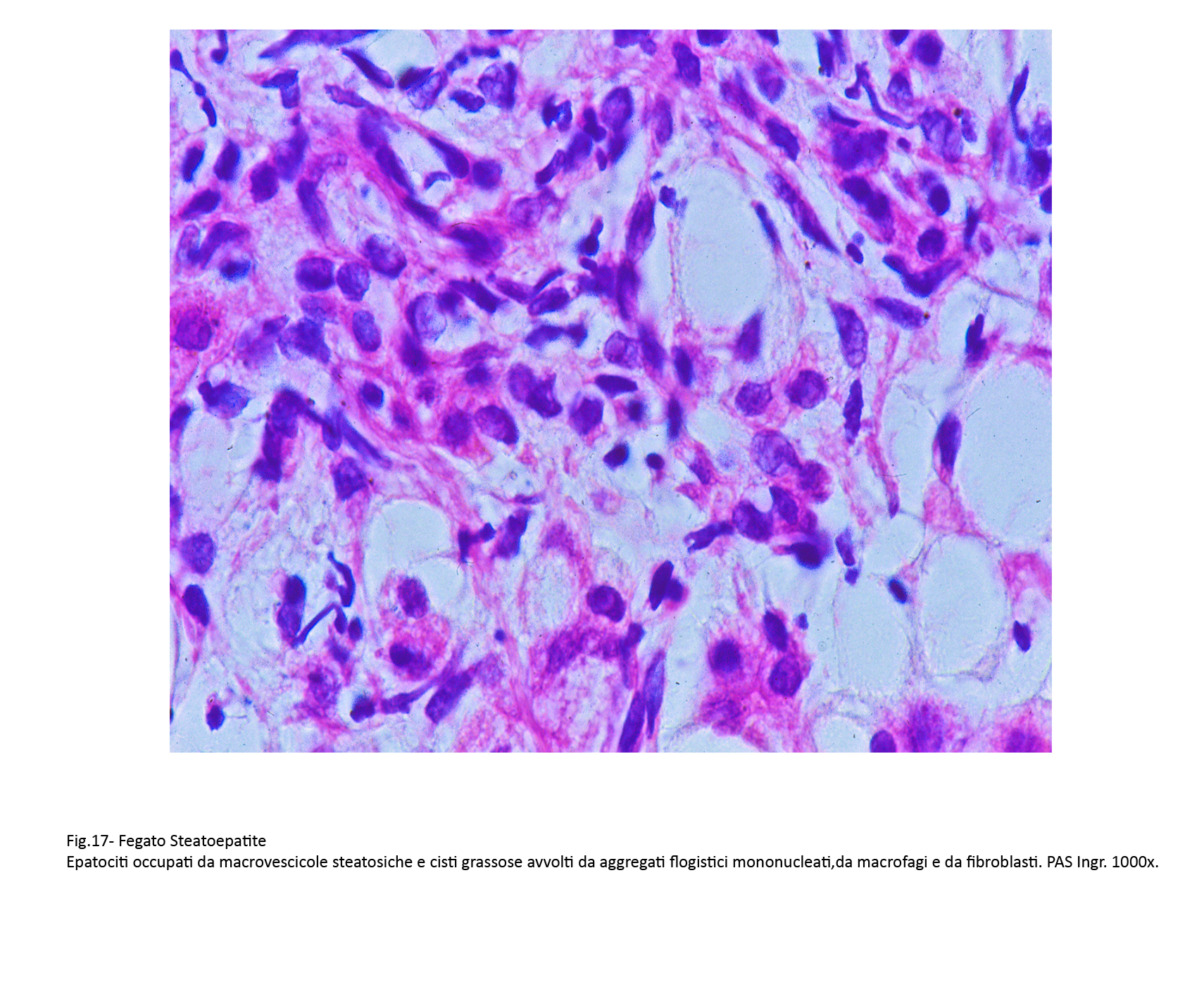 Fig.18
Fig.18 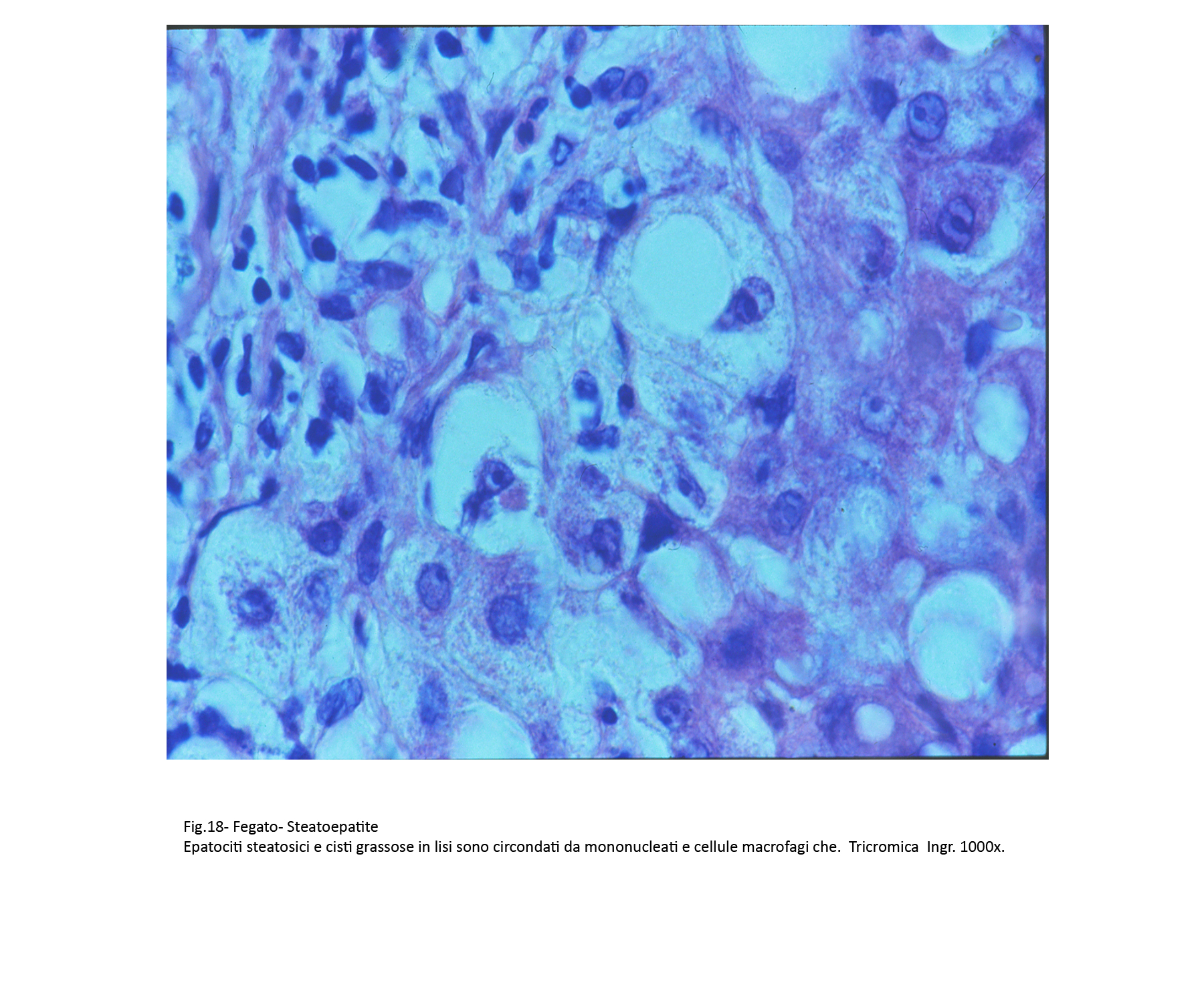 Fig.19
Fig.19 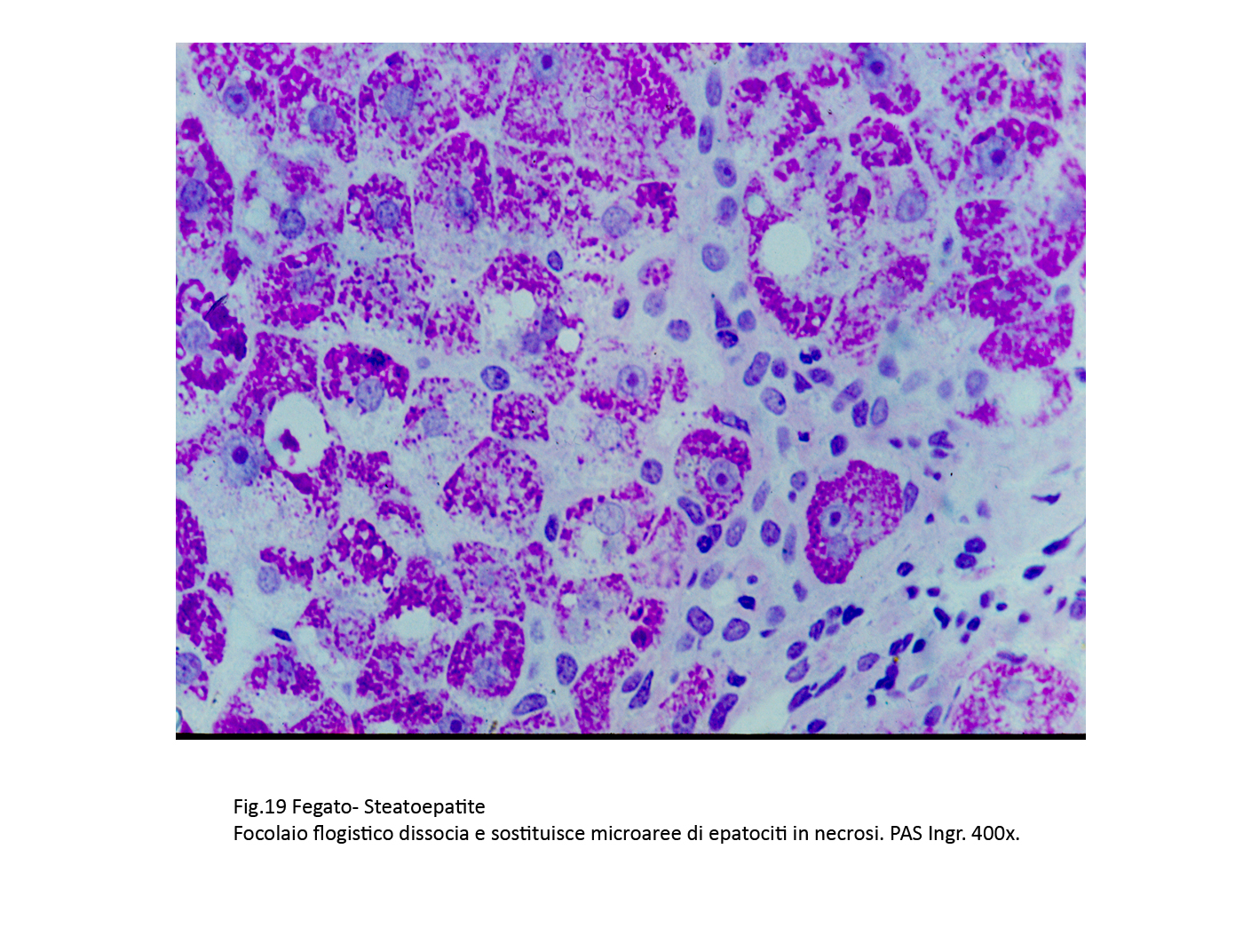
Assieme a epatociti steatosici si repertano gruppi più o meno estesi di epatociti con caratteri di degenerazione balloniforme. Questi appaiono voluminosi, globosi e sono forniti di un ampio citoplasma con un nucleo ipercromatinico in posizione centrale. Il citoplasma è trasparente, diafano, uniforme se non è occupato da piccole quote di materiale ialino microfilamentoso o da qualche corpo di Mallory-Denk.
Fig.20 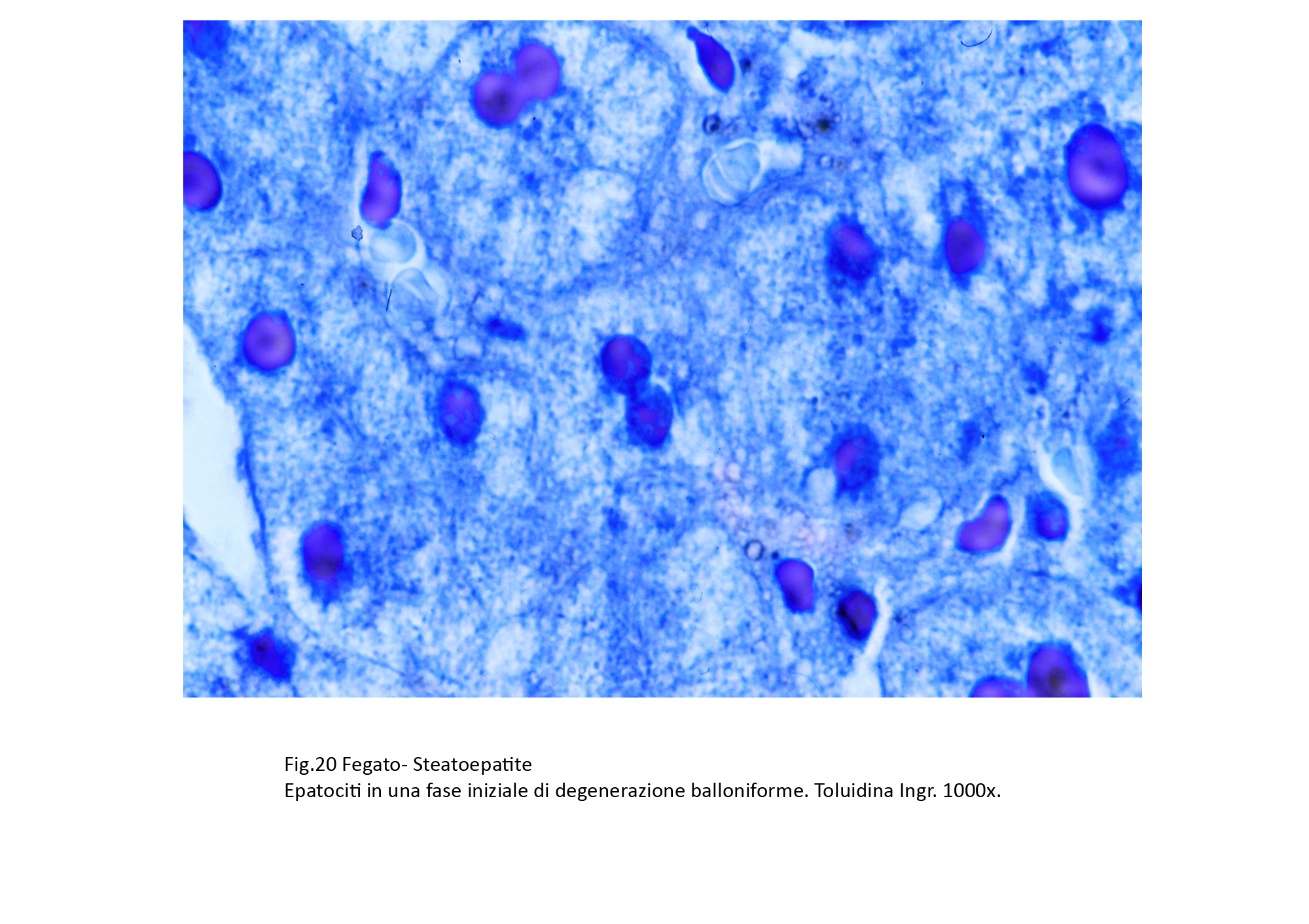 Fig.21
Fig.21 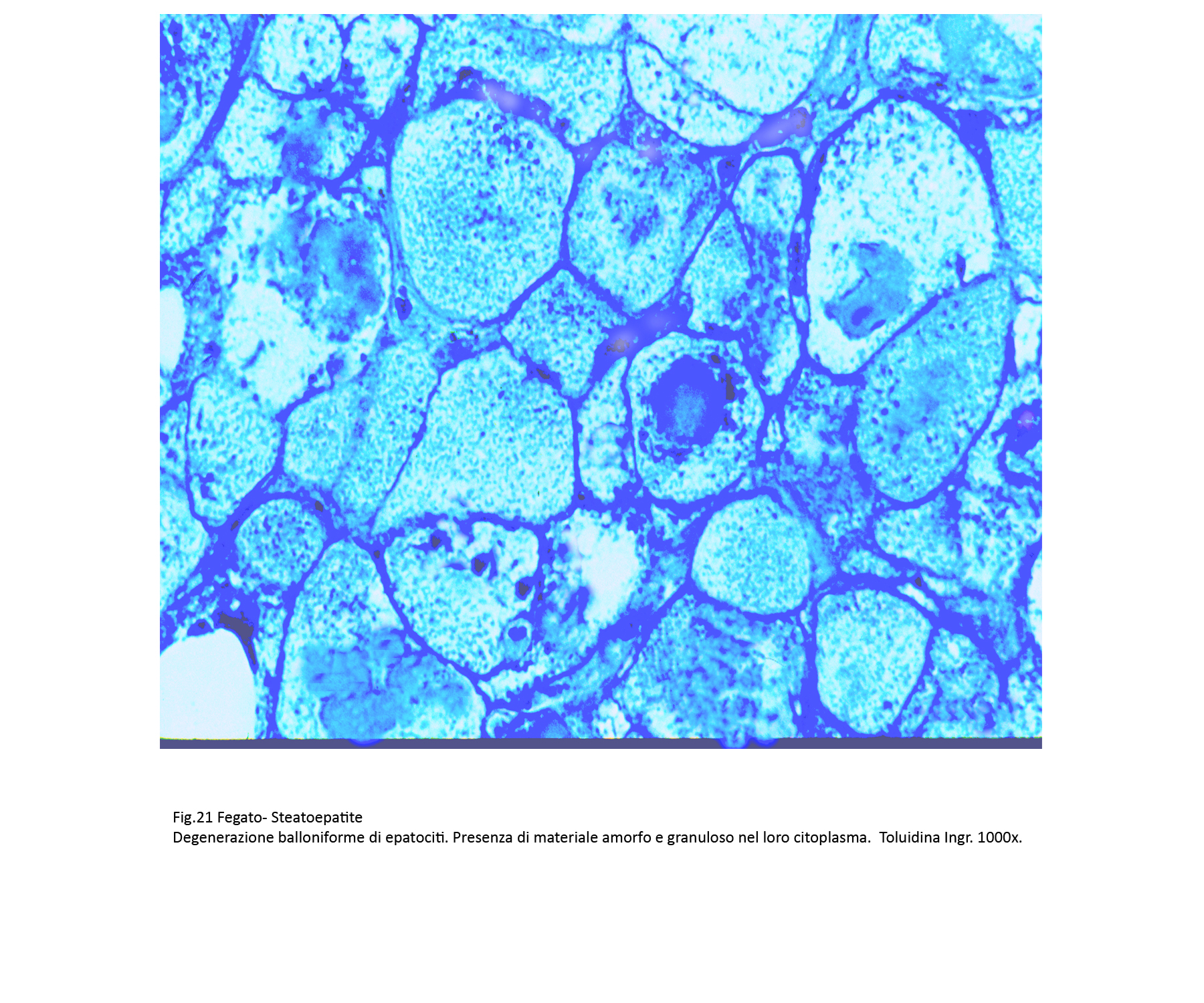 Fig.22
Fig.22 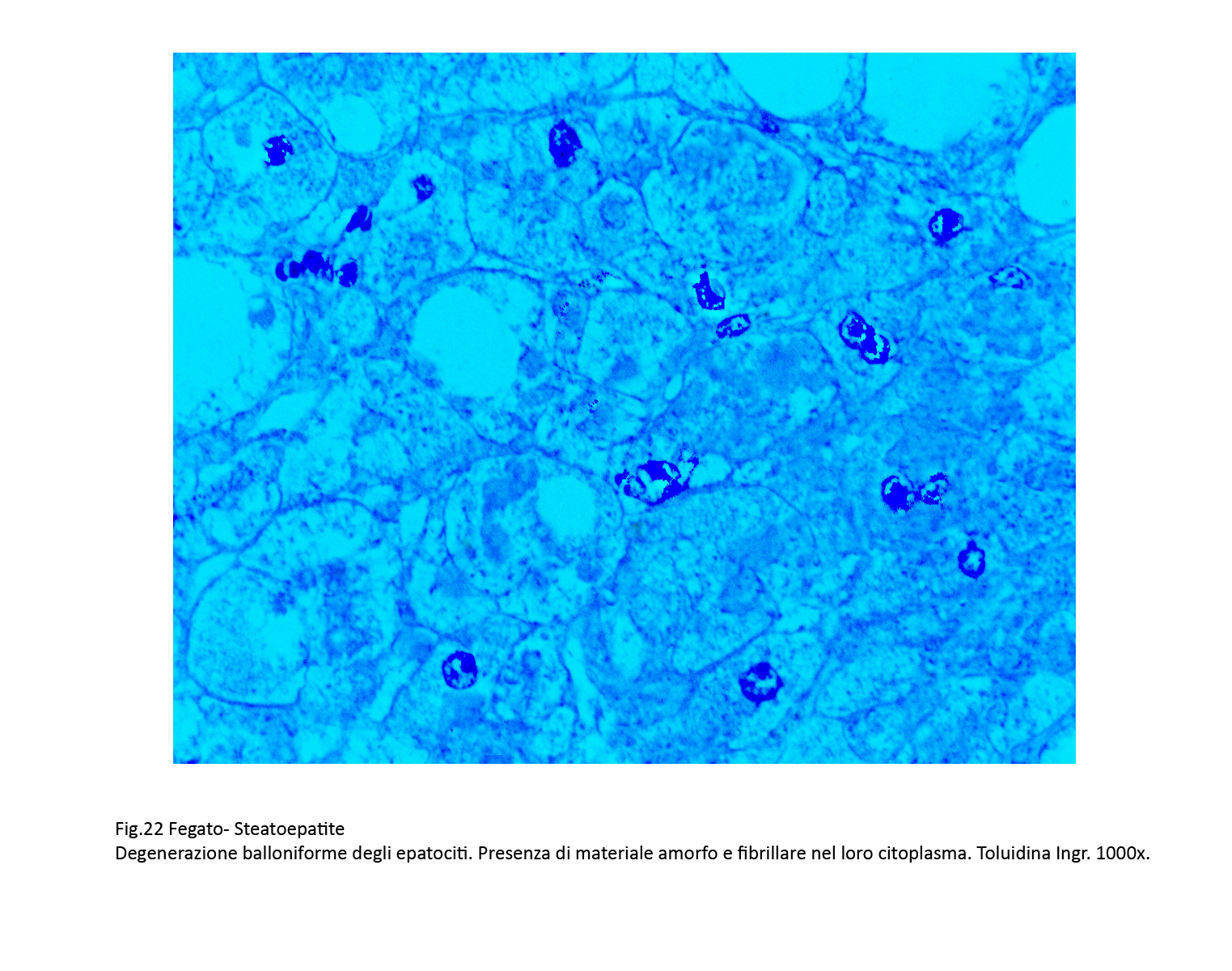
Fig.23 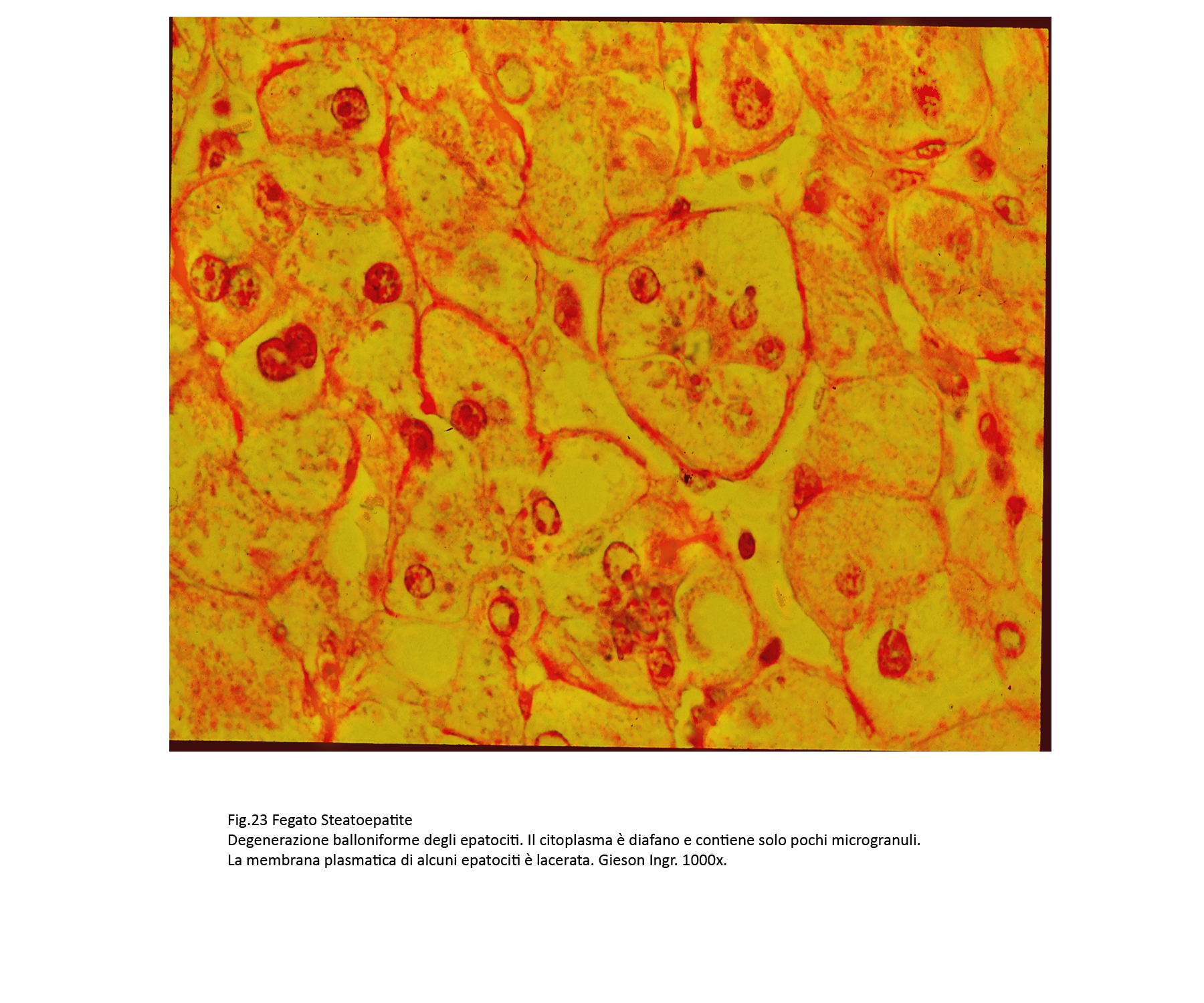 Fig.24
Fig.24 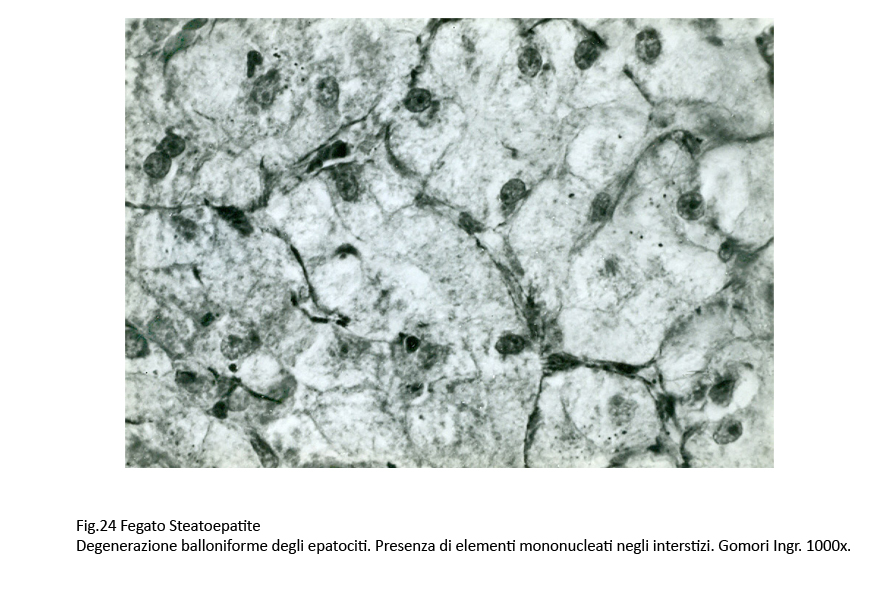
Anche questi epatociti, spesso, sono circondati da filiere di elementi flogistici cronici linfo-monocitari, macrofagici,con fibroblasti e con un affiorare di fibrille precollagene;il tutto, verosimilmente,è attivato da molecole riversate negli interstizi e provenienti dalla lisi degli epatociti.
Fig.25 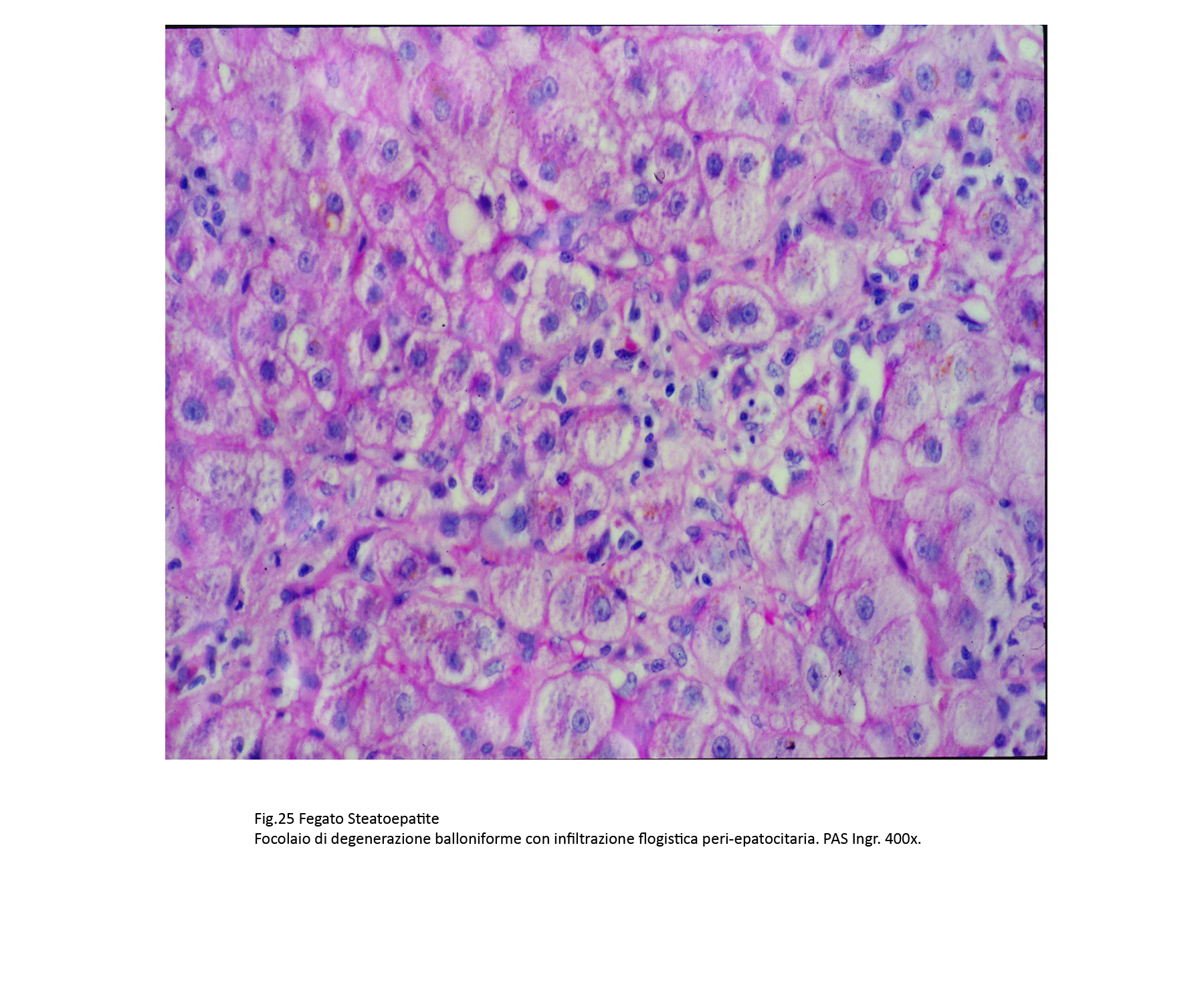 Fig.25bis
Fig.25bis 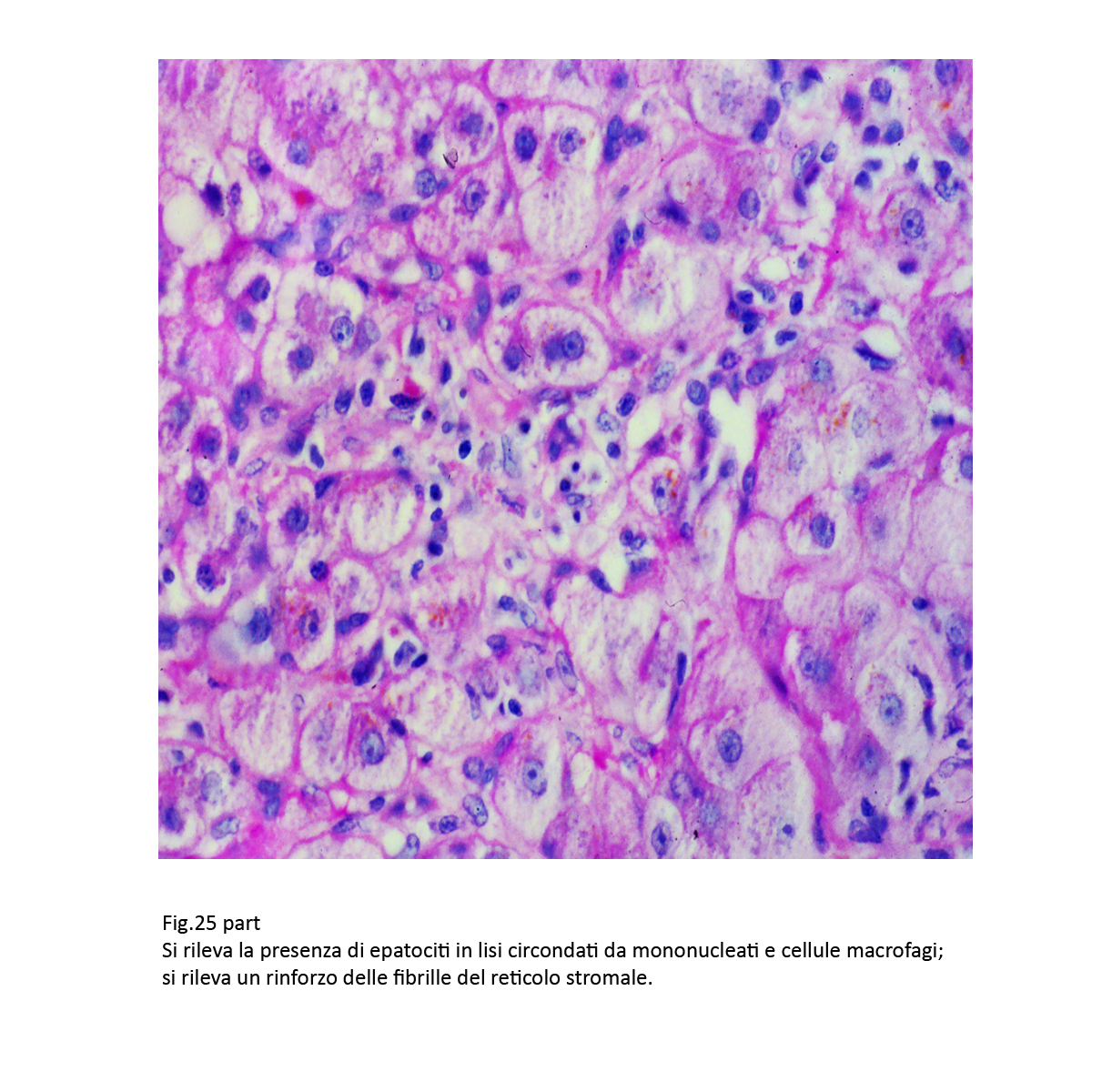 Fig.26
Fig.26 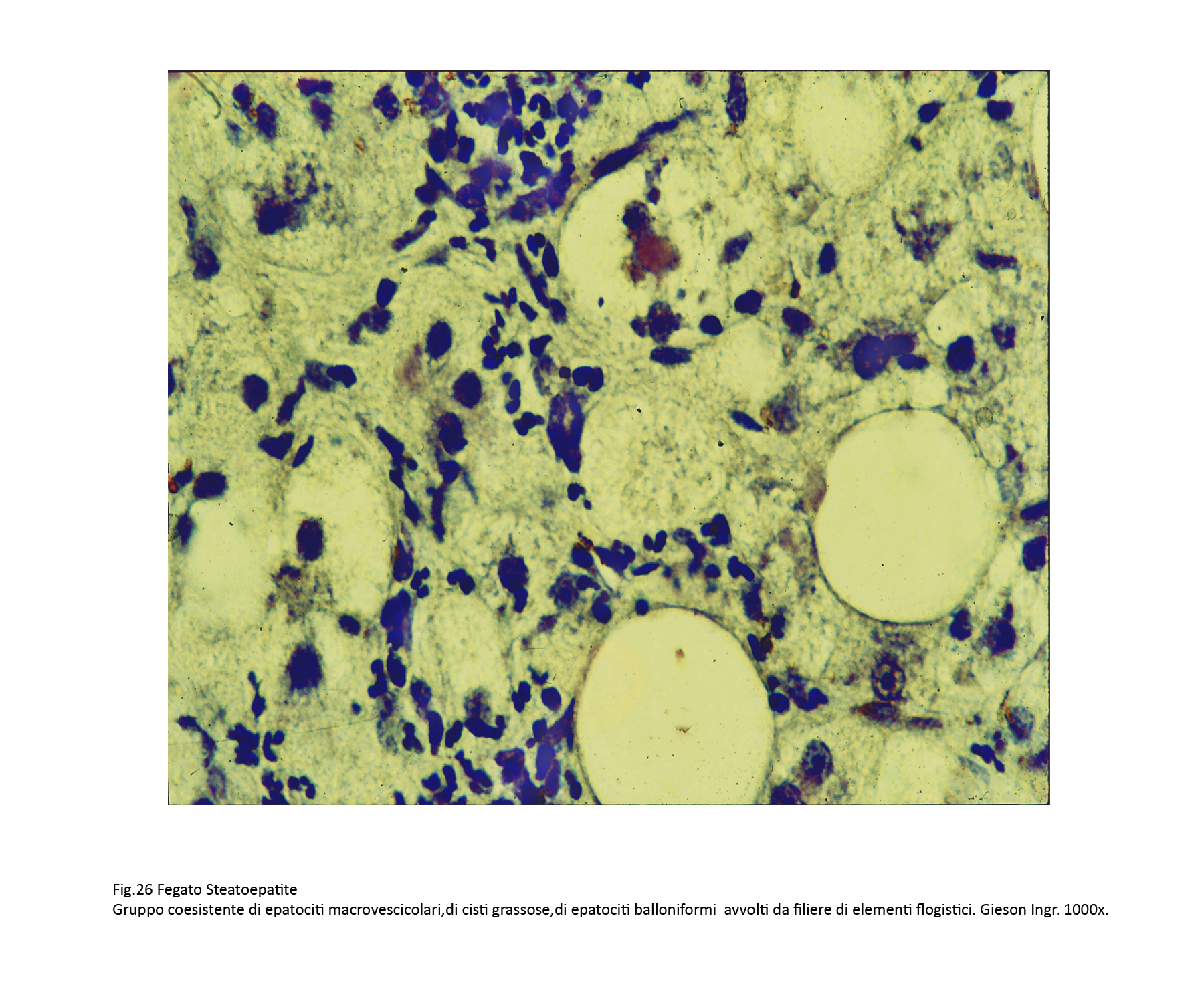
Fig.27 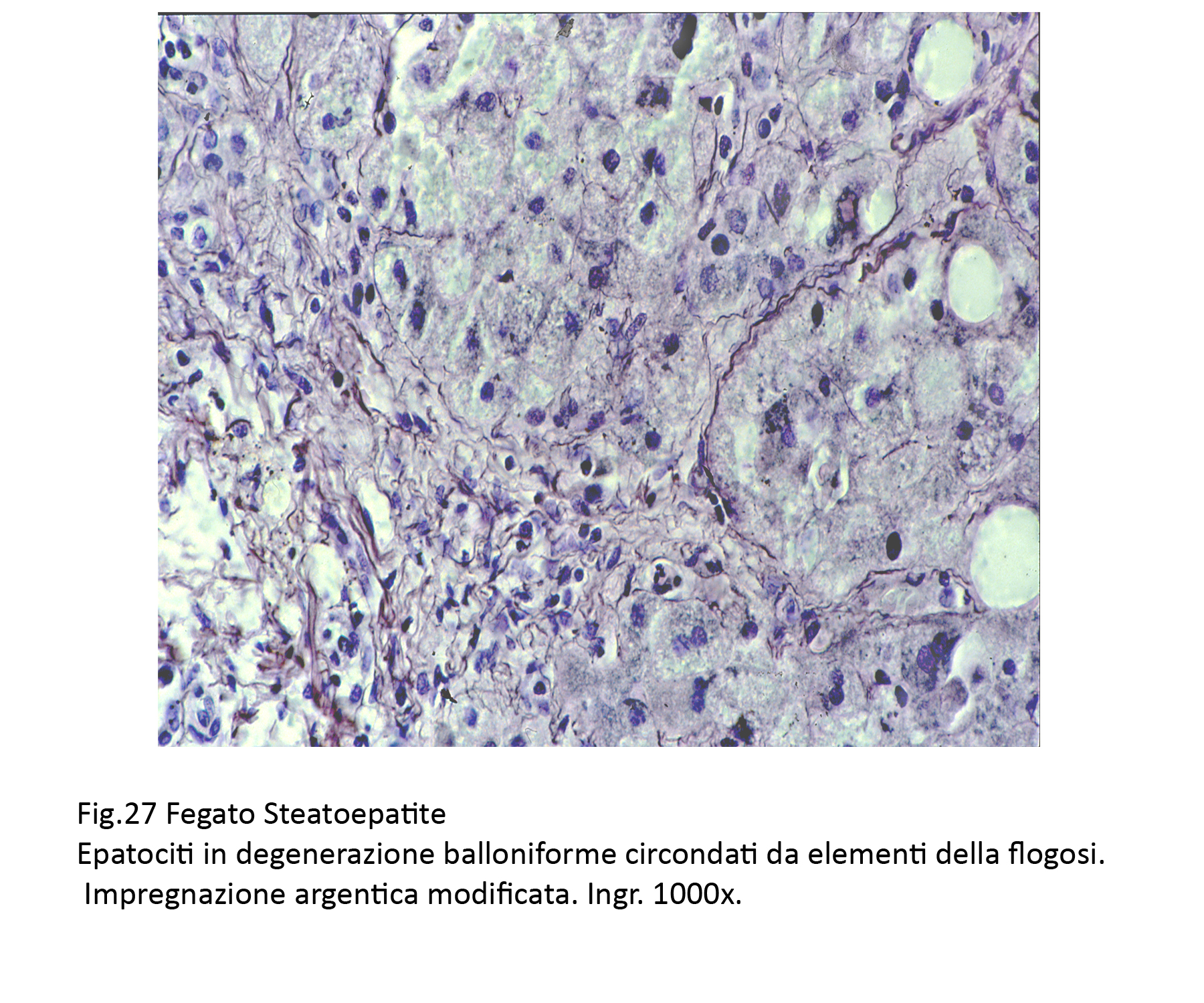 Fig.28
Fig.28 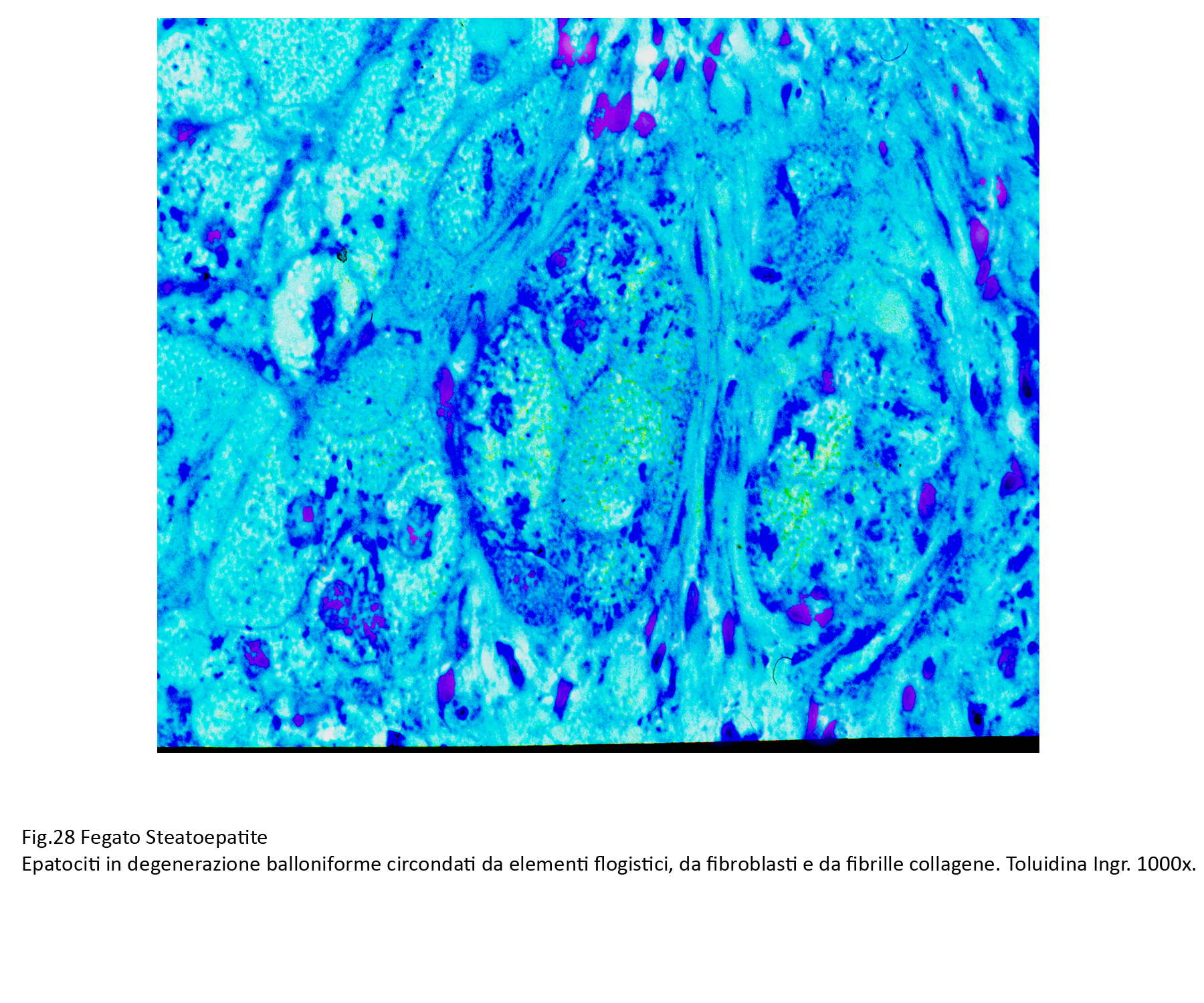 Fig.29
Fig.29 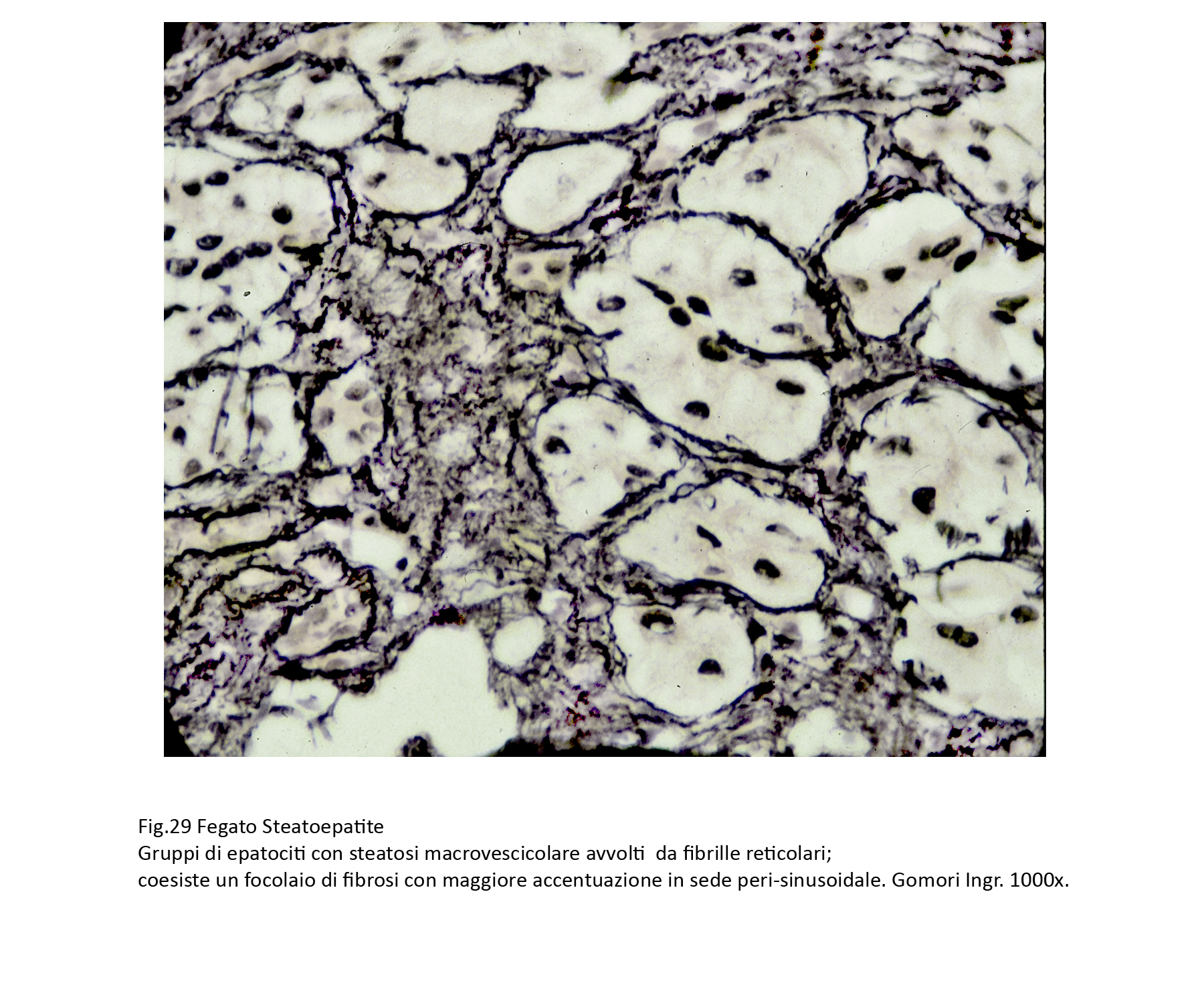
Fig.30 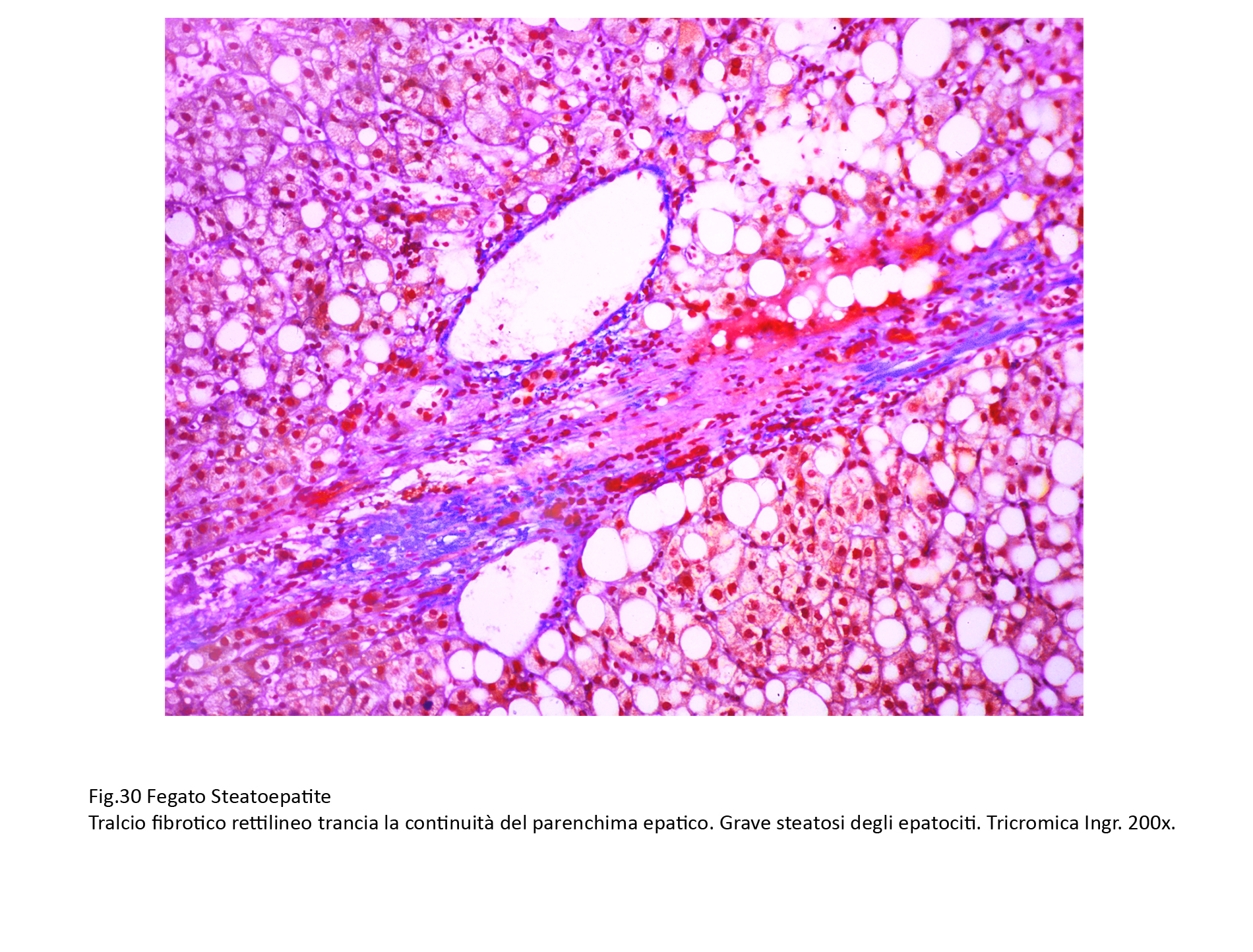 Fig.31
Fig.31 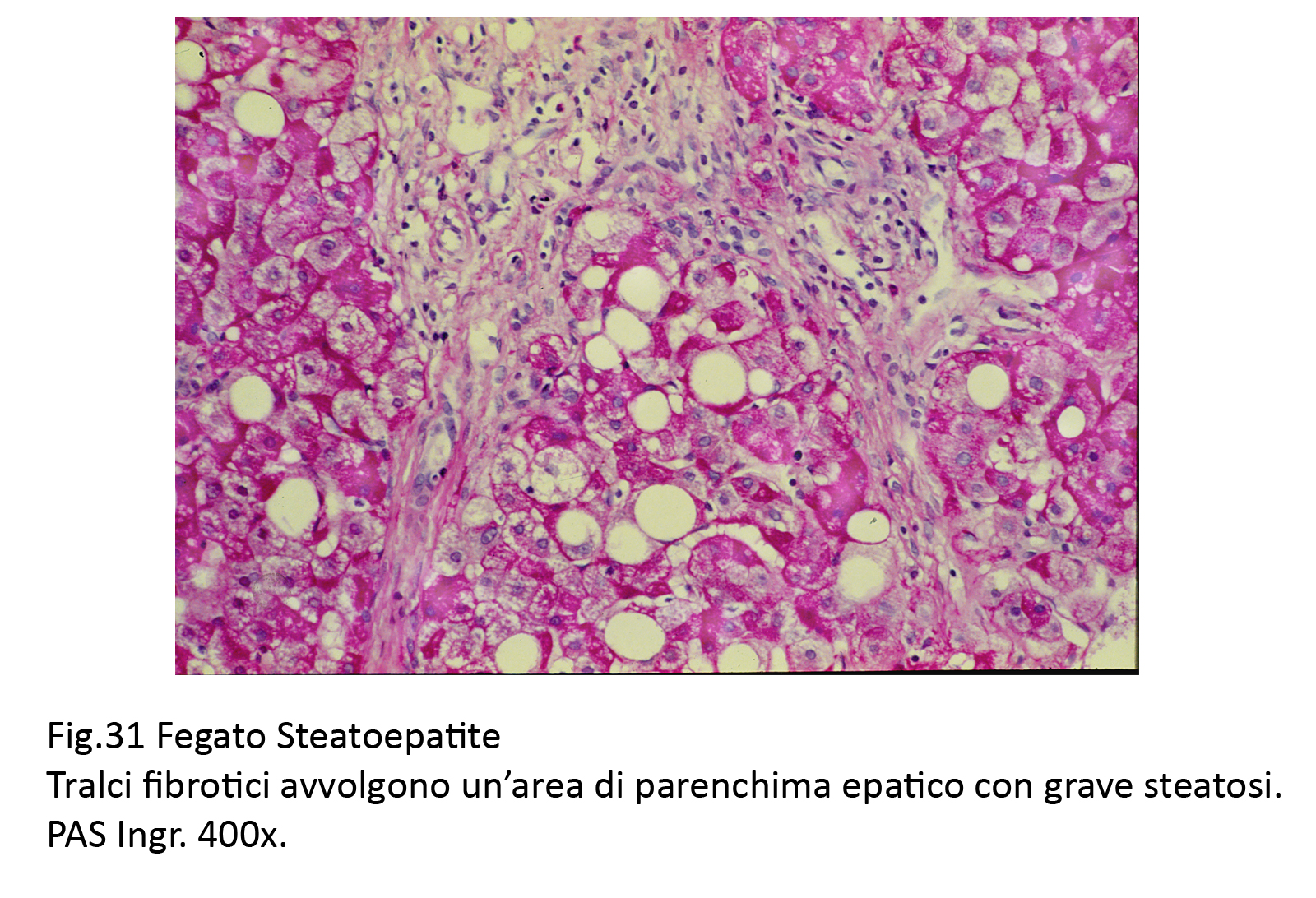 Fig.32
Fig.32 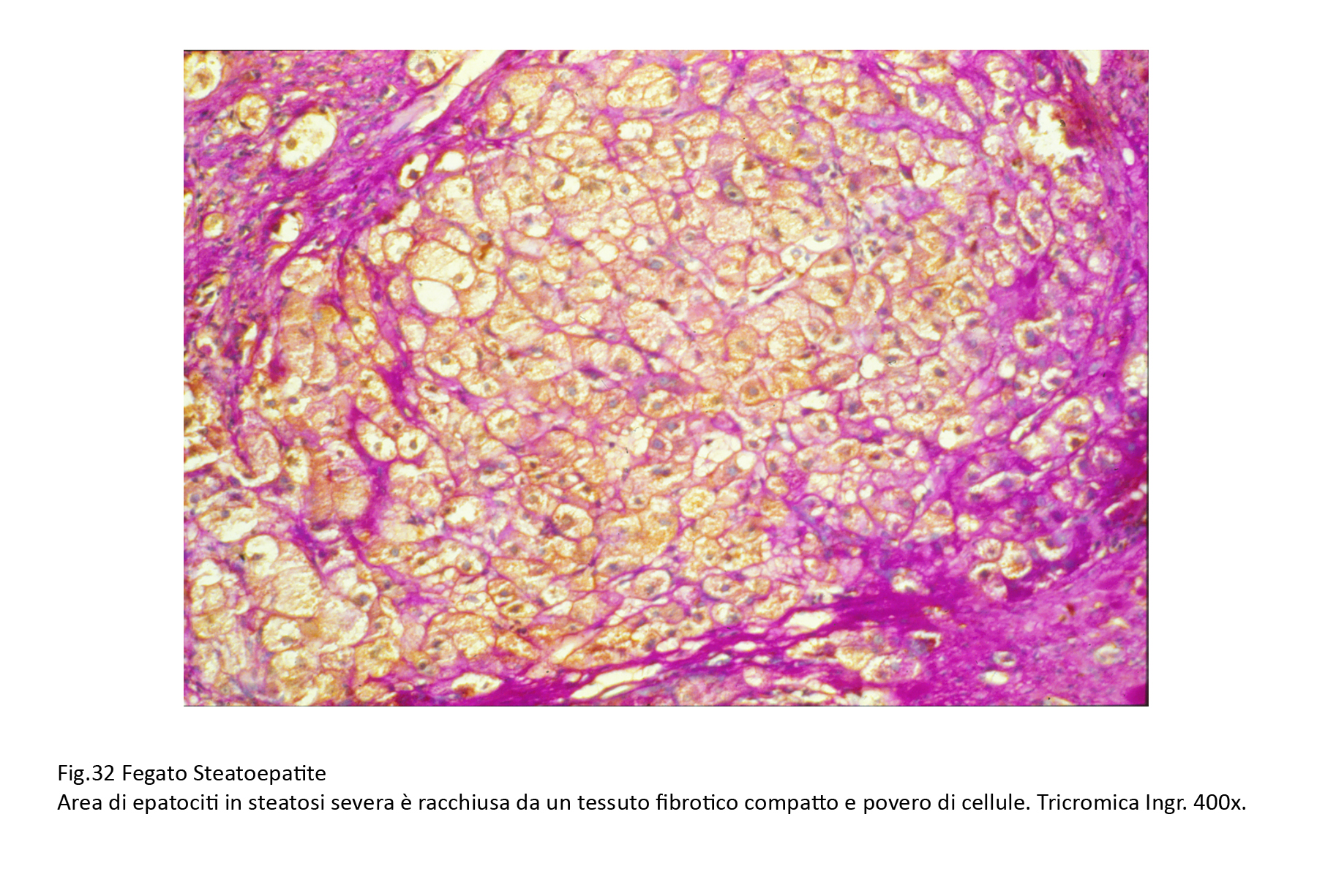
Fig.33 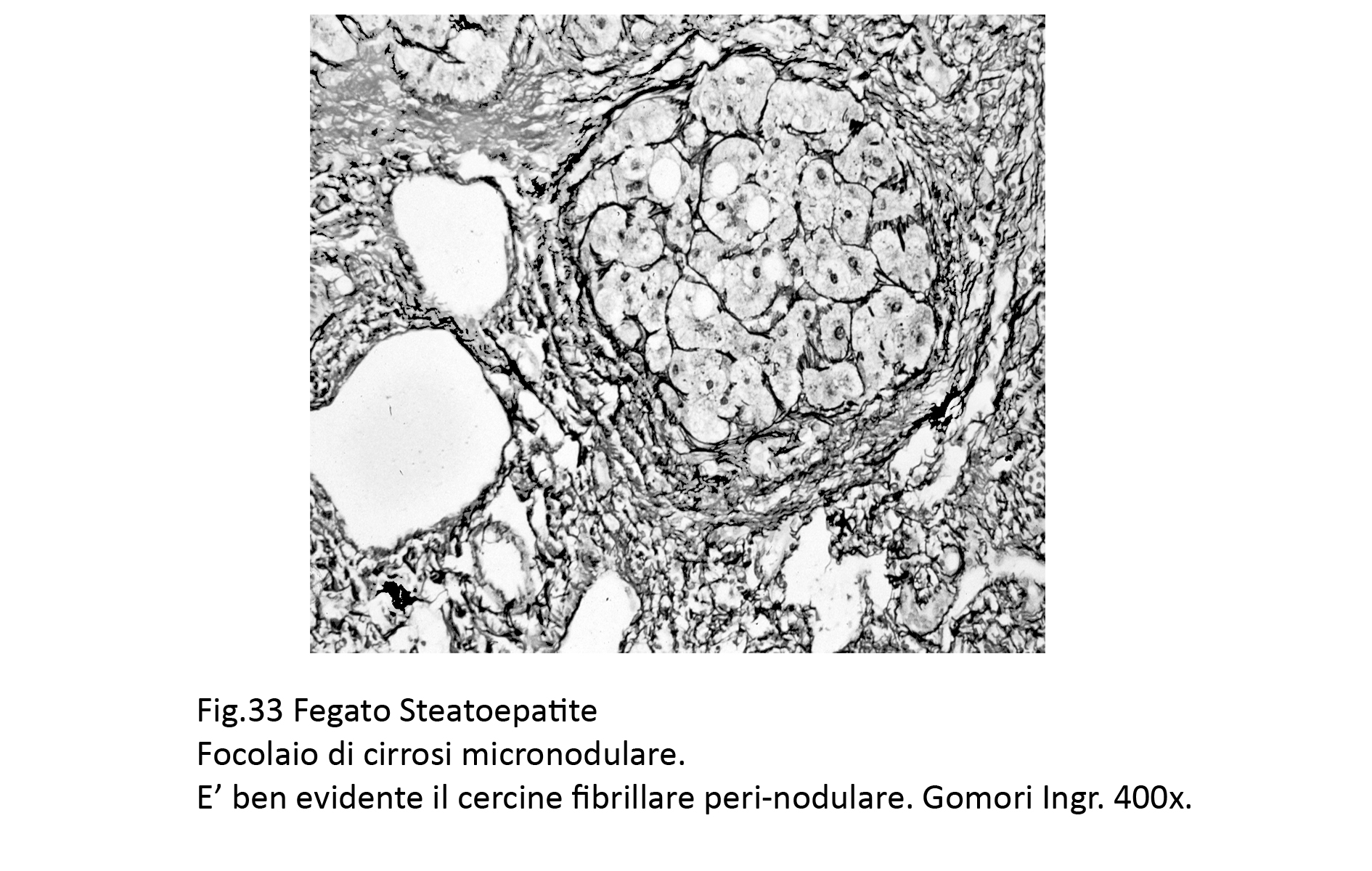
La sintesi di questo composito quadro istopatologico deve essere ricercata nella interconnessione e interazione dei processi degenerativo-necrotici con quelli flogistico-fibrotici. La loro valutazione richiede una lettura secondo criteri dinamico-evolutivi, poiché questi processi tendono ad acquisire nuovi caratteri per una maggiore incidenza dei processi di flogosi cronica e loro tramutarsi in composizione cellulare evolvente verso la fibrosi.Infatti si osserva la comparsa di fibroblasti e nel contempo un affiorare di fibrille precollagene e fibrille collagene a livello portale,periportale,intralobulare,a livello degli spazi di Disse; questo processo è progressivo e si tramuta in tralci fibrotici che sepimentano in modo irregolare il parenchima epatico fino a disegnare il quadro cirrotico
COMMENTO
L’approccio istopatologico della steatosi epatica e della steatoepatite è successivo all’acquisizione dei dati clinico-anamnestici e biochimico-metabolici in considerazione della assenza di alterazioni morfologiche specifiche e caratterizzanti.
La morfopatologia è indispensabile per l’acquisizione di una diagnosi di certezza, per escludere altre forme morbose associate, per formulare un indice circa la gravità del processo, per stabilire la sua stadi azione, per esprimere una valutazione concreta circa la sua capacità evolutiva , per differenziare la steatosi-steatoepatite dell’età pediatrica da quella dell’adulto.
Mediante osservazioni di istopatologia è possibile cogliere anche la sua unitarietà che inizia con il quadro di steatosi irreversibile evolve verso la steatoepatite e si conclude con la cirrosi, spesso complicata dal carcinoma epatocellulare.
Infatti, nella steatosi moderata-severa irreversibile compaiono processi di satellitosi periepatocitari sostenuti in prevalenza da linfociti e monociti. Questa presenza di elementi della flogosi, più accentuata attorno alle cisti grassose, rappresenta una fase iniziale delle manifestazioni flogistiche che si riscontrano nelle steatoepatiti.
.Nelle steatoepatiti in fase avanzata con focolai flogistici estesi anche agli spazi portali, alle vene entrolobulari con presenza di lipogranulomi e di microgranulomi intralobulari, con gravi alterazioni della rete sinusoidale si hanno modificazioni della composizione del quadro citologico della flogosi. Queste modificazioni sono rappresentate dalla comparsa sempre più accentuata di fibroblasti e con essi di fibrille pre collagene e collagene. Esse si appalesano attorno ai singoli epatociti steatosici o balloniformi, a livello degli spazi di Disse, a livello degli spazi portali e periportali, invadono i focolai granulomatosici e le sue sedi di flogosi. La comparsa di queste fibrille indica la transizione dalla fase flogstica a quella fibrogenetica che in modo evolutivo porterà alla cirrosi.
