Polo sinusoidale del fegato:
Le cellule di Kupffer
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica dell'Università della Campania "Luigi Vanvitelli"
Le cellule di Kupffer sono presenti negli spazi dei sinusoidi del fegato. Esse fanno parte del sistema mononucleare fagocitico (già sistema reticolo endoteliale) (Compr. Physiol. 2013; 3: 785-797).
Non costituiscono una popolazione cellulare di aspetto uniforme per la plasticità del loro fenotipo in rapporto alle loro funzioni conseguenti ai diversi stimoli alle quali sono sottoposte (Pflugers Arch. 2017; 469: 553-560).
Questa eterogeneità del fenotipo è stata rilevata e confermata mediante osservazioni su campioni di fegato umano e mediante prove sperimentali (J. Hepatol. 2017; 66: 1300-1312).
Tutto ciò è espressione morfo-funzionale di un adeguamento ai segnali fisiologici, parafisiologici e patologici provocati da molecole presenti nella corrente ematica o derivanti da cellule parenchimali e non parenchimali presenti nel fegato (Cell. Mol. Immunology 2016; 13: 316-327).
Queste cellule sono considerate quale popolazione macrofagica residente e la loro plasticità è finalizzata a mantenere l’omeostasi del fegato e/o favorire la guarigione mediante risposte rapide, mirate, specifiche (Nat. Rev. Immunol. 2017; 17: 306-321).
Esse, in modo continuo sono a contatto con proteine esogene ed endogene, con sostanze chimiche, con farmaci, con lipoproteine e glicoproteine alterate, con microbi provenienti dall’intestino, con materiali immuno-reattivi, con detriti cellulari, con agenti tossici, con cellule apoptotiche o comunque danneggiate , con virus patogeni e non patogeni e non ultimo con alti tassi di colesterolo e di diete iperlipidiche (J Clinic. Invest. 2017; 127: 55-64) ( Mol. Immunol. 2017; 85: 222-229).
Questo “contatto” avviene quasi sempre attraverso recettori localizzati su le superfici delle cellule di Kupffer (mediante i PRRs ,recognition receptors) che inducono un processo di attivazione caratterizzato dal rilascio di mediatori biologici attivi (citochine, chemochine, eicoesanoidi),di enzimi proteolitici,di ROS, di ossido nitrico,di regolatori delle cellule I, TNF,; questa attivazione è integrata da fenomeni di endocitosi , di fagocitosi, e dalla sintesi di antigeni APAC (potential antigen presenting).
Allorquando l’azione dannosa cessa, si manifestano segnali molecolari atti a stimolare i macrofagi per procedere a finalizzati processi riparativi (J. Hepat. 2009; 51: 212-223) (PLoS One 2013; 8-12): e81949) (J. Hepatol. 2017; 68: 1300-1312) (J. Clinic Invest. 2017; 127: 55-64).
In condizioni di fisiologia, le cellule di Kupffer rivelano anche un indice di tolleranza (fenotipo tolerogenico) allorquando vengono a contatto con antigeni innocui provenienti dall’intestino o con antigeni provenienti da cellule senescenti o in necrosi e trasportati dalla corrente ematica (Compr. Physiol. 2013; 3: 785-797) (mol. Immunol. 2017; 85: 222-229).
Molta attenzione è stata rivolta all’azione provocata dal flusso dei batteri intestinali su le cellule di Kupffer: E’ stato infatti accertato che queste cellule subiscono modificazioni morfologiche e funzionali indotte da questi batteri, indicati con al sigla MAMPs (Microbial-associated molecule patterns) (Am. J. Pathol. 2013; 182: 180-191).
Tra le molteplici attività di queste cellule, quelle particolarmente significative sono la endocitosi e la fagocitosi.
La prima, l’endocitosi, interessa i composti solubili; questi sono “endocitati” mediante l’attivazione di recettori presenti su la membrana plasmatica delle cellule di Kupffer.
Le molecole, così captate, sono raccolte in diverse piccole vescicole che tendono a fondersi in corpi vescicolari più voluminosi. In una fase successiva questi corpi vescicolari si fondono con lisosomi per la demolizione enzimatica del materiale così raccolto.
La seconda, la fagocitosi, è un processo finalizzata a ingolfare particelle solide mediante pseudopodi emessi dalle cellule di Kupffer. I frammenti così fagocitati sono avvolti da una membrana a monostrato formando così i corpi fagosomici; in una fase successiva questi corpi si fondono con i lisosomi, venendo così a costituire i fagolisosomi. Il materiale incorporato nei fagolisosomi viene sottoposto a digestione enzimatica,e dopo essere stato demolito è infine espulso. Le cellule di Kupffer fagocitano anche corpi apoptotici e frammenti cellulari derivanti da epatociti in lisi, da eritrociti, da neutrofili e da linfociti (Laboratory Investigation 2010; 90: 1805-1816).
La plasticità morfofunzionale di questi elementi rende difficile fissare in una descrizione standard la loro dettagliata morfologia. In modo generico e approssimativo sono stati identificati e descritti due citotipi, dei quali il primo è stato definito cellula di Kupffer attivata e il secondo è stato indicato cellula di Kupffer quiescente.
Il primo ( cellula di Kupffer attivata) è fornito di un ampio citoplasma, mostra superfici irregolari per la presenza di microvilli e microinvaginazioni della membrana plasmatica.
Il citosol è ipodenso o diafano ed è sostenuto da una ricca componente fibrillare del citoscheletro. Nel citosol sono raccolti, oltre agli organelli abituali (mitocondri, Golgi, reticolo endoplasmico, ergastoplasma), un numero variabile di lisosomi primari, di lisosomi secondari, di endosomi, di fagosomi e di fagolisosomi. L’area centrale di tali elementi è occupata da un grosso nucleo, di forma oblunga contenente ammassi di eterocromatina disposta alla periferia, a ridosso della membrana nucleare.
Il secondo citotipo (cellula di Kupffer quiescente) evidenzia una ridotta volumetria,ed è fornito di una quota citoplasmatica modesta; le superfici cellulari sono lisce, mostra un citosol compatto e solo zonalmente è sede di microvuacuoli. Gli organelli intracitoplasmatici sono rari e, in particolare, sono presenti solo pochi lisosomi primari. L’area centrale è tenuta da una massa nucleare eterocromatinica.
Tra questi due citotipi, descritti in modo schematico, sono repertabili numerosi altri con caratteri citomorfologici intermedi; questi caratteri sono variabili in rapporto al tipo, all’intensità e alla durata delle stimolazioni.
Tali variazioni sono correlate anche alle varie zone dell’acino epatico; è stato rilevato,infatti, che a livello peri-portale le cellule di Kupffer sono,più numerose, più voluminose, più attive per la fagocitosi (J. Hepatol. 2009; 51: 212-223).
Esiste anche una eterogeneità funzionale delle cellule di Kupffer quale risposta molecolare alle diverse situazioni morfofunzionali del parenchima epatico.
In proposito,sono stati evidenziati e descritti due sottotipi di tali cellule,i quali sono stati etichettati con le sigle M1 e M2.
Il sottotipo M1 è formato da cellule di Kupffer atte a sintetizzare e a rilasciare citochine pro-infiammatorie IL-6, IL-12, il TNF-a, i NoS, IL-1B, IL-18. Le cellule M1 attraverso le citochine pro-infiammatorie favoriscono l’arrivo e l’infiltrazione di linfociti T e di neutrofili, inducono la presenza di alti livelli di interferone gamma (IEN-Y) e di cellule natural Killer (CNT) e di IL-12 (Int. I. Biol. Sci. 2011; 7: 1273-1286).
Una dieta iperlipidica ed alti tassi di colesterolo ematico provocano una attivazione delle cellule M1 con incremento di citochine pro-infiammatorie e di TLR-4.
Il sottotipo M2 è dato da cellule di Kupffer capaci di sintetizzare in cospicua quantità citochine anti-infiammatori quali IL-10, H-1 e in piccole quantità mediatori pro-infiammatori, con azioni sul metablismo dei glicidi e dei lipidi.
Questa distinzione in due sottotipi, è in corso di ulteriore elaborazione e di definizione, poiché è riportato in letteratura la esistenza di sottoclassi delle cellule di Kupffer M2, sottoclassi denominate M2a, M2b, M2c (Compr. Physiol. 2013; 3: 785-797) (Curr. Mol. Med. 2016, 16: 809-819).
Le cellule di Kupffer sono elementi mobili, spostandosi in microaree sedi di flogosi e di necrobiosi, possono attraversare la barriera endoteliale e trovarsi negli spazi di Disse a contatto con le cellule stellate. In questi casi si ha il rilascio di citochine pro-infiammatorie, si ha attivazione delle cellule stellate con la produzione di matrice extracellulare e sintesi di collagene 1 negli spazi di Disse.
In condizioni di patologia epatica,le cellule di Kupffer sono sempre coinvolte in vario modo e con diversi indici di gravità; pertanto, l’elenco di tali processi transeunti o perduranti diventa difficile ed è sempre incompleto.
In questa sede, è possibile ricordare soltanto alcuni di tali processi tra i più significativi:
Le cellule di Kupffer intervengono nella regolazione del metabolismo lipidico e in diverse malattie metaboliche conseguenti a dis-regolazione lipidica del fegato, quali, per es. la IALD e NASH e nelle diverse forme di steatosi epatica; inoltre sono danneggiate dall’accumulo o dal metabolismodi lipidi tossici derivanti da lipoproteine ossidate (Compr. Physiol. 2013; 3: 785-797).(World J.Hepatol.2015;7:2184-2188).
Molecole provenienti da epatociti danneggiati o in lisi (DAMP= damage-endogenous-associated-molecular- pattern), molecole derivanti da stati di disbiosi della mucosa intestinale,e da passaggi di batteri in soggetti obesi (PAMP= Pathogen associated molecular pattern) non solo attivano le cellule di Kupffer ma provocano successivamente l’infiltrazione di linfociti e neutrofili (World J. Hepatol. 2015; 7: 2184-2188).
Anche nelle steatoepatiti alcooliche e non alcooliche le cellule di Kupffer si attivano e mostrano i segni morfologici della fagocitosi, con frequente coinvolgimento di neutrofili,e di linfociti (Modern. Pathology; 2002: 15: 699-704 )
Le epatopatie autoimmuni,oltre i loro specifici caratteri morfologici ed evolutivi,si accompagnano a disfunzioni delle cellule di Kupffer. (Mol. Med. Rep. 2016; 13: 3874-3880).
I processi di rigenerazione epatica,indotti da varie situazioni patologiche,hanno come aspetti significativi una iperplasia e una attivazione delle cellule di Kupffer (Pflungers Arch. 2017; 469: 553-560).
Le cellule di Kupffer sono direttamente coinvolte anche nel corso di processi neoplastici primitivi o secondari del fegato. La loro risposta bio-morfologica è bi-modale: nelle fasi iniziali del processo neoplastico svolgono azione inibitoria, successivamente in modo indiretto ne favoriscono l’impianto e la crescita.
L’attivazione di queste cellule provoca, tra l’altro, la produzione di fattori pro-angiogenetici e il rilascio di VEGF, di IL-8, di IL-6, di TNF-a e sostanze capaci di modificare la matrice extracellulare (Cancer Biol. Ther 2013; 14: 606-613).
REPERTI SELEZIONATI
I reperti riguardanti cellule di Kupffer qui di seguito presentate sono stati selezionati da casi di epatiti virali croniche, di steatosi semplice, di steatopatite non alcoolica o alcoolica. Sono stati prescelti campi microscopici nei quali la struttura sinusoidale appariva ben disegnata, sebbene fossero presenti fenomeni di rigonfiamento o di desquamazione degli endoteli di rivestimento.
Le osservazioni ultrastrutturali hanno evidenziato in modo costante la esistenza sia di cellule di Kupffer modificate nella loro morfologia sia cellule di Kupffer sedi di processi regressivi ingravescenti fino alla necrosi.
Si rimane consapevole che quanto osservato rappresenta solo un piccolo, ridotto incompleto elenco rispetto alla già ricordata eterogenea plasticità morfologica di questi elementi esposti alle innumerevoli sostanze interne ed esterne e agli agenti patogeni che in modo diretto o indiretto agiscono su tali cellule.
RILIEVI DI ISTOLOGIA
Quale introduzione alle descrizioni ultrastrutturali sono sintetizzati alcuni rilievi di istologia. La microarchitettura dei sinusoidi è fornita del rivestimento endoteliale e gli spazi endosinusoidali sono occupati da cellule di Kupffer.
Queste osservazioni al microscopio luce,condotte soprattutto su sezioni semifini, documentano sia la possibilità, in condizioni di varia patologia, di processi iperplastici sia di fenomeni regressivi di vacuolizzazione o di necrobiosi.
A sostegno di tale asserto, si documenta nella Fig 1 uno stato iperplastico- proliferativo delle cellule di Kupffer; nelle figg.2-3 si ritrovano tali elementi con caratteri dimetrici,voluminosi e sede di processi regressivi: nelle figg.4-5 sono riprodotte cellule di Kupffer con citoplasma in disfacimento per processi di necrosi.
fig.1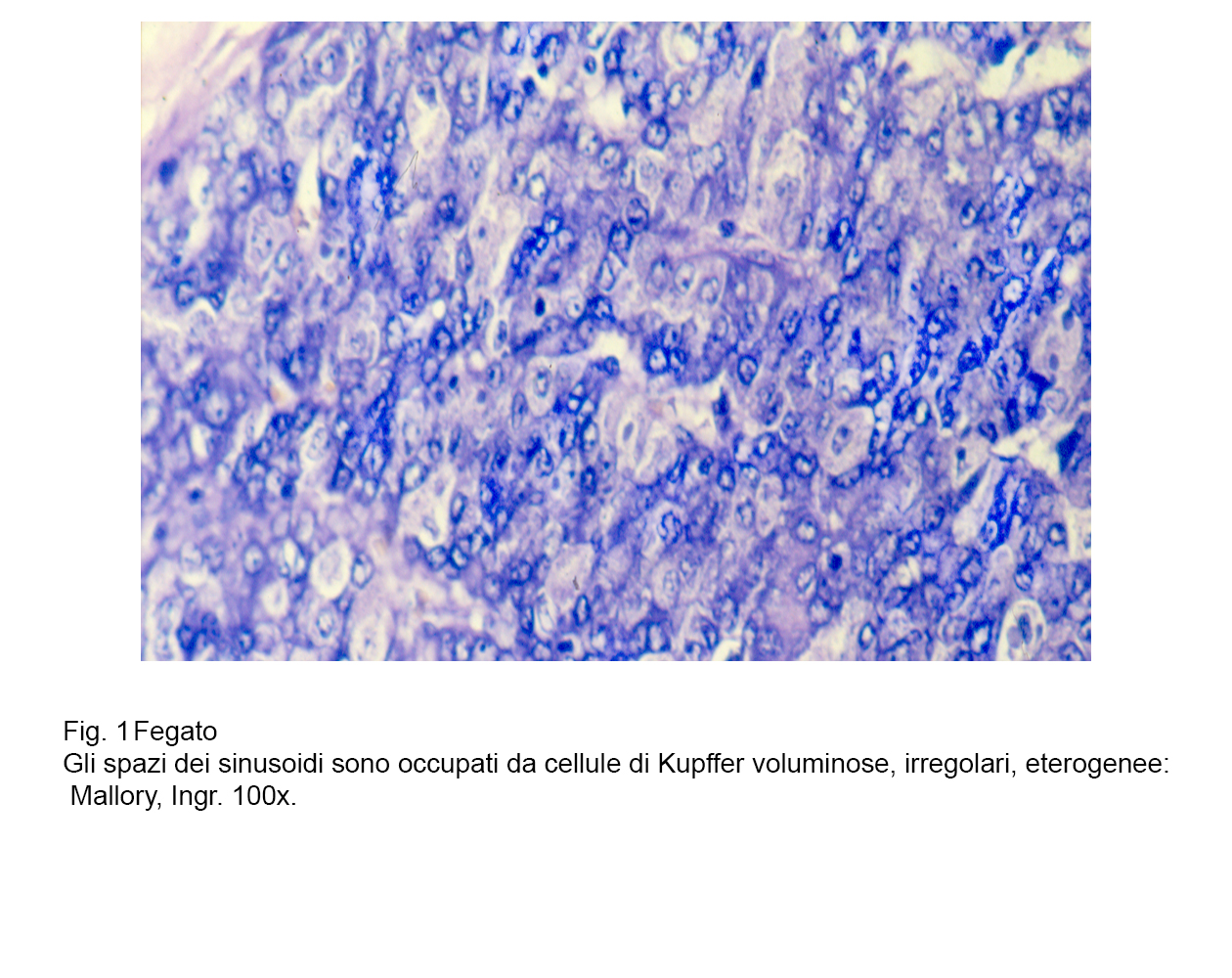 fig.2
fig.2 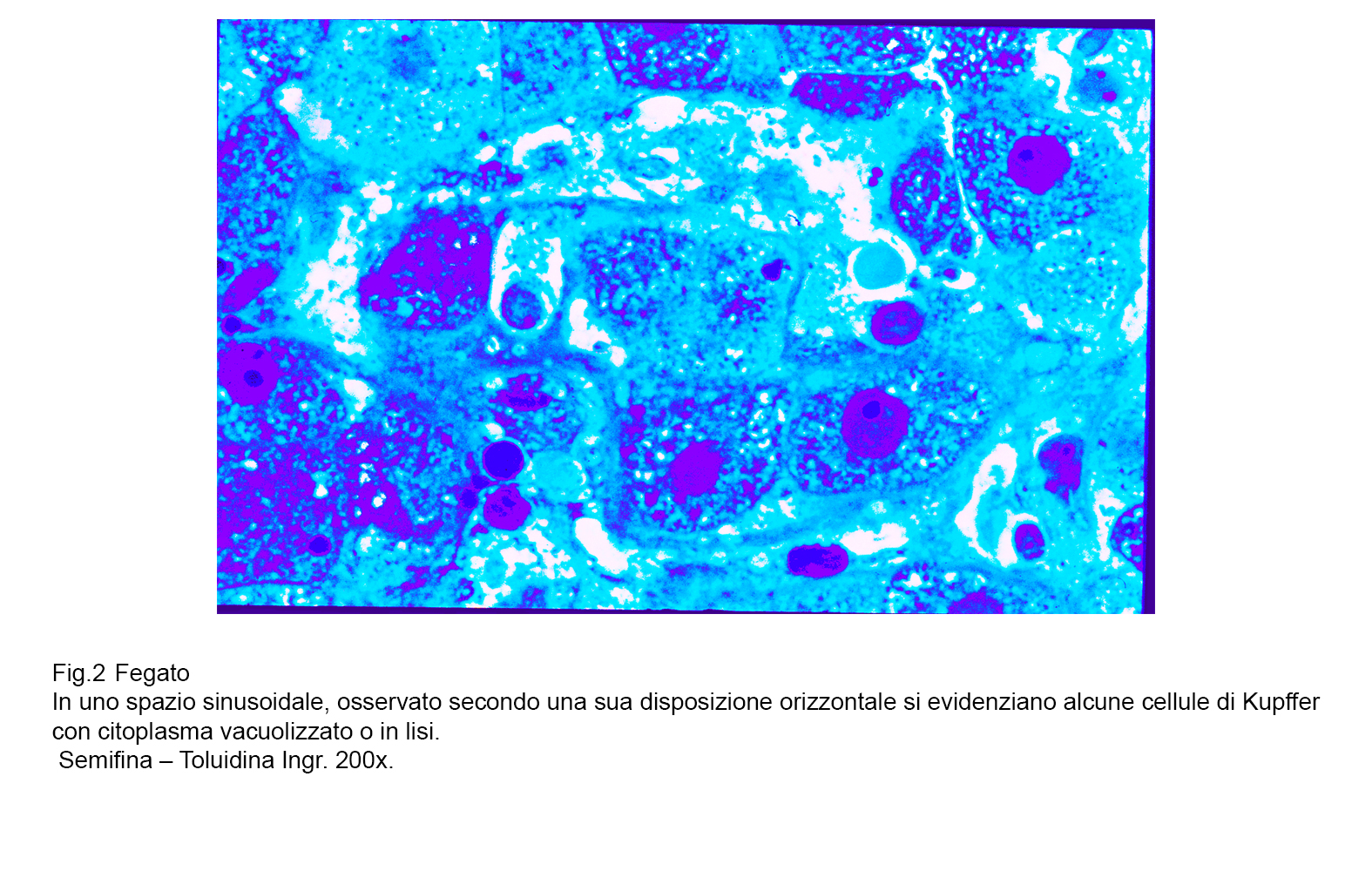
fig.3  fig.4
fig.4 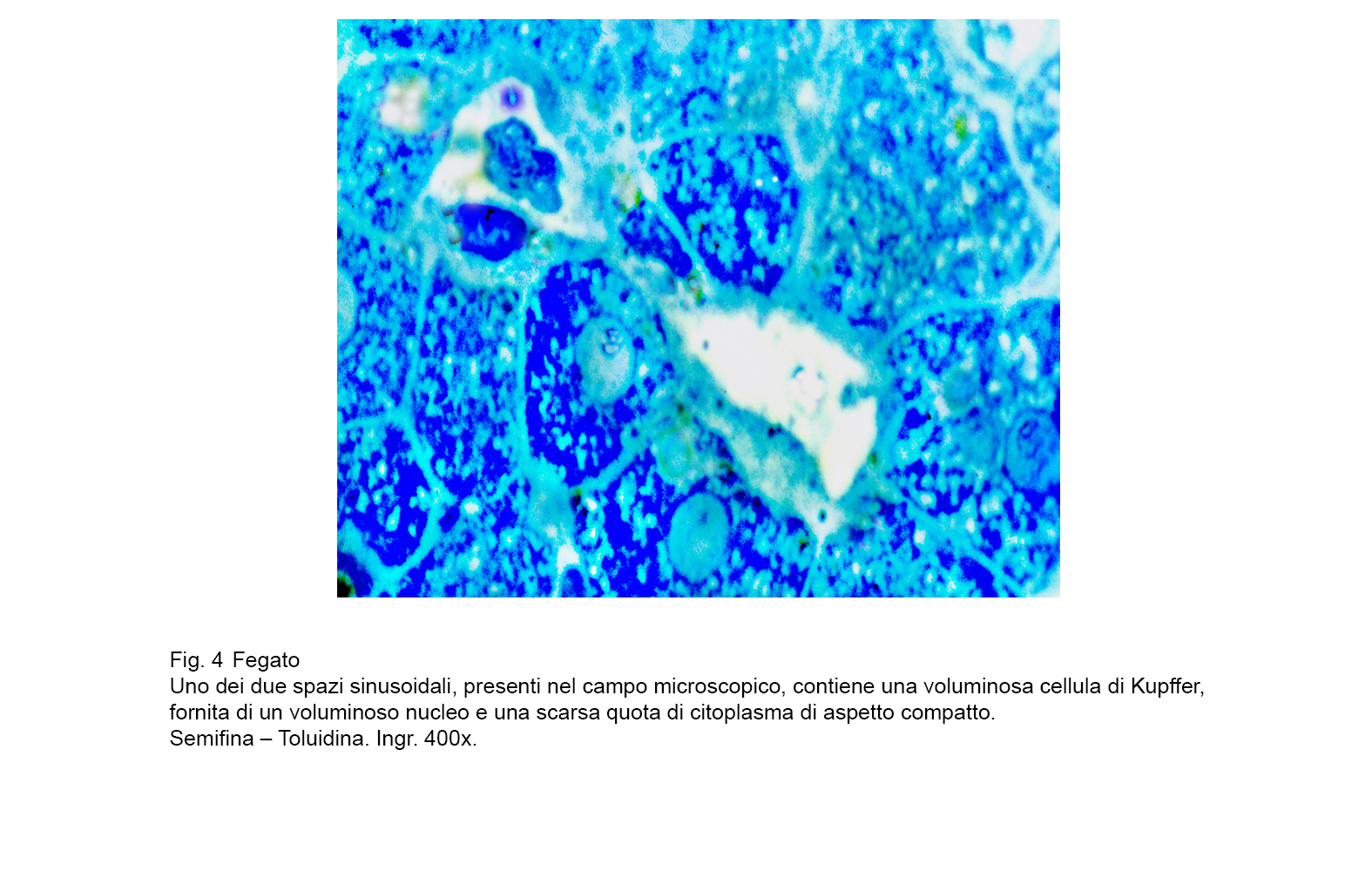
fig.5 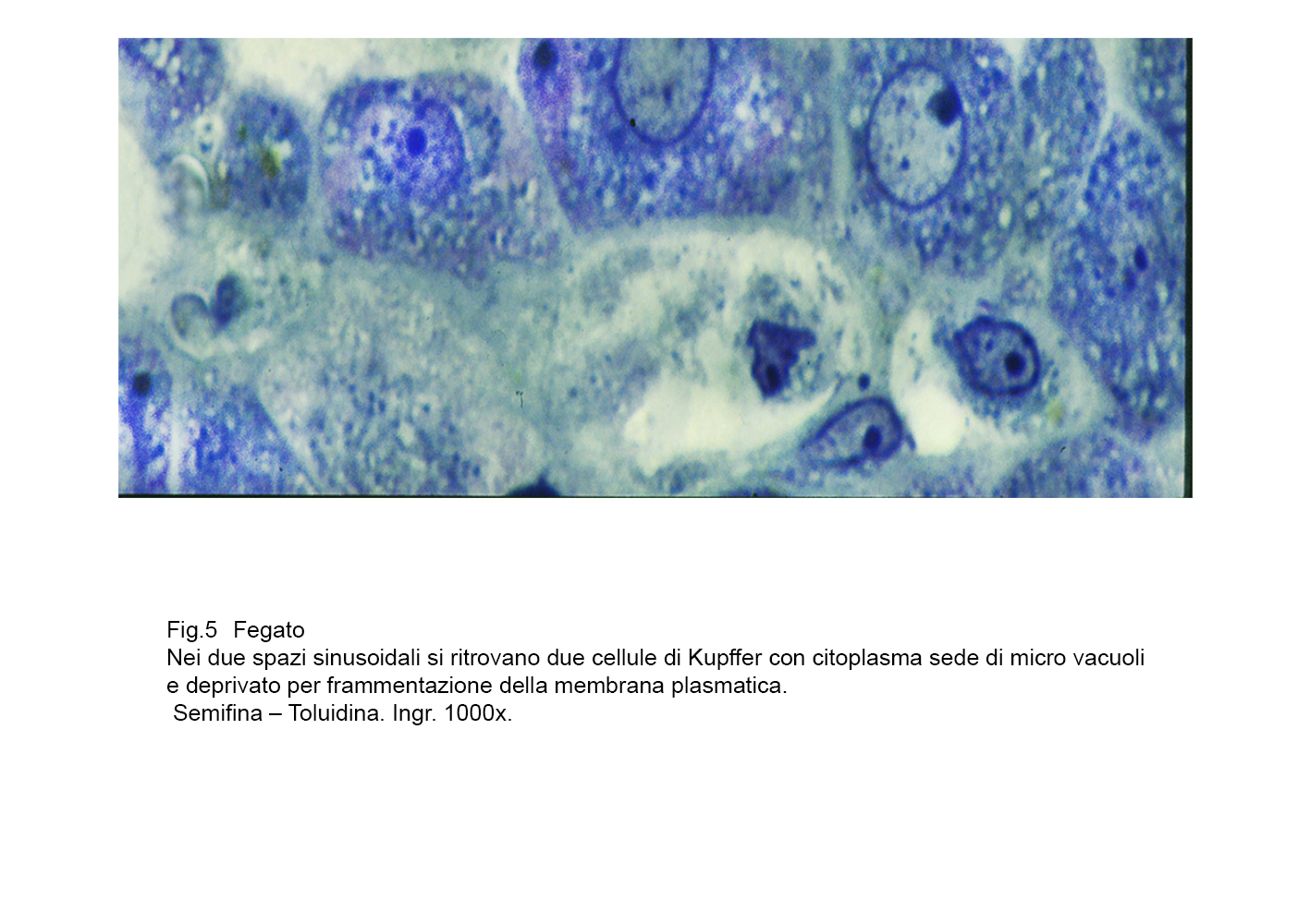
CARATTERI ULTRASTRUTTURALI
Le cellule di Kupffer selezionate per la presente nota riguardano:
- Cellule di Kupffer attivate
- Cellule di Kupffer quiescenti
- Cellule di Kupffer con processi regressivi
- Cellule di Kupffer in necrosi
- A Cellule di Kupffer attivate:
Questo fenotipo è dato da cellule di Kupffer voluminose, spesso occupanti quasi l’intero spazio sinusoidale.
Questi elementi sono forniti di una membrana plasmatica ben disegnata ed evidenziano superfici irregolari, per la presenza di microvilli e invaginazioni.
Sono centrati da un grosso nucleo, spesso ovoidale, allungato, irregolare, il quale è occupato da ammassi di eterocromatina raccolta preferenzialmente a ridosso della membrana nucleare.
Il citoplasma è ampio ed è costituito da un citosol ipodenso, nel quale si ritrovano fibrille retiformi del citoscheletro.
In tale struttura di base si raccoglie una componente caratterizzante queste cellule la quale è rappresentata dal grande numero di lisosomi primari e secondari con presenza anche di fagosomi e di endosomi di varie dimensioni.
Questa componente, quantitativamente molto espressa, maschera in buona parte la esistenza di mitocondri, di campi golgiani, di brevi strutture ergastoplasmatiche e di piccole cisterne del reticolo endoplasmico.
fig.6 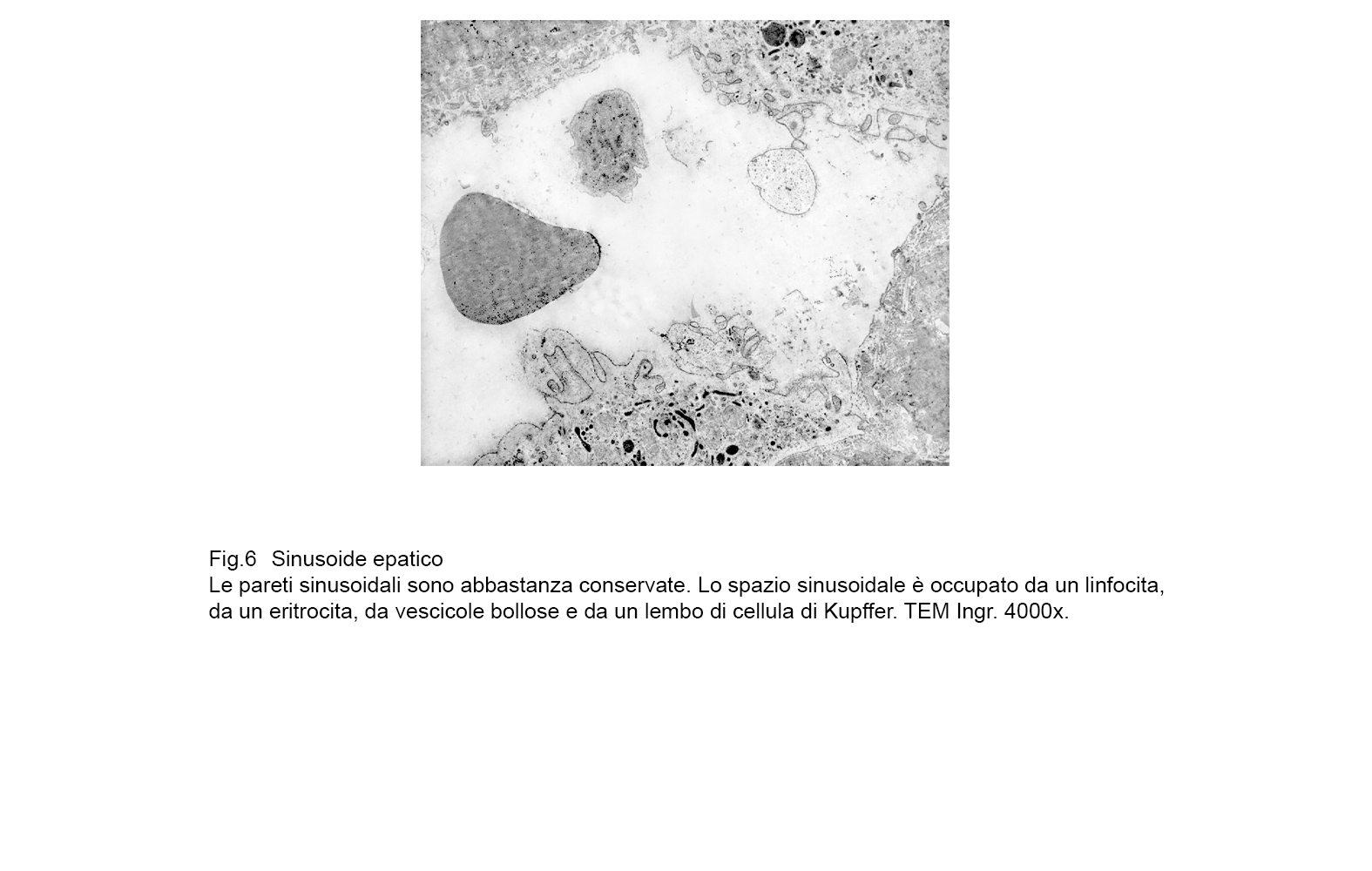 fig.6a
fig.6a 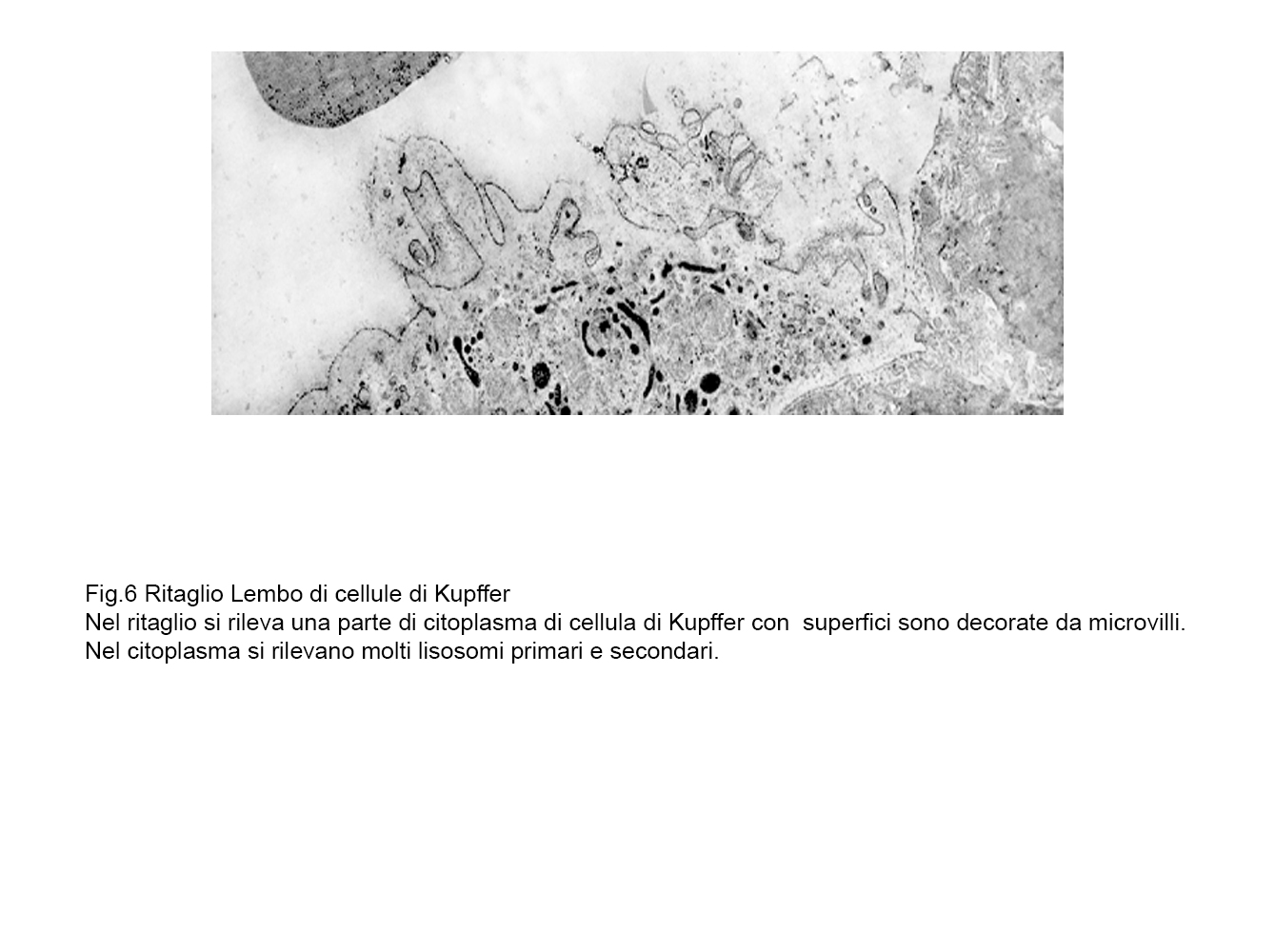
fig.7 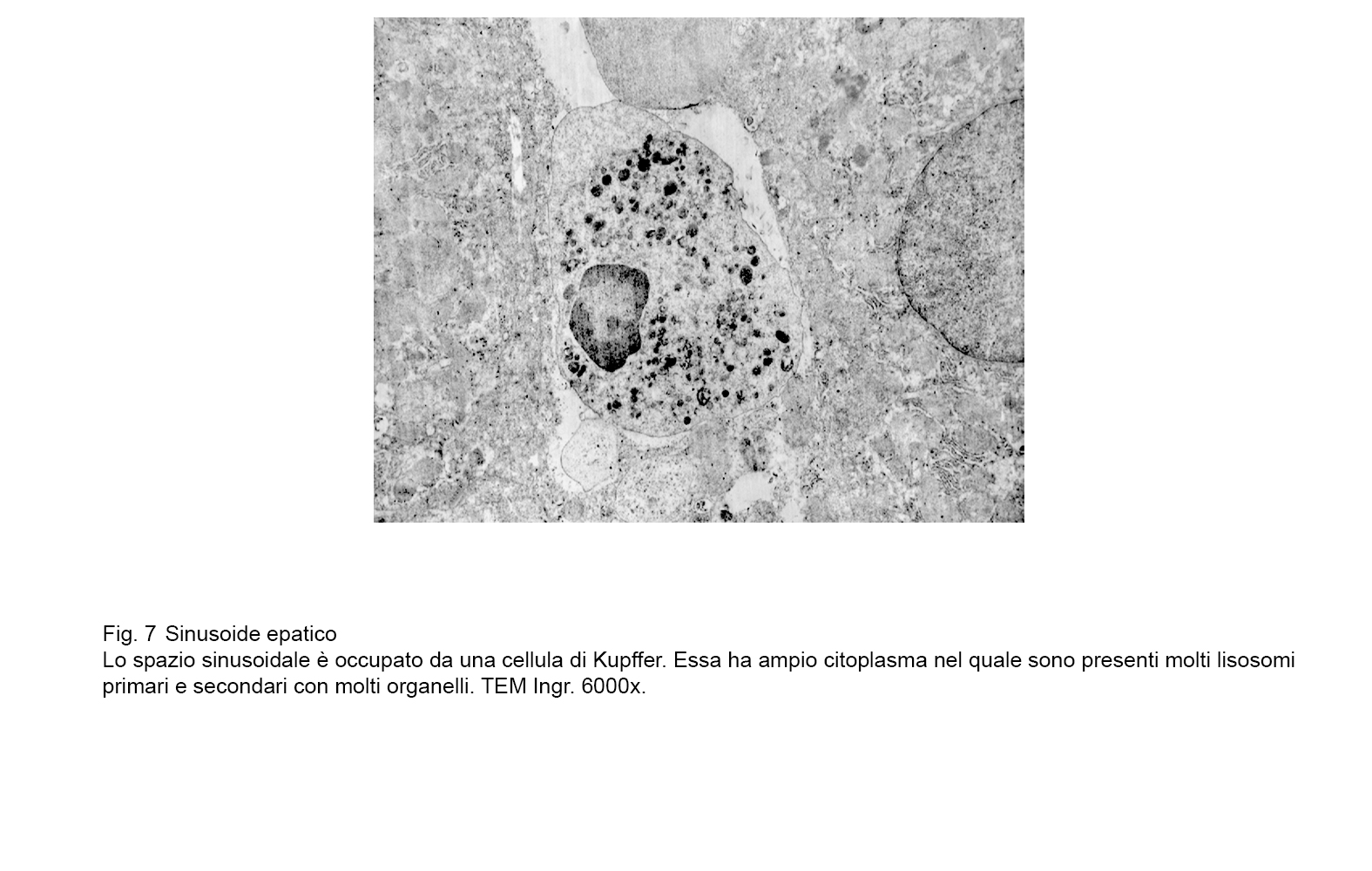 fig.7a
fig.7a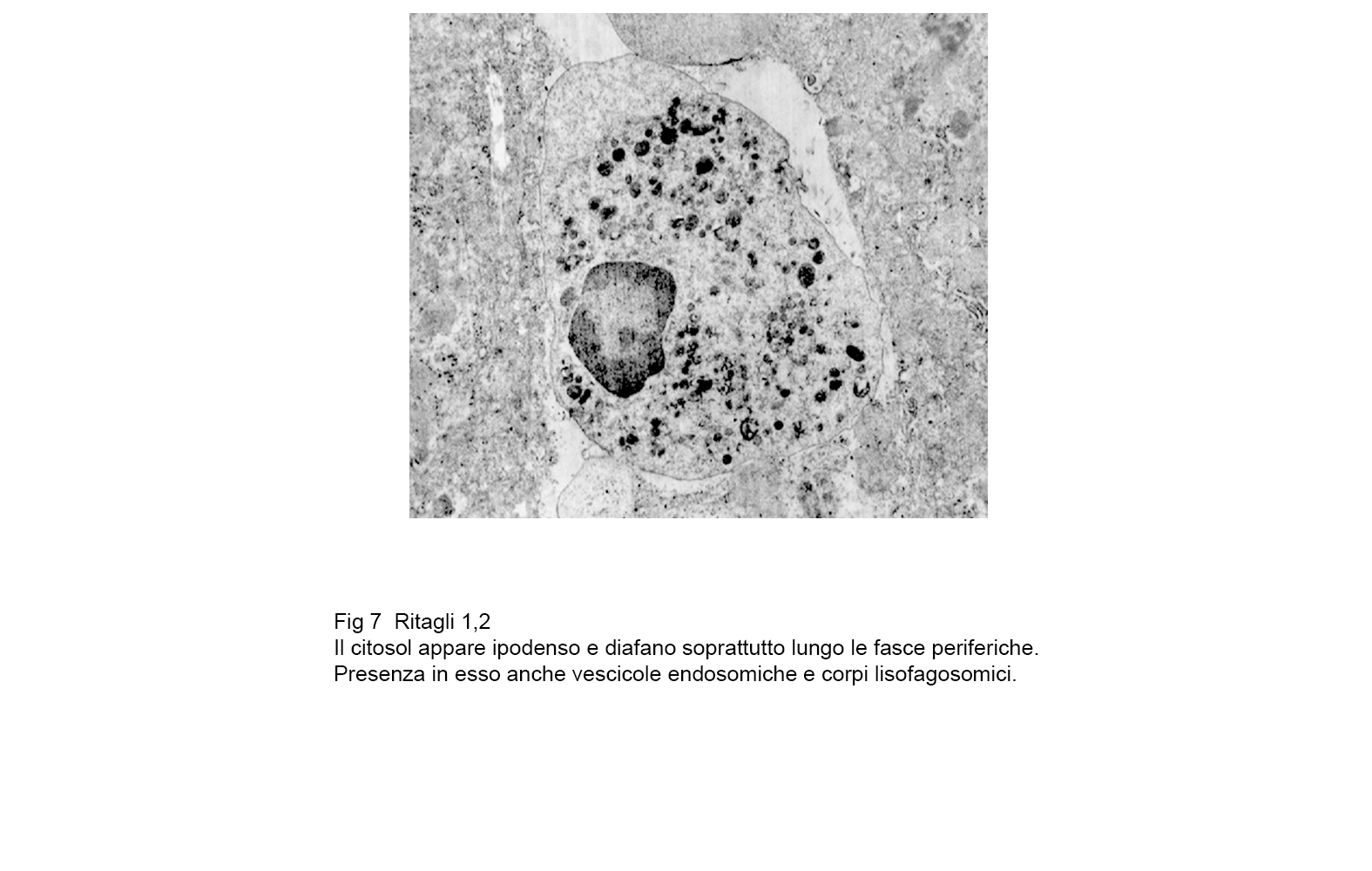
fig.8 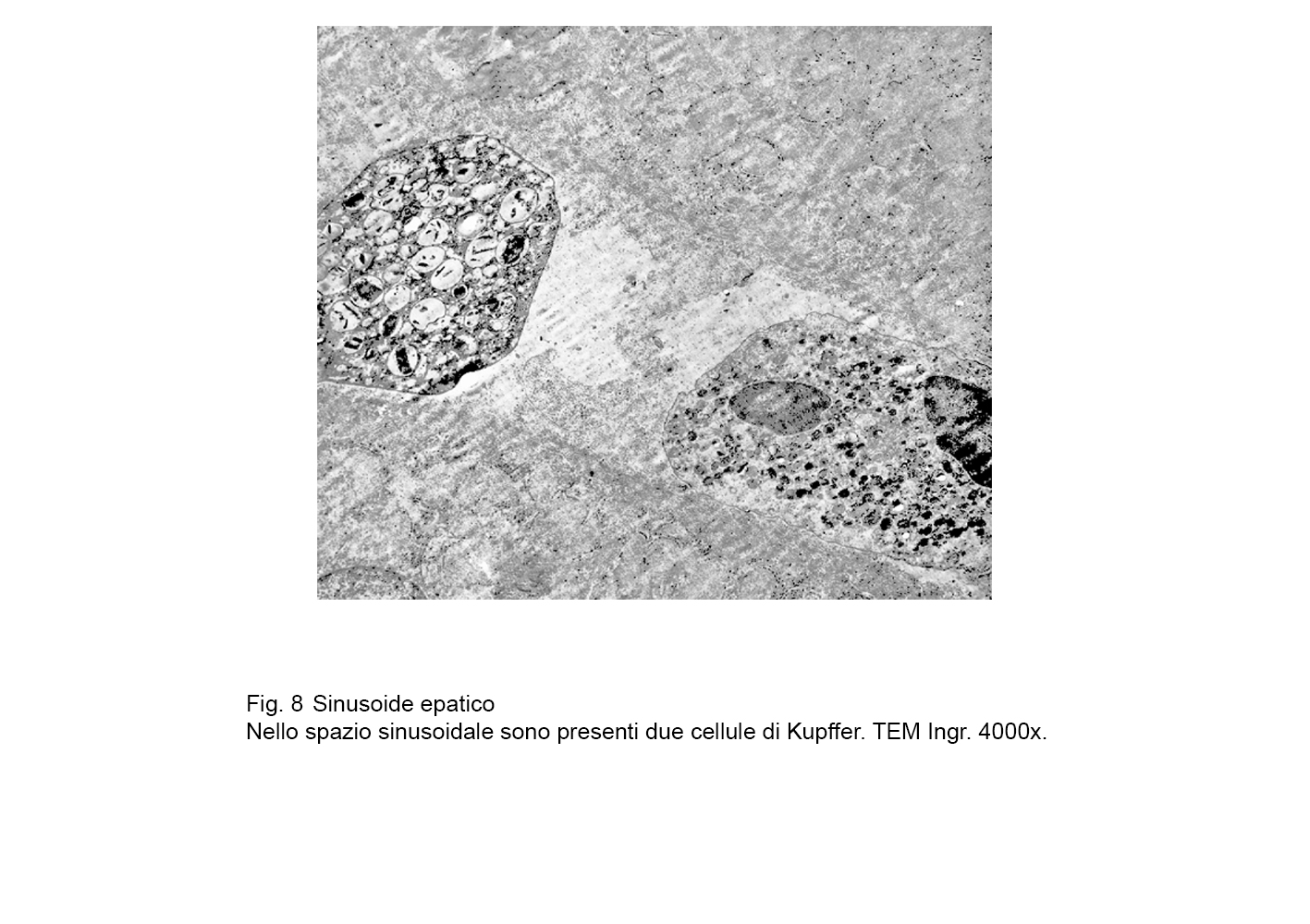 fig.8a
fig.8a 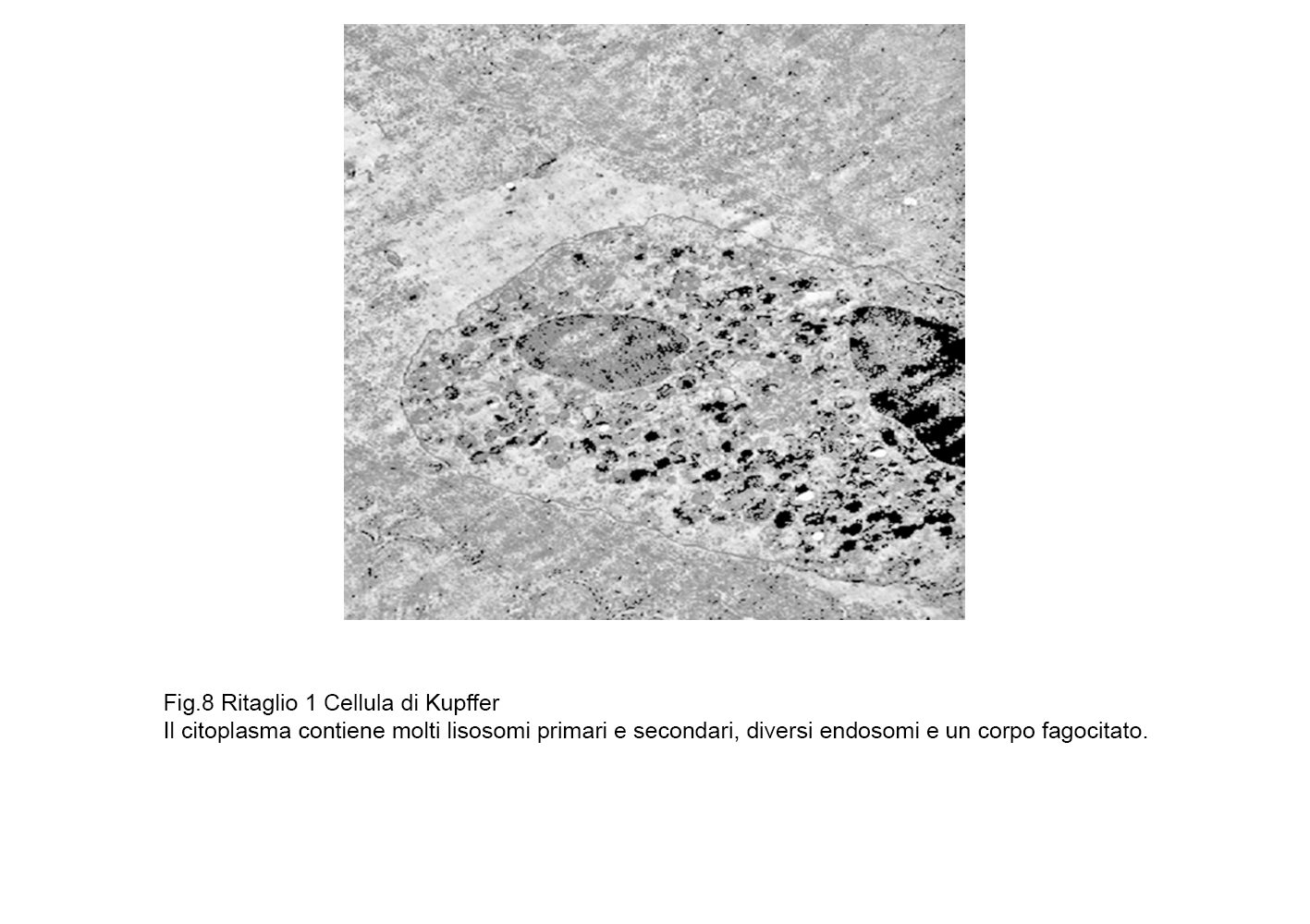
fig.8b 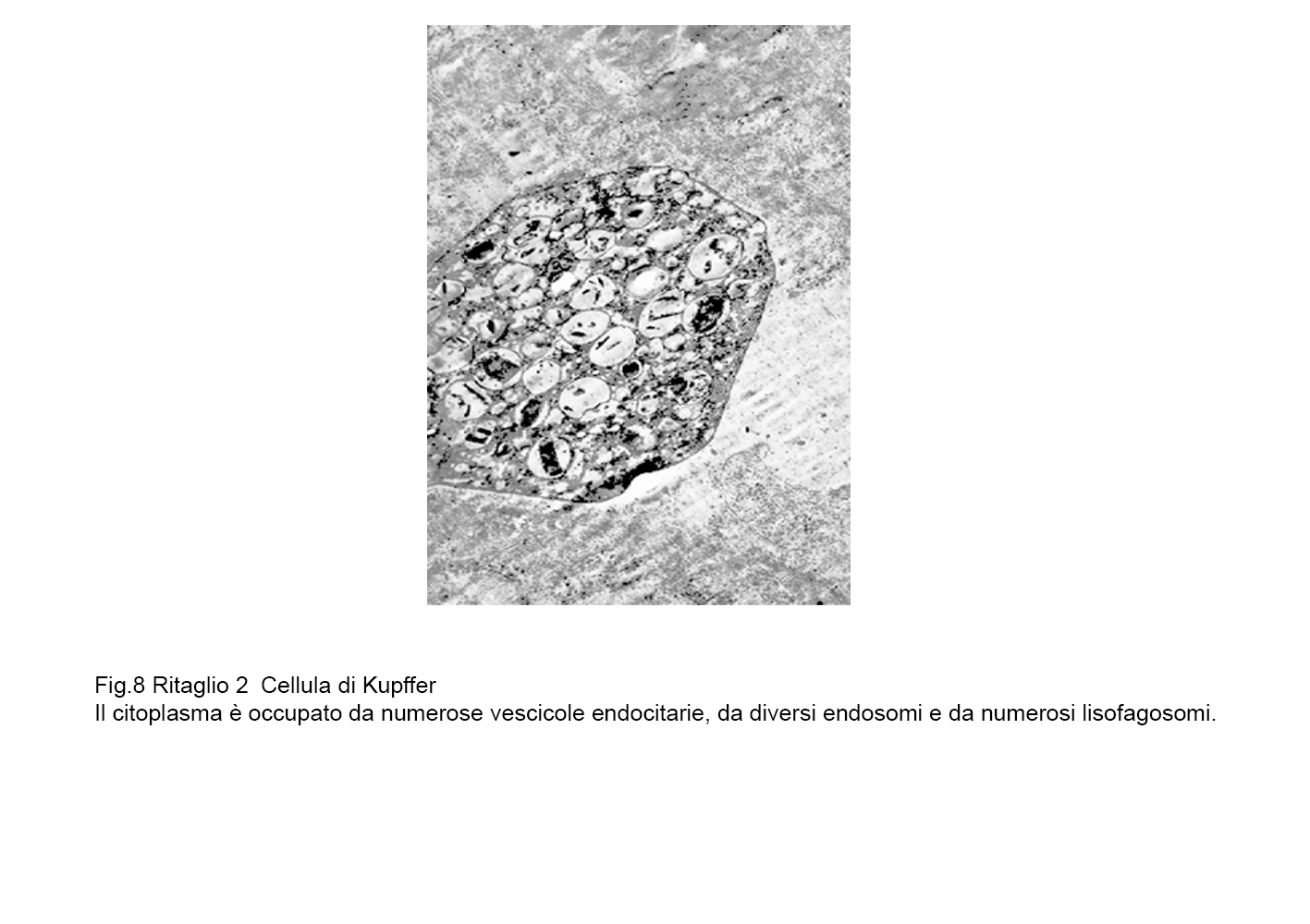 fig.9
fig.9 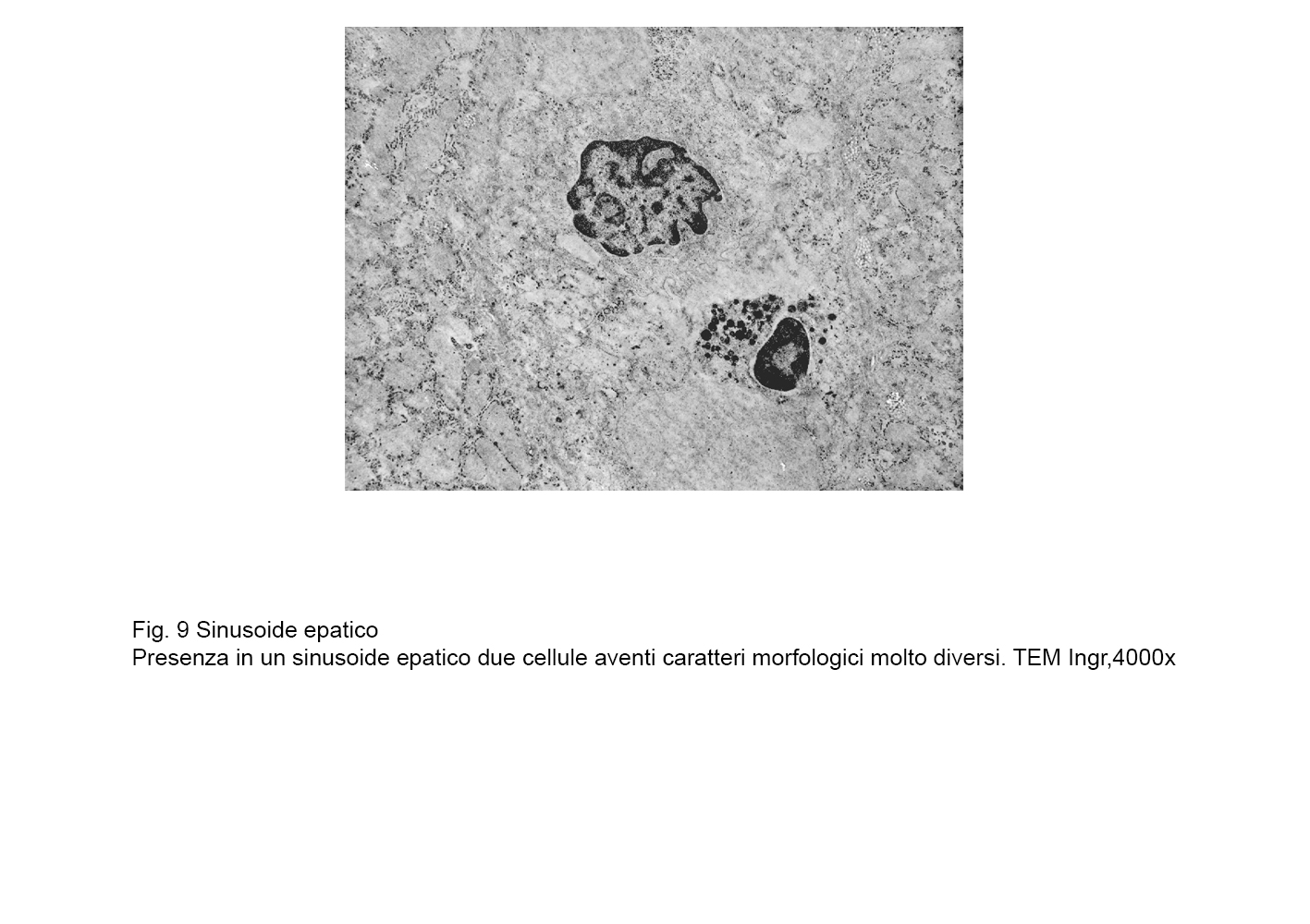
fig.9a 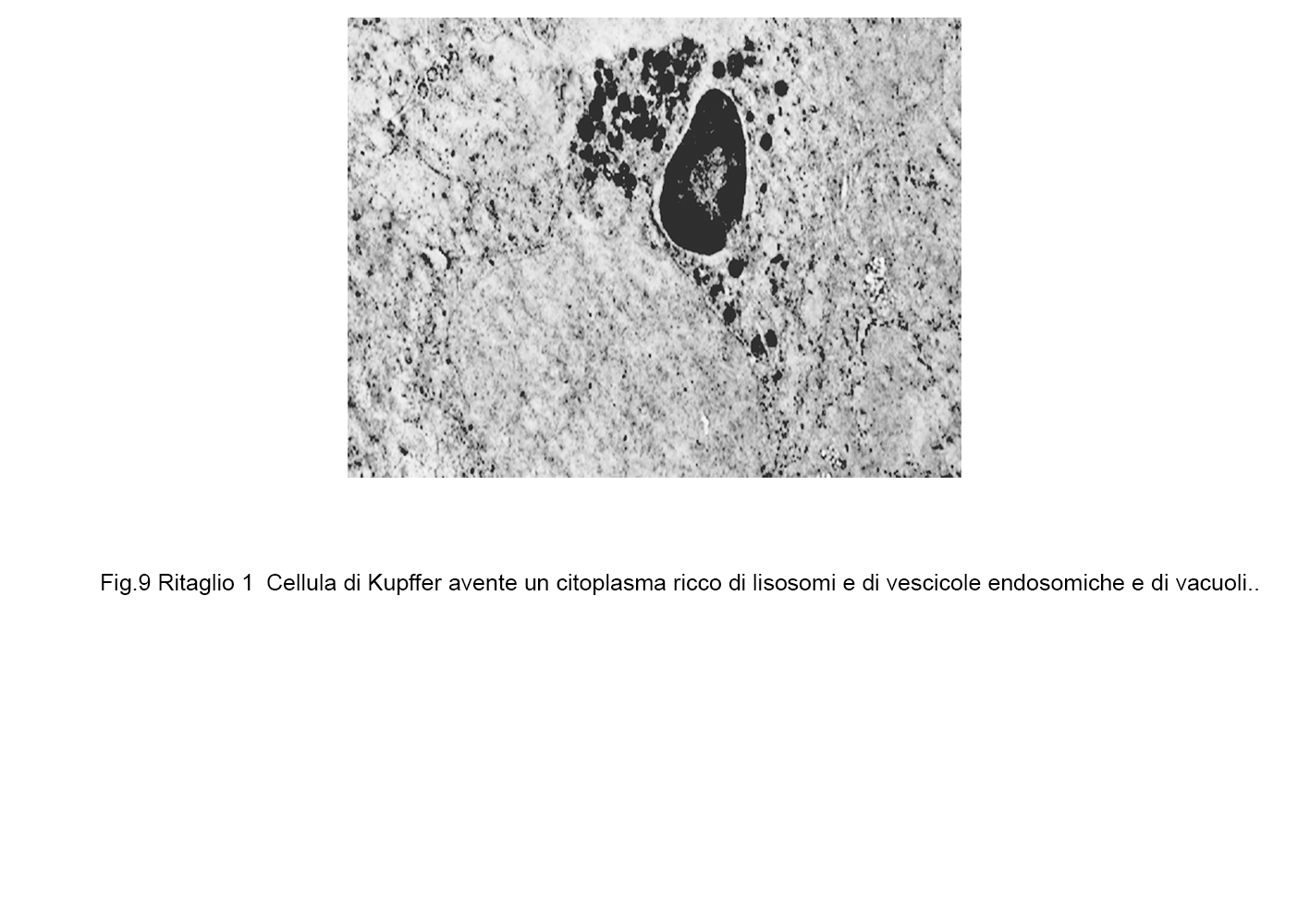 fig.9b
fig.9b 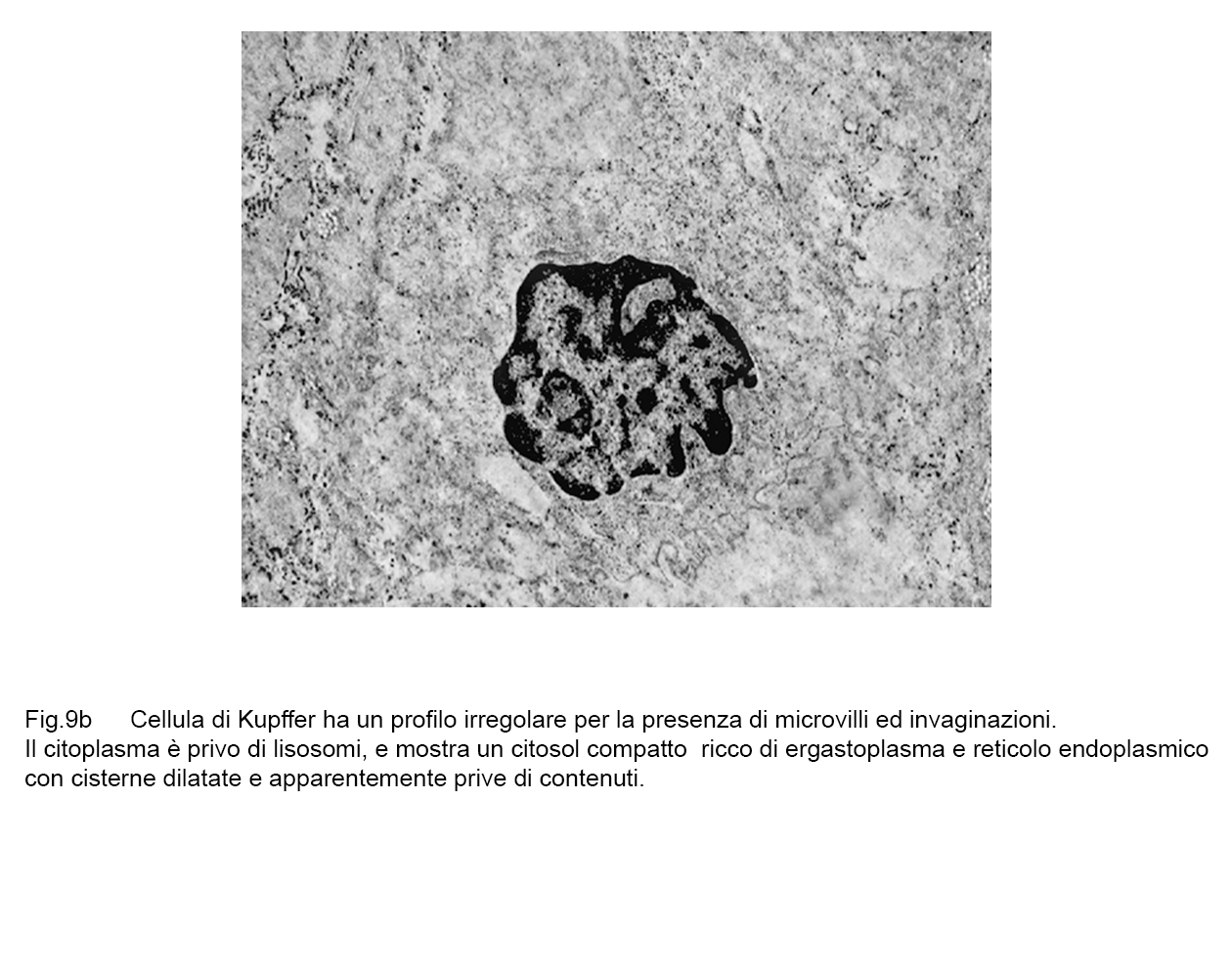
fig.10 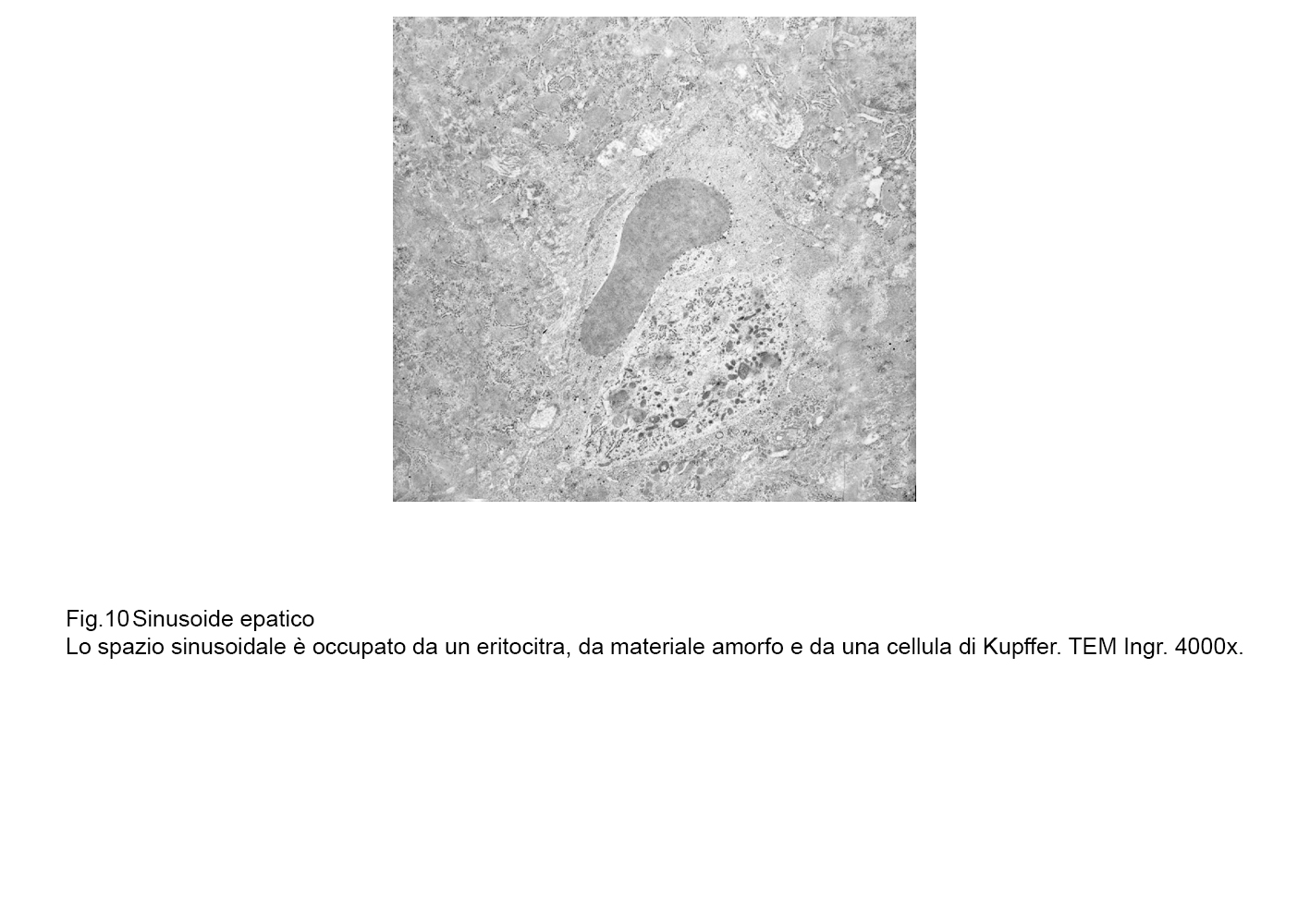 fig.10a
fig.10a 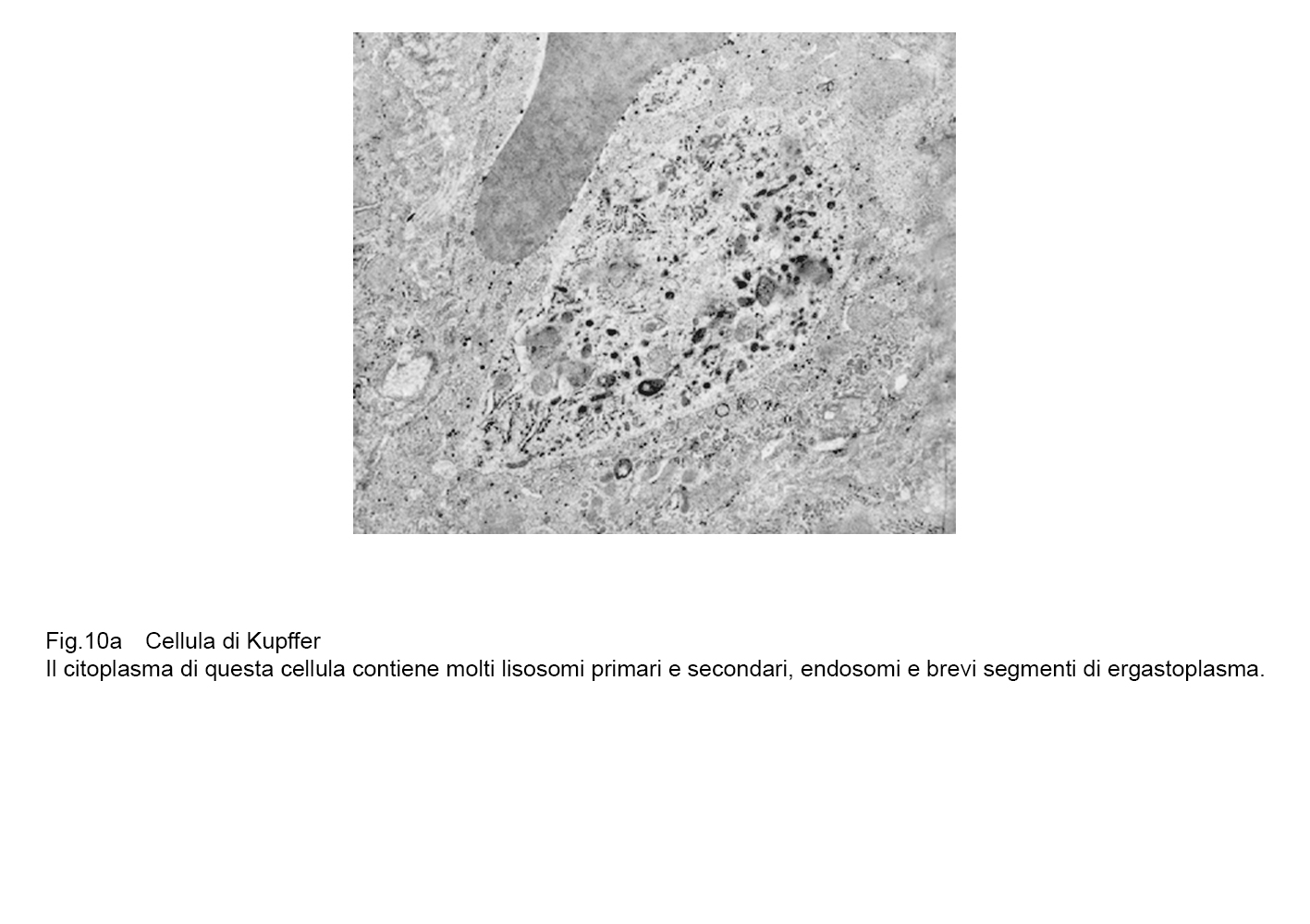
fig.11 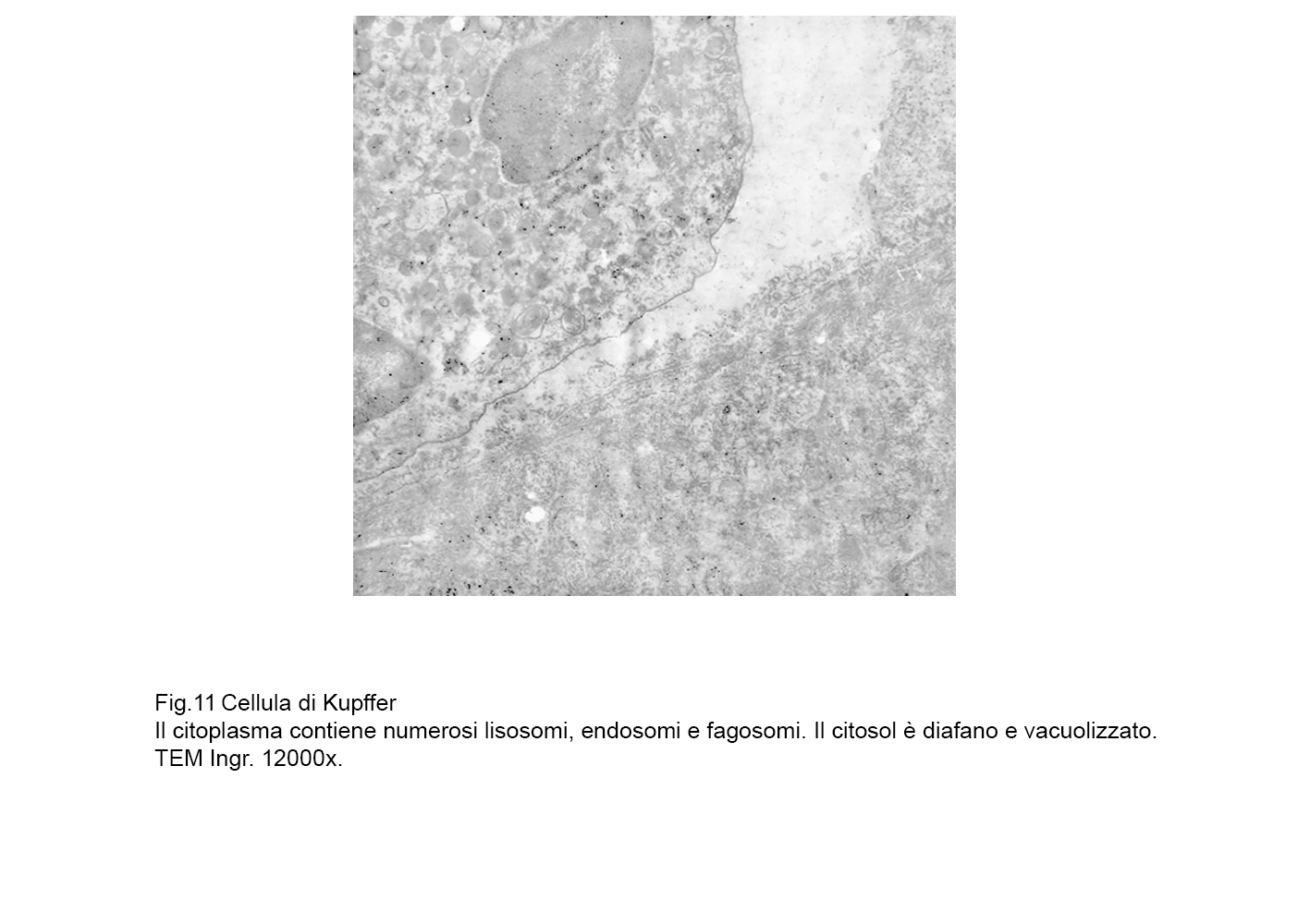 fig.12
fig.12 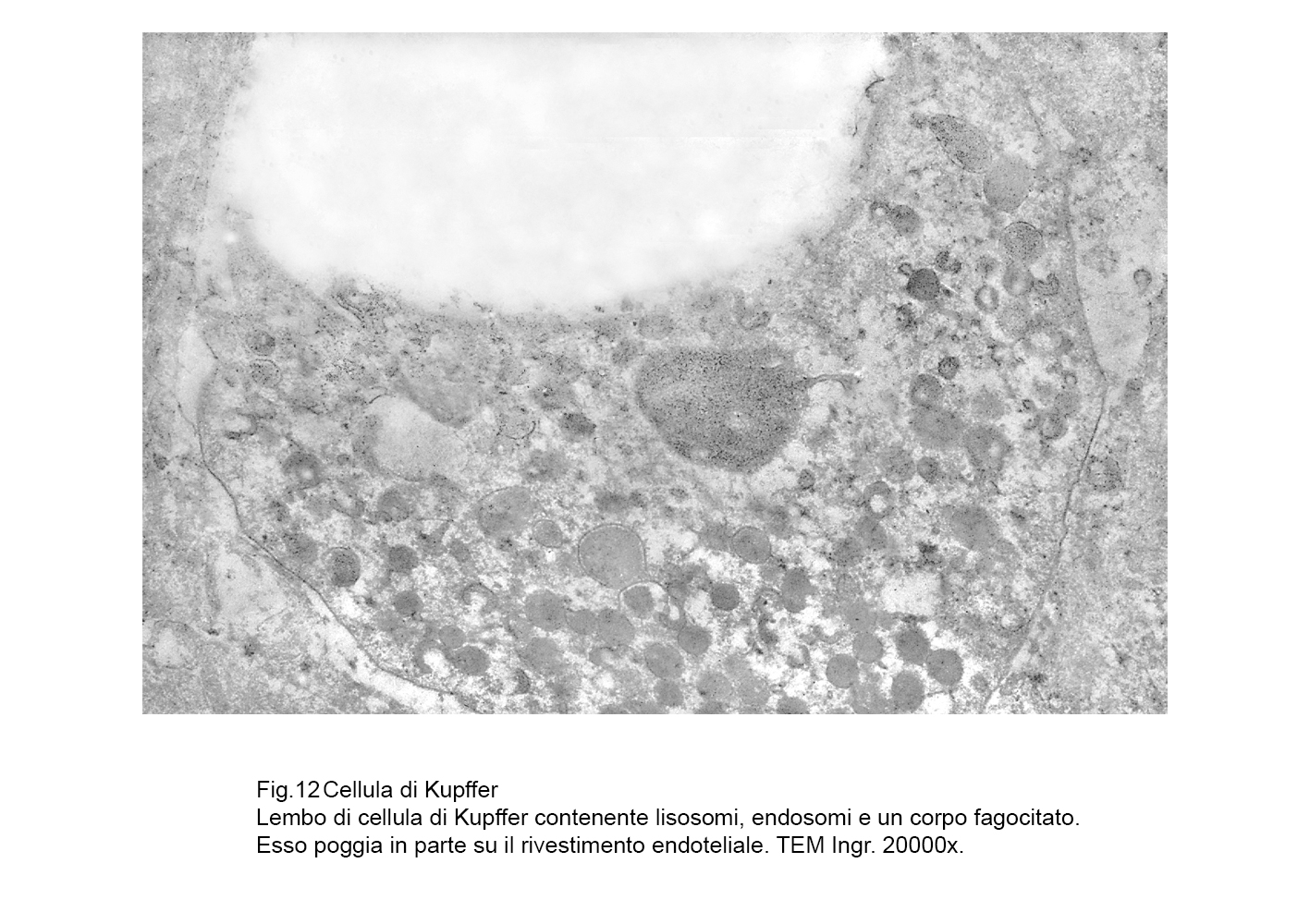
B Cellule di Kupffer quiescenti:
Il secondo fenotipo è rappresentato da elementi di dimensioni inferiori rispetto al precedente; le cellule che lo costituiscono hanno forma ovoidale oppure oblunga, mostrano superfici lisce e sono sempre delimitate da una netta membrana plasmatica.
Il citoplasma è esiguo ed è centrato da una massa nucleare di eterocromatina a blocchi distribuiti in modo disomogeneo.
Il citosol appare ipodenso o diafano, è fornito di una delicata rete fibrillare del citoscheletro e contiene un ridotto patrimonio di organelli quali mitocondri di piccole dimensioni, brevi strutture ergastoplasmatiche, piccole cisterne di reticolo endoplasmico, piccoli campi golgiani e rari lisosomi primari
Solo in modo infrequente si riscontrano vacuoli apparentemente privi di contenuti visibili agli elettroni.
fig. 13 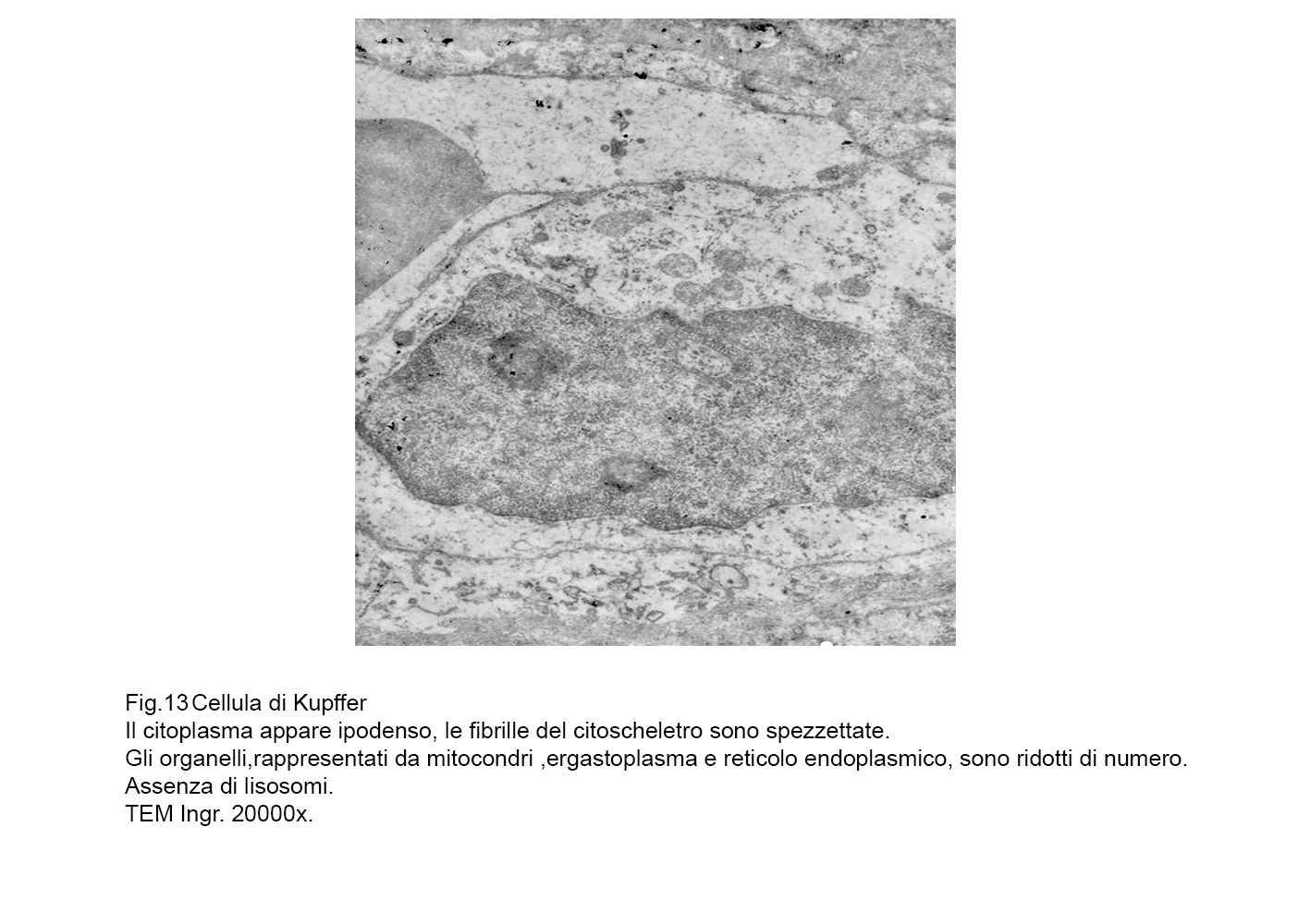 fig.14
fig.14 
fig.15 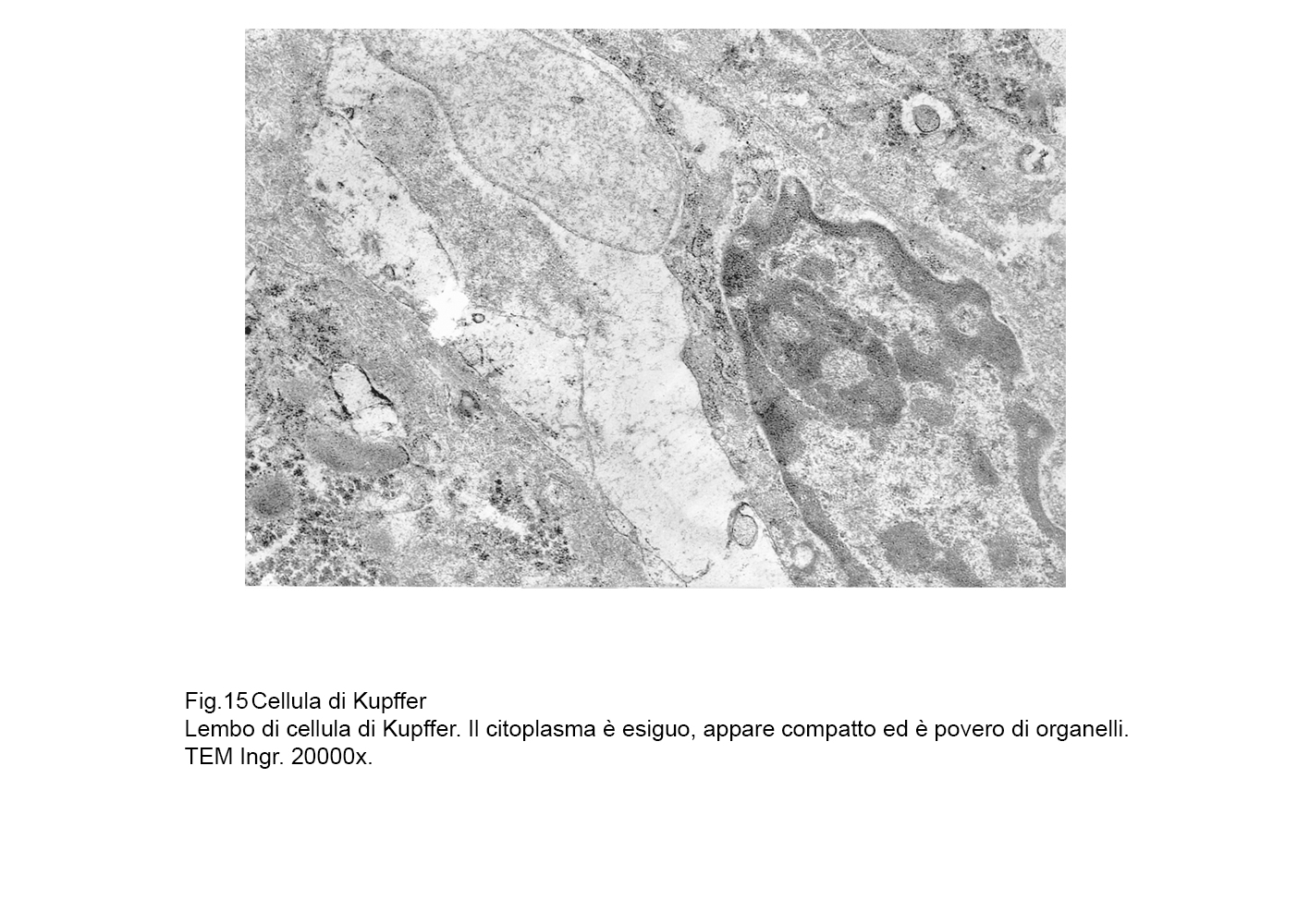 fig.16
fig.16 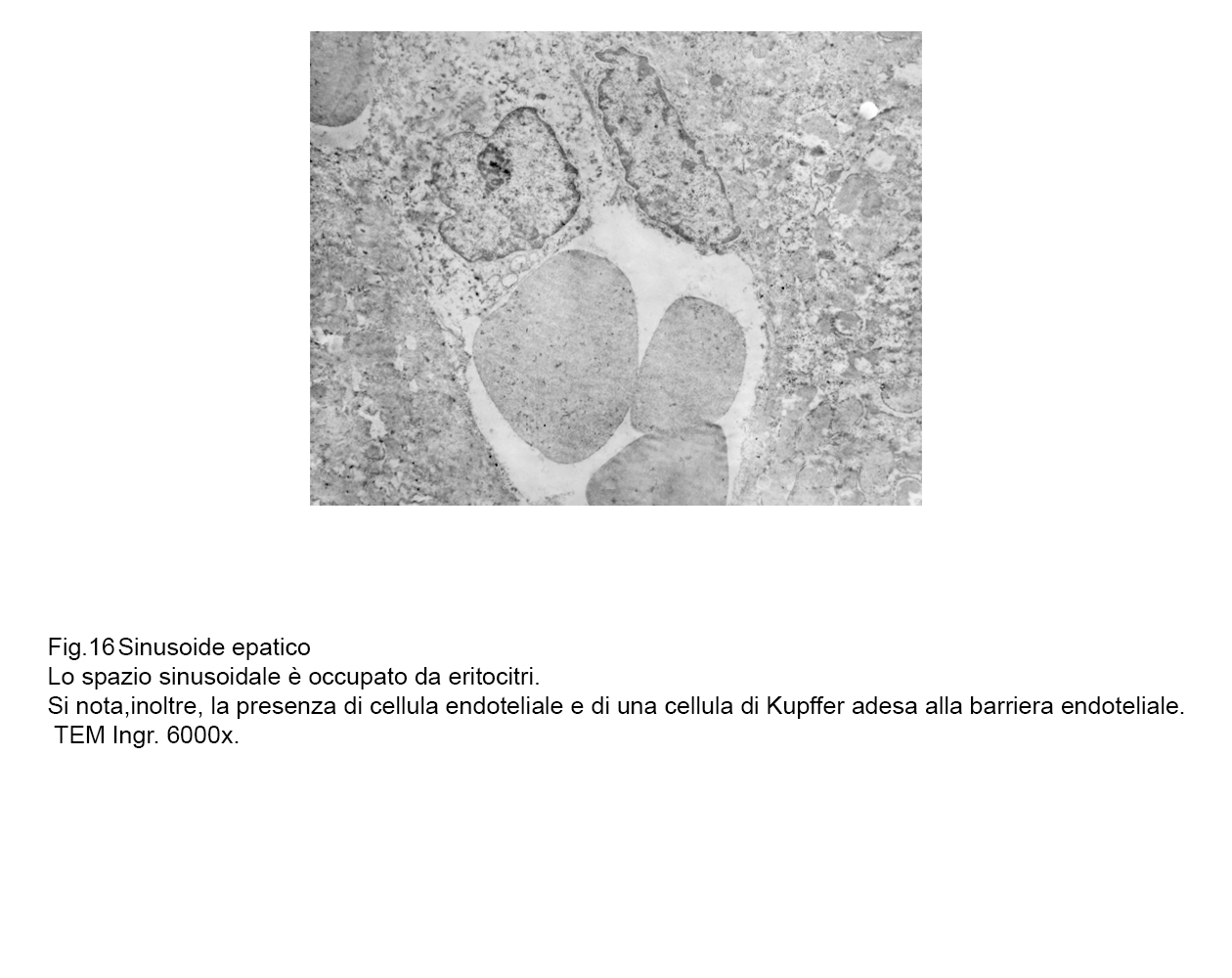 fig.16a
fig.16a 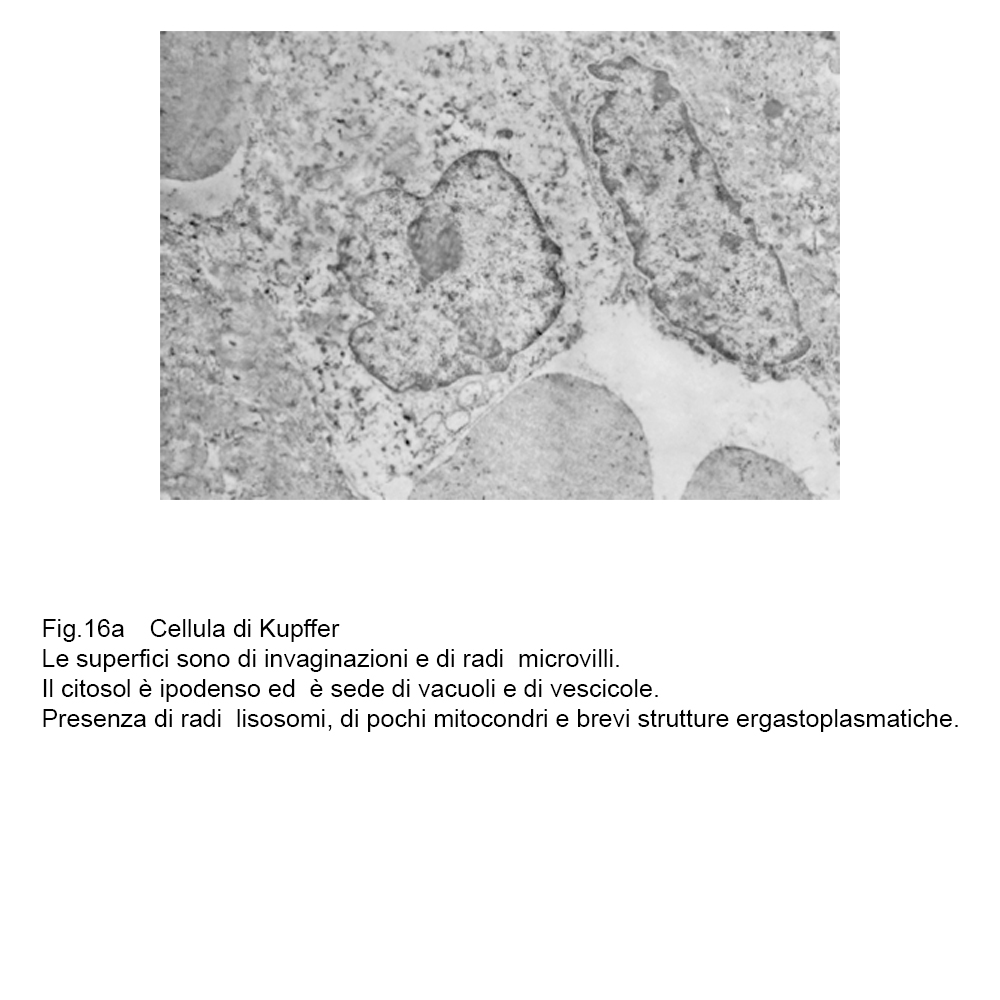
C Cellule di Kupffer con processi regressivi
In campi caratterizzati da strutture sinusoidali e perisinusoidali strutturalmente conservate, si può rilevare la presenza di cellule di Kupffer modificate per eventi regressivi.
Queste modificazioni, qui documentate, sono date principalmente da processi di vacuolizzazione di varia gravità.
La loro grandezza varia da microvacuoli a macrovacuoli i quali occupano ampi spazi del citosol . La loro estensione può essere limitata a una zona circoscritta del citoplasma oppure, accrescendosi, possono interessare l’intera area cellulare.
Le cellule colpite da microvacuolizzazione diffusa acquistano un aspetto finemente cribroso; quelle coinvolte da vacuoli ampi appaiono quasi trasparenti, poiché le quote residue di citoplasma sono ridotte a sottili strie, spesso anche spezzettate.
fig.17  fig.18
fig.18 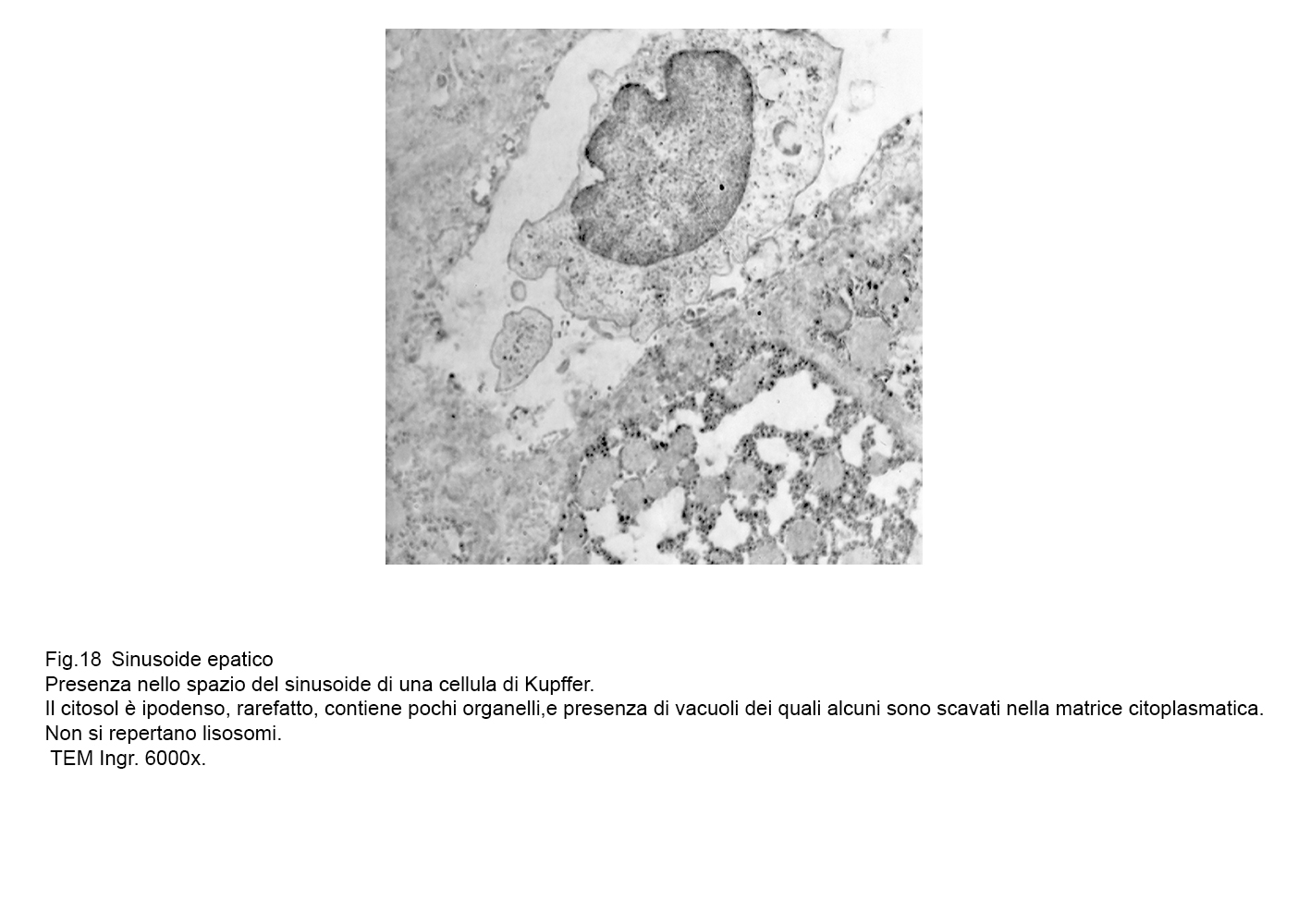 fig.19
fig.19 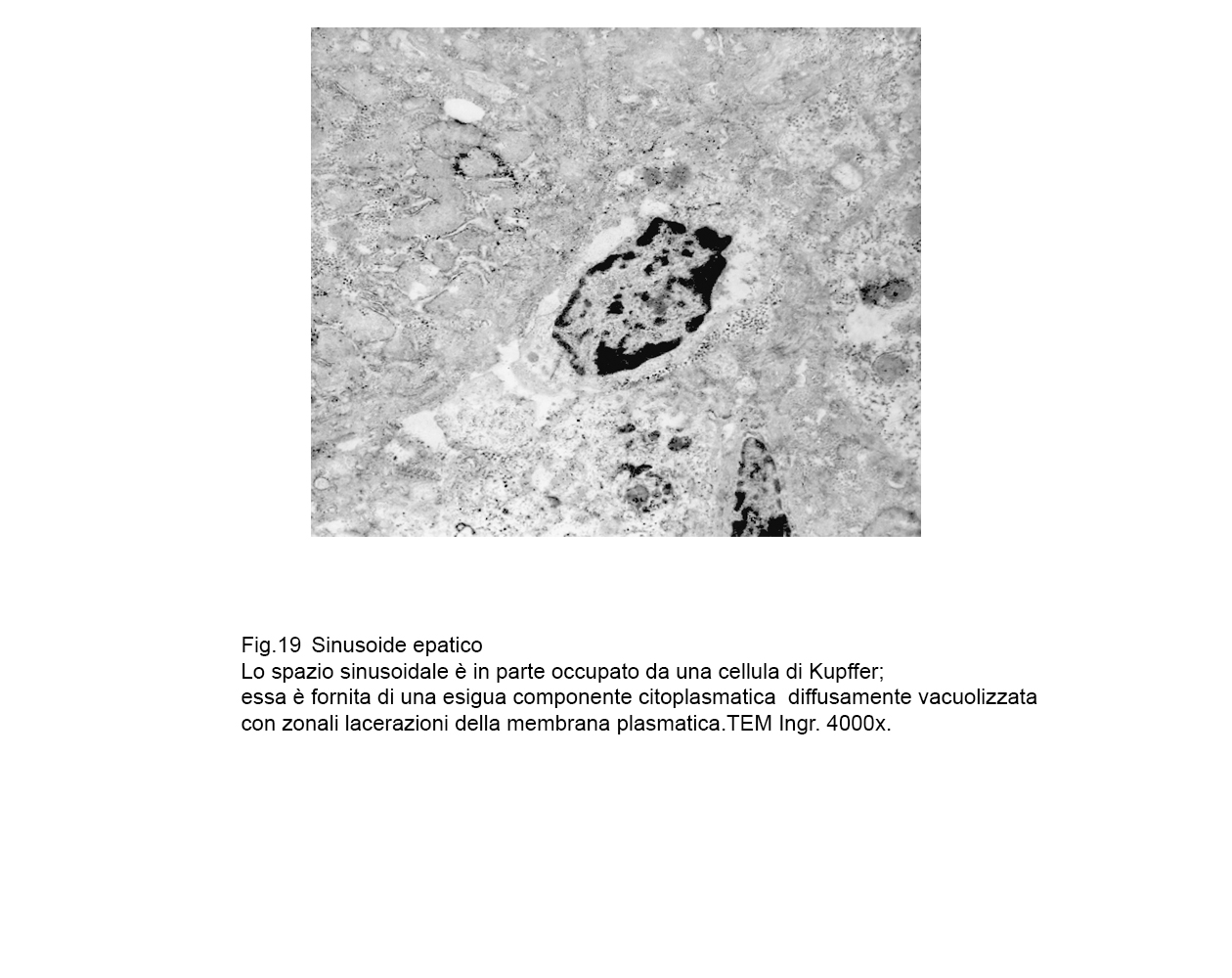
fig.20 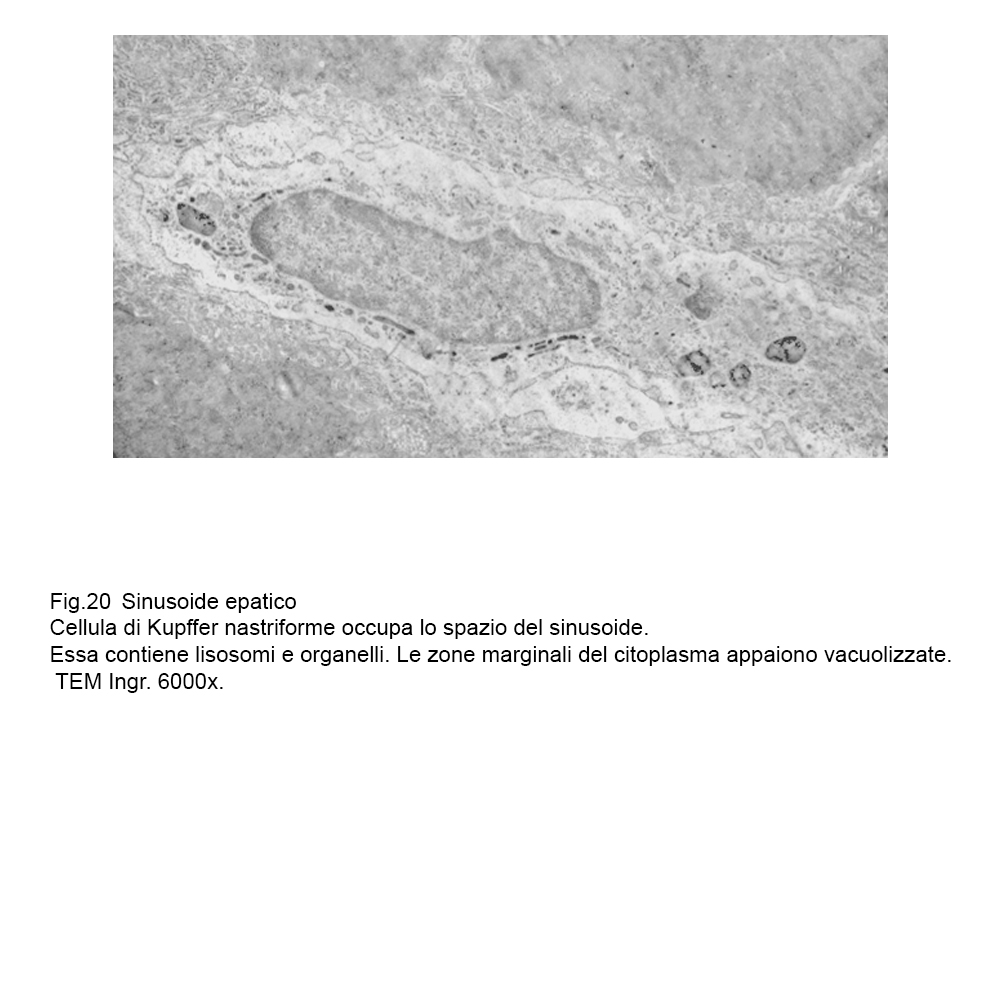
Le cellule interessate da processi di macrovacuolizzazione sono voluminose, globose, hanno la membrana plasmatica iperdistesa, assottigliata fino al punto da subire lacerazioni.
Frequentemente si ritrovano cellule di Kupffer con aspetti transizionali;infatti, esse contengono microaree citoplasmatiche “ attivate” e microaree sedi di processi regressivi.
In tutti i casi di micro-macrovacuolizzazione il loro lume è privo di contenuti visibili agli elettroni e non si evidenziano pareti proprie essendo scavati direttamente nell’ambito del citosol con notevole rimaneggiamento dell’assetto del citoscheletro.
fig.21 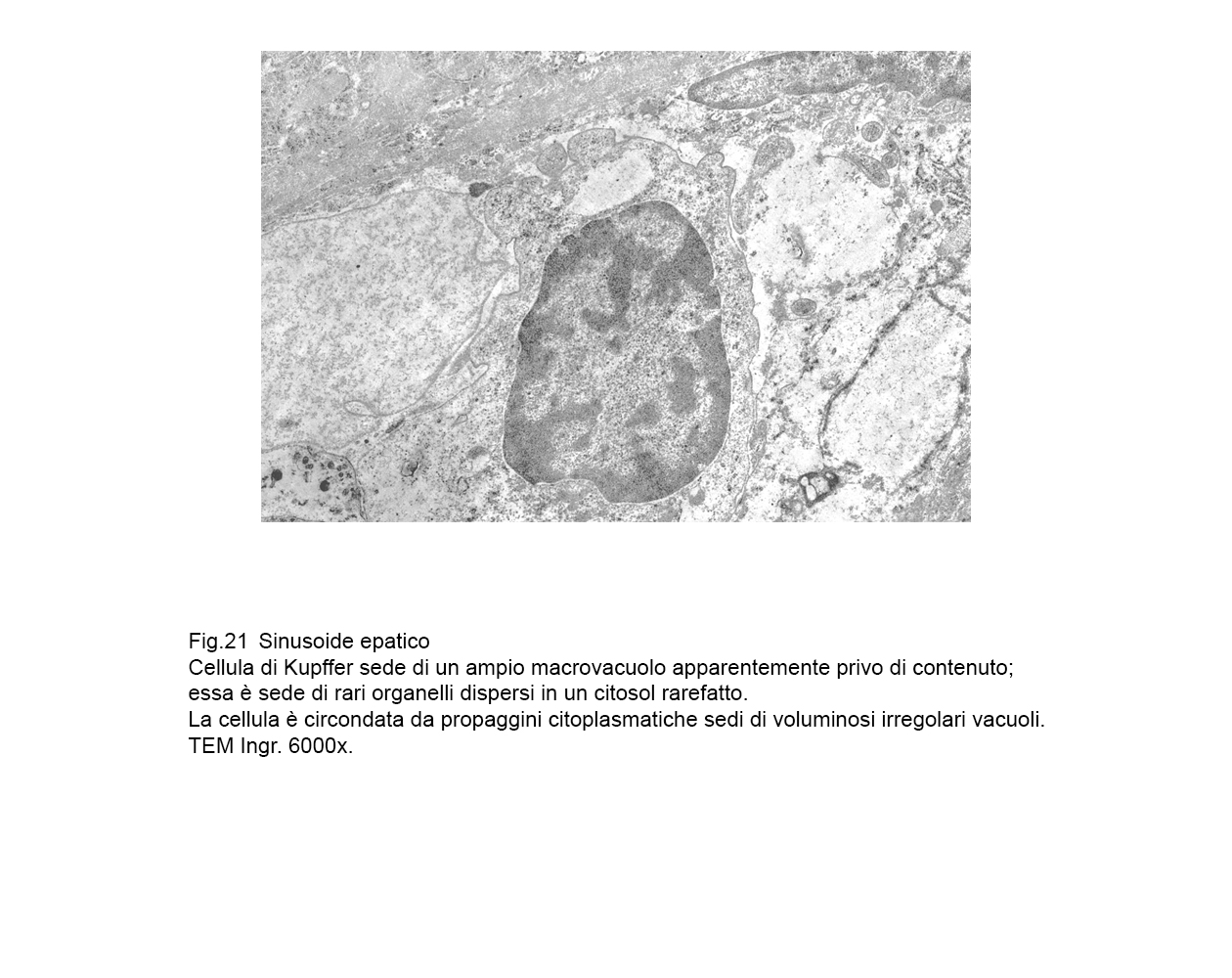 fig.22
fig.22 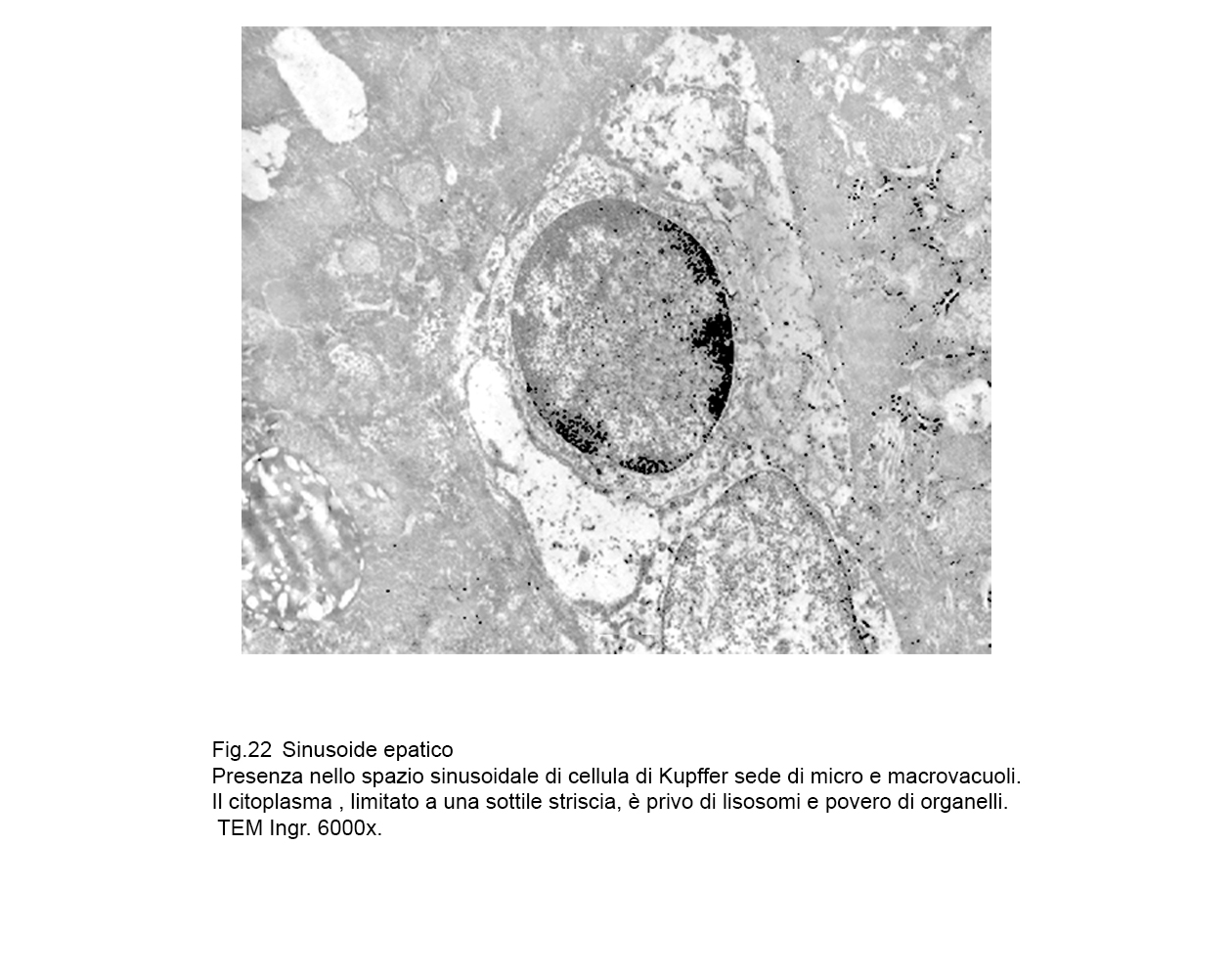 fig.23
fig.23 
D Cellule di Kupffer in necrosi:
Il processo di disfacimento necrotico delle cellule di Kupffer osservate e descritte in questa nota trova il suo punto causale nella rottura della membrana plasmatica con successivo svuotamento nel lume sinusoidale del contenuto endoplasmatico e degli organelli citoplasmatici.
Tale rottura può essere la conclusione dell’aggravarsi di eventi di macrovacuolizzazione con frammentazione della membrana plasmatica, perdita del contenuto
endocitoplasmico, e reperto residuale finale rappresentato da un nucleo “nudo".
fig.24 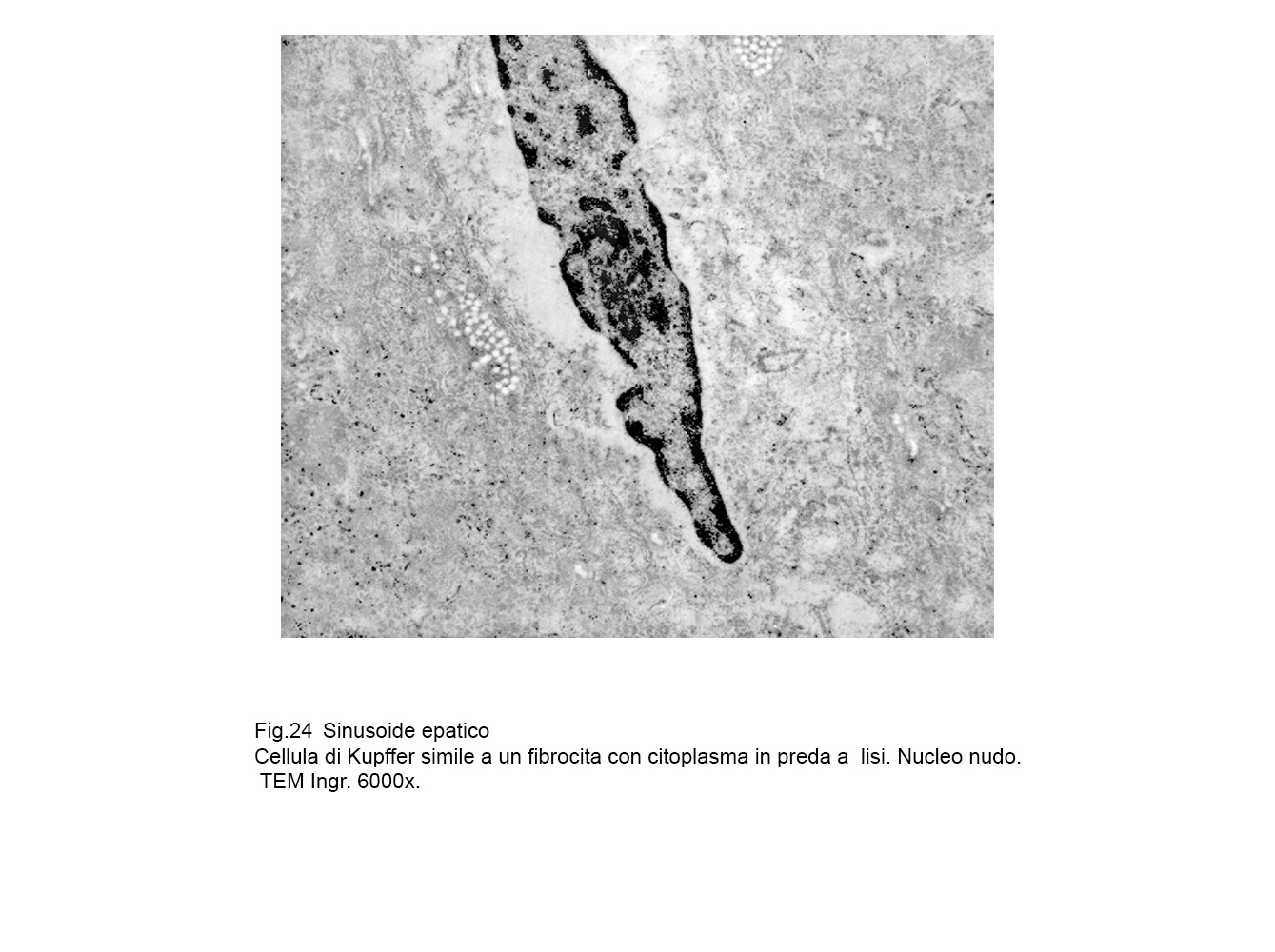 fig.25
fig.25 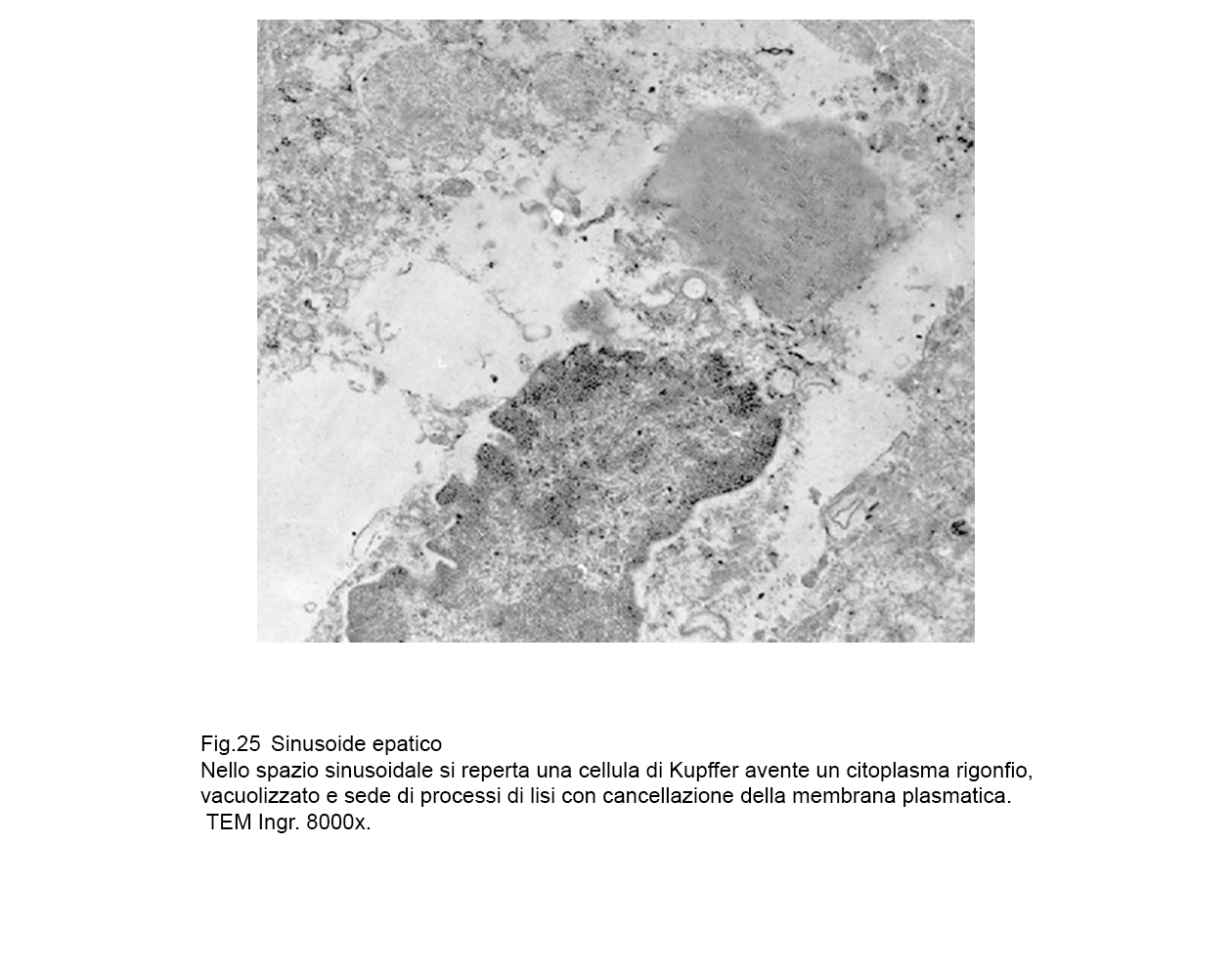 fig.26
fig.26 
Oppure la rottura della membrana plasmatica si ha a carico di cellule di Kupffer attivate ed integre; tale lesione è indotta verosimilmente da agenti extracellulari o da fattori enzimatici intracellulari.
.In tali evenienze,i reperti sono molto diversi in quanto sono rappresentati da elementi ricchi di organelli, di endosomi,e di fagosomi con membrana pasmatica lacerata o frammentata e finale svuotamento di tutte queste componenti del citoplasma nel lume sinusoidale.
fig.27 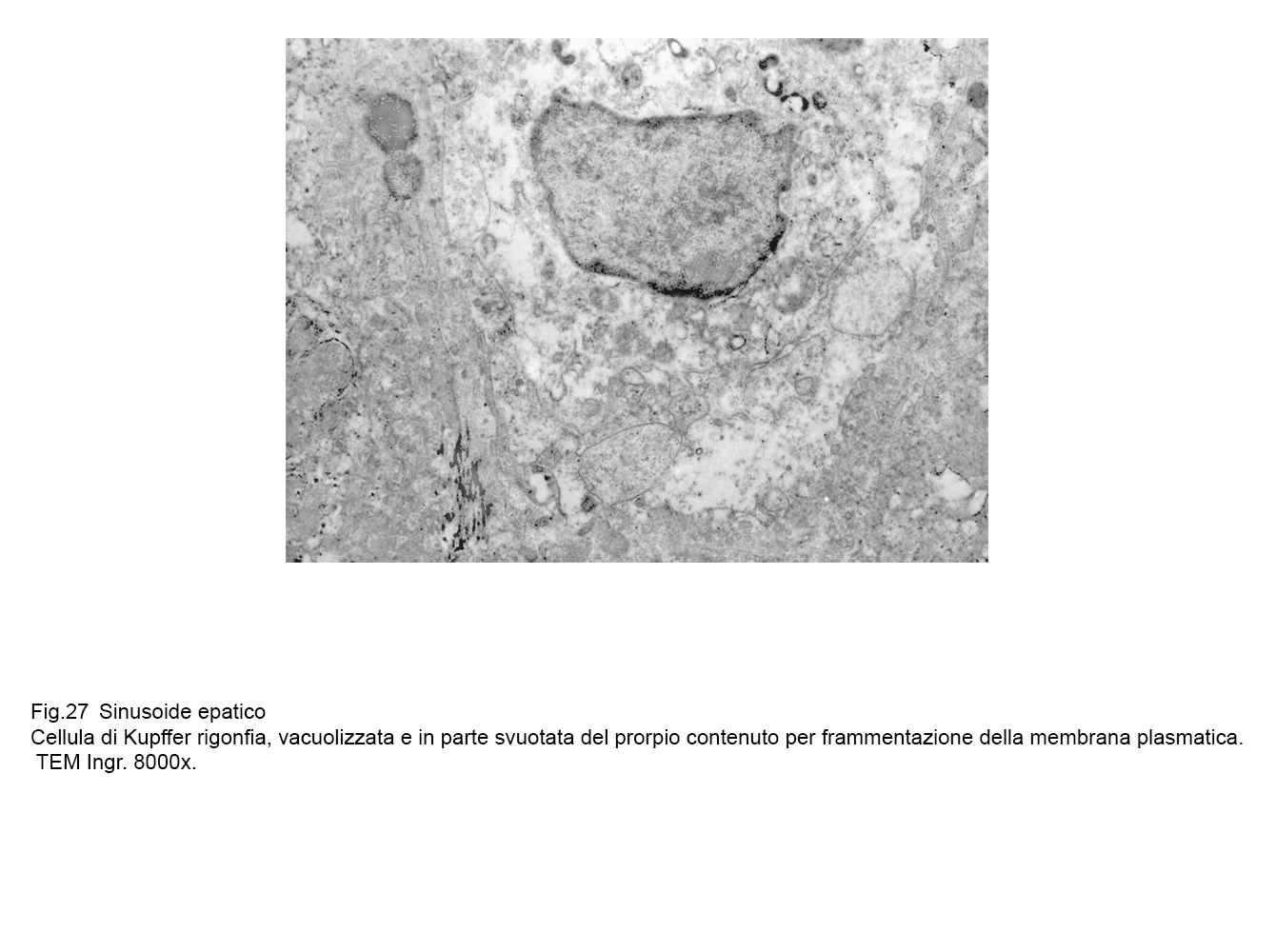 fig.28
fig.28 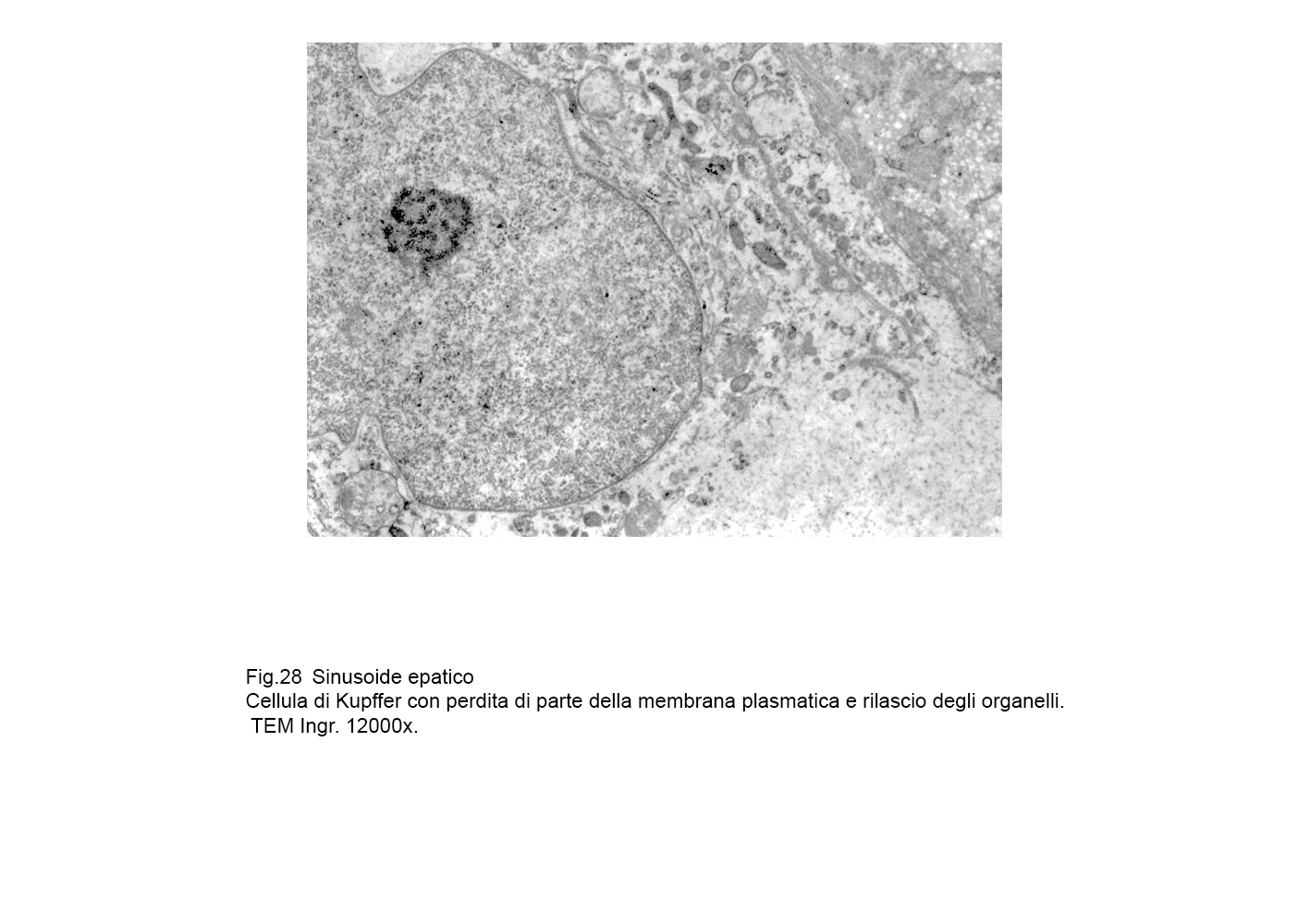
fig.29 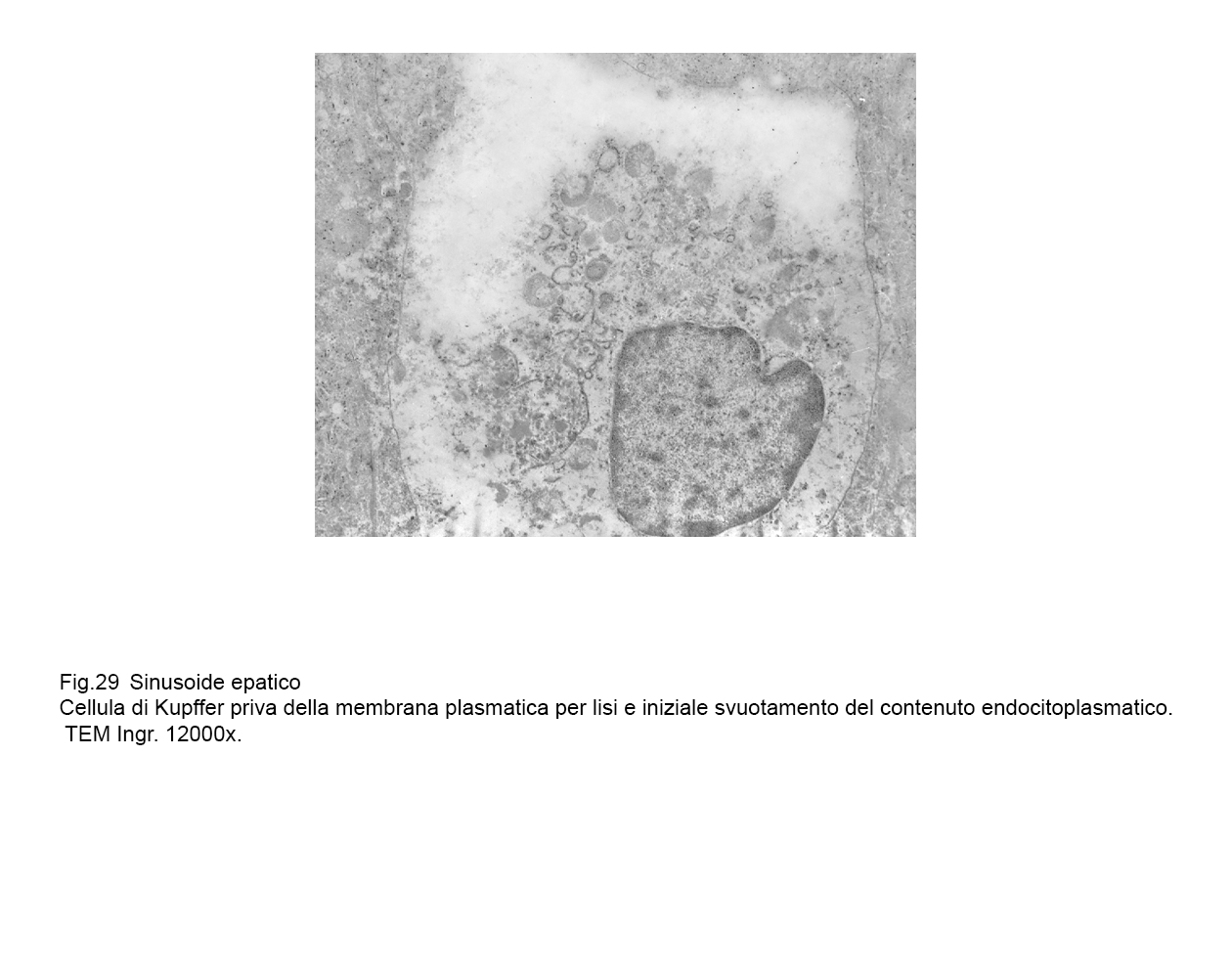 fig.30
fig.30 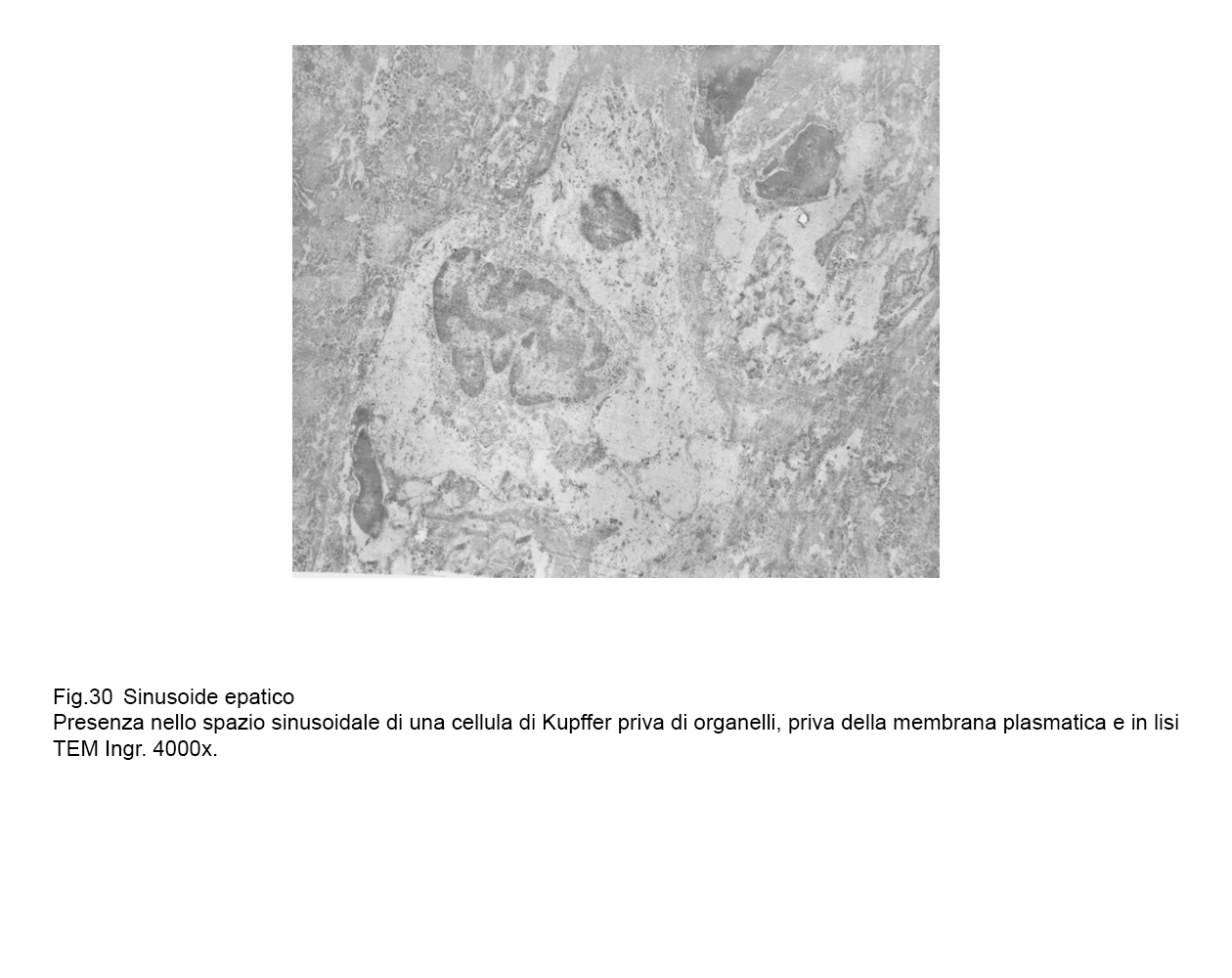
COMMENTO
Questa breve quanto incompleta presentazione di alcune cellule di Kupffer serve a sottolineare, ancora una volta, la loro eterogeneità e plasticità morfologica e implicitamente funzionale.
Questi caratteri (eterogeneità e plasticità) sono attributi citologici di base mediante i quali svolgono le loro molteplici funzioni quali appartenenti al sistema monocitario macrofagico (J. Clinic. Invet. 2012; 122: 787-795).
Secondo teorie, attualmente accettate, i macrofagi residenti (tra questi anche le cellule di Kupffer) derivano da precursori embrionali che si insediano in tali tessuti prima della nascita e permangono in loco per tutta la vita extra uterina; in situazioni di varia patologia a questa componente è possibile una integrazione di cellule monocitarie evolventi in senso macrofagico derivanti dal midollo osseo (Immunity 2016; 44: 439-449).
Questa teoria sta a sottolineare che le cellule macrofagiche del fegato hanno le capacità di self-replenish e solo in situazioni di emergenza si attiva l’apporto di monociti provenienti dal midollo osseo (Immunity 2013; 38: 79-91).
Questi macrofagi tissutali, verosimilmente, hanno una comune origine ma acquisiscono una eterogeneità fenotipica come è possibile accertare dai markers distribuiti su le superfici delle loro cellule (J. Clin. Invest. 2012; 122: 787-795).
Le cellule di Kupffer possono transdifferenziarsi e possono riprogrammarsi in diversi tipi di cellule e acquisire caratteri fenotipici e funzionali adatte alle singole situazioni fisiopatologiche (Am. J. Pathol. 2009; 174: 1972-1980) (Biotechnol. Lett. 2011; 33: 1751-1758) (Am. J. Pathol. 2015; 185: 1596-2606).
La loro capacità a transdifferenziarsi si manifesta nell’acquisizione dei caratteri di un altro citotipo, così come da una cellula di Kupffer si acquisisce i caratteri di una cellula endoteliale o di un elemento progenitore di tale citotipo (Am. J. Pathol. 2015; 185: 2596-2606).
Alla stessa maniera le cellule di Kupffer possono riprogrammarsi divenendo cellule pluripotenti, processi questi riscontrabili durante le attività rigenerative (Biotechnol. Lett. 2011; 33: 1751-1758).
Se si considera il polo sinusoidale come una unità morfologico-strutturale e funzionale ,le suddette inter relazioni tra le cellule di Kupffer, gli endoteli , le cellule stellate,e gli epatociti svolgentisi con modalità bidimensionali e/o pluridimensionali devono essere considerate come processi finalizzati alla conservazione del polo sinusoidale e degli epatociti.
