La Necroptosi nella Iperplasia
dutto-lobulare atipica della mammella
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica dell'Università della Campania "Luigi Vanvitelli"
L’omeostasi delle cellule a livello dei tessuti e degli organi è un processo complesso regolato anche dai processi di morte programmata delle cellule.
Attraverso di esso si ha un equilibrio dinamico della popolazione cellulare tra la comparsa di nuovi elementi e la rimozione di quelli preesistenti, definiti “senescenti”.
La morte programmata regola l’omeostasi degli organi e dei tessuti a seconda dell’età e degli stati morfofunzionali di tali strutture e si rivela importante per preservare lo stato di salute, per proteggere da eventi morbosi, e tra questi ridurre il rischio di neoplasie.
Tra le forme di morte programmata, comprendenti la apoptosi la ferroptosi e la piroptosi si ricorda la necroptosi quale necrosi caspasi indipendente riscontrata in varie condizioni di patologia ( Pathol. . Res. 2011, 17(4): 791-800 ).
Tra le numerose condizioni di patologia, la necroptosi è stata riscontrata, tra l’altro, nei focolai infiammatori infettivi o sterili, nell’infarto del miocardio, nei processi di ischemia-riperfusione, nei trapianti di organi, nell’artrite reumatoide, nella sclerosi multipla, nelle malattie ostruttive del polmone e nella tumorogenesi. (Mol. Med. 2012, 18: 577-586) (Cell Death Differ. 2016; 23: 1565-1576).
E’ stata documentata la esistenza di focolai di necroptosi in diversi tumori maligni ma è rimasto ancora incerto il ruolo di questo processo nei fattori e cofattori su l’origine,e su la progressione neoplastica.
Su tale tema si sono sviluppate due linee di pensiero tra loro contrapposte: La prima ritiene che la necroptosi impedisca o rallenti lo sviluppo neoplastico; la seconda sostiene che questa morte programmata favorisca in modo diretto o indiretto la progressione neoplastica.
In letteratura ricorre una teoria secondo la quale, nello sviluppo delle neoplasie, la necroptosi avrebbe una duplice azione: da un lato, mediante una forte azione immunitaria, frenerebbe lo sviluppo tumorale, dall’altra mediante risposte flogistiche e processi di immunosoppressione delle cellule linfocitarie T favorirebbe la tumorogenesi e le metastasi (Mol Cancer 2019; 18(1): 100) (Trends Cancer 2022; 8(1): 21-27) (Oncotarget 2023; 14: 295-296).
Al di là delle varie ipotesi patogenetiche, viene ammesso che la necroptosi interviene nella tumorogenesi attraverso azioni regolatrici di meccanismi ancora non ben conosciuti, meccanismi considerati perfino come variabili a seconda della tipologia della neoplasia (Cell Death Differ. 2020; 27: 161-175) (Breast Cancer Res.2023;25:10).
Tra questi meccanismi ipotizzati è sta presa, come possibile, un’azione correlata al ROS e a molecole associate atte a provocare una instabilità del genoma favorendo le mutazioni e le trasformazioni delle cellule (PLoS One 2015; 10: e 0/4 2287) (Oxid Med Cell Longev 2016; 2016: 3907147).
I reperti morfologici ultrastrutturali evidenziano, nella nefroptosi, una rarefazione del citosol associata a fenomeni di micro-macrovacuolizzazione. Tra gli organuli endocellulari, i mitocondri subiscono gravi alterazioni: infatti essi appaiono rigonfi, poveri o privi di creste, deformati, con fenomeni di fusione e di fissione, con alterazioni del mtDNA. A queste alterazioni mitocondriali si addebita un aumento del ROS che è determinante per lo sviluppo della necroptosi in quanto facilita la fosforilazione del RIPK1 e RIPK3 (J. Clin. Invest. 2014; 124: 3987 – 4003) (Oncogene 2015; 34: 5796 – 5806).
A queste alterazioni mitocondriali si associano dilatazioni delle cisterne dell’ergastoplasma e del reticolo endoplasico, un aumento delle quote di ribosomi e unaumento della quota lisosomiale (Cell 2005; 120 (4): 483-495). (Pharmacological Rev. 2016; 68(1): 20-48).
A questa fase, avente caratteri di aspecificità, segue una fase caratterizzata dalla comparsa di focolai di autofagia e si determinano condizioni di interdipendenza tra autofagia e necroptosi (Nat. Cell. Biol. 2004; 6: 1221 – 1228) (Nature 2018; 562: 69-75) (Int J. Mol. Sci. 2021; 22(1): 68).
A queste modificazioni si aggiungono foci di abnorme permeabilità della membrana plasmatica, formazione di fori fino alla rottura della stessa con fuoriuscita negli spazi intercellulari dei contenuti endocellulari mediante anche meccanismi attivi attraverso la partecipazione del reticolo endoplasmico e dell’apparato del Golgi. (Nature 2010; 464: 104-107) (Immunity 2013; 38: 209-22) (Cell Rep. 2020; 30: 1260-1270 e5).
Questi contenuti contengono molecole DAMPs (danger associated molecular patterns) conseguente alla attivazione dei recettori TNFR1 (tumor necrosis receptor 1) e TNFR3 ( tumor necrosis receptor 3) e il rilascio di molecole di citochine e chemiochine pro-infiammatorie che innescano focolai di flogosi con forte risposta immunitaria e partecipazione di cellule fagocitarie (Nat. Immunol. 2015; 167: 689 – 697) (Physiol. Rev. 2018; 28(2): 727 – 780) (Cell. Mol. Immunol. 2021; 18(5): 1106-1121). 68).
Si ritiene che in certi tipi di tumori quali quelli della mammella, del colon retto, del melanoma, delle leucemie, la necroptosi abbia un effetto down-regulated, mentre in altri tipi di tumori, quali quelli del polmone e del pancreas abbia una azione up-regulated (Mol Cancer 2019; 18(1): 100).
Tra le ricerche riguardanti la necroptosi e le neoplasie, numerose di esse sono state rivolte su il carcinoma della mammella su temi riguardanti il ruolo della necroptosi su l’origine e progressione di queste neoplasie, su la loro prognosi e nell’ambito del trattamento terapeutico (Front Immunology 2022;13: 964118)(Cell Biol. Int. 2022; 46(1): 12-33)(Breast Cancer Res. 2023; 25(1): 10.).
Nel solco di tali studi è stata presa in considerazione l’opportunità di verificare al microscopio elettronico la esistenza di processi di necroptosi anche a livello di una manifestazione pre-neoplastica della mammella quale la iperplasia dutto-lobulare atipica.
Questa iperplasia atipica è un processo proliferativo degli epiteli avente caratteri architettonici e citologici atipici; essa si sviluppa a livello delle unità dutto-lobulari e delle strutture contigue e viene considerata una fase intermedia, transizionale, evolutiva, tra la iperplasia usuale e il carcinoma in situ di lieve grado (Rosen’s Breast Pathology, Wolters Kluwer.2021).
La diagnosi si pone attraverso le ricerche di elementi epiteliali caratterizzati da nuclei irregolari voluminosi e ipercromatinici, dal numero delle mitosi tipiche e atipiche, dalla scarsa coesione intercellulare, dal disordine architettonico.
Questa valutazione qualitativa richiede la integrazione di una lettura semi quantitativa per calcolare il numero degli elementi atipici in rapporto alla popolazione presente nella struttura duttale e procedere nella differenziazione le forme di iperplasia atipica in lievi, medie e gravi. (Rosen’s Breast Pathology Wolters Kluwer, 2021).
Gli epiteli di questi dutti frequentemente presentano fenomeni regressivi rappresentati da vacuolizzazione del citoplasma che accentuandosi si concludono con la lisi della cellula. Inoltre, si formano attorno ai dutti così modificati corone più o meno dense di elementi della flogosi rappresentati da linfociti, monociti, plasmacellule e macrofagi. In situazioni più gravi questi elementi infiltrano la membrana basale dei dutti, penetrano nell’interno e si distribuiscono tra le filiere epiteliali favorendo così la necrobiosi.
La esistenza di questi processi regressivi a livello degli epiteli atipici ha suggerito di valutare al microscopio elettronico il loro stato morfologico e questa verifica ha messo in evidenza alterazioni citoplasmatiche e nucleari complesse, non riducibili ad aspecifici fenomeni degenerativi, bensì rivelanti aspetti rientranti nel capitolo della necroptosi.
REPERTI
L’iperplasia duttale atipica è caratterizzata da strutture dutto-lobulari e da dutti occupati da epiteli in iperplasia con presenza di epiteli con caratteri di atipia. Questi elementi si riconoscono per la scarsa coesione intercellulare e per l’assenza di una disposizione architettonica ben definita.
I singoli elementi sono identificabili, per il loro dismorfismo e soprattutto per i caratteri dei nuclei che appaiono voluminosi, irregolari, ipercromatinici e spesso in mitosi.
Fig.1 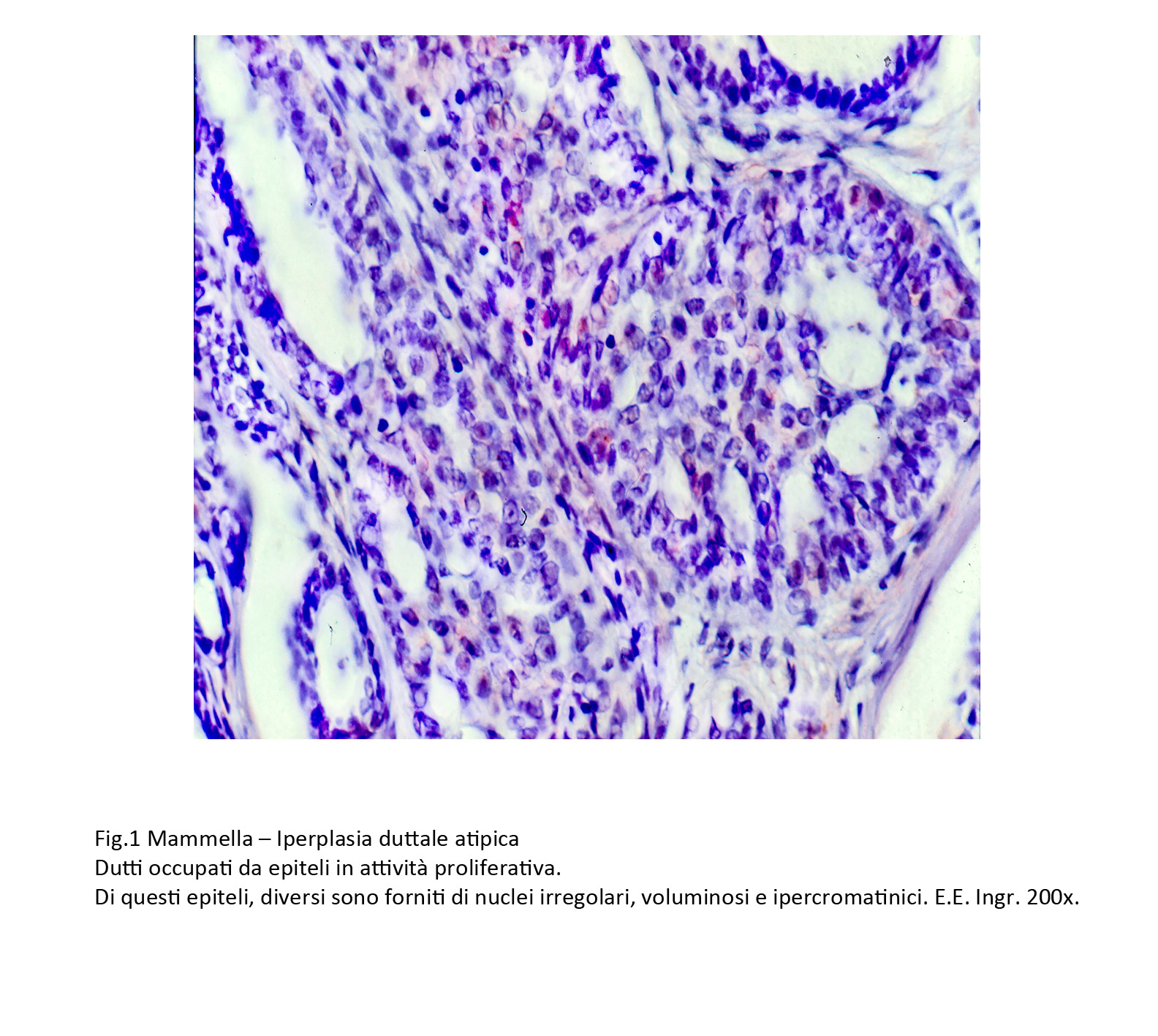 Fig.2
Fig.2 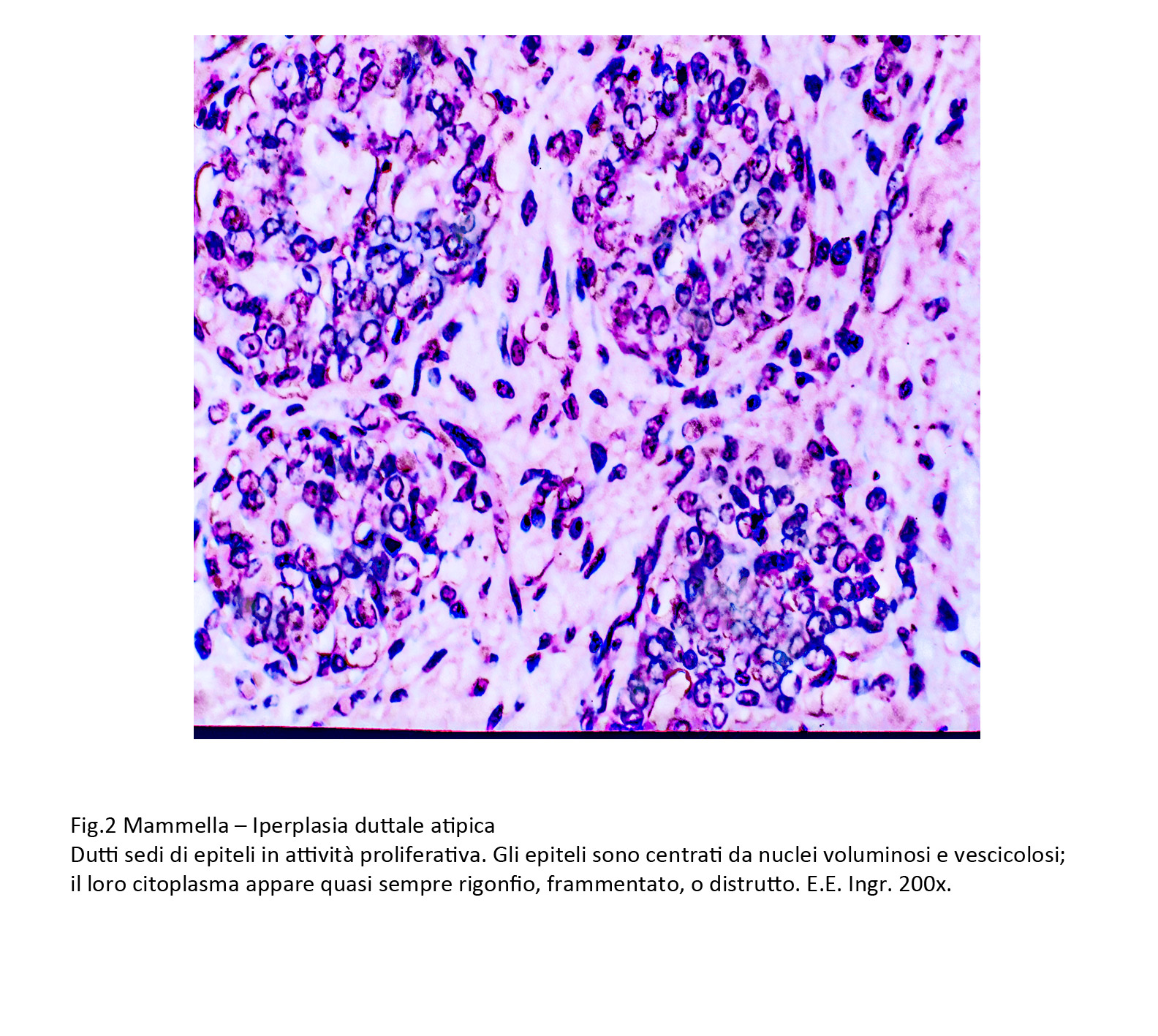
Le quote di questi epiteli atipici variano da poche unità disperse tra gli elementi ben differenziati a gruppi più o meno consistenti o ancora a quote dominanti o quasi esclusive, acquisendo così i caratteri del carcinoma duttale in situ di lieve grado.
Fig.3 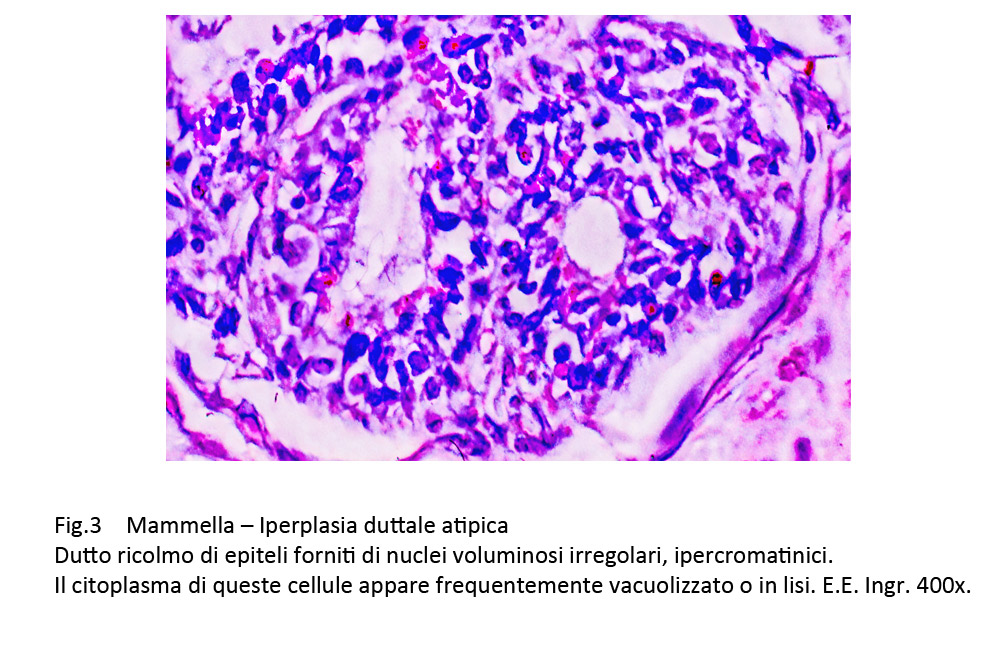
Frequentemente nello stroma periduttale si raccolgono focolai flogistici cronici sostenuti da mononucleati con la partecipazione di macrofagi.
Fig.4 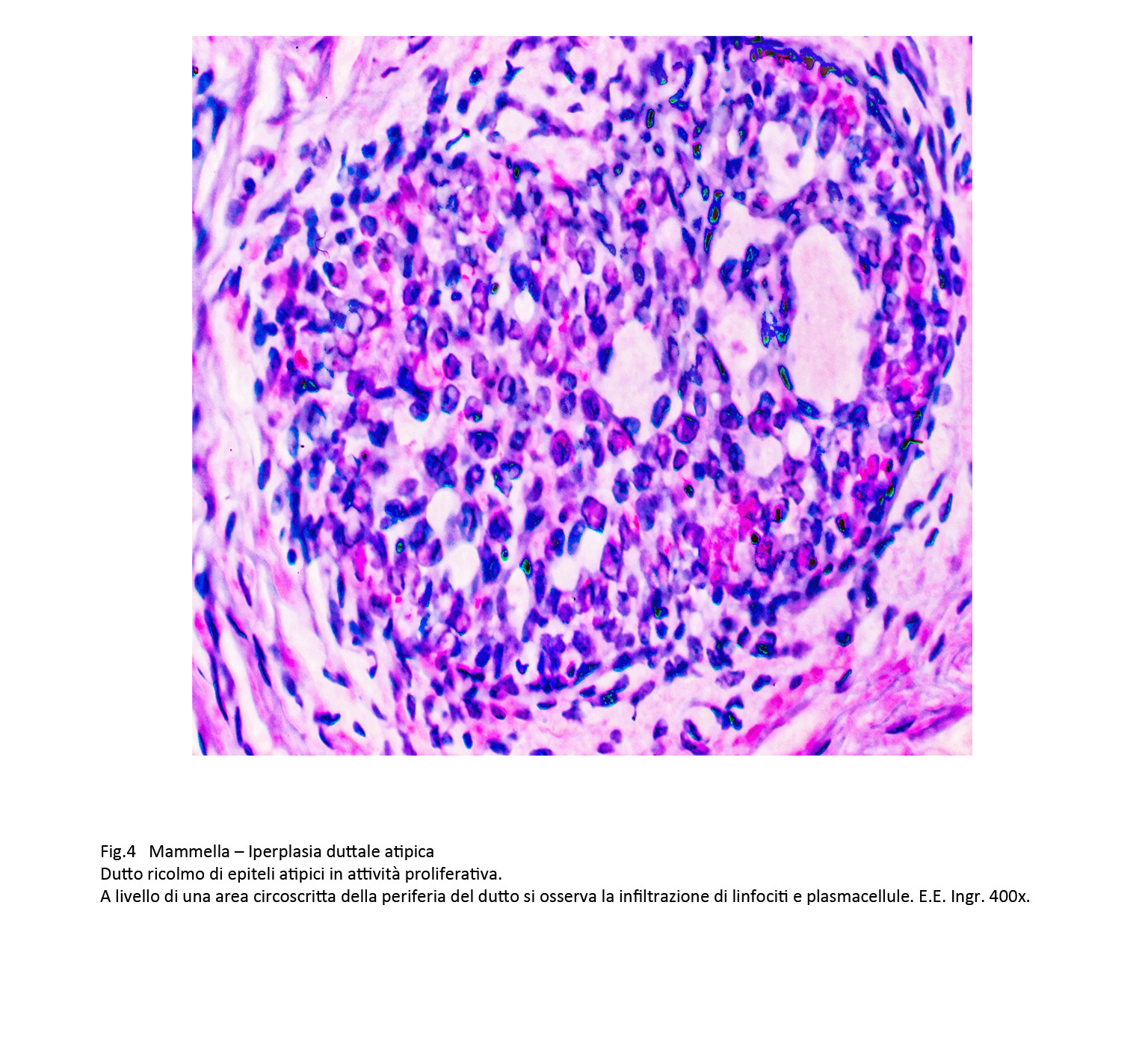
Questi elementi si stratificano a ridosso della membrana basale dei dutti e perforandola penetrano nell’interno della struttura provocando fenomeni di vacuolizzazione o di lisi del citoplasma.
Fig.4part 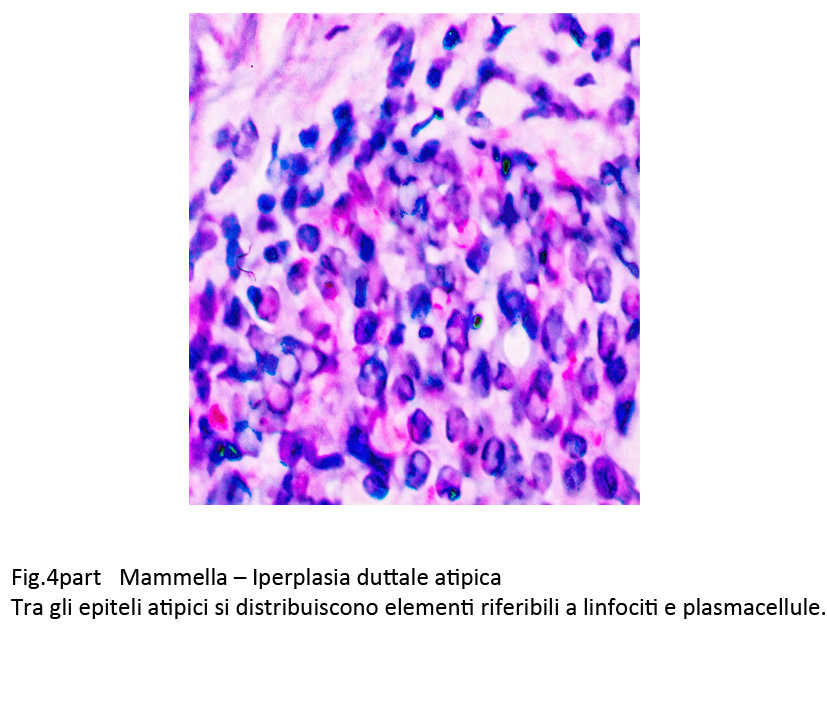
L’esame ultrastrutturale degli epiteli atipici mette in evidenza, con frequenza, alterazioni regressive del citoplasma e uno stato di rarefazione della cromatina nucleare. Già in immagini d’insieme è possibile evidenziare uno stato alterativo riguardante il citosol, la membrana plasmatica, i mitocondri e l’ergastoplasma.
Fig.5 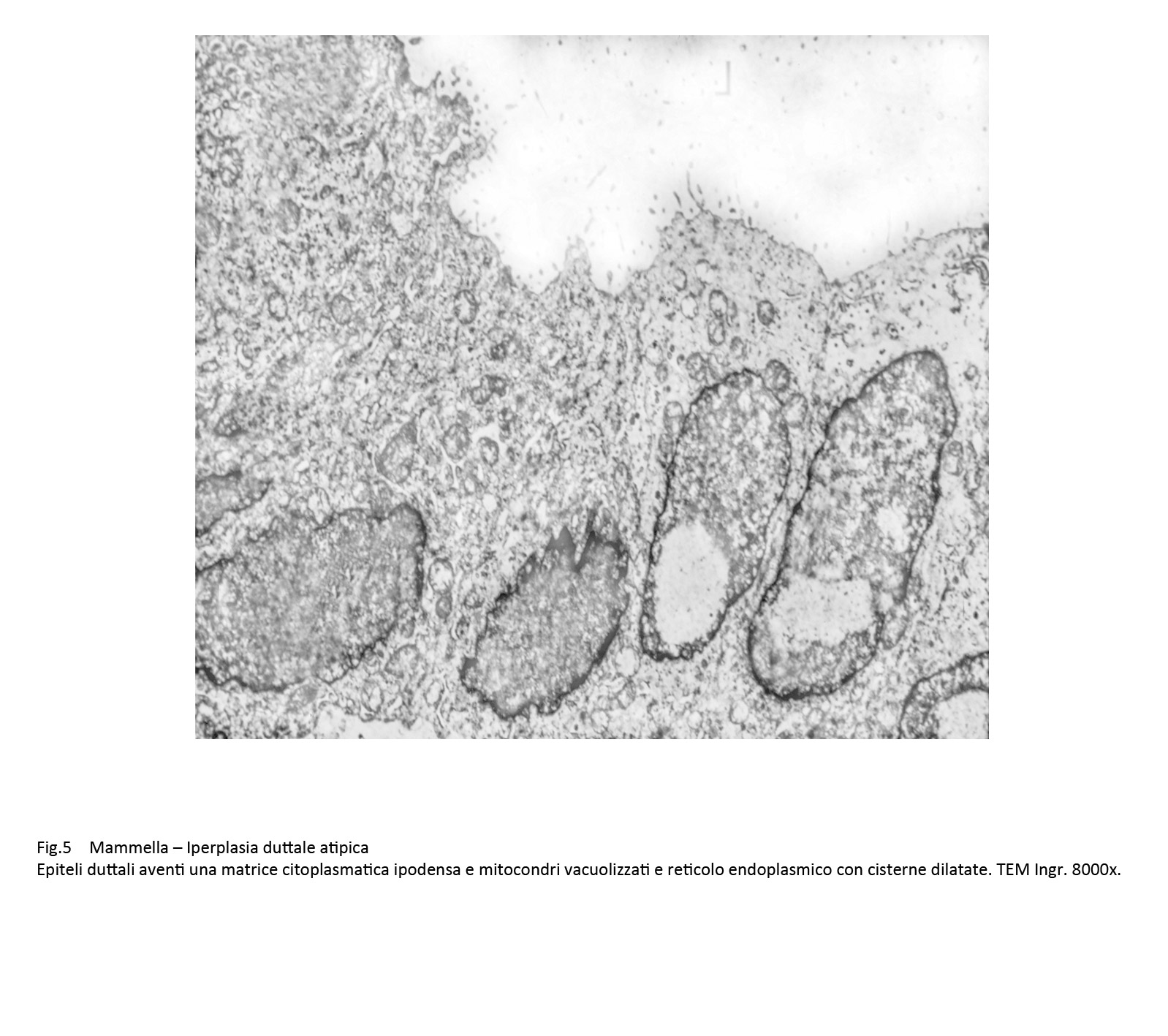 Fig.6
Fig.6 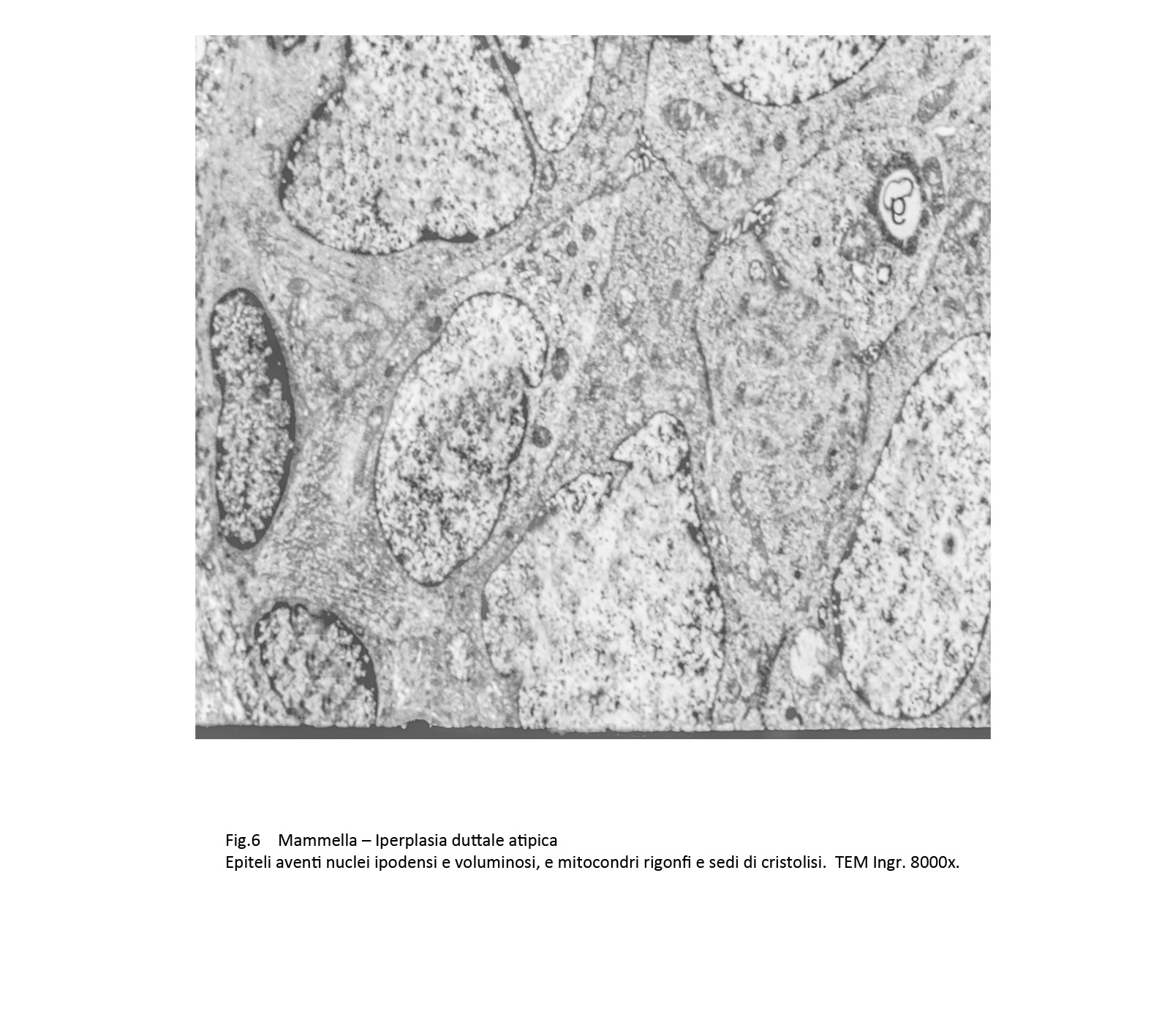
Fig.7 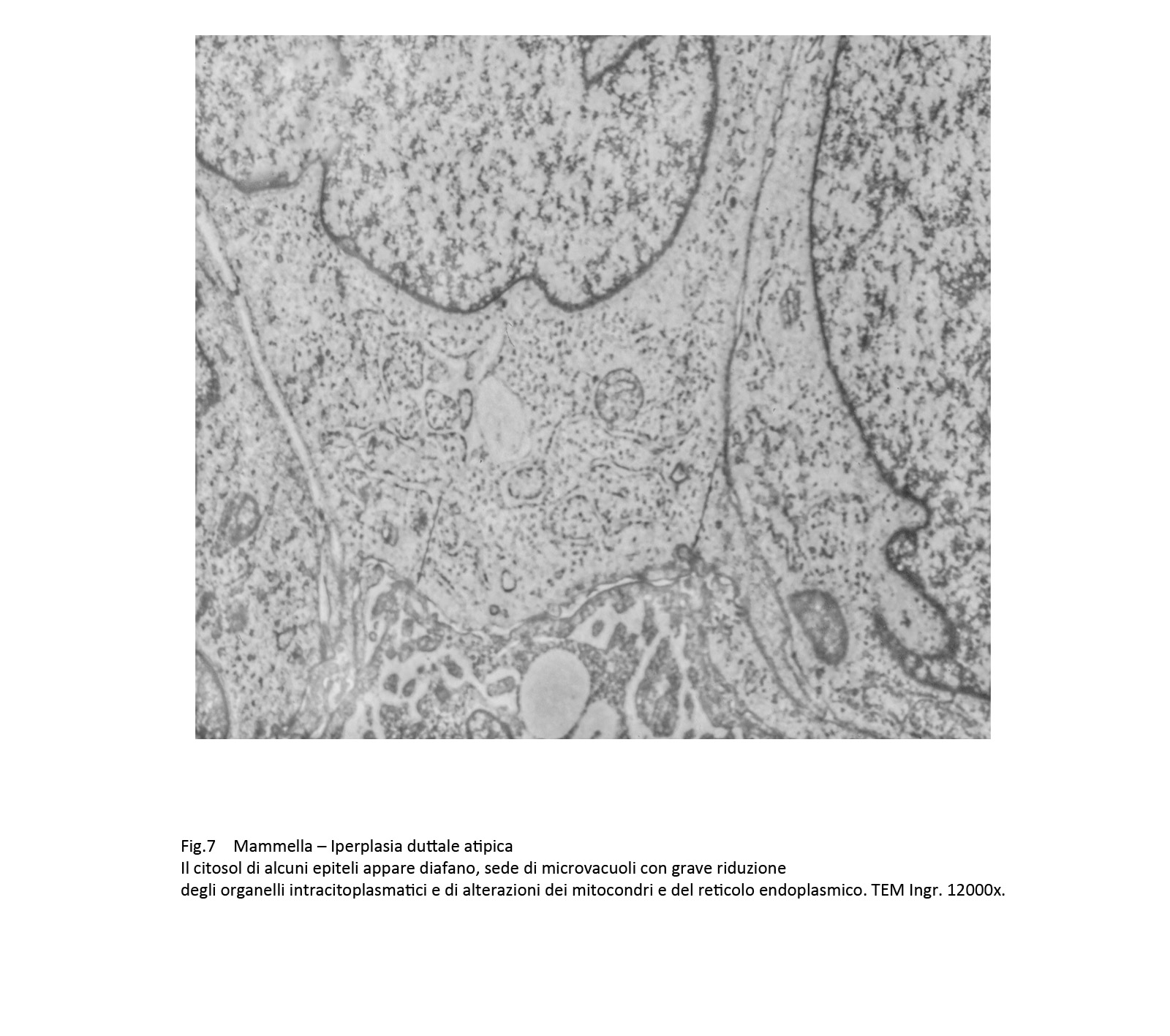 Fig.8
Fig.8 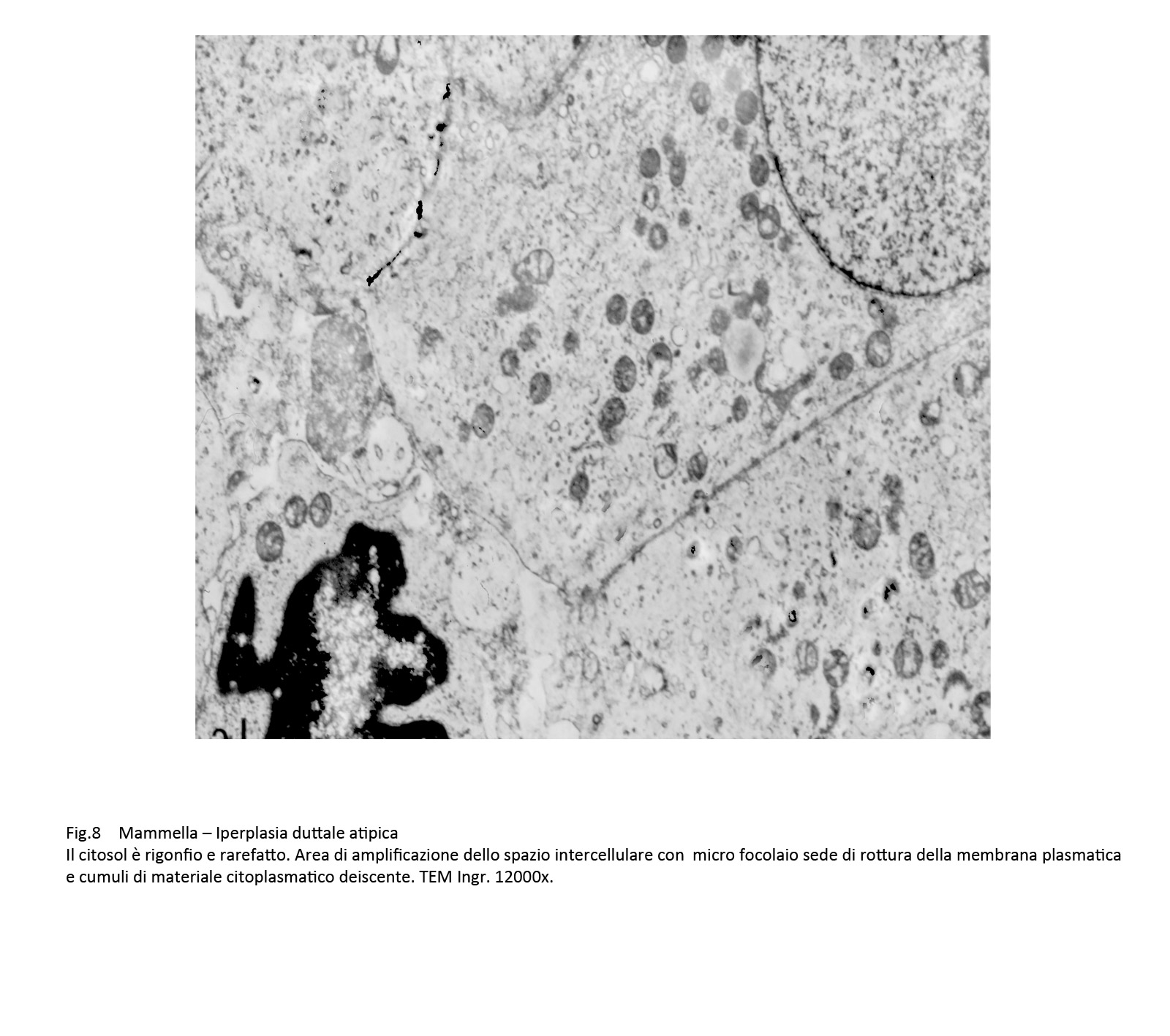
Il citosol appare ipodenso, rarefatto, sede di microvacuoli, privo del normale assetto del citoscheletro. A queste alterazioni si associano locali frammentazioni della membrana plasmatica con deiezione di materiale endocellulare negli spazi intercellulari.
Fig.9 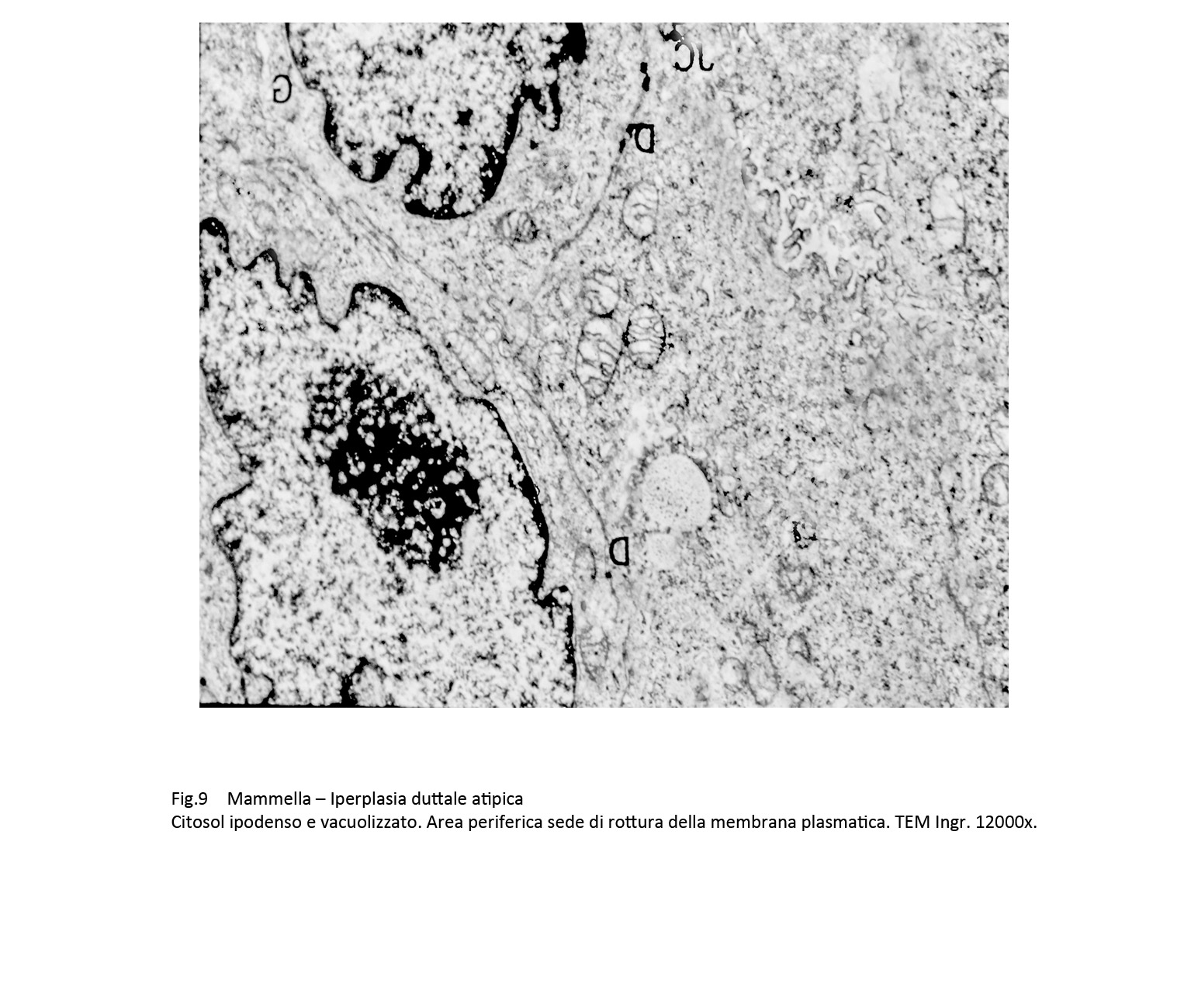 Fig.9part
Fig.9part 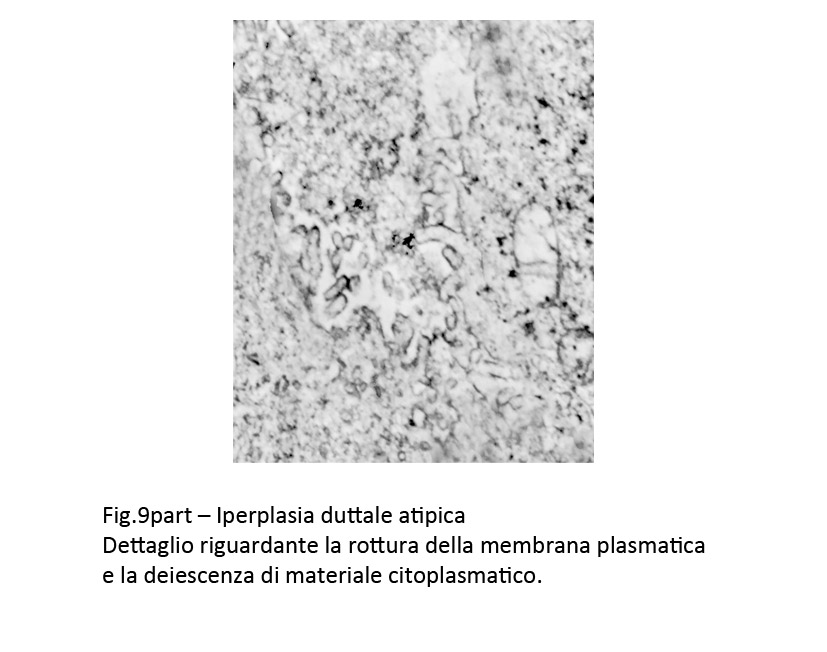
In tale contesto si repertano alterazioni dei mitocondri, dell’ergastolasma e del reticolo endoplasmatico. I mitocondri appaiono rigonfi, dismorfi, poveri o privi di creste e spesso in fissione.
Fig.10 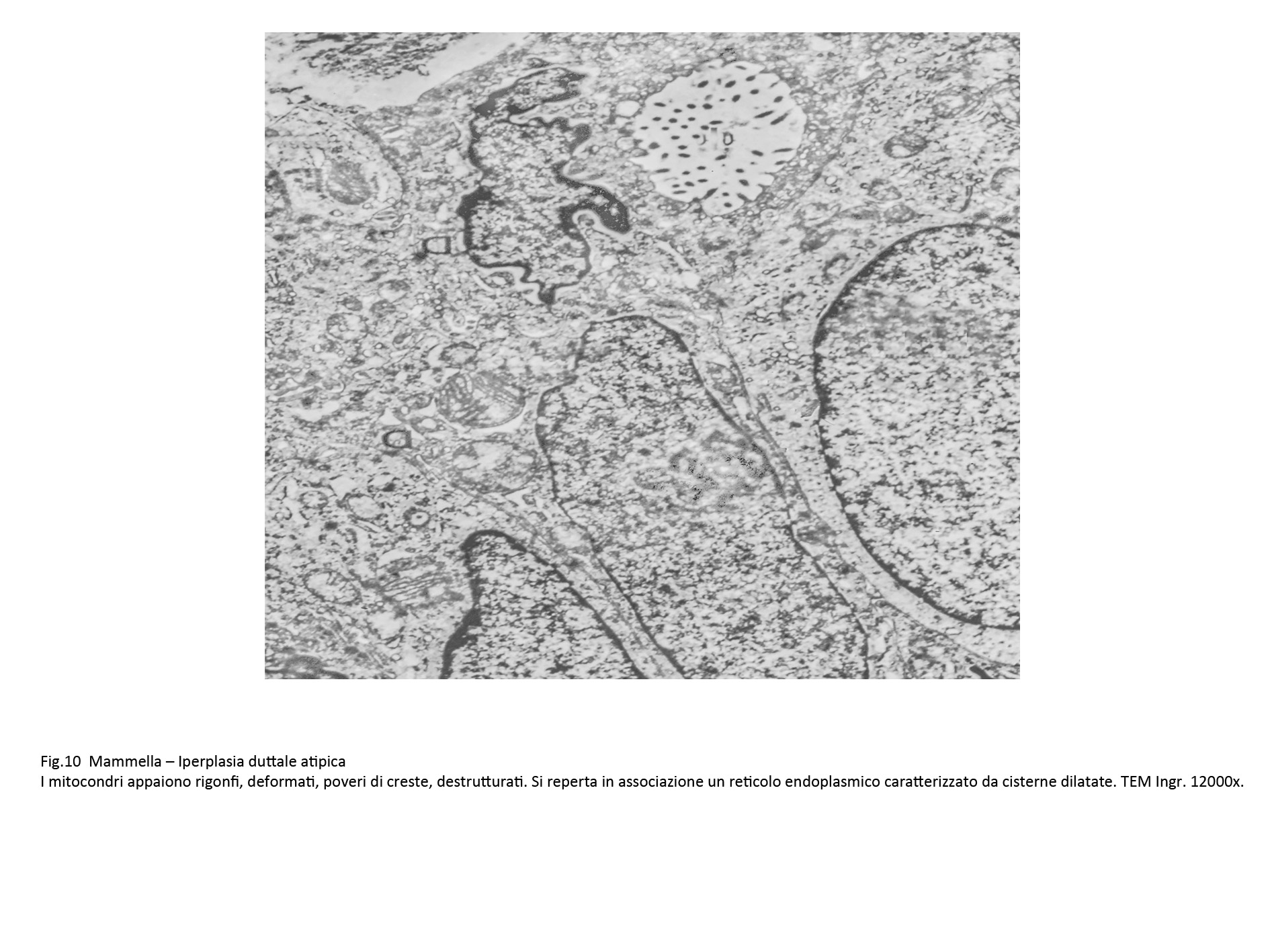 Fig.11
Fig.11 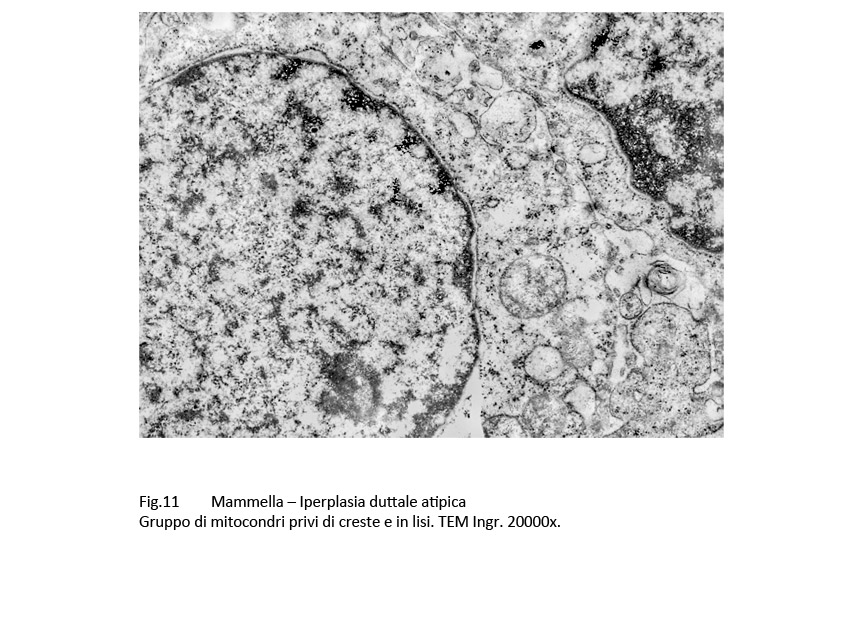 Fig.12
Fig.12 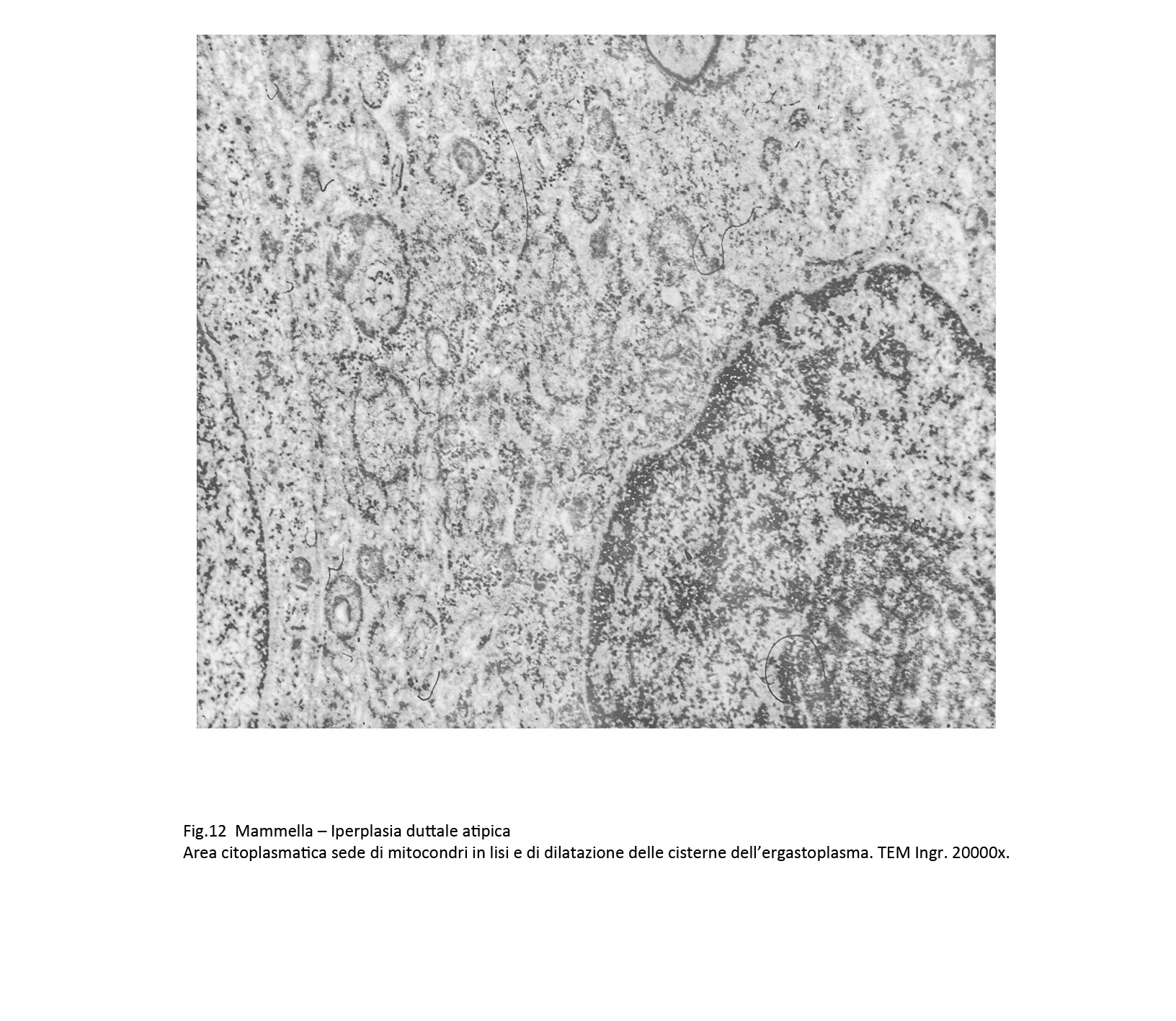
L’ergastoplasma e il reticolo endoplasmatico mostrano una dilatazione più o meno accentuata dalle loro cisterne con modificazioni del loro profilo.
Fig.13 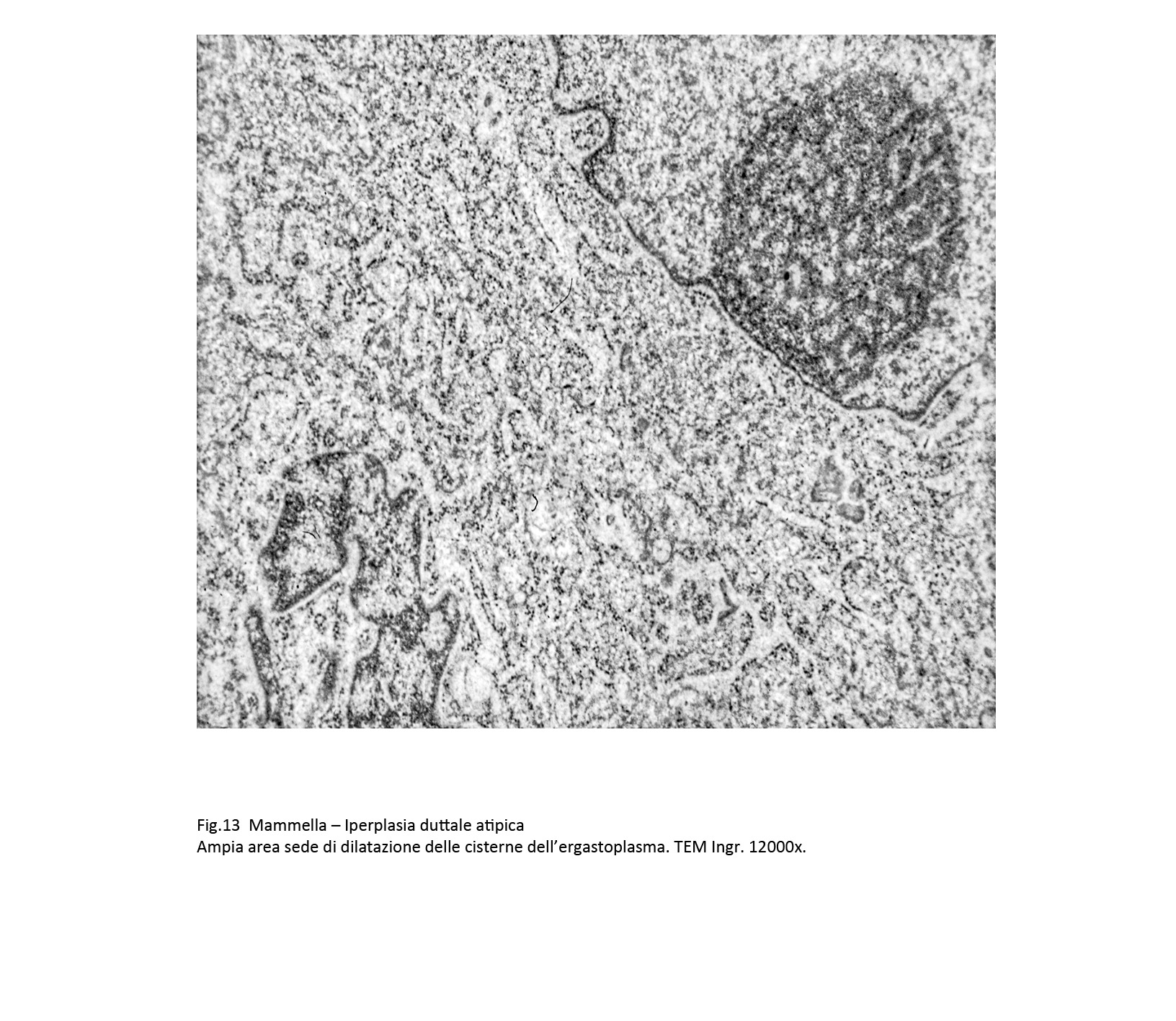 Fig.14
Fig.14 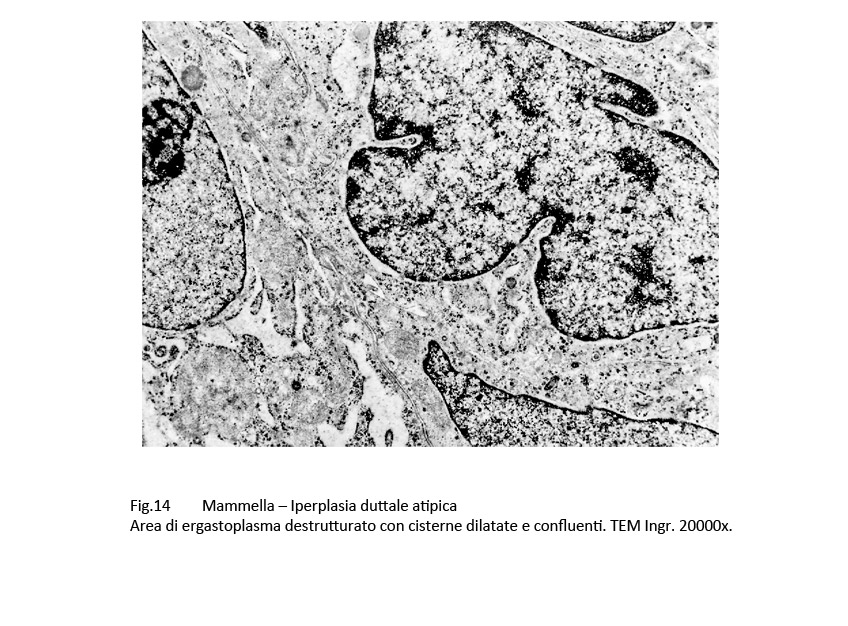 Fig.14part
Fig.14part 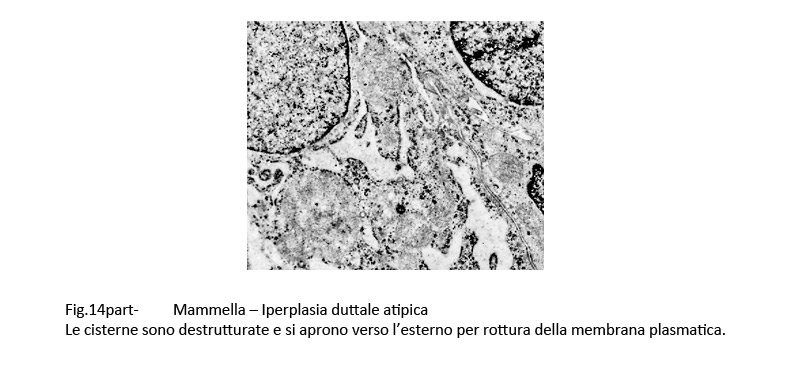
Fig.15 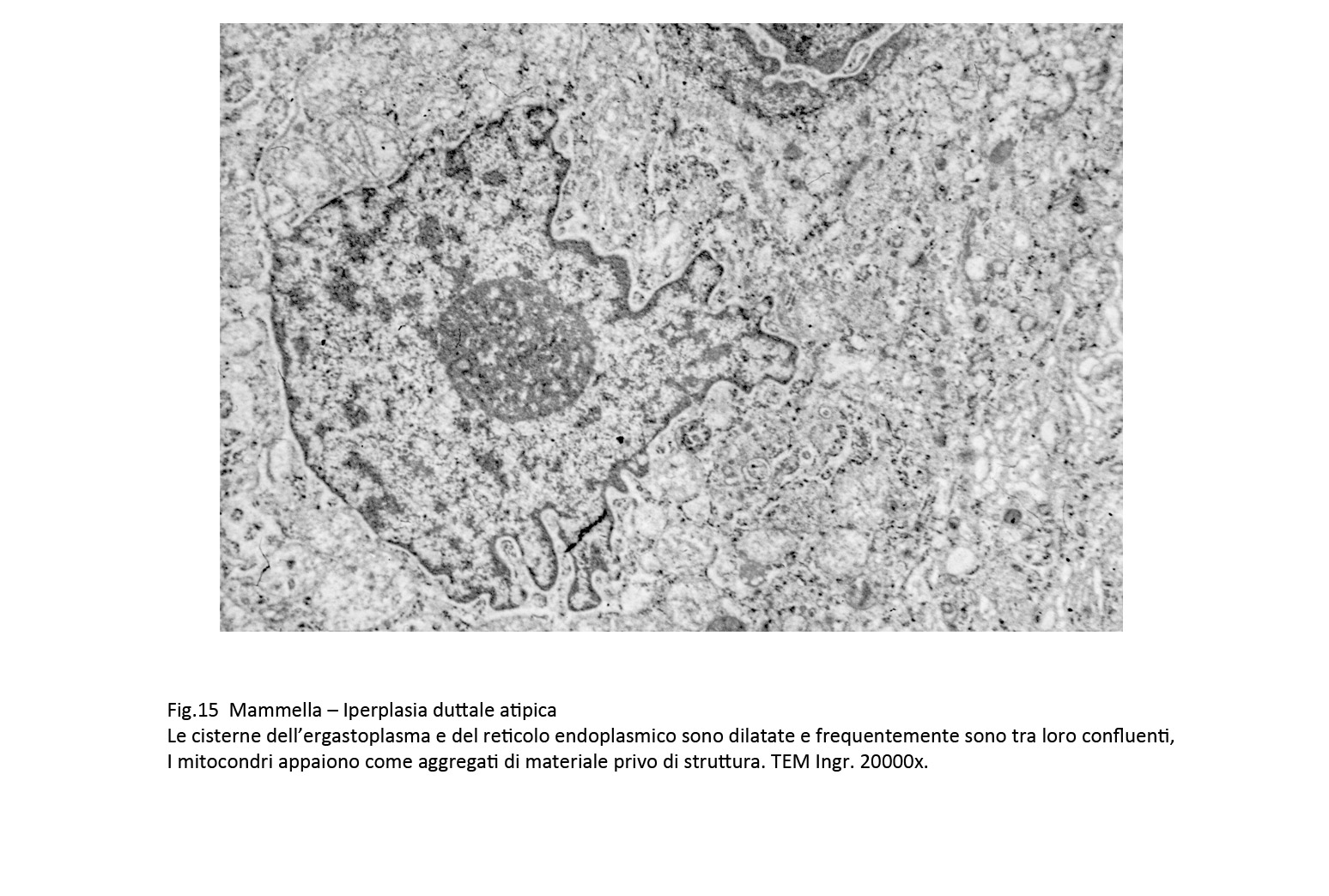 Fig.16
Fig.16 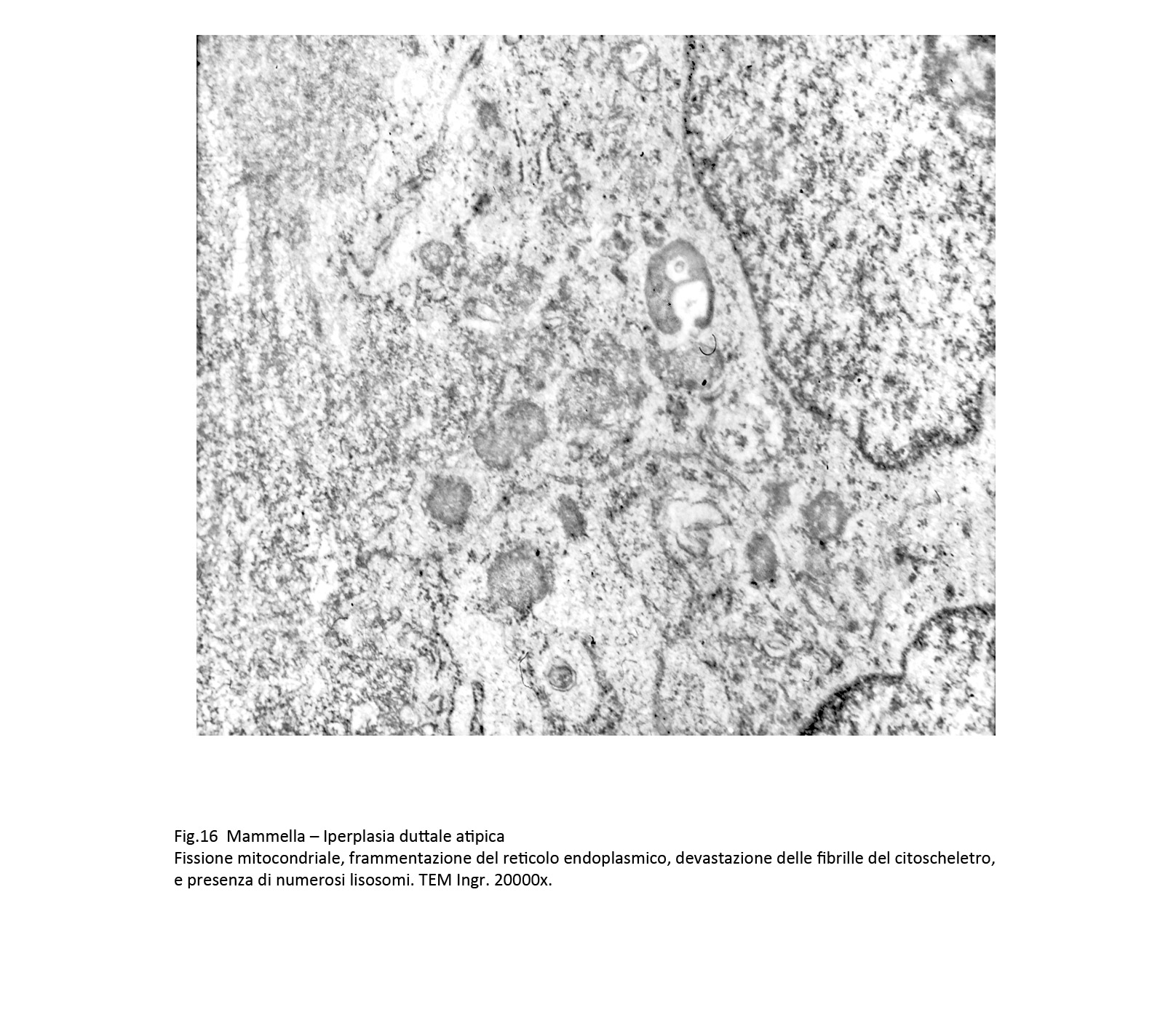
Queste alterazioni si ritrovano nella stessa area citoplasmatica e si condizionano reciprocamente e rappresentano verosimilmente una fase alterativa iniziale capace di evolvere in manifestazioni più complesse.
Queste alterazioni composite sono date da focolai di micronecrosi endocitoplasmatica e dalla formazione di autofagosomi. Le aree di micronecrosi sono di grandezza diversa, sono a margini sfumati e si ritrovano lungo le fasce periferiche del corpo cellulare. L’area interessata appare destrutturata per la compromissione e il sovvertimento del citoscheletro, per i processi di lisi degli organuli e per la presenza dominante di formazioni lisosomiali.
Fig.17 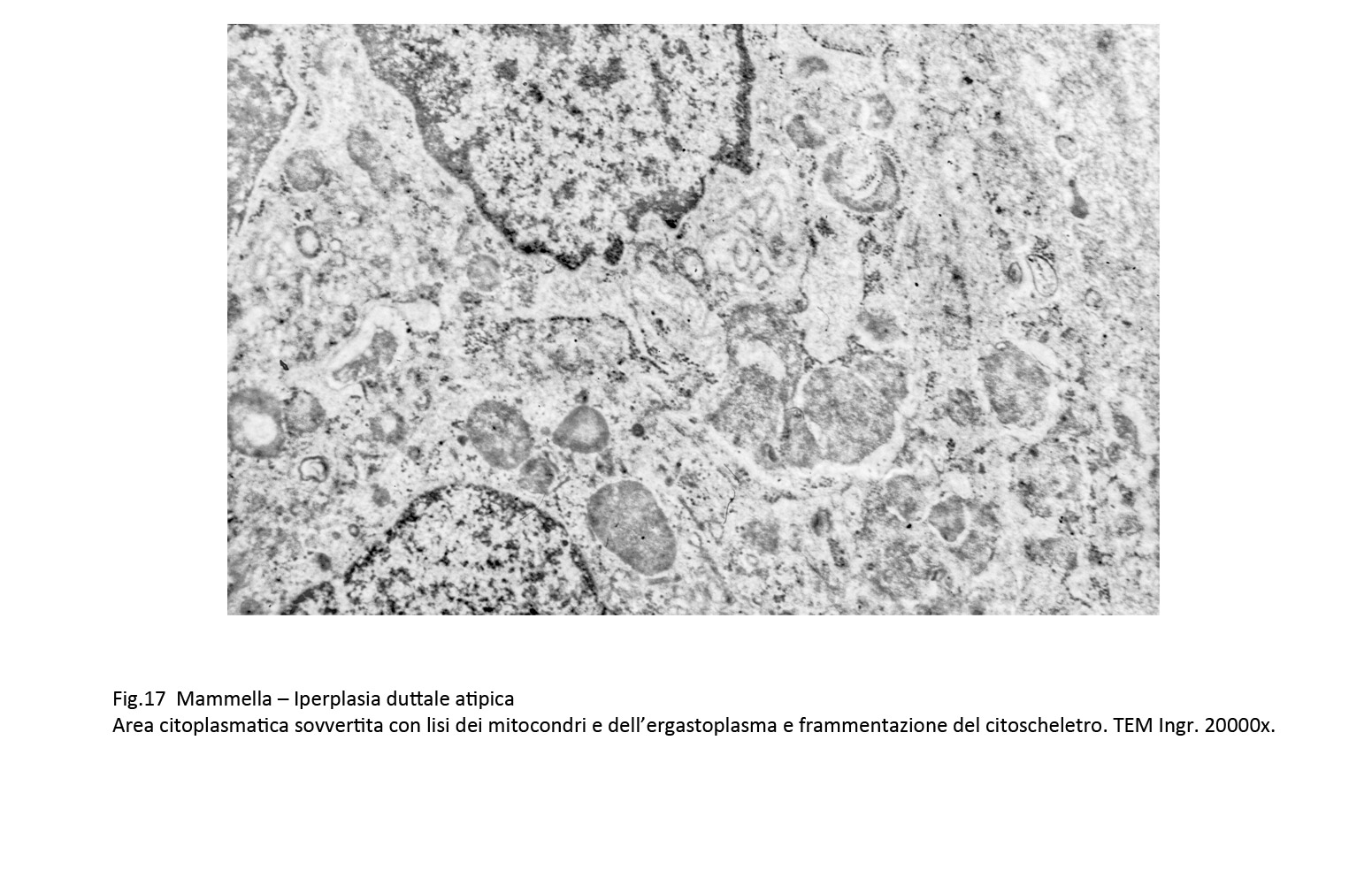 Fig.18
Fig.18 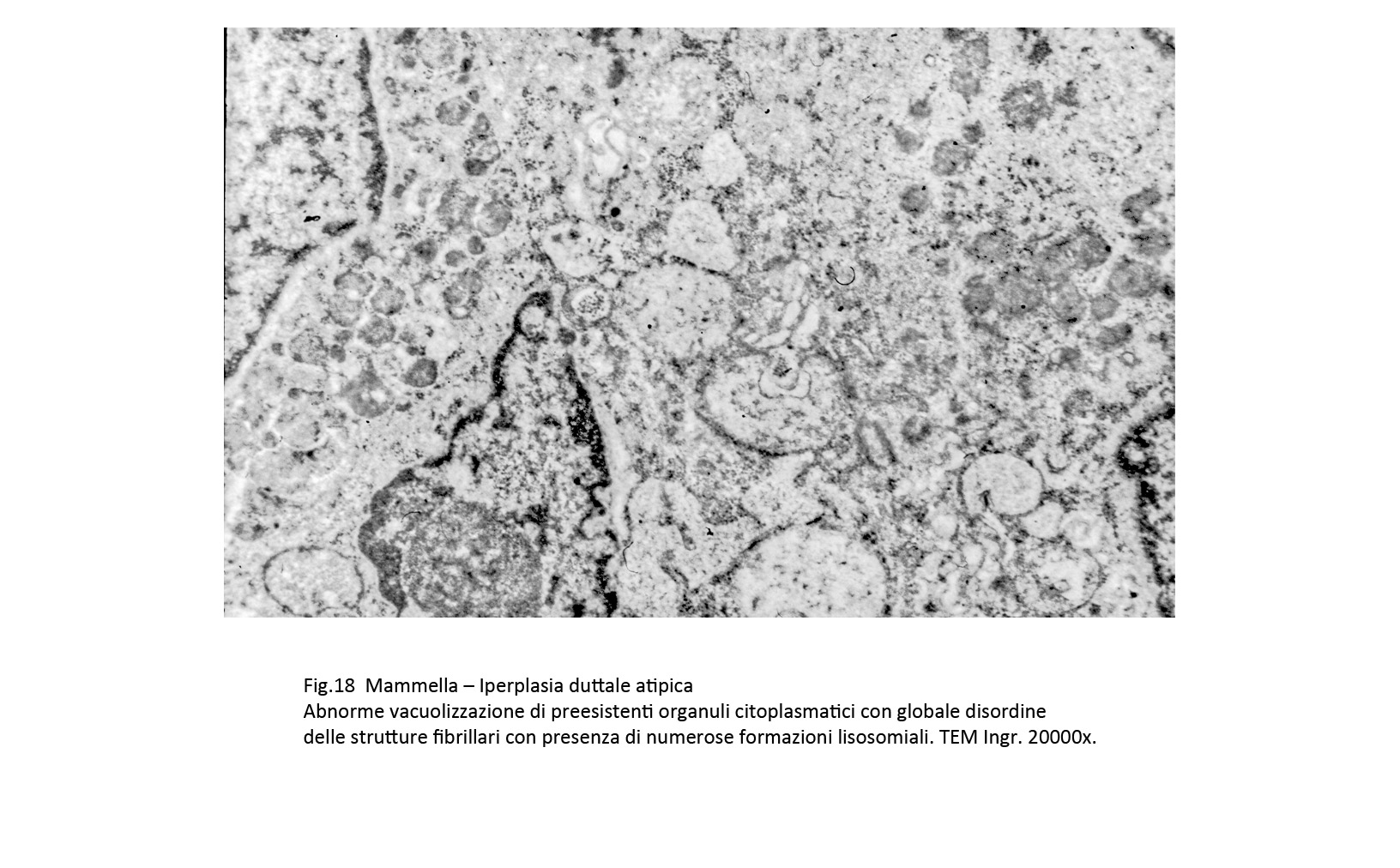
Fig.19 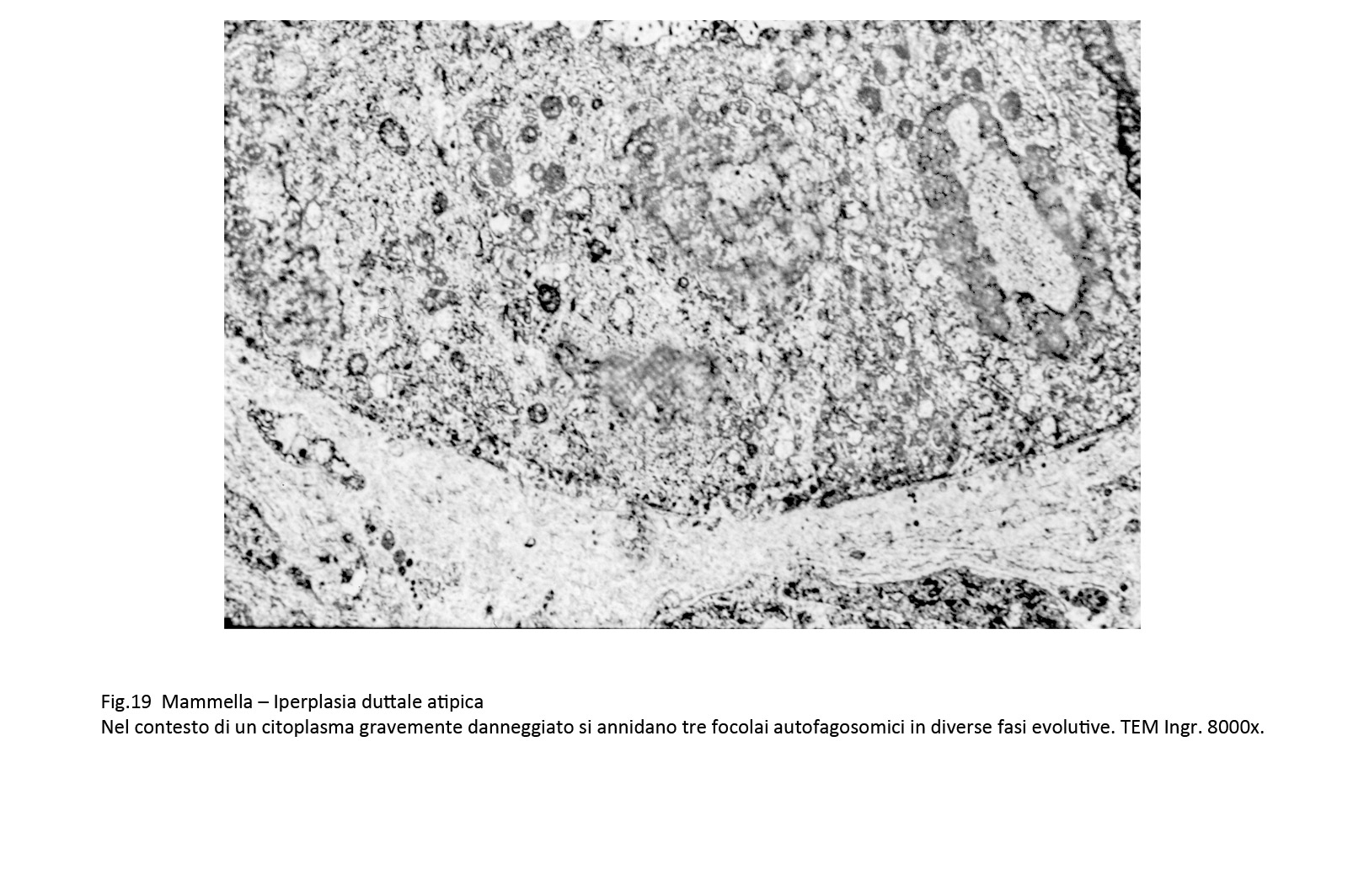 Fig.19part
Fig.19part 
Gli autofagosomi sono ben disegnati nel contesto della matrice citoplasmatica per la esistenza della doppia membrana di contorno disposta a delimitare uno spazio cavo. Sono di varia grandezza e mostrano i caratteri di diverse fasi evolutive; il loro spazio endofagosomico contiene spesso frammenti di contenuti endocellulari.
Fig.20 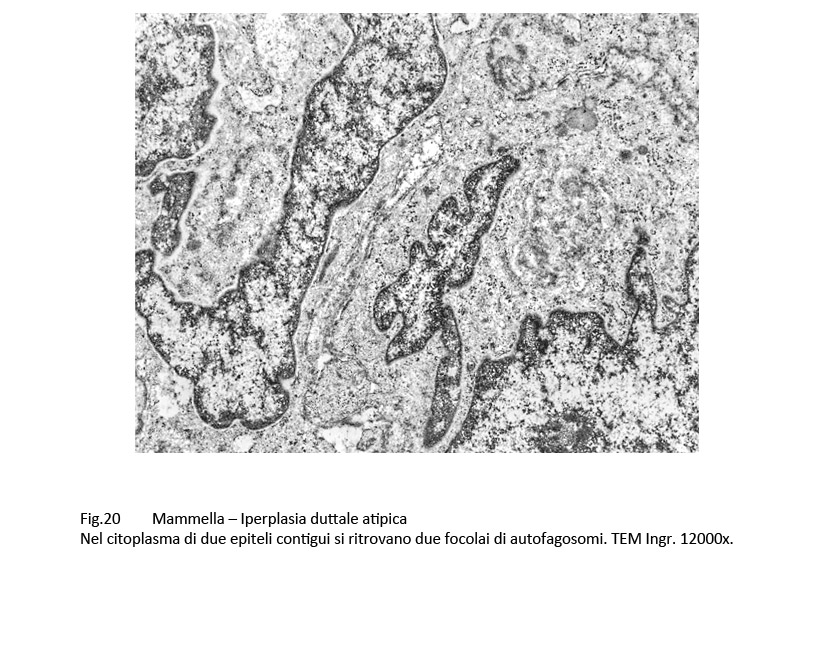 Fig.20part1
Fig.20part1 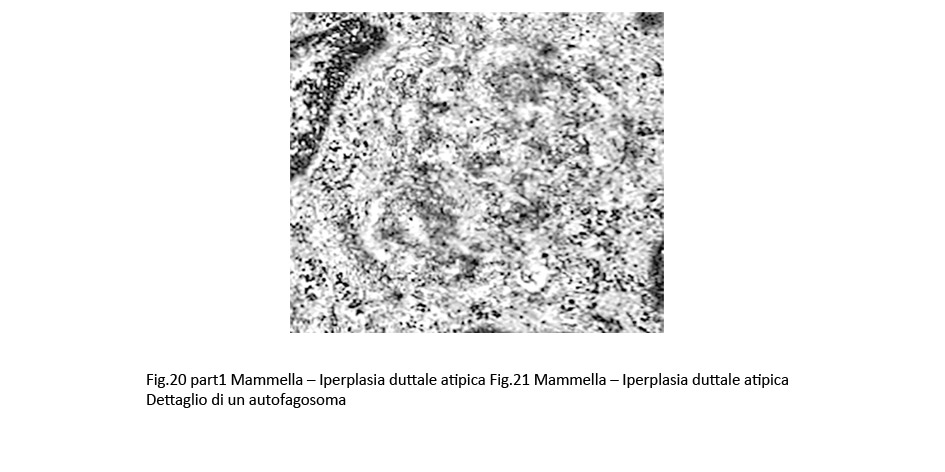 Fig.20part2
Fig.20part2 
COMMENTO
La necroptosi fa parte della biologia riguardante la morte programmata delle cellule. Essa si differenzia dalla apoptosi in quanto si manifesta con rarefazione e vacuolizzazione citoplasmatica associata ad autofagia.
Eventi di necroptosi sono stati evidenziati in numerosi organi e tessuti sedi di diverse forme di patologia e tale asserto permette di dedurre essere la necroptosi un processo biologico di primo piano nella regolazione omeostatica delle cellule
Il suo percorso bio-morfologico è idealmente divisibile in due fasi: La prima è strettamente endocellulare ed è caratterizzata da processi regressivi del citosol, dei mitocondri e del reticolo endoplasico e si conchiude con la permabilizzazione e poi rottura della membrana plasmatica. Tra gli organelli citoplasmatici sono danneggiati in notevole grado i mitocondri e conseguente collasso energetico della cellula.
La seconda fase si realizza a livello degli spazi extra-cellulari per la presenza dei contenuti endocellulari ivi riversati e l’arrivo di elementi della flogosi; questi sono espressione di attività immunogenetica e di operazioni fagocitanti i residui citoplasmatici in lisi.
Le osservazioni dianzi riportate hanno evidenziato la possibilità mediante la microscopia elettronica di documentare le due fasi dianzi citate, e di riconoscere nella gravità del danno mitocondriale e nella rottura della membrana plasmatica con la partecipazione dei lisosomi gli aspetti salienti della nefroptosi, mentre le manifestazioni extra cellulari sono da considerare conseguenti e derivanti dalla prima fase, che rappresenta l’essenza del processo necroptotico.
