La gastrite cronica di H-Pylori è una affezione progressiva evolvente da un iniziale quadro di flogosi cronica,a quello di adenocarcinoma per instabilità genetica degli epiteli (World J Gastroenterology 2014;20:5461-5473) (Pathogens 2021;10(9):1099).
Secondo il sistema Correa, questa affezione si manifesta attraverso le fasi di gastrite cronica non atrofica, di gastrite cronica atrofica multifocale, di metaplasie di varia morfologia, di displasia di lieve grado (neoplasia non invasiva di lieve grado), displasia di alto grado (neoplasia non invasiva di alto grado),e di adenocarcinoma (Am. J. Gastroenterology 1988; 83(5): 504-509).
Il quadro istopatologico della gastrite cronica da H.Pylori è aspecifico; in breve, esso è caratterizzato da processi erosivo-ulcerativi correlati a infiltrazione di elementi della flogosi e una progressiva distruzione del patrimonio ghiandolare; nelle fasi avanzate, si configura una immagine di mucosa depauperata di ghiandole con plaghe di stroma occupato in modo cospicuo da elementi flogistici.
Questo processo nel suo dinamismo evolutivo tende ad acquisire due varianti istopatologiche:
La prima è rappresentata da processi evolventi verso strutture sclero-cicatriziali con esaurimento della componente flogistica e sostituzione di questa con macrofagi, fibroblasti e neoformazione di fibrille pre-collagene e collagene con sbocco conclusivo in un quadro istopatologico di tipo cicatriziale.
La seconda variante è data dalla persistenza del processo flogistico e successiva sostituzione degli epiteli nativi con altri aventi i caratteri morfo-funzionali appartenenti ad altri segmenti dell’apparato digerente, configurandosi in tal modo reperti circoscritti o diffusi di metaplasia di tipo intestinale.
La istogenesi di questo processo metaplasico si ritrova nella necrosi degli epiteli parietali e nelle susseguenti abnormi manifestazioni rigenerativo-proliferative degli epiteli residui. (Am. J. Gastroenterol. 1998; 93: 376-379). (Nature 2002; 420: 860-867) (Dig. Liver Dis. 2008; 40: 490-496) (World J. Gastroenterol. Oncology 2019; 11(9): 665-678).
Questi processi,progressivi e ingravescenti, sono riscontrati nelle gastriti croniche da H-Pylori o da altre cause e sono considerati precursori di eventuali sbocchi carcinogenetici; i dati epidemiologici documentano il rischio di questo passaggio dalla flogosi cronica alle lesioni carcinomatose passando attraverso le fasi delle metaplasie e delle displasie (Cancer Res. 1975; 35: 3452-3459) (J. Infect. Dis. 2003; 187(8): 1165-1177) (Pathologica 2020; 112(3): 166-185).
Le fasi delle metaplasie si manifestano secondo diversi aspetti istologici e sono indicate con i termini di Metaplasia intestinale completa, Metaplasia intestinale incompleta, Metaplasia pseudopilorica:
A. Metaplasia intestinale completa
Questa forma è caratterizzata dalla presenza nella mucosa gastrica di epiteli colonnari simili a quelli dell’intestino tenue; essi mostrano un citoplasma eosinofilo fornito di un orletto a spazzola; questa filiera di elementi è intercalata da cellule caliciformi e da vari elementi del Paneth. Indagini istochimiche hanno evidenziato la perdita delle mucine gastriche e la presenza di mucina MUC 2 (Nat.Rev.Cancer 2017;17(10):594-604).
B. Metaplasia intestinale incompleta
La mucosa gastrica, sede di questa metaplasia,si presenta con i caratteri microscopici della mucosa del colon. Gli epiteli di superficie e quelli delle ghiandole sono mucipari, contengono gocce di mucine intracitoplasmatiche; a questi si associano numerose cellule caliciformi secernenti le mucine MUC-5HC e MUC6 (J. Gastroenterology 2005; 40: 337-344) (Int. J. Mol. Sci. 2017; 18(10): 2063).
C. Metaplasia pseudopilorica (SPEM =Spamolitic Polipeptide Metaplasia)
Questa metaplasia è caratterizzata dalla sostituzione degli epiteli acidofili delle ghiandole del corpo e del fondo gastrico con ghiandole mucipare del piloro. A questa modificazione morfologica si associa la produzione del fattore TEF2 (Trefoil Factor Family 2) (Pathologica 2020; 112(3): 166-185).
Le metaplasie, se sono persistenti e proliferative, possono acquisire i caratteri morfo-biologici delle displasie di lieve o di alto grado (Nat. Rev. Cancer 2017; 17(10): 594-604).
Le displasie di lieve grado (neoplasie intraepiteliali di lieve grado) si distinguono con difficoltà dai normali processi proliferativo-rigenerativi. Esse sono caratterizzate da ghiandole moderatamente dismorfe, rivestite da epiteli pluristratificati, occupati da nuclei monomorfi, ma voluminosi, ipercromatinici o vescicolosi, con nucleoli preminenti, raramente in attività mitotica.
Le displasie di alto grado (neoplasie intraepiteliali di alto grado) sono caratterizzate da modificazioni del profilo delle ghiandole; gli epiteli sono pleomorfismi, hanno perduto la polarità citoplasmatica, hanno nuclei voluminosi con nucleoli preminenti,e spesso in mitosi. Queste forme sono distinguibili con difficoltà dal carcinoma in situ (Pathologica 2020; 112(3): 166-185).
L’eziopatogenesi di questi processi metaplasici- displastici con possibili evoluzione in adenocarcinoma, è stata oggetto di una immensa letteratura; in essa è stato documentato che gli H.-pylori svolgono la loro azione patogena soprattutto mediante meccanismi quali i fattori di virulenza, le alterazioni di alcuni miRNAs, la secrezione di citochine e chemochine, i coinvolgimenti epigenetici.
Di notevole importanza sono ritenuti i fattori di virulenza sintetizzati dagli H.-pylori; essi sono molteplici e quelli maggiormente patogeni, capaci di produrre plurime lesioni delle cellule, sono le molecole VacA e CagA (J. Dig. Dis. 2013; 14(7): 341-349).
Questa loro potenzialità patogenetica ha imposto la necessità di distinguere gli H.-pylori nei seguenti due sottogruppi:
Ceppi di H-Pylori positivi per la sintesi delle molecole VacA e CagA
Ceppi di H-Pylori negativi per la sintesi di tali molecole (World J. Gastroenterol. 2020; 26(25): 3673-3685).
I ceppi di H.-pylori positivi mediante la sintesi di tali molecole sono causa delle seguenti plurime quanto gravi alterazioni citologiche:
A) Il fattore VacA (Vacuolating Citotoxin A), è una proteina costituita da due sub-unità: 33/A e 55KDa; la prima causa pori a carico della membrana plasmatica, la seconda si lega agli organelli intracitoplasmatici danneggiandoli (J. Biol. Chem. 2003; 278: 1201-1208). Esso viene internalizzato mediante i meccanismi dell’endocitosi e del sistema T4SS (Type IV secretory system), si raccoglie negli endosomi per poi interagire con le proteine del cytosol e legarsi alle membrane dei mitocondri (Gut Microbes 2010; 116: 392-395) (Adv. Exp. Med. Biol. 2019; 1149: 35-56).La sua azione è polivalente in quanto determina lesioni regressive, risposte infiammatorie e alterazioni dei sistemi di controllo dei processi proliferativi e carcinogenetici (World J. Gastroenterol. 2014; 20(36): 12767-12780).
B) Il fattore CagA (Citotoxin asociated gene A) è altamente virulento provocando ulcere e carcinoma gastrico (Science 2000; 287: 1497-1500).
E’ sintetizzato dagli H-Pylori e anch’esso viene internalizzato nelle cellule ospiti mediante il sistema T4SS (Helicobacter 2011; 16: 19-25). Le alterazioni epiteliali indotte da questo fattore sono molteplici e riguardano il sistema giunzionale, la polarità delle cellule, le alterazioni delle fibrille di actina del citoscheletro, l’attivazione delle citochine flogogene, ma soprattutto il potenziamento delle attività proliferative delle cellule. Questa azione è aggravata da coesistenti processi di trans-differenziazione degli epiteli, dal rimodellamento della matrice extracellulare con perdita dell’adesione intercellulare (Nature 2007; 447: 330-333) (FEBS 2011; 278: 1203-1212)(World J. Gastroenterol 2015; 21(45): 1272-1276).
E’ stato riscontrato in vivo e in vitro che gli H-Pylori alterano la espressività dei miRNAs, molecole atte ad alterare il genoma delle cellule ospiti,a modificare il loro ciclo cellulare, a favorire l’apoptosi, a indurre processi neoplastici. (Int. J. Cancer. 2011; 128: 361-370) (RNA Biol. 2012; 9: 742-750 ) (World J. Gastroenterol. 2013; 19:2985-2996). Il riscontro di miRNAs modificati in tutti i tumori suggerisce la loro implicazione nella tumorogenesi anche mediante regolazione di oncogeni o geni soppressori (Am.J Pathology 2009;174:1131-1138).
Nel corso della flogosi dagli H-Pylori si ha la secrezione di citochine, chemochine, fattori di crescita, prostglandine, ROS (Reactive Oxigen Species) che possono danneggiare il DNA e il RNA degli epiteli con il rischio di mutazioni geniche, alterazioni della sintesi delle proteine e di importanti enzimi, tutte condizioni favorenti processi carcinogenetici (J.Cancer Rev 2015; 20(1): 25-40) (Pathol Oncol.Res 2015; 21: 527-534).
Gli H.-pylori, mediante interazione con le cellule ospiti attivano processi epigenetici, quali mezzi che agiscono sul genoma aumentando la possibilità della carcinogenesi (Helicobacter 2008;13:35-41) (Genes,Basel 2014;5:821-864). I meccanismi epigenetici sono importanti quali regolatori dei processi di metilazione del DNA e l’azione su l’assetto dei miRNAs. Nelle infezioni da H.-pylori sono stati riscontrati livelli alti di metilazione del DNA nei reperti di gastrite atrofica, nelle gastriti metaplasiche e displasiche (Clin.Cancer Res. 2006; 12:989-995) (J.Pathol. 2009;219:410-416).
REPERTI
I quadri istopatologici qui di seguito descritti riguardano la mucosa del corpo gastrico, sede di flogosi cronica,di metaplasie e di displasie correlate ad infezione da H.-Pylori.
Il quadro morfologico di base è rappresentato da una superficie della mucosa di aspetto variabile con passaggio da reperti nei limiti della norma ad altri caratterizzati da erosioni o ulcerazioni superficiali.
La tonaca propria è sede di infiltrati flogistici costituiti da elementi mononucleati ed è fornita di una trama fibrillare ben sviluppata e dissociata da edema interstiziale. Questo stato morfologico tende verso un progressivo accrescimento delle fibrille collagene con un viraggio della popolazione flogistica verso la comparsa di macrofagi e fibroblasti.
La quota delle ghiandole è ridotta ed esprime la gravità del processo di atrofia in atto. Non è infrequente il riscontro, accanto a ghiandole invase dalle cellule flogistiche e in preda a necrobiosi degli epiteli, di altre ghiandole in rigenerazione con epiteli aventi i caratteri della metaplasia o della displasia.
I sopracitati reperti di metaplasia sono diversi, e rientrano nei quadri della metaplasia intestinale completa, della metaplasia intestinale incompleta, della metaplasia pseudopilorica e mostrano il seguente profilo morfologico:
A. Metaplasia intestinale completa
Le superfici della mucosa sono diversificate per la presenza, a seconda dei casi, di proiezioni simil-villose o di aree di erosioni o di ulcerazioni. La quota ghiandolare è ridotta ed è rappresentata da strutture tubulari rivestite da epiteli acidofili intercalati da cellule caliciformi. Questi elementi sono simili agli enterociti dell’intestino tenue,ma con i comuni metodi di istologia non è possibile evidenziare la presenza dell’orletto a spazzola.
Fig.1 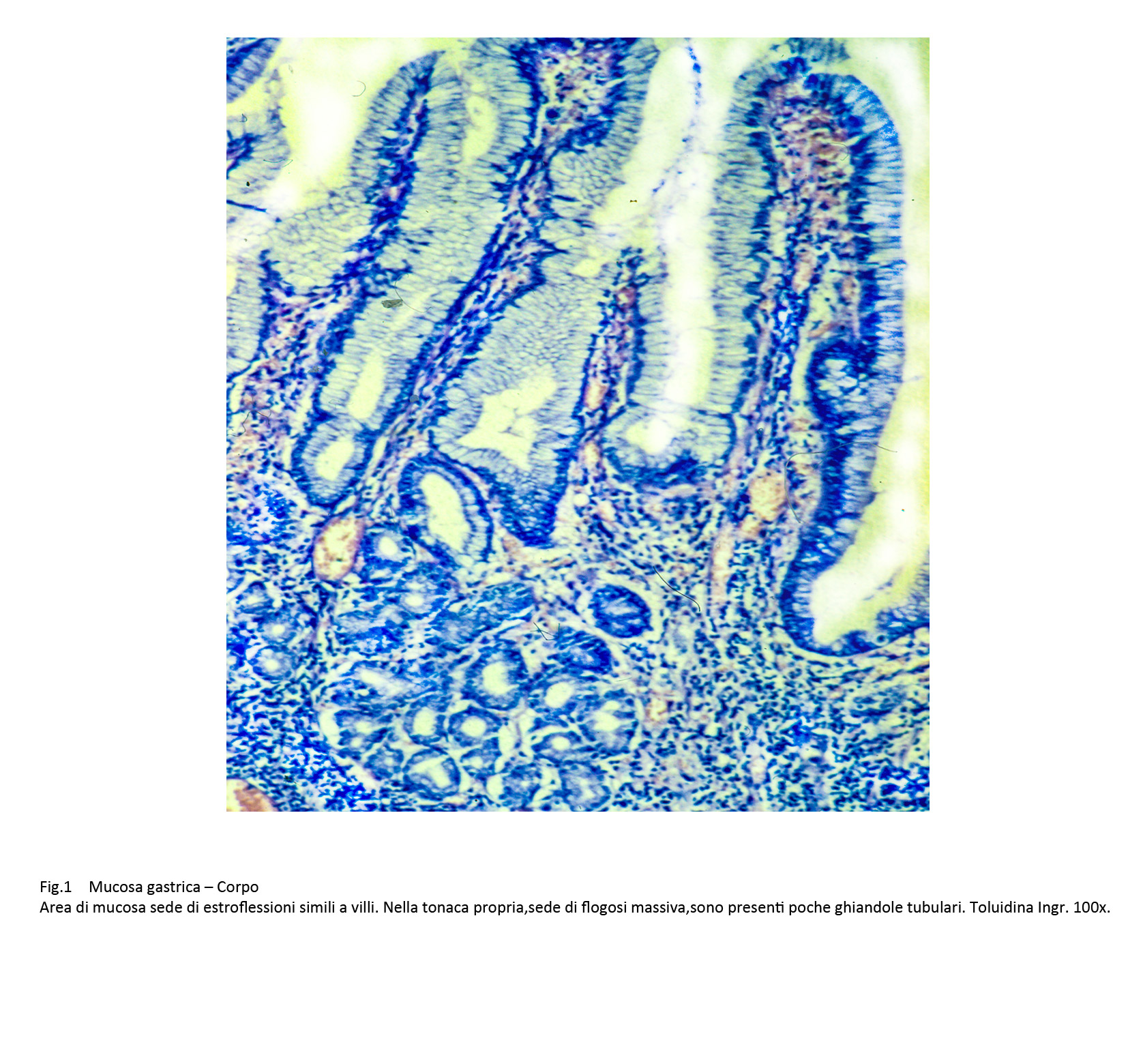 Fig.2
Fig.2 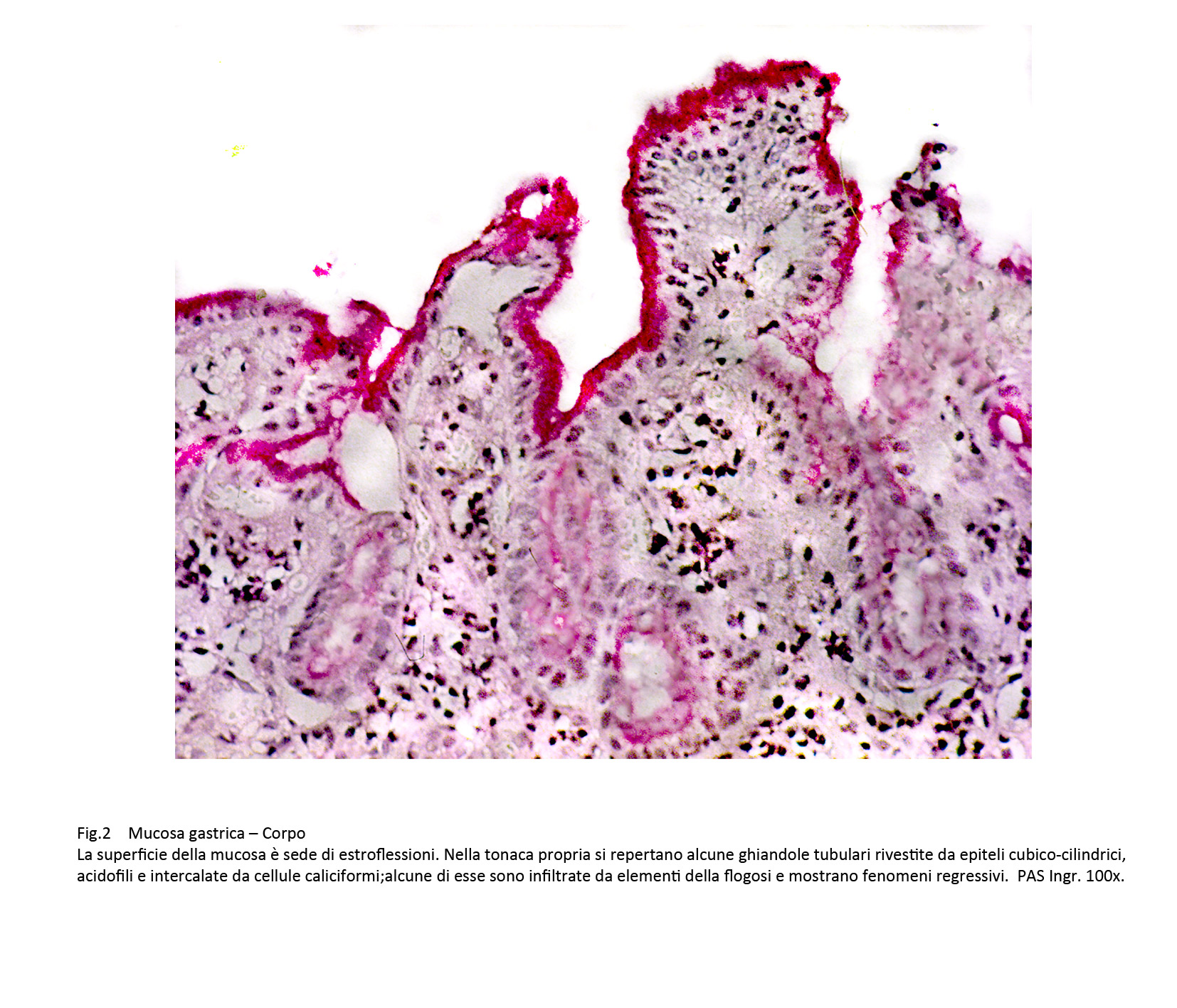 Fig.3
Fig.3 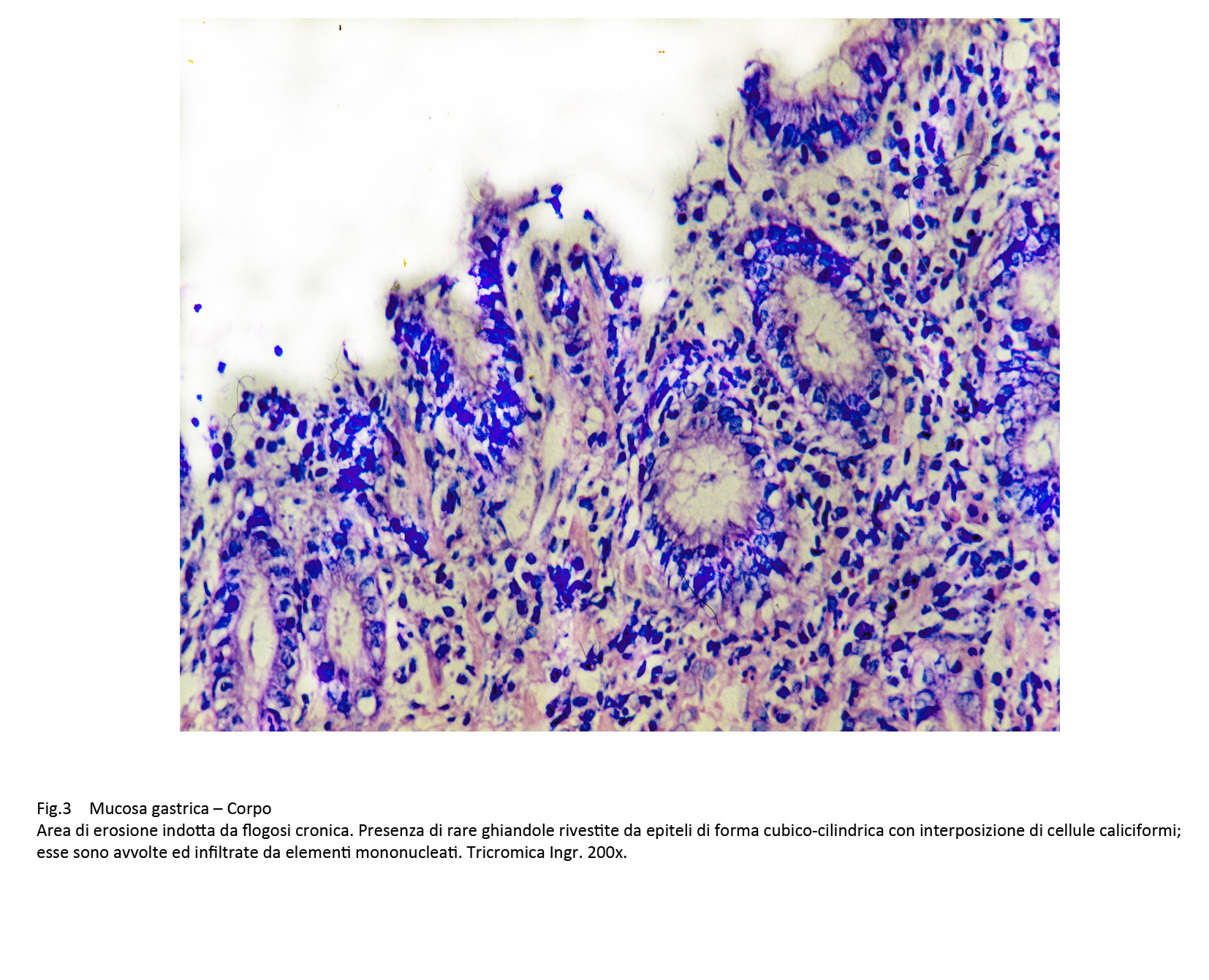
Fig.4 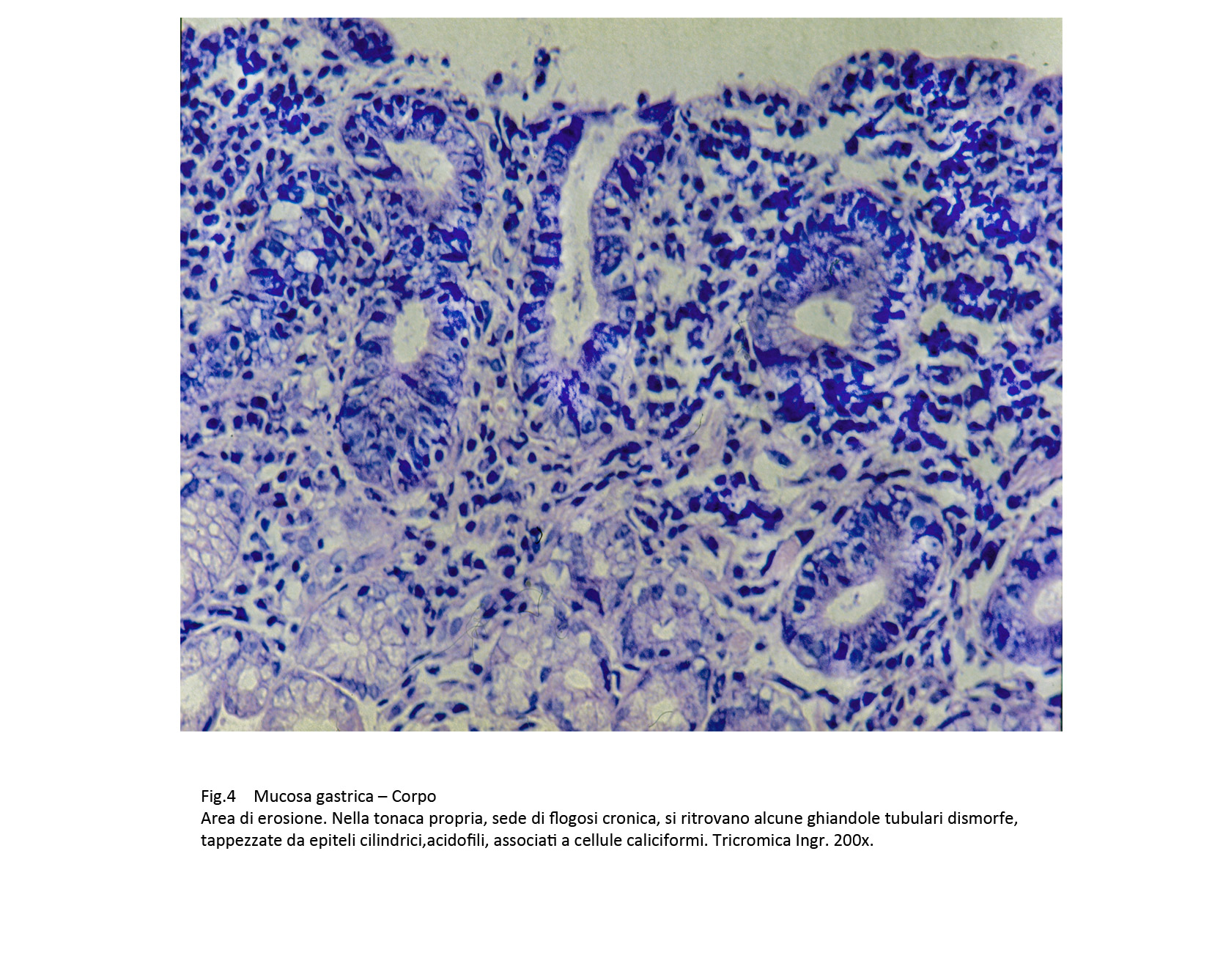 Fig.4a
Fig.4a 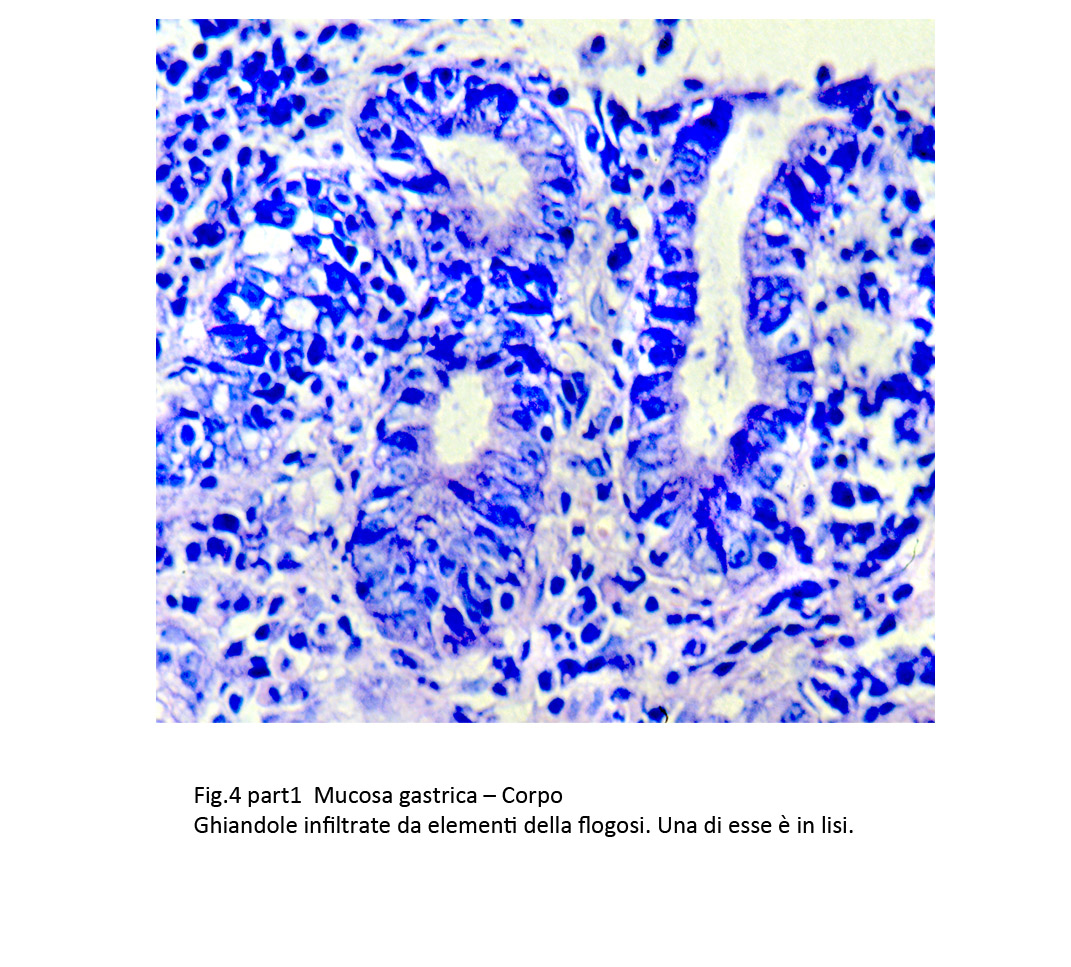
Fig.4b 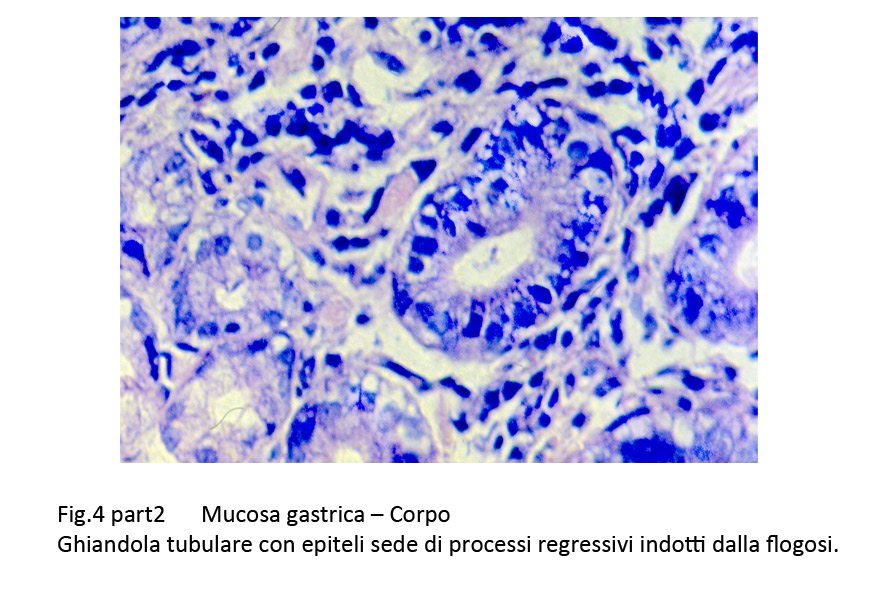 Fig.5
Fig.5 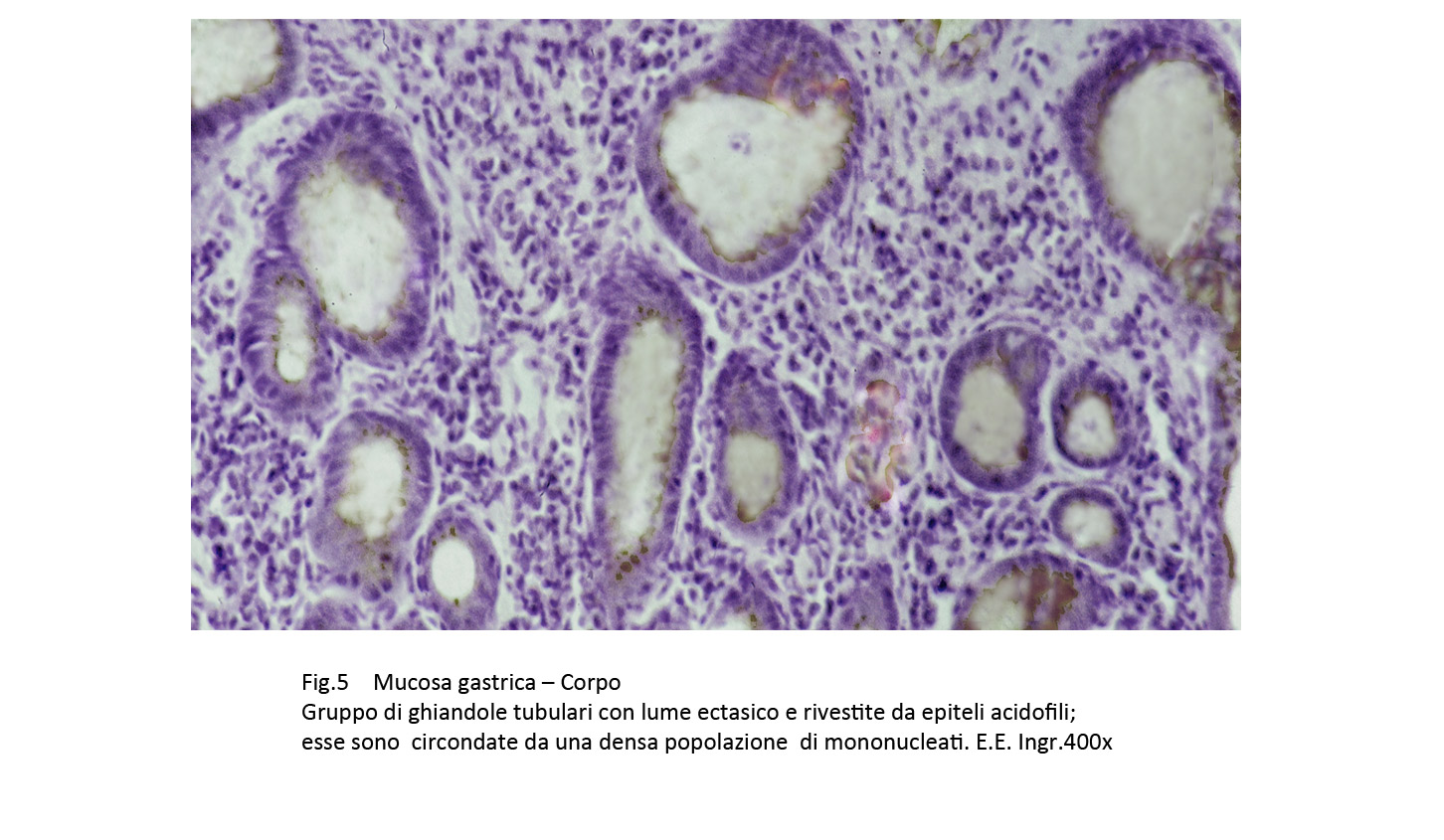
B. Metaplasia intestinale incompleta
Il rivestimento della mucosa varia da quadri di integrità microscopica a quelli di erosione o di ulcerazione. Nei casi in cui esso è conservato, si manifesta come una linea continua di cellule mucipare.
La quota ghiandolare è ridotta di numero ed è rappresentata da strutture tubulari di diverso diametro rivestite da epiteli mucipari in attività secretiva. In immagini d’insieme tale quadro microscopico è simile a quello della mucosa del colon.
Fig.6 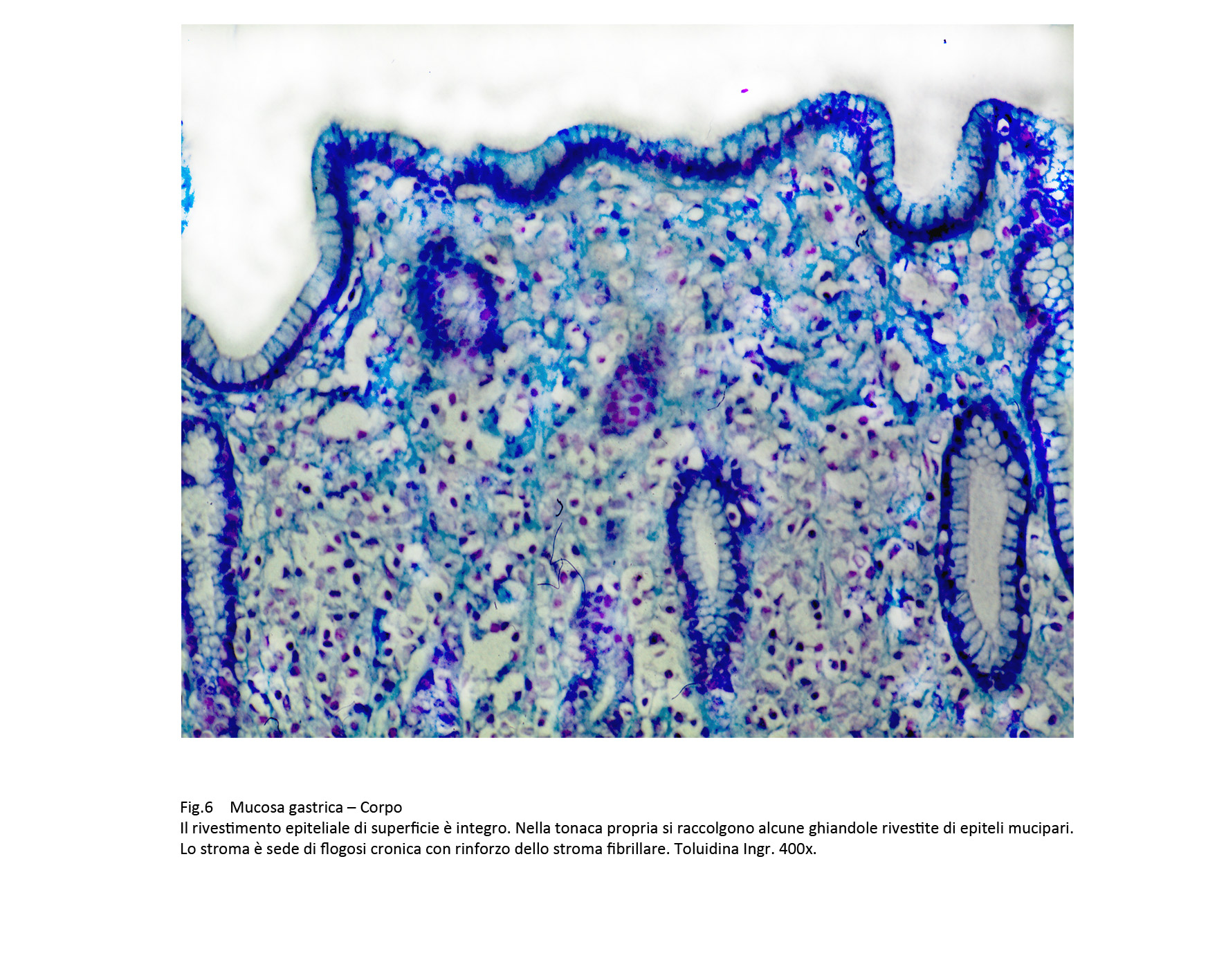 Fig.7
Fig.7 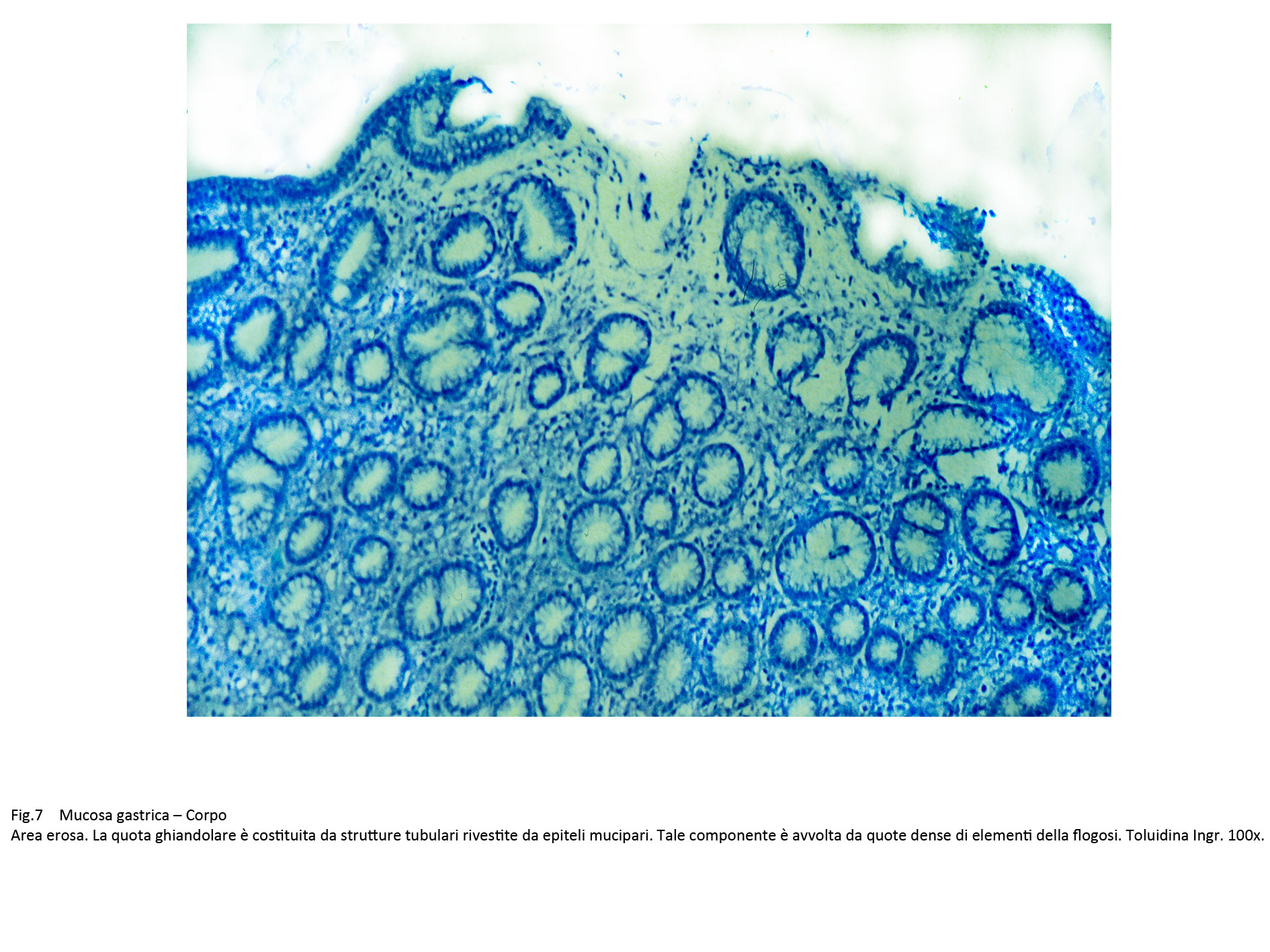 Fig.8
Fig.8 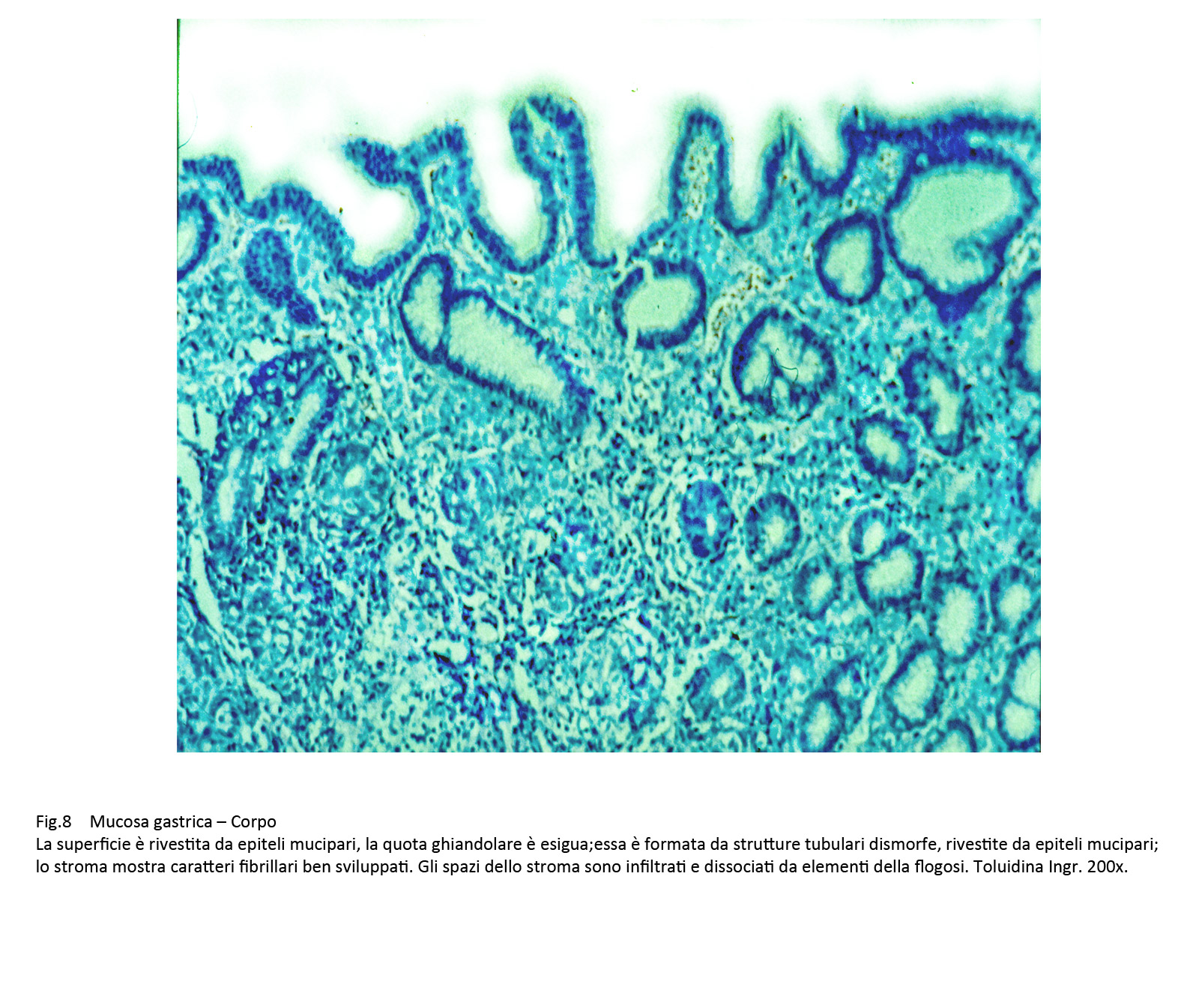
Fig.9 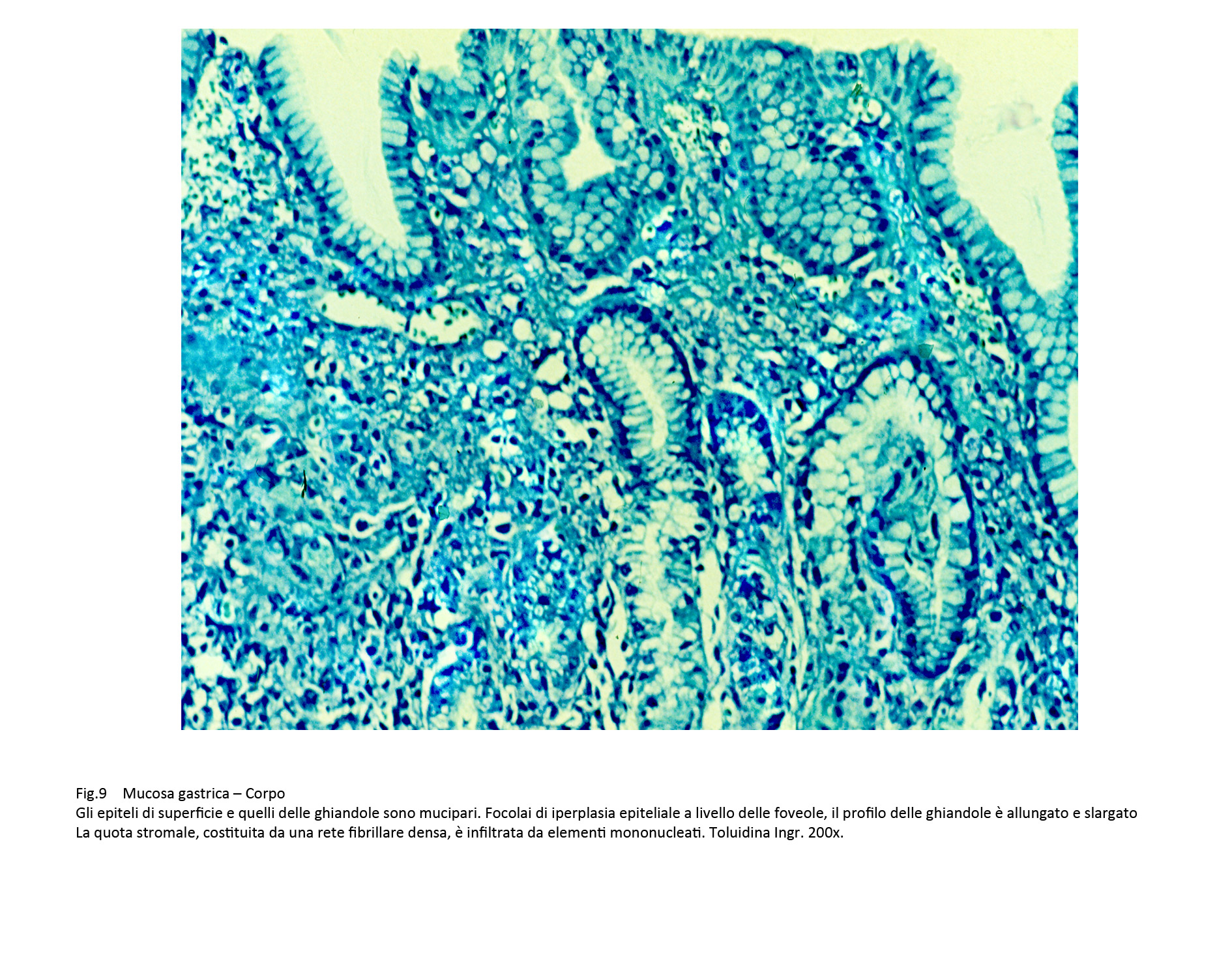 Fig.10
Fig.10 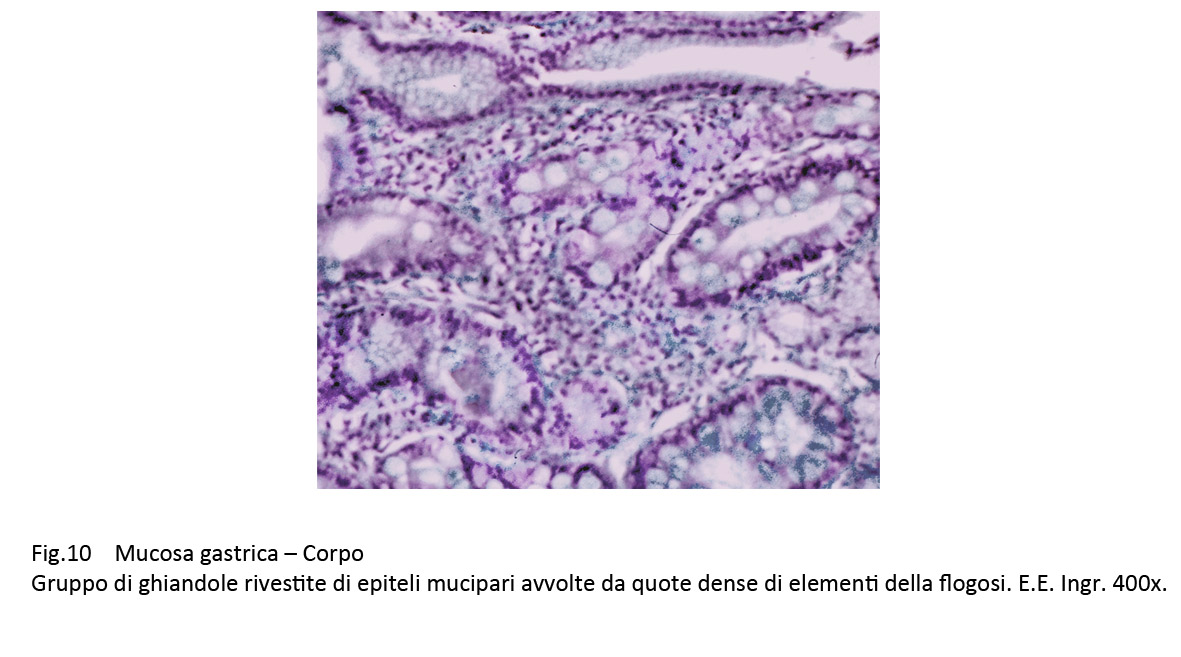
C. Metaplasia pseudopilorica
Il quadro istopatologico è simile a quello della mucosa del piloro.
La superficie se non è danneggiata da lesioni destruenti, appare sollevata in piccole creste o in estroflessioni di varia altezza. La quota ghiandolare è rappresentata da strutture tubulari ramificate rivestite da epiteli mucipari. Esse sono avvolte da elementi della flogosi che le invadono provocando gravi processi regressivi degli epiteli. I reperti istopatologici sono di orientamento diagnostico,per una valutazione di certezza è necessario eseguire il dosaggio del pepsinogeno, la marcatura della mucina MUC6 e della Spasmolitic Polypeptyde Expressing (SPEM).
Fig.11 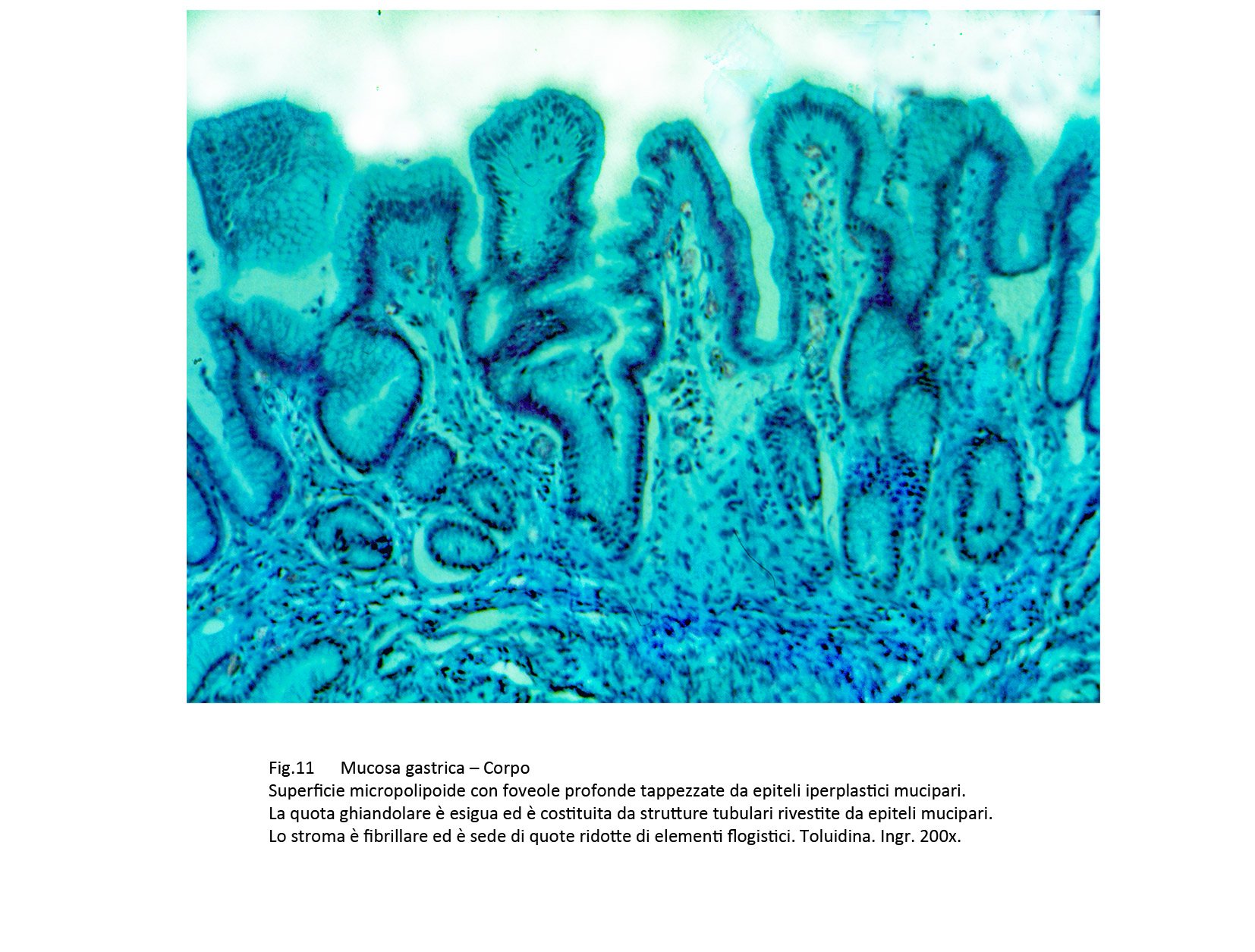 Fig.12
Fig.12 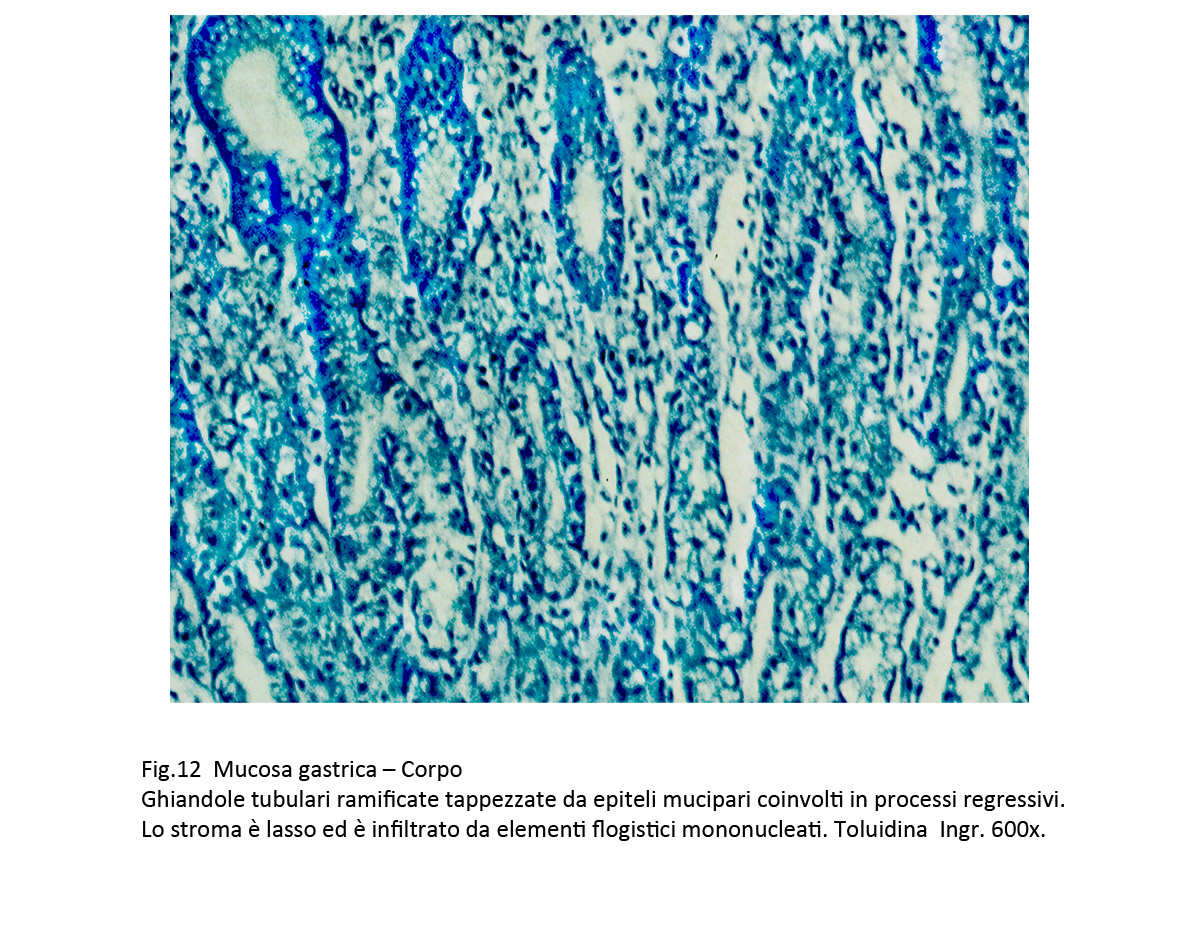 Fig.13
Fig.13 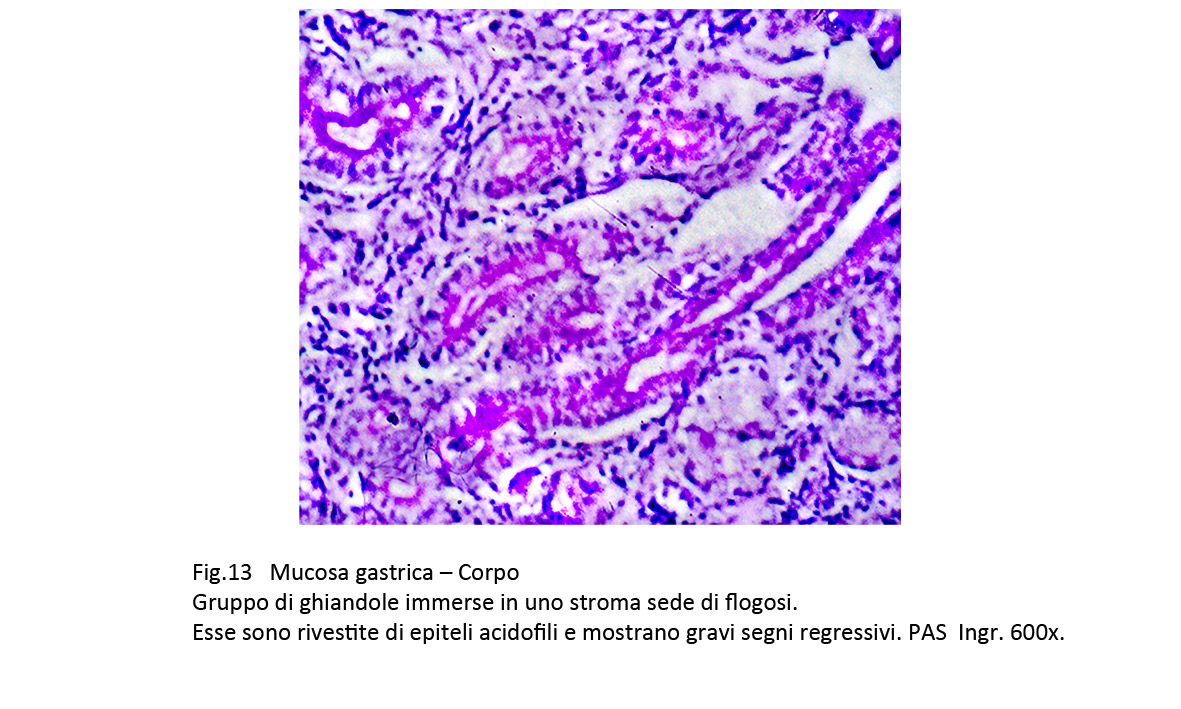
La persistenza dello stato della flogosi associato a una condizione ingravescente di metaplasia può innestare un processo un displastico nelle varianti di lieve o alto grado:
Displasia di lieve grado
Microfocolai di displasia di lieve grado si riscontrano a livello degli epiteli di superficie, delle foveole e di quelli ghiandolari.
Gli epiteli di rivestimento acquisiscono una maggiore volumetria, sono centrati da un nucleo ingrandito vescicoloso o ipercromatinico, sempre fornito di nucleolo preminente.Nelle aree di displasia delle foveole queste modificazioni iniziano a livello degli epiteli staminali e successivamente coinvolgono gli strati intermedi e superficiali senza danneggiare la loro coesione intercellulare.
Fig.14 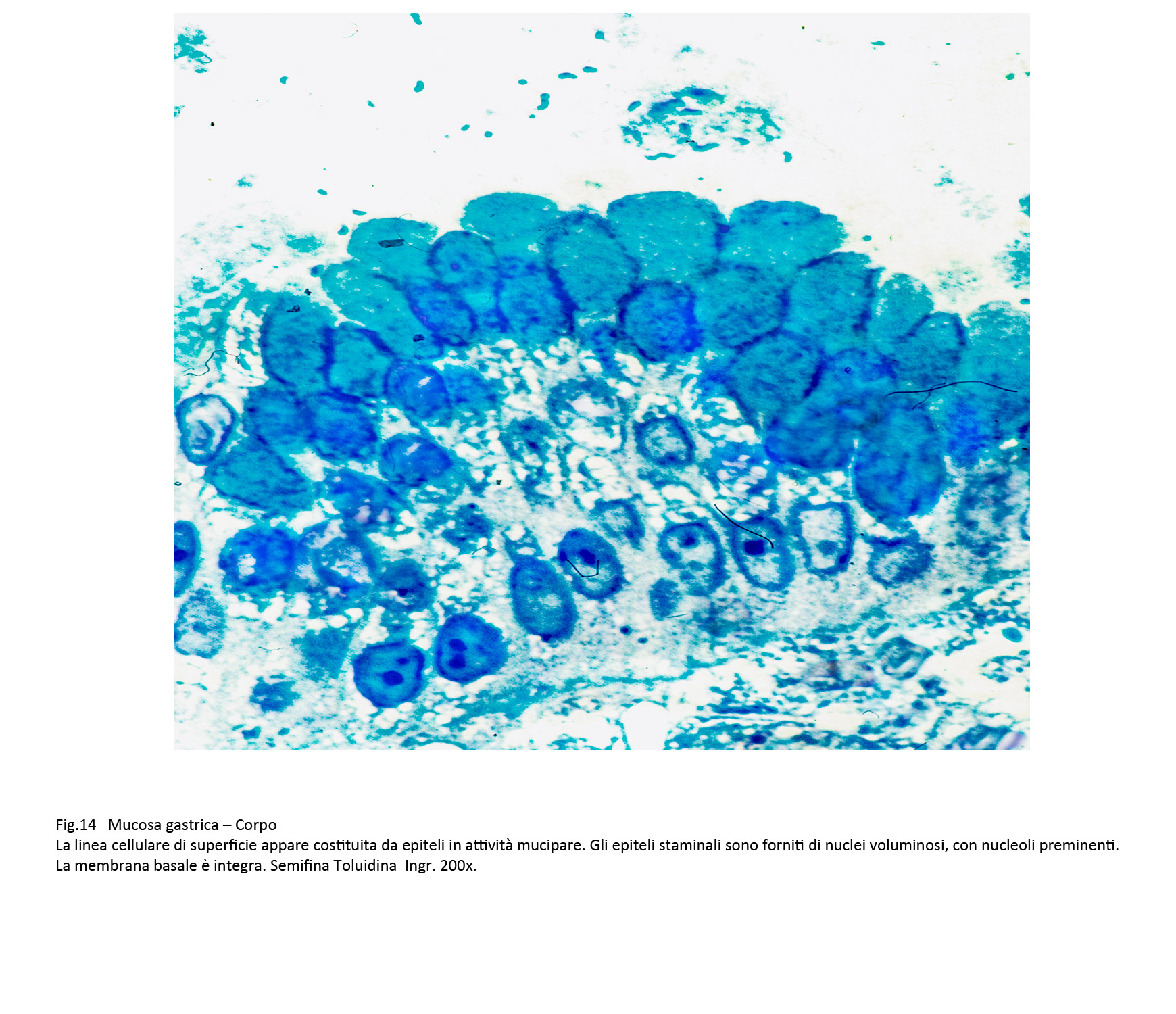 Fig.15
Fig.15 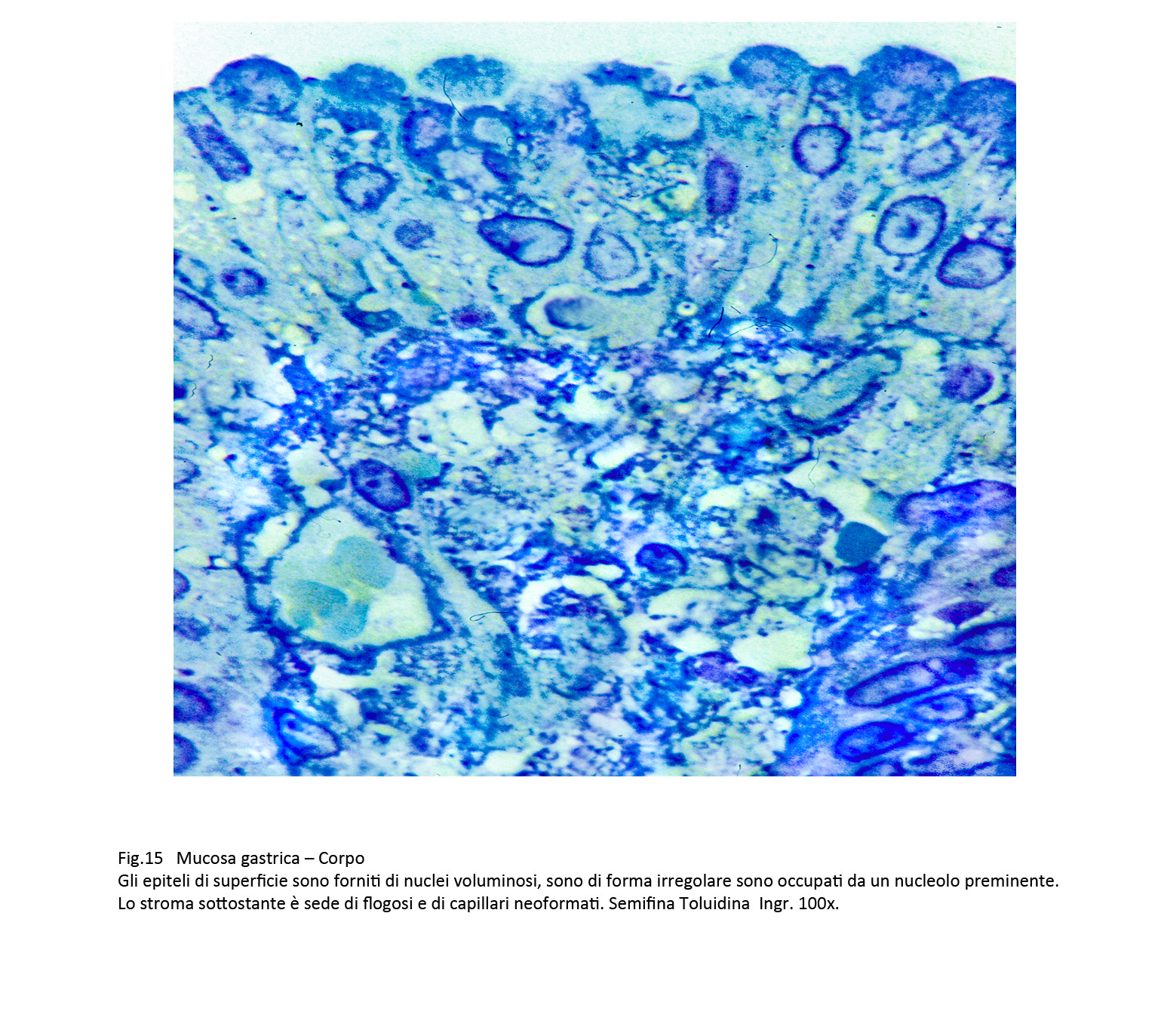 Fig.16
Fig.16 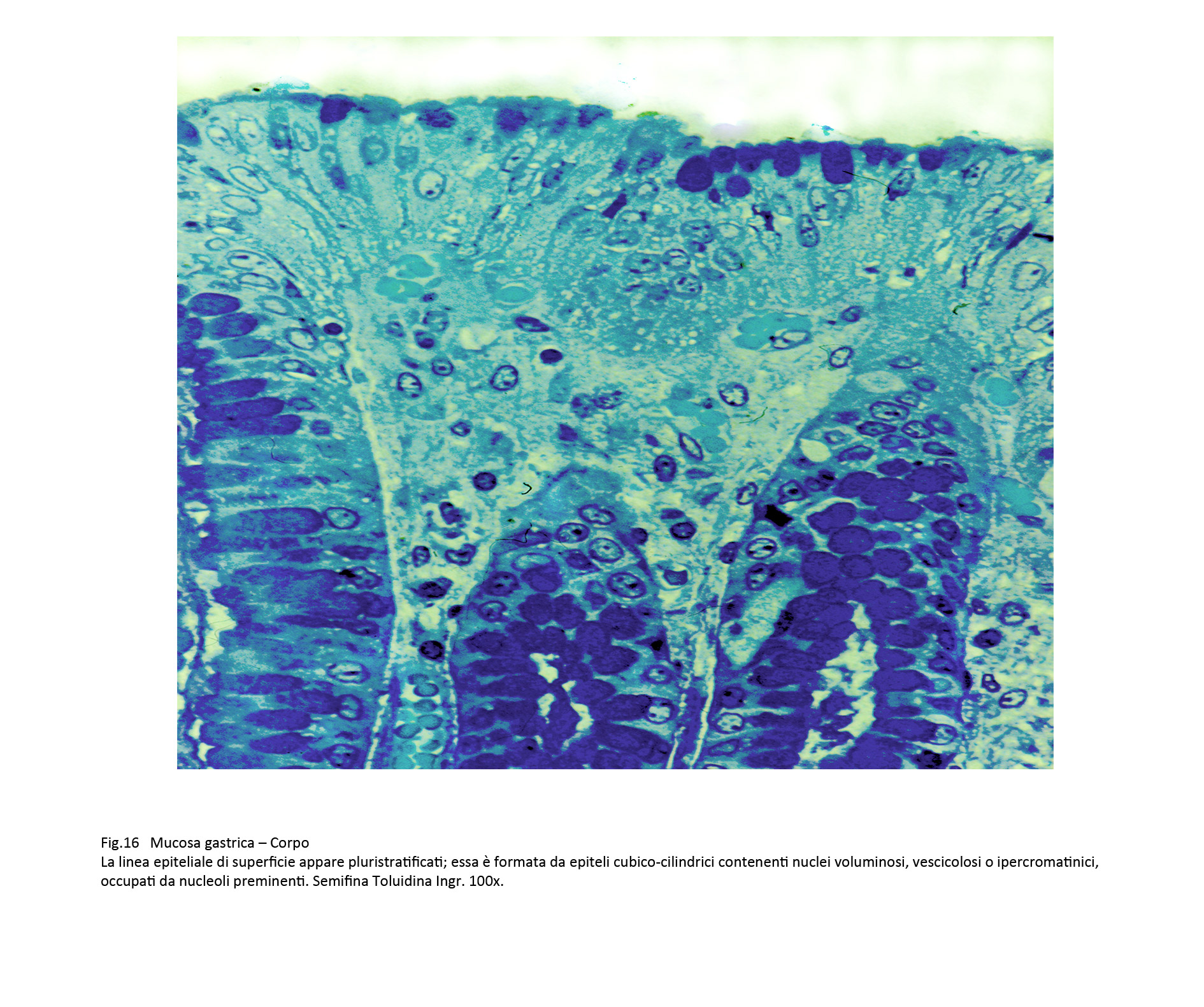
Il medesimo reperto emerge a livello delle cellule staminali delle ghiandole; questi elementi inizialmente rimangono confinate agli strati basali in prosieguo,moltiplicandosi, acquisiscono posizioni intermedie o sporgenti nel lume delle ghiandole.
Fig.17 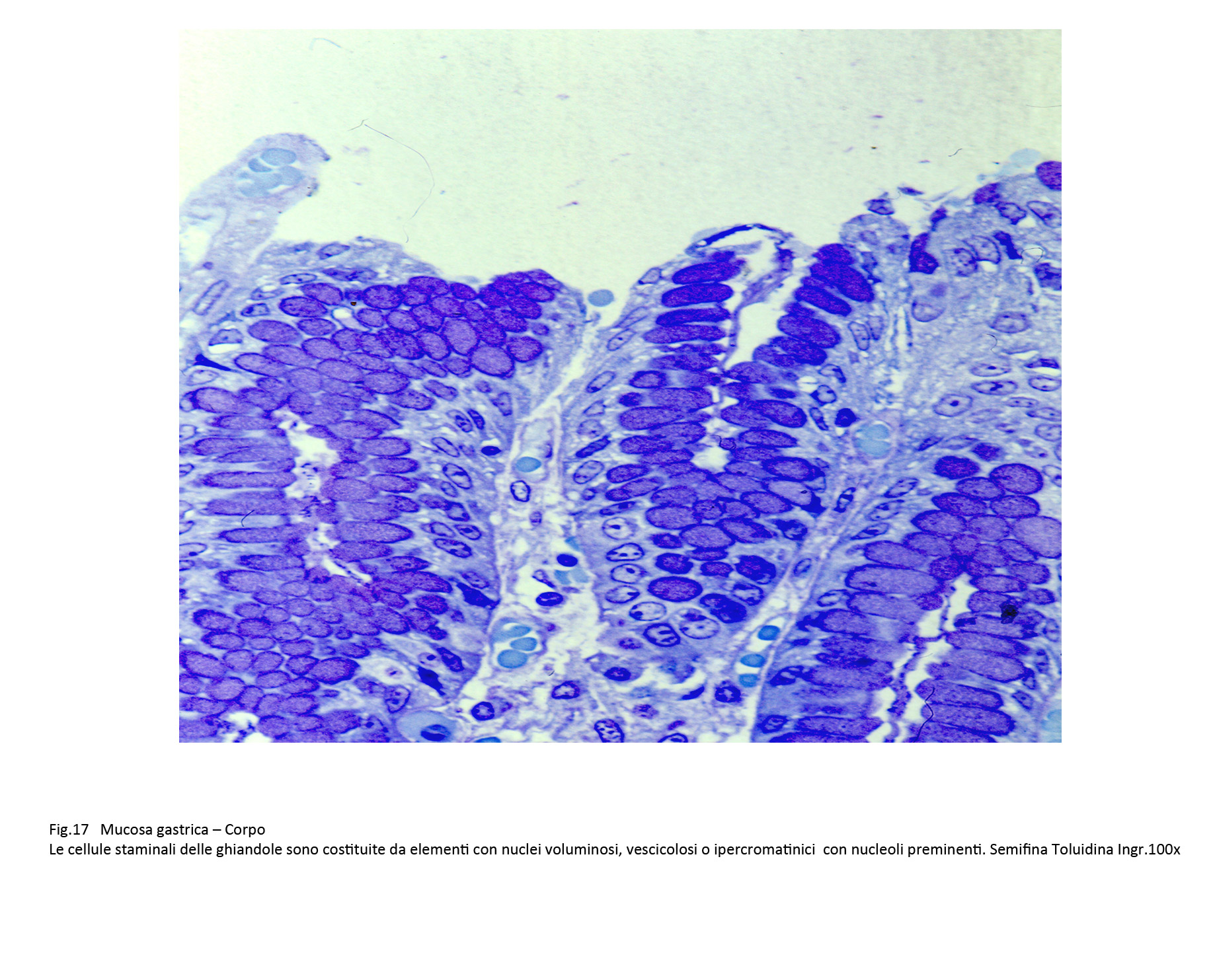 Fig.17part
Fig.17part 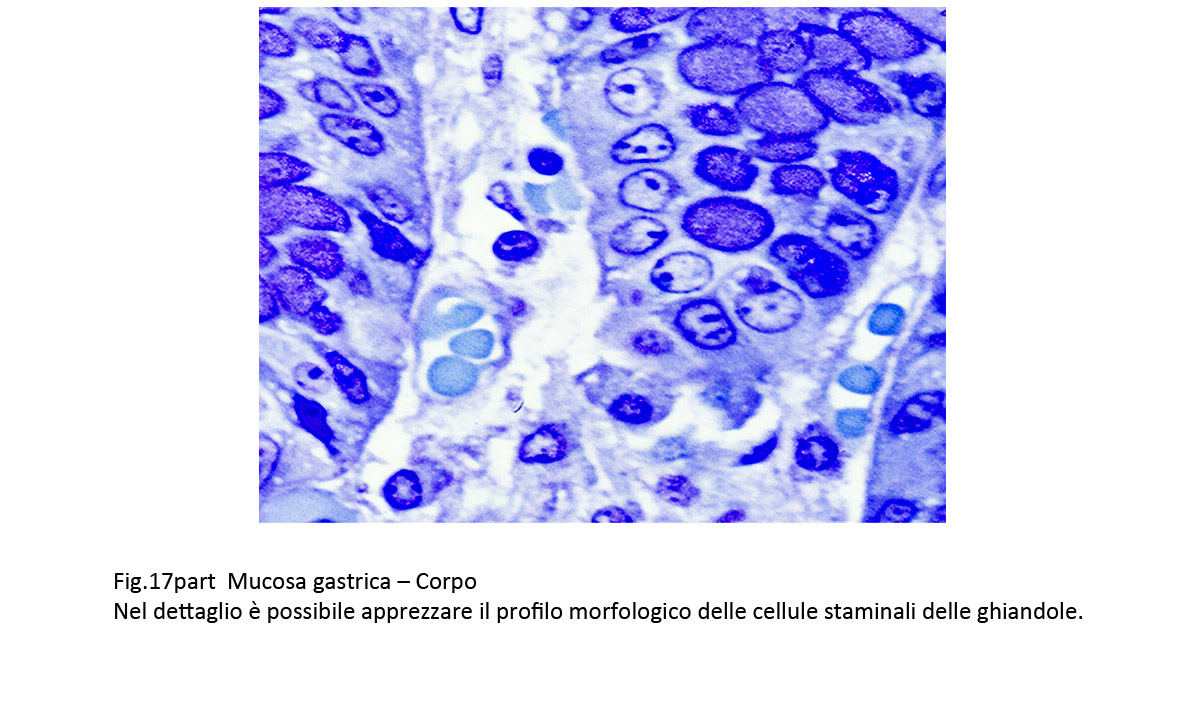 Fig.18
Fig.18
Fig.18 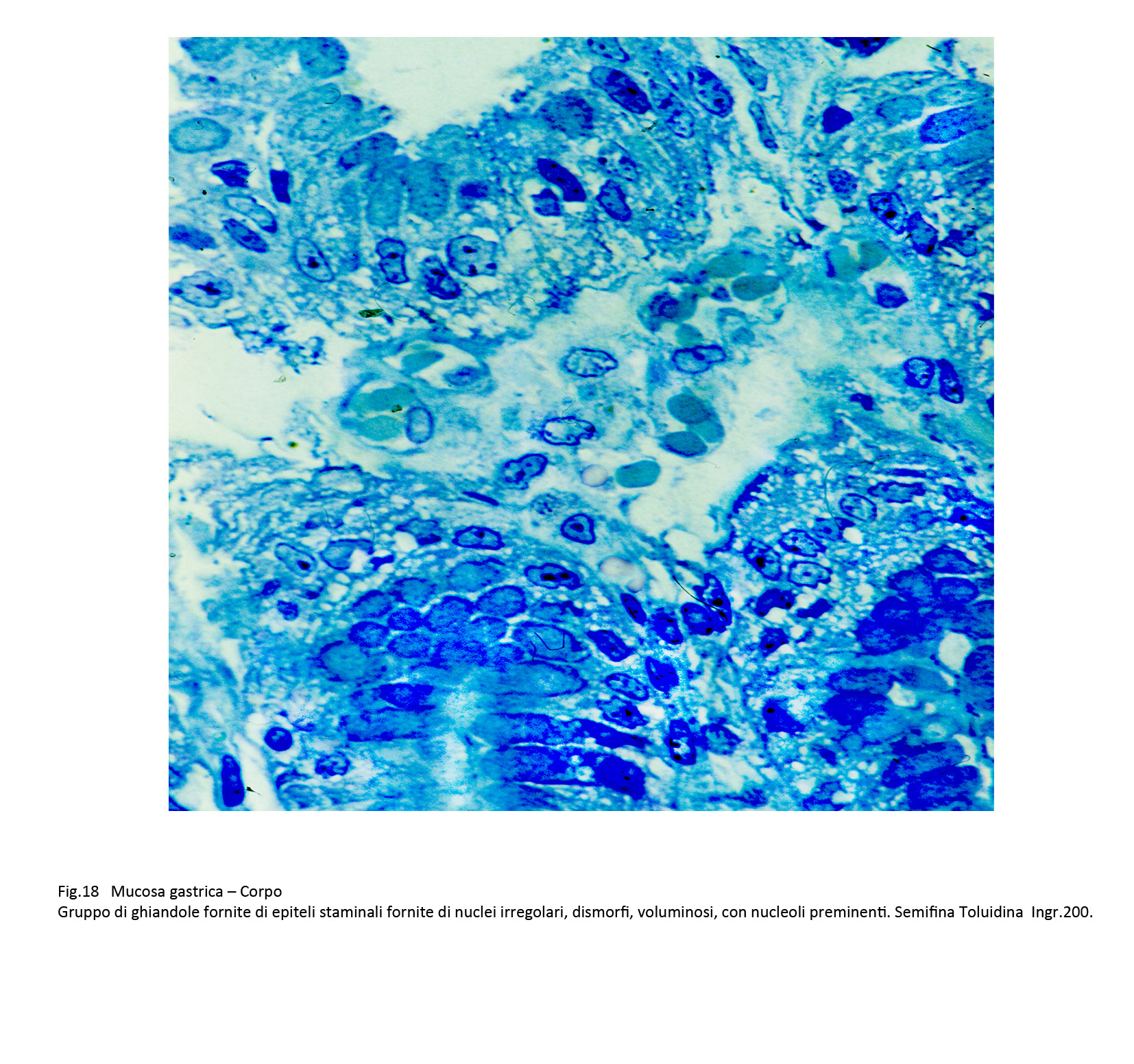 Fig.19
Fig.19 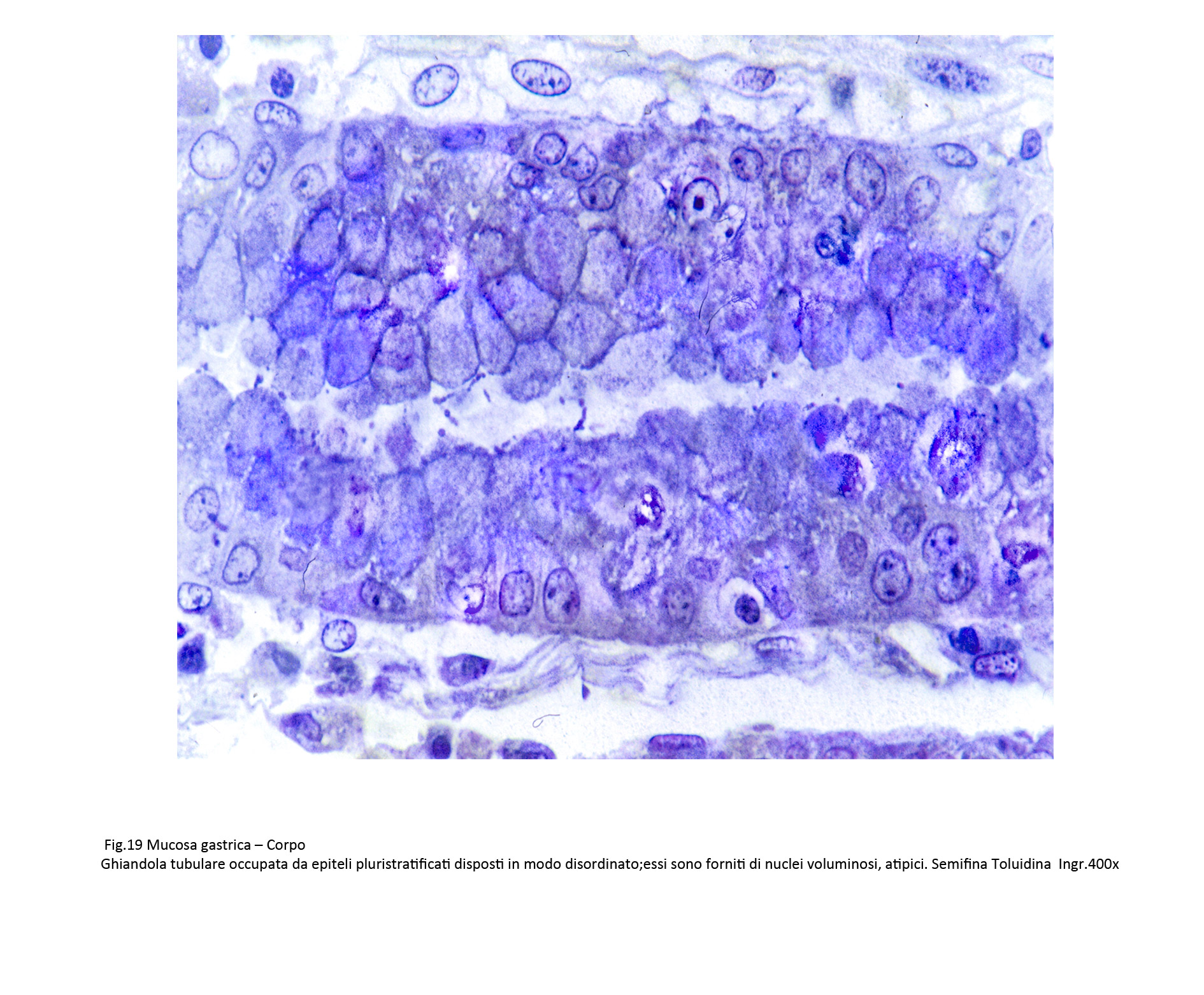
Displasia di alto grado
I focolai di displasia di alto grado si riconoscono per la esistenza di una pluristratificazione disordinata degli epiteli; i singoli elementi evidenziano una ridotta connessione intercellulare, sono irregolari fino all’atipia, sono centrati da nuclei dismorfi, ipercromatinici o vescicolosi, sempre occupati da nucleoli ben evidenti.
Fig.20 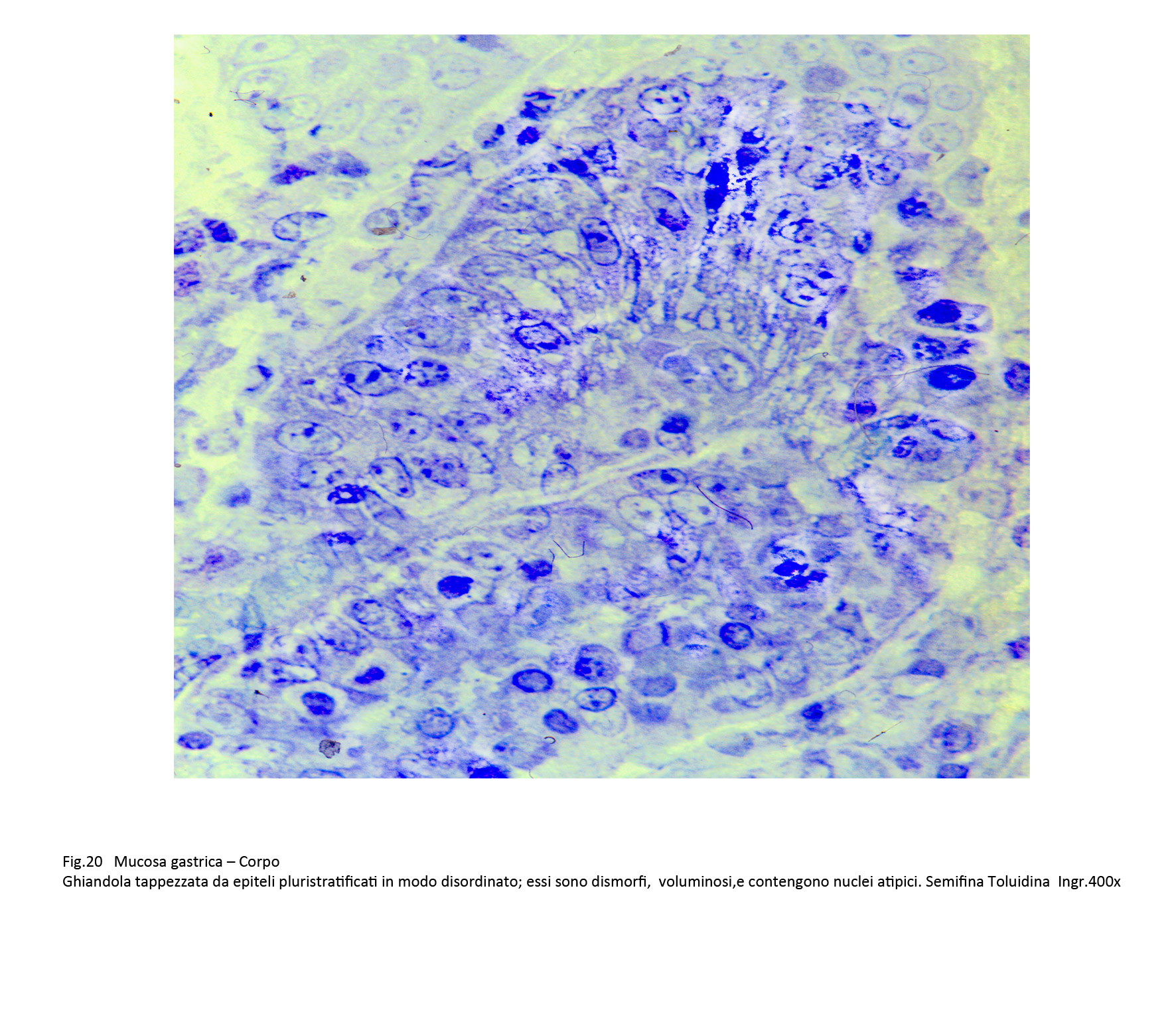 Fig.21
Fig.21 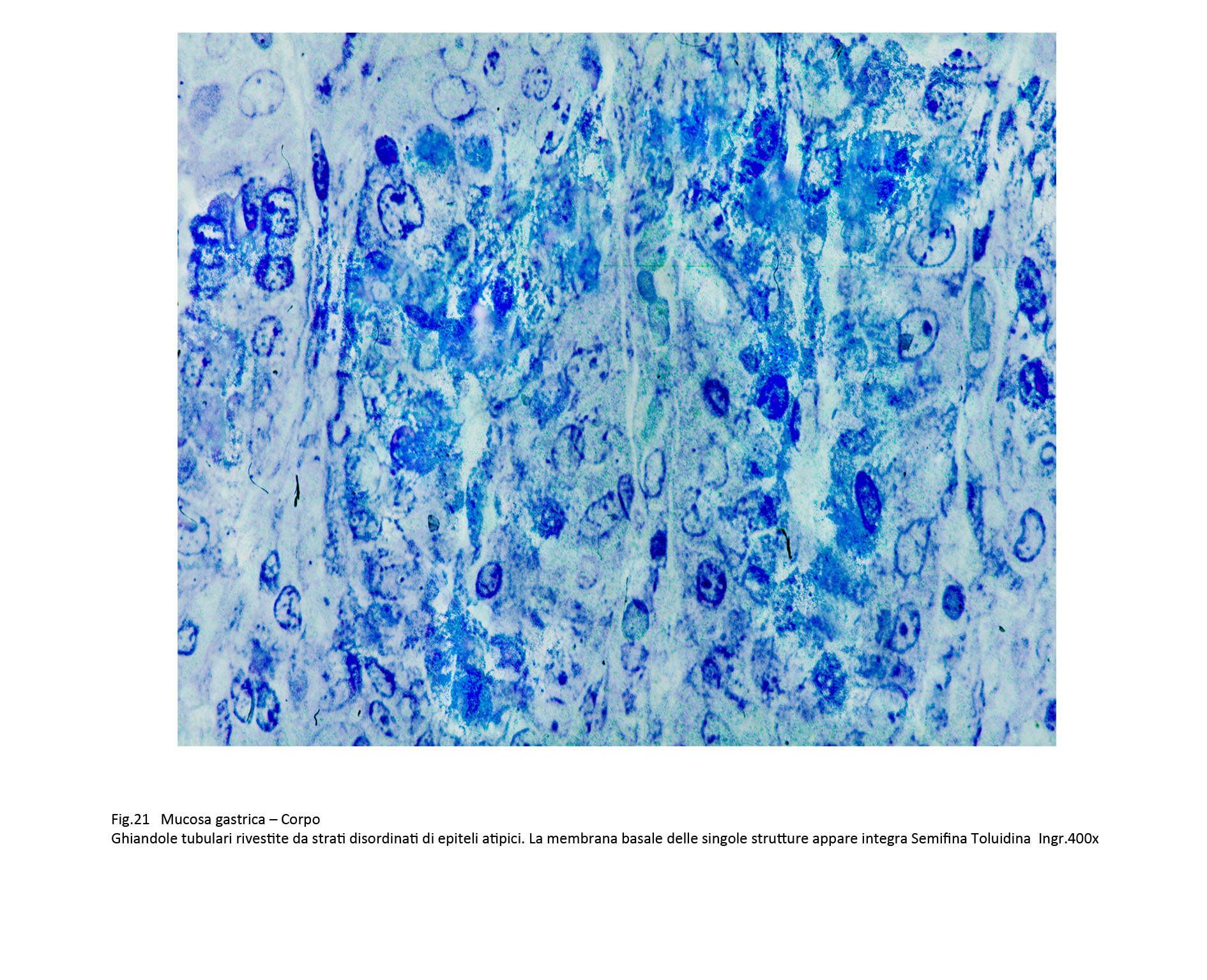
Un riferimento importante per la diagnosi differenziale tra displasia grave e adenocarcinoma in situ è dato dalle condizioni della membrana basale; se questa è stata frammentata e il disegno delle ghiandole appare indefinito, si pone la diagnosi di adenocarcinoma.
Fig.22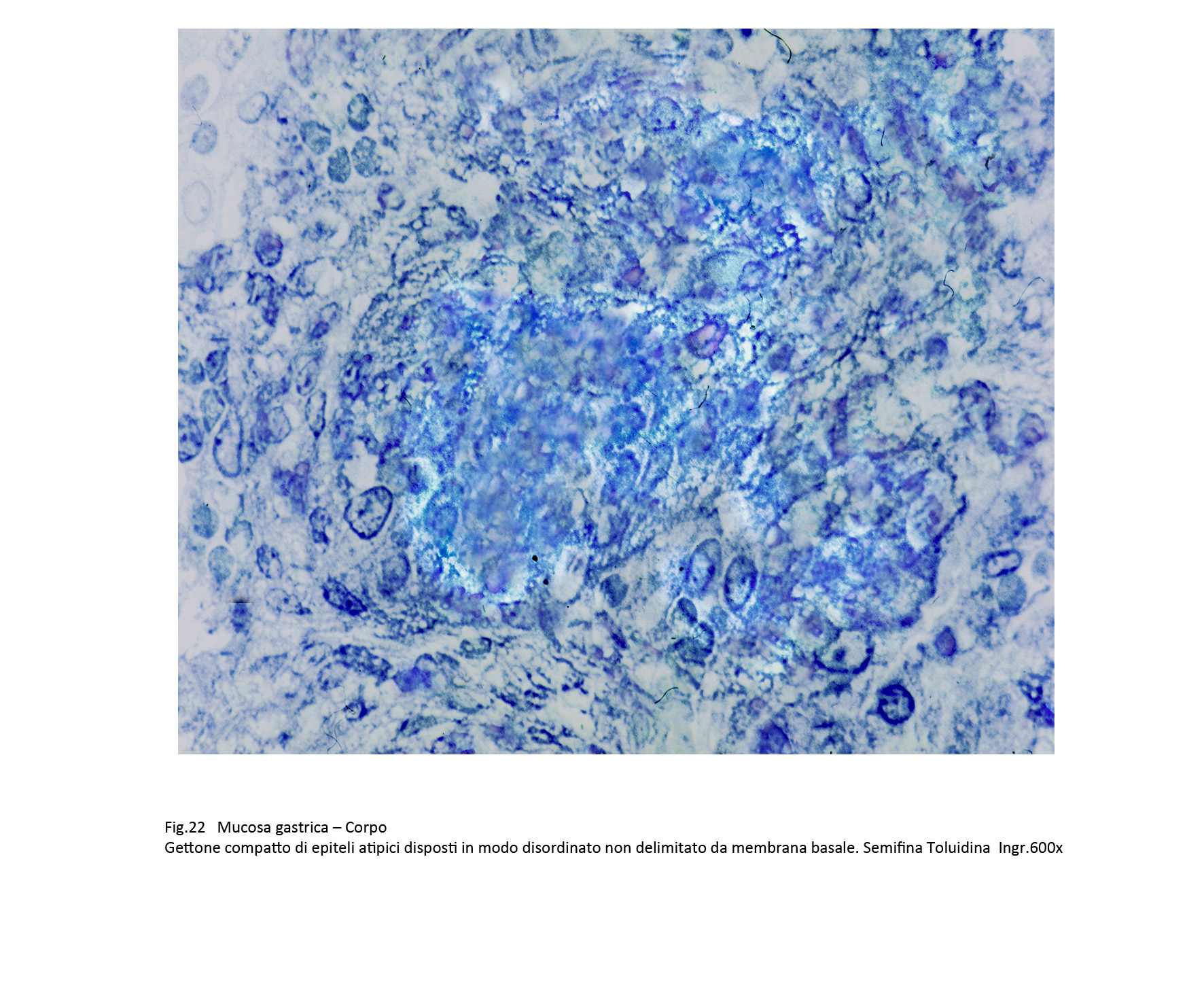
COMMENTO
Le manifestazioni patologiche indotte dagli H-Pylori a carico della mucosa gastrica,nella loro progressione, sono aspecifiche,e simili a gastriti croniche da altre cause. Pertanto il sistema Correa può essere applicato in modo efficiente ed utile a tutte le forme di gastriti croniche, senza prendere in considerazione la loro eziopatogenesi.
Le osservazioni cliniche, i dati epidemiologici sottolineano la costante associazione tra l’infezione da H-Pylori e il progressivo danno gastrico, mentre le acquisizioni istopatogenetiche risultano ancora incomplete per interrogativi patogenetici non ancora risolti. Alcuni di questi interrogativi sono qui di seguito brevemente riassunti:
1. Il numero dei fattori di virulenza secreti dagli H.-Pylori non ancora è stato completato.
2. E’ importante selezionare i diversi ceppi di H.-Pylori rapportando ciascuno di essi al rispettivo quadro istopatologico.
3. I fattori di virulenza hanno una azione diretta su le cellule (valutabile anche in vitro) e un’azione indiretta,e mediata su l’entità della risposta flogistica e su l’attivazione di meccanismi epigenetici. Non è stata ancora definita la importanza patogenetica
4. I meccanismi biologici mediante i quali gli H-Pylori svolgono azioni patogenetiche evolventi verso il carcinoma gastrico rimangono ancora sconosciuti. Si deve tener conto che la patogenesi del carcinoma gastrico è multifattoriale coinvolgendo lo stile di vita, le condizioni ambientali, la stabilità genetica, l’anamnesi personale, e forse come fattore scatenante, l’infezione da H.-Pylori.
