LESIONI DEGLI EPATOCITI IN CORSO DI ALCOOLISMO CRONICO:
ALTERAZIONI DEL RETICOLO ENDOPLASMICO E DEI MITOCONDRI
(osservazioni al microscopio elettronico)
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica
-
Introduzione
La patologia epatica da alcoolismo cronico si manifesta secondo un percorso che ha il suo inizio come steatosi, progredisce come steatoepatite, si conclude come cirrosi,spesso aggravata da epatocarcinoma.
Questo percorso non si manifesta secondo fasi ben scandite,e tra loro distinte bensì come reperti transeunti, tra loro commisti, mostrando una unità di base evolvente verso la destrutturazione e il sovvertimento architettonico del parenchima epatico (Clin. Liver. Dis Hoboken 2013; 2 (3): 64-67).
A fronte della steatosi epatica, quadro patologico reversibile, la steatoepatite appare come quadro composito e complesso per il co-interessamento di tutte le componenti il parenchima epatico.
Il danno principale è a livello degli epatociti per la esistenza di fenomeni degenerativo-necrotici; a questi si associano infiltrati flogistici cronici, profonde alterazioni vascolari, iperplasia delle cellule di Kupffer e delle cellule stellate, neosintesi di fibre collagene, rigenerazione di epatociti, e neoangiogenesi. L’insieme di questi processi, tra loro interconnessi ed interattivi determinerà il sovvertimento cirrotico e le atipie dell’epatocarcinoma (Cli. Liver Dis. 2016; 20(3): 473-489) (Clin. Liver Dis 2019; 23(1): 11-23).
Alla base delle alterazioni degli epatociti si riscontra un crosstalk che altera le omeostasi di diversi organelli (Golgi, Lisosomi, ER, mitocondri), organelli che comunicano tra loro attraverso connessioni ultrastrutturali e mediante vescicole di trasporto (Biomolecules 2015; 5(2): 1099-1121).
Nell’organismo,l’alcool è metabolizzato mediante ossidazione e secondo meccanismi non-ossidativi;tra questi il percorso ossidativo è fondamentale e si concretizza attraverso i seguenti tre sistemi biochimici:
-
1.L’alcool deidrogenasi localizzata nel citosol.
-
2.Il sistema MEOS (Microsonal ethanol oxidation system) situato nel reticolo endoplasmico liscio.
-
3.Il sistema catalasi localizzato nei perossisomi.
L’alcool deidrogenasi è una famiglia di enzimi che è presente nel citosol di diversi organi e tra questi nel fegato e nell’apparato gastroenterico (Alcohol Clin Exp. Res 1990; 14: 946-950) (Alcohol Clin Exp Res 1996; 20: 267-272).
Le molecole di alcool mediante l’alcool deidrogenasi sono ossidate ad acetaldeide; successivamente queste sono rapidamente metabolizzate in acetato mediante l’aldeide deidrogenasi 1 presente nel citosol e mediante l’aldeide deidrogenasi 2 presente nei mitocondri. (Annals of Hepatology 2003; 2(2): 60-68) (Semin. Liver Dis 2007; 27: 44-54) (FASEB J. 2001; 15: 1355-1359). L’acetato, mediante l’enzima acetato-CoA-lipasi viene avviato alla biosintesi di molecole più complesse quali acidi grassi oppure è inserito nel ciclo di Krebs. I metaboliti dell’alcool dopo l’alcool deidrogenasi inducono nel citoplasma degli epatociti depositi di trigliceridi, aumento di sintesi degli acidi grassi, riduzione della sintesi e della secrezione di lipoproteine. (Annals of Hepatology 2003; 2(2): 60-66).
Il sistema MEOS (Microsomal ethanol oxyaling system) è presente nel reticolo endoplasmico e svolge la sua azione mediante gli enzimi del citocromo P-450, NADPH e ossigeno (Alcohol Clin. Exp. Res. 1999; 23: 991-1007). Questi provvedono alla ossidazione dell’alcool e di altri substrati endogeni come gli steroidi e gli acidi grassi (Biochem. Soc. Trans. 1987; 15: 576-578) (Alcohol Clin Exp. Res. 1999; 23: 991-1007). Questo sistema si sviluppa a seconda delle concentrazioni di alcool e nell’etilismo cronico e si riscontra uno stato di iperplasia del reticolo endoplasmico.
Il sistema ossidativo catalasi è localizzato nei perossisomi.
Infine, l’alcool subisce un processo metabolico mediante una via non ossidativa, mediante la quale si producono anche molecole di estere etilico dagli acidi grassi (Science 1986; 231: 497-499).
L’uso e l’abuso di alcol inducono alterazioni dell’ergastoplasma rugoso e liscio,dei mitocondri e attivano processi di autofagia; queste modificazioni possono essere considerate manifestazioni iniziali e ancora reversibili,ma prolungate nel tempo sono atte a determinare alterazioni complesse quali la steatoepatite,la cirrosi,l’epatocarcinoma.
ALTERAZIONI DELL'ERGASTOPLASMA RUGOSO E LISCIO
-
-
L’alcool metabolizzato in acetaldeide-acetato provoca:1) una condizione di ER-stress,2) una produzione di ROS (reactive oxigen species) 3) un blocco delle attività proteasomiche (Biomolecules 2015; 5(2): 1099-1121).
1)Uno stato di ER-stress è determinato dall’accumulo nelle cisterne del reticolo endoplasmico di proteine mal ripiegate (misfolded) o non ripiegate (unfolded). Questa situazione disfunzionale induce l’attivazione del sistema UPR (Unfolded protein response) che provvede alla degradazione delle proteine in tal modo accumulate, aumenta la capacità di ripiegamento delle proteine e riporta in equilibrio la quota delle proteine normalmente ripiegate (Int J. Hepatol 2014; 20(4): 5137-5187).
Nei casi in cui il sistema UPR risulti insufficiente a riportare l’omeostasi, viene attivato il sistema ERAD (Endoplasmic Reticulum Associated protein Degradation) il quale avvia il processo della autofagia.
Le proteine misfolded e unfolded si accumulano nel citoplasma formando aggregati insolubili che resistono alla degradazione proteasomica e che richiedono la rimozione tramite l’autofagia.(Hepatology, 2011; 53(5): 1752-1763) (Sem. Liver Dis. 2019; 39(2): 235-248).
2) Durante un eccessivo uso di alcool, l’ER liscio partecipa al metabolismo etanolo-acetaldeide mediante il citocromo CYP2E1. Tale processo genera ROS (Reactive Oxygen Species) e questo provoca ulteriori processi patologici (Semin. Liver Dis. 2019; 39(2): 235-248
3) Il consumo di alcool inibisce l’attività proteasomica; ciò consente la formazione di aggregati di proteine contenenti citocheratina 8 e 18 in associazione con altre proteine incluse l’ubiquitina e la p62, aggregati denominati Corpi di Mallory-Denk (Adv. Pharmacol 2019; 85: 109-137).
ALTERAZIONI DEI MITOCONDRI
I metaboliti derivanti dalla degradazione delle molecole dell’etanolo provocano gravi alterazioni dei mitocondri. E’ stato documentato che allo stress del reticolo endoplasmico si associa, nell’etilismo cronico, uno stress mitocondriale con danno del DNA mitocondriale, riduzione della respirazione mitocondriale, attivazione dei processi di mitofagia e di biogenesi mitocondriale (Gastroenterology 2016; 150(8); 1756-1768
Mediante una azione ossidativa si ha una depolarizzazione della membrana esterna dei mitocondri e alterata permeabilità ai soluti con danni funzionali e morfologici rappresentati da rigonfiamento mitocondriale e rottura della membrana esterna( Free Radical Biology and Medicine 2002;32(6):487-491) (Biochem Biophys Acta 2006; 1757 (9-10): 1297-3000). Un ruolo importante nella alterata permeabilità dei mitocondri è il decremento del potenziale di membrana e la penetrazione di Ca2+ (World J. Gastroenterol 2007; 13(16): 2352-2356).
Queste alterazioni sono aggravate quando coesiste uno stato di ER-stress, in considerazione che tra gli organelli intracitoplasmatici (ER, Golgi, lisosomi, mitocondri) esiste una interconnessione con scambio di informazioni biologiche, di molecole, e un coordinamento finalizzato a dare una risposta unica agli stress per il recupero dell’omeostasi (Biomolecules 2015; 5(2): 1099-1121).
L’alterata permeabilità delle membrane mitocondriali provoca rigonfiamento della matrice mitocondriale, rilascio del citocromo C, alta concentrazione di Ca2+, insufficiente produzione di ATP., alterata capacità ossidativa, iperproduzione di ROS, e danno ossidativo del DNA mitocondriale (Oncogene 2008; 27(3): 285-299) (Alcohol Clin. Exp. Res. 2012; 36(8): 1301-1308) (World J. Gastroenterol 2014; 20(9): 2136-2142).
Mitocondri così danneggiati sono esposti all’azione di un processo di autofagia selettiva (mitofagia) che si concretizza secondo le seguenti due modalità:
La prima si realizza secondo le fasi abituale autofagia con un iniziale focolaio fagofore, passaggio ad autofagosoma e successiva degradazione mediante enzimi lisosomiali (autofagolisosoma). La seconda modalità è data da mitocondri decorati da vescicole contenenti aggregati di GFP-LC3; questi, coalescendo, avvolgono il mitocondrio e lo trasformano in mitofagosoma. Questa seconda modalità si riscontra soprattutto a carico di mitocondri gravemente danneggiati, depolarizzati e con gravi compromissioni della permeabilità (Autophagy 2011; 7(2): 248-249) (Alcohol Clin. Exp. Res 2012; 36(8): 1301-1308) (Curr Mol Pharmacol 2017; 10(3): 165-171).
Un processo di mitofagia insufficiente o disordinata non consente il recupero dell’omeostasi cellulare e innesca processi evolventi verso la degenerazione citoplasmatica e l’apoptosi (Liver Res 2018; 12 (3): 125-132).
AUTOFAGIA
Le alterazioni intraepatocitarie dianzi segnalate si associano e/o si concludono con la comparsa di focolai di autofagia. Questo, dell’autofagia, è un processo catabolico programmato a livello genetico che si manifesta quale risposta a processi di stress, di degradazione di proteine intracitoplasmatiche, di organelli danneggiati, per la conservazione dell’omeostasi (Alcohol Clin Exp Res; 2012; 36 (8): 1301-1308).
L’autofagia mantiene il controllo-qualità delle proteine, dei lipidi e degli organelli intracitoplasmatici, provvedendo a eliminare l’eccesso di tali molecole alterate e di organelli danneggiati (J. Cell Biol. 2005; 169: 425-436). A sostegno di tale tesi, sono riportati diversi studi secondo i quali la inibizione genetica o farmacologica del meccanismo dell’autofagia favorisce l’involuzione e la morte cellulare (Am J. Pathol 2007b; 171: 513-524).
Focolai di autofagia sono frequenti e numerosi a livello degli epatociti in soggetti etilisti; questi focolai sono associati e/o rappresentano la fase conclusiva di diverse alterazioni intracitoplasmatiche quali la inibizione dell’attività proteasomica, lo ER-stress, l’accumulo di proteine alterate, le alterazioni mitocondriali, il blocco delle attività lisosomiali, l’accumulo di lipidi, e sono maggiormente manifeste quando si instaura un blocco della fase di degradazione lisosomiale (Alcohol Clin Exp Res 2007; 31(9): 1446-1459) (J. Gastroenterol Epatol 2008; 23 (Suppl1): 516-524).
Nell’etilismo, l’acetaldeide attiva il meccanismo dell’autofagia in situazioni di Er-stress al fine di degradare e rimuovere i cumuli di proteine misfolded e unfolded depositate in loco (Mol Cell Biol 2006; 26(24): 9220-9231)(Autophagy 2013; 9(1): 63-73).
A livello delle cellule di etilisti si riscontrano anche focolai di autofagia selettiva; questa è attivata quando la conservazione della omeostasi cellulare è legata allo inglobamento e alla demolizione di singoli organelli. Pertanto esistono forme di autofagia selettiva di mitocondri, di reticolo endoplasmico, di molecole lipidiche, di ribosomi, di perossisomi (Curr Mol. Pharmacol 2017; 20(3): 165).
Questi focolai si attivano nelle steatosi a livello dei lipidi intracellulari; queste molecole sono inglobate formando autofagosomi contenenti gocce lipidiche che poi saranno degradate dalle lipasi lisosomiali (lipofagia) (Autophagy 2011; 7(2): 248-249). Una altra manifestazione di autofagia selettiva riguarda i mitocondri (mitofagia). Come è stato dianzi segnalato, i mitocondri sono danneggiati in corso di etilismo in quanto sito primario di ROS e il DNA mitocondriale è esposto a un danno ossidativo e ciò attiva il processo di autofagia.
Gradi istopatologici di progressione della steatoepatite alcolica:
A livello istopatologico sono stati riportati in letteratura criteri valutativi per stabilire il grado di progressione della steatoepatite alcolica, secondo i seguenti criteri:
1.Fibrosi: portale, lobulare, a ponte, cirrosi
2.Stasi biliare: duttulare, canalicolare
3.Infiltrazione di neutrofili
4.Steatosi
5.Epatociti balloniformi
6.Corpi di Mallory-Denk
7.Megamitocondri
(Gastroenterology 2014; 146(5): 1231-1239 e6).
CONFRONTO TRA EPATOPATIE ALCOOLICHE E NON ALCOOLICHE
In letteratura sono riportati i confronti a livello morfologico, biochimico, clinico tra reperti di epatopatie alcooliche ed epatopatie non alcooliche (NALD); i risultati depongono per una similitudine tra le due patologie;a livello morfologico si evidenziano quadri sovrapponibili aventi un unico percorso istopatogenetico.
Le due epatopatie differiscono per i fattori eziologici ed epidemiologici con variazioni quantitative di singole alterazioni e la diagnosi differenziale può essere dedotta soltanto mediante dati anamnestici e reperti clinici (Clin Liver Dis, 2002; 6(2) 399-420) (Clin Liver Dis 2005; 9(1); 37-53) (Dig Dis 2011; 29(2): 202-210) (World J. Gastroenterol 2014; 20(44): 16474-16479).
In opposizione a tali interpretazioni, altri AA. sostengono che esista una differenza quantitativa riguardante gli stati di ER-stress, di autofagia e di incidenza dell’’apoptosi; questi sarebbero più gravi nelle epatopatie di alcool (ALD) rispetto a quelle non alcooliche (NALD) (Exp. Mol. Pathol 2016; 101(2): 201-206).
REPERTI
La documentazione qui di seguito esaminata è stata selezionata da casi epatite da etilismo cronico non associati a processi di epatiti virali;sono stati presi in considerazione, mediante sezioni semifini, gruppi di epatociti disposti in lamine monostratificate.
A una visione d’insieme gli epatociti sono tra loro normalmente coesi e conservano un rapporto topografico nei limiti della norma con le componenti il polo sinusoidale . Il citoplasma degli epatociti è compatto,è ricco di organelli, in particolare di eragstoplasma rugoso e liscio e di mitocondri.
Fig.1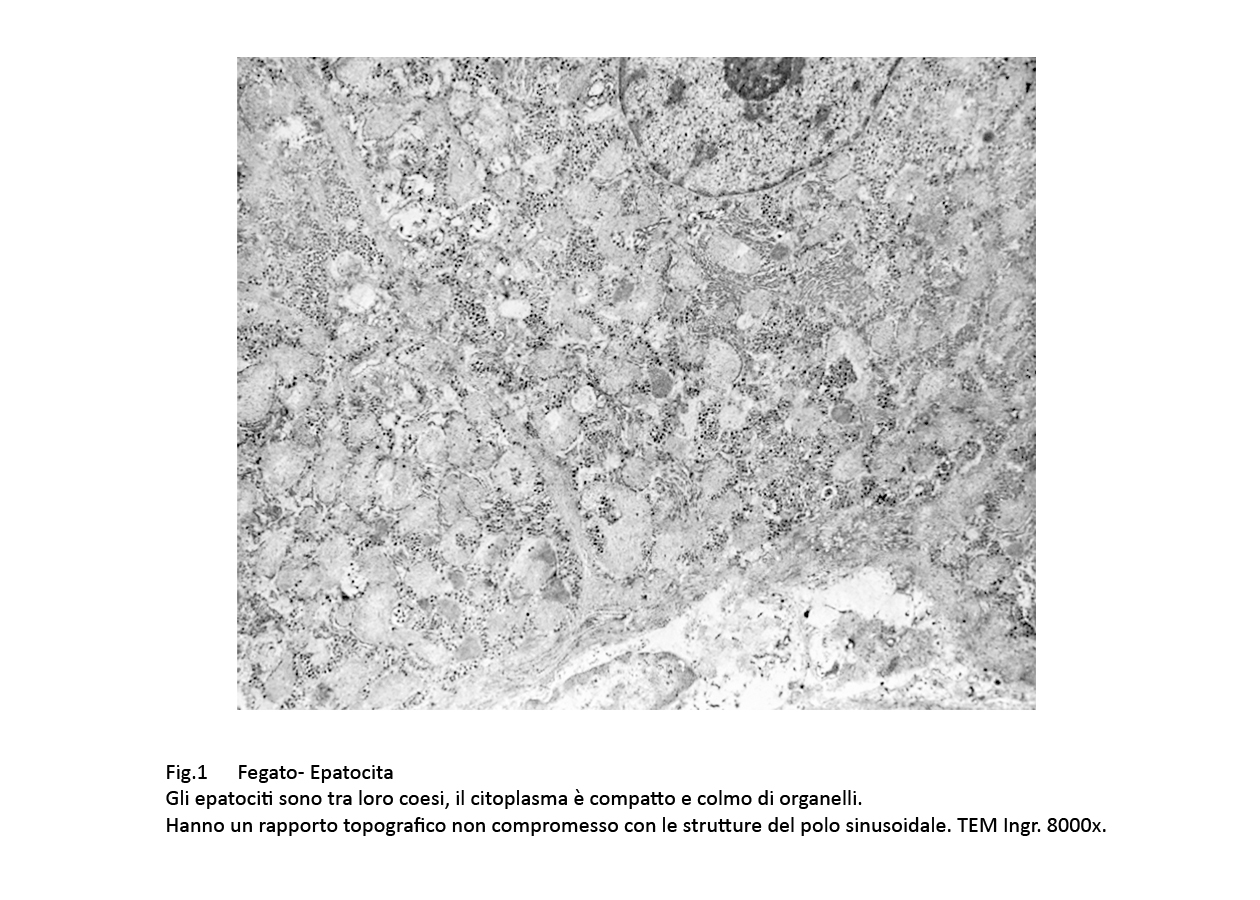
La quota di ergastoplasma rugoso, presente in tutto l’ambito del citoplasma, spesso si interpone tra mitocondri contigui e spesso dà immagini di aderenza ad essi; è stato riscontrato che esso è presente in modo iperplastico a livello delle fasce periferiche degli epatociti;
Fig.2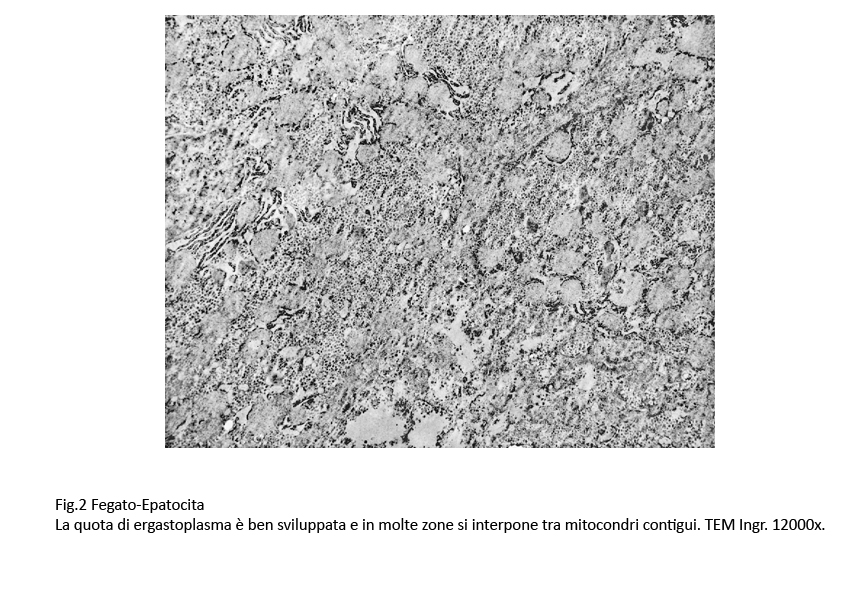 Fig.2part Fig.2part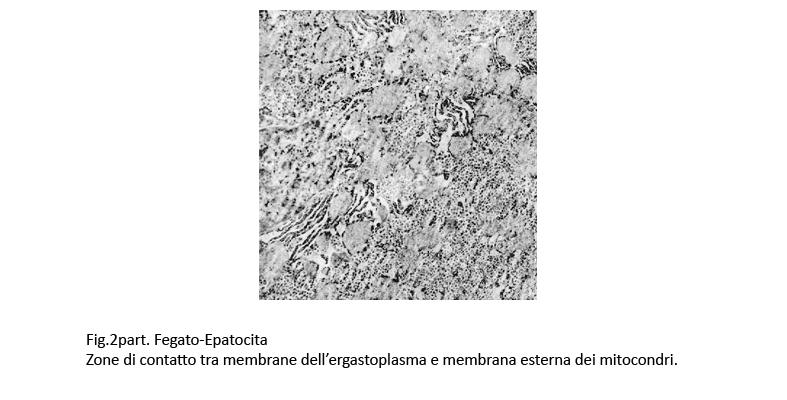
sul piano morfologico,esso appare tortuoso, ben decorato da ribosomi, mostra cisterne variamente dilatate contenenti materiale amorfo commisto a granuli e a fibrille.
Fig.3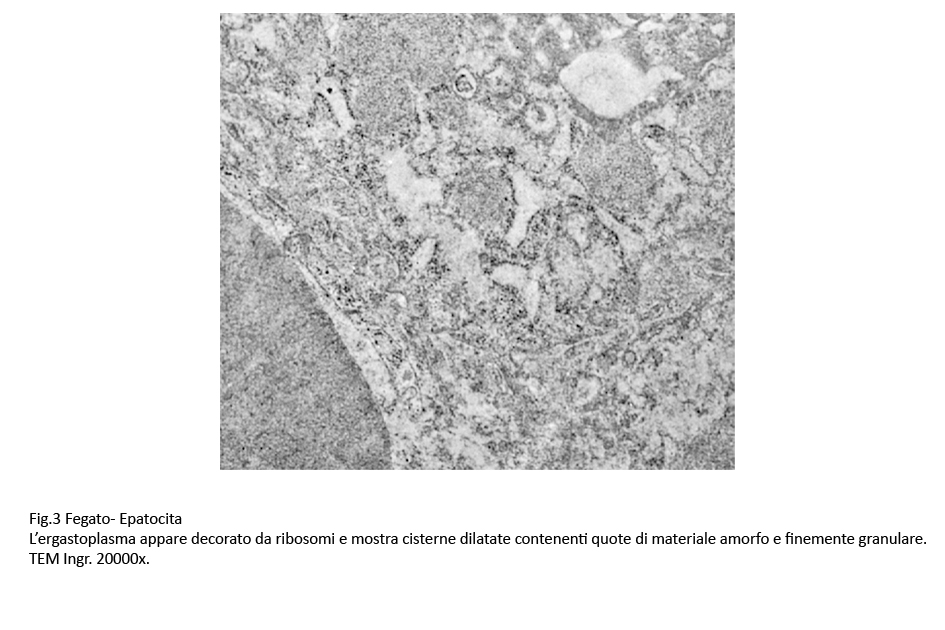 Fig.3bis Fig.3bis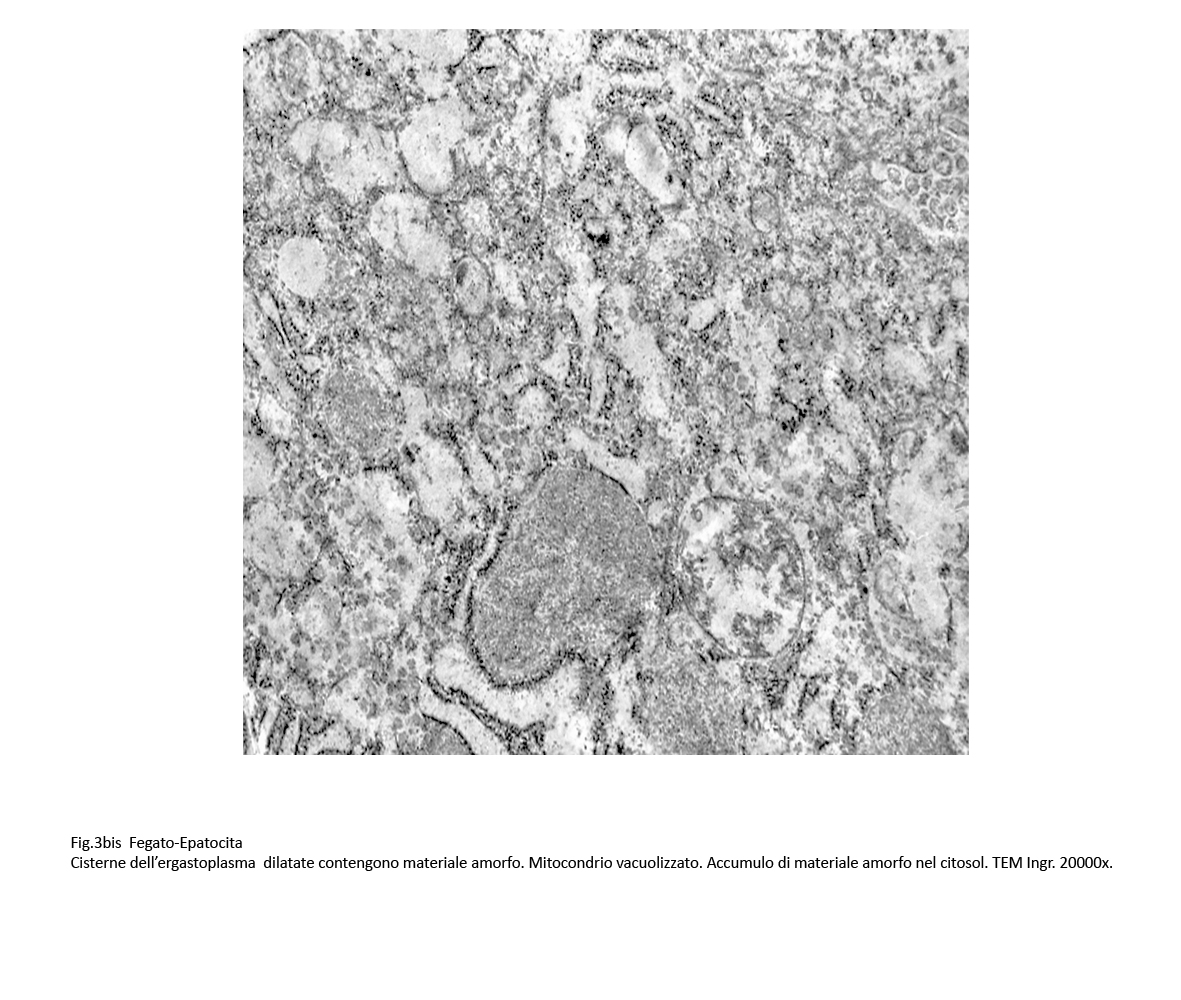
In qualche campo microscopico l’ergastoplasma si dispone a strati concentrici attorno a un centro ideale;
Fig.4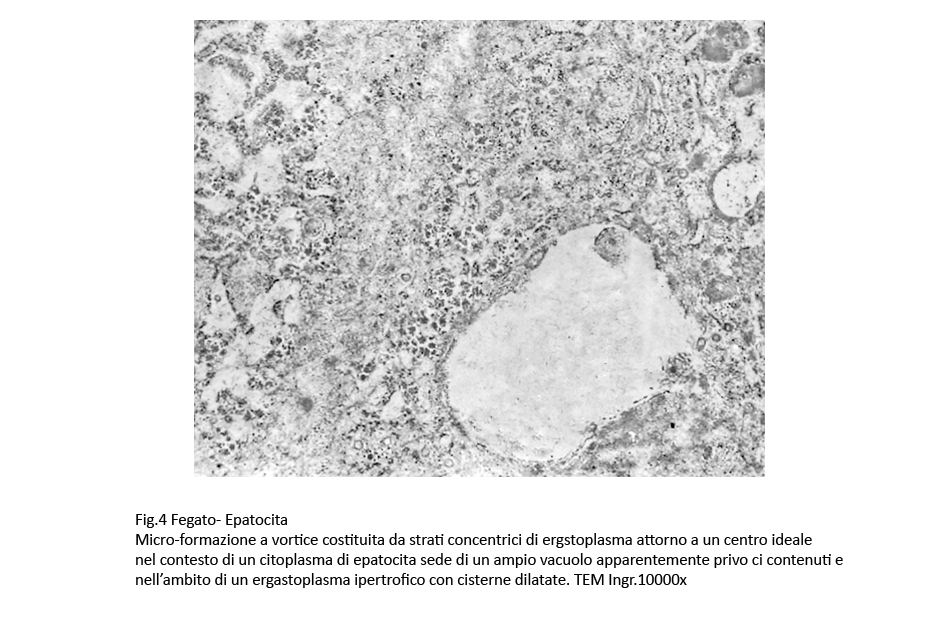 Fig.4part Fig.4part
in molte zone si rileva stati di adesione della membrana dell’ergastoplasma alla membrana esterna di un mitocondrio, venendosi a formare immagini di contatto tra membrane.
Fig.5
La dilatazione delle cisterne ergastoplasmatiche può essere cospicua fino ad acquisire aspetti microcistici; in queste condizioni la membrana dell’ergastoplasma si può lacerare, frammentarsi in zolle o addirittura polverizzarsi fino a non essere apprezzabile; dopo tale evento, il contenuto delle cisterne rimane depositato direttamente nel citosol.
Fig.6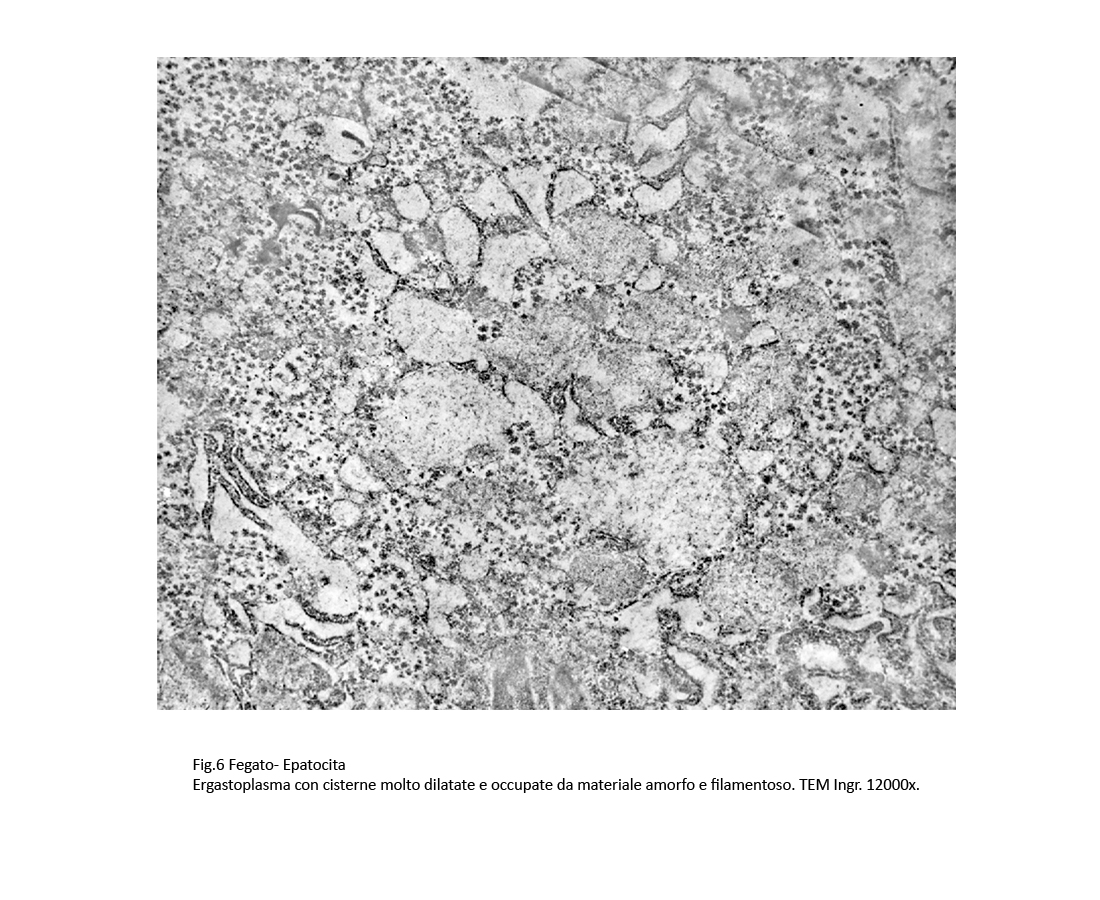 Fig.6bis Fig.6bis 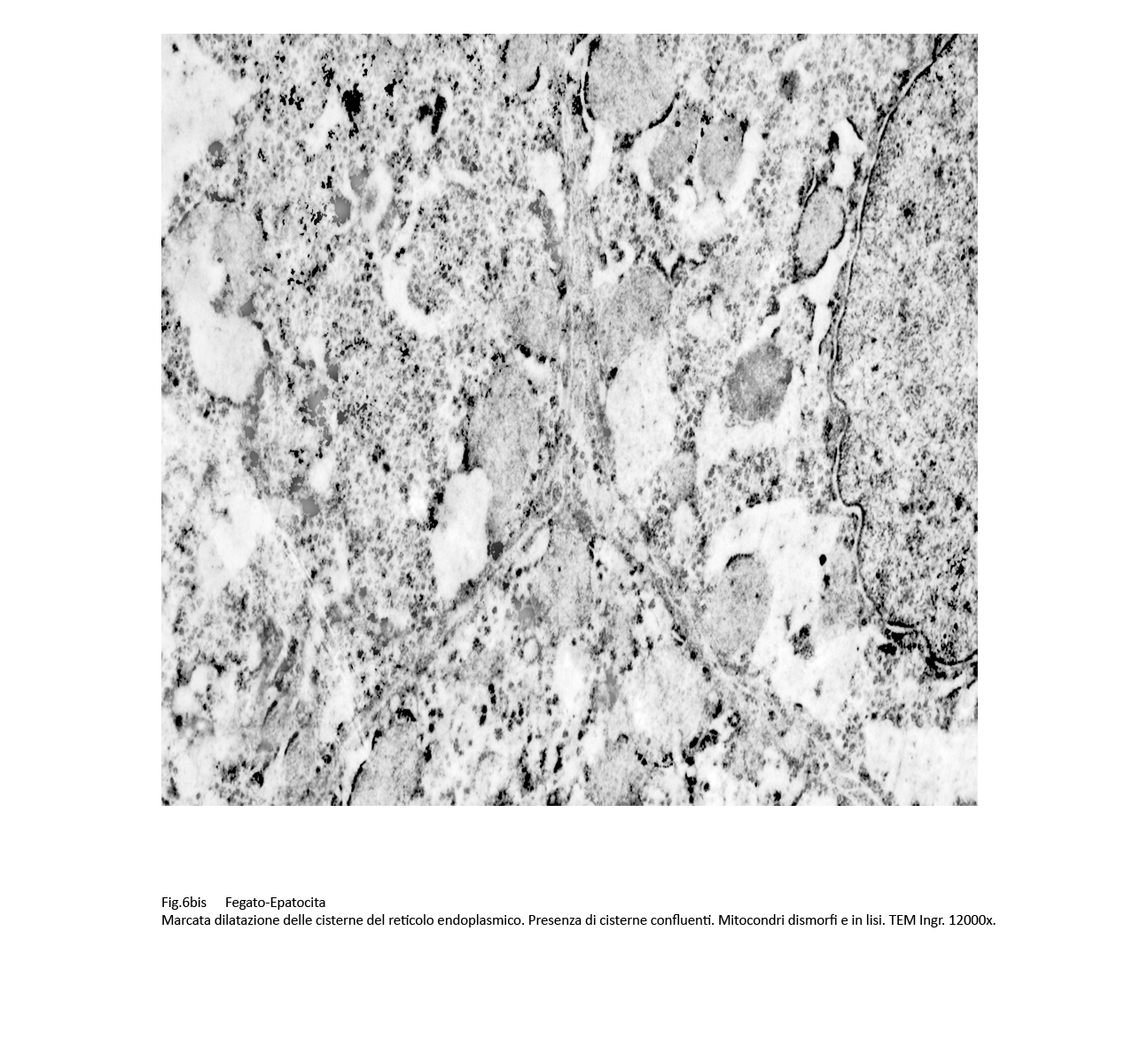 Fig.7 Fig.7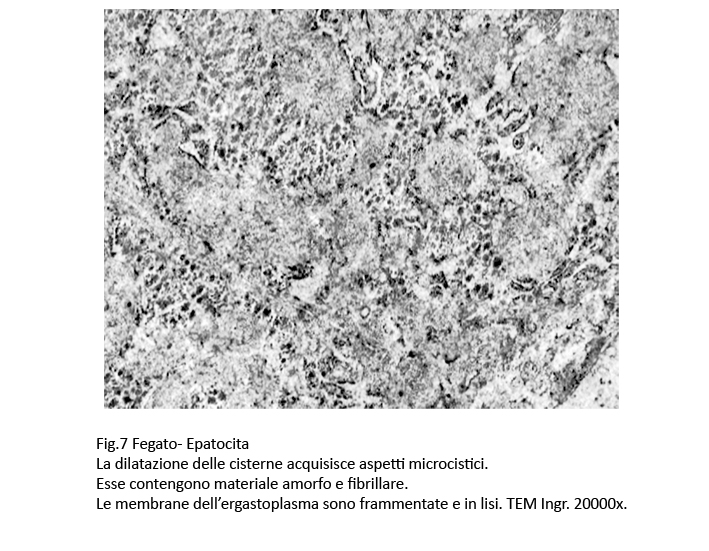
Fig.8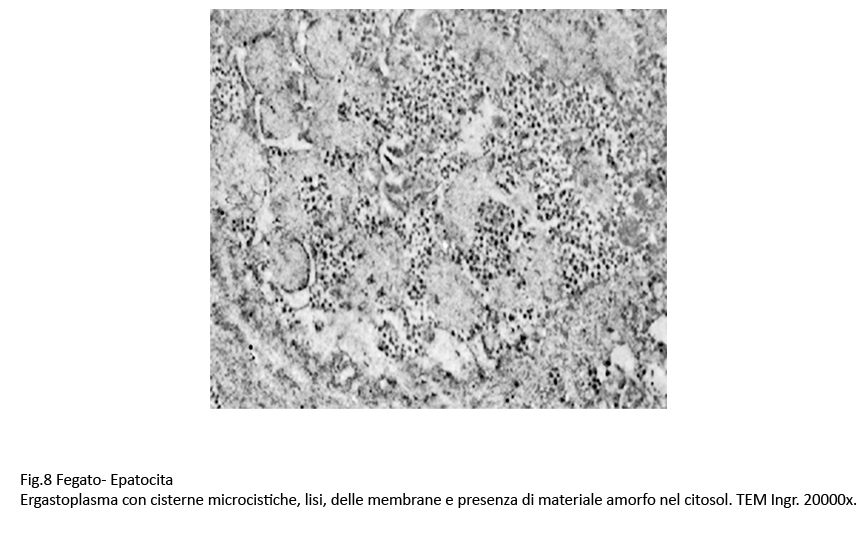 Fig.8bis Fig.8bis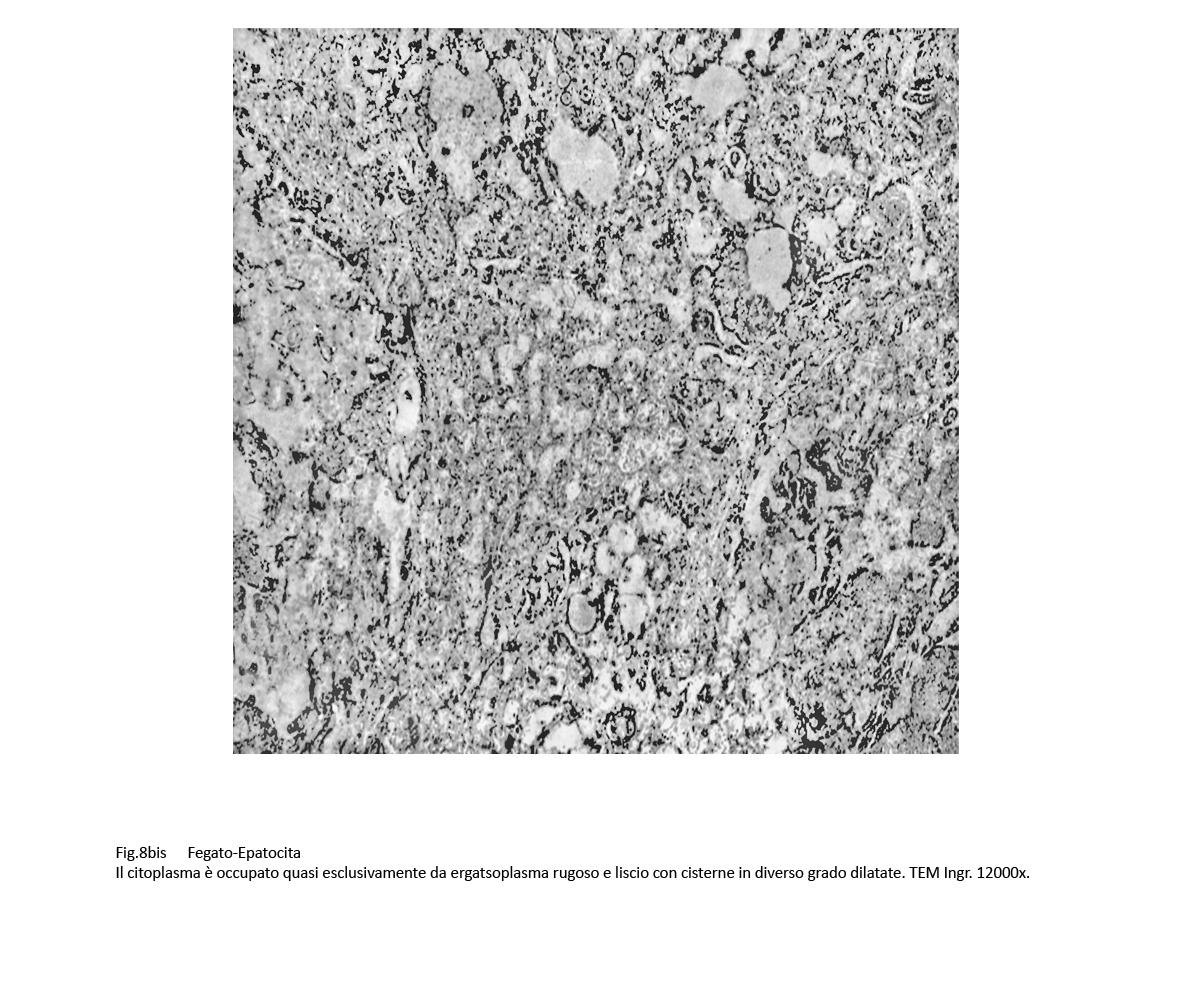 Fig.9 Fig.9
Reperti simili si osservano anche a livello delle aree occupate in prevalenza da ergastoplasma liscio;infatti, si rileva la esistenza di aggregati di tali organelli aventi cisterne dilatate occupate da materiale amorfo e granuloso e delimitate da membrane in preda a processi di lisi.
Fig.10
La frammentazione con lisi delle membrane dell’ergastoplasma rugoso e liscio può indurre processi di disaggregazione della tessitura citoplasmatica e formazione di escavazioni prive di pareti proprie e a margini frastagliati.
Fig.11
Gli epatociti esaminati contengono un grande numero di mitocondri, molto spesso a contatto con le membrane dell’ergastoplasma. Al loro cospicuo numero non corrisponde una struttura nei limiti della norma;infatti, presentano alterazioni di forma, di volumetria e di architettura interna. Molti di essi sono voluminosi, hanno un profilo irregolare, sono privi di creste, presentano una matrice iperchiara o iperdensa.
Fig.12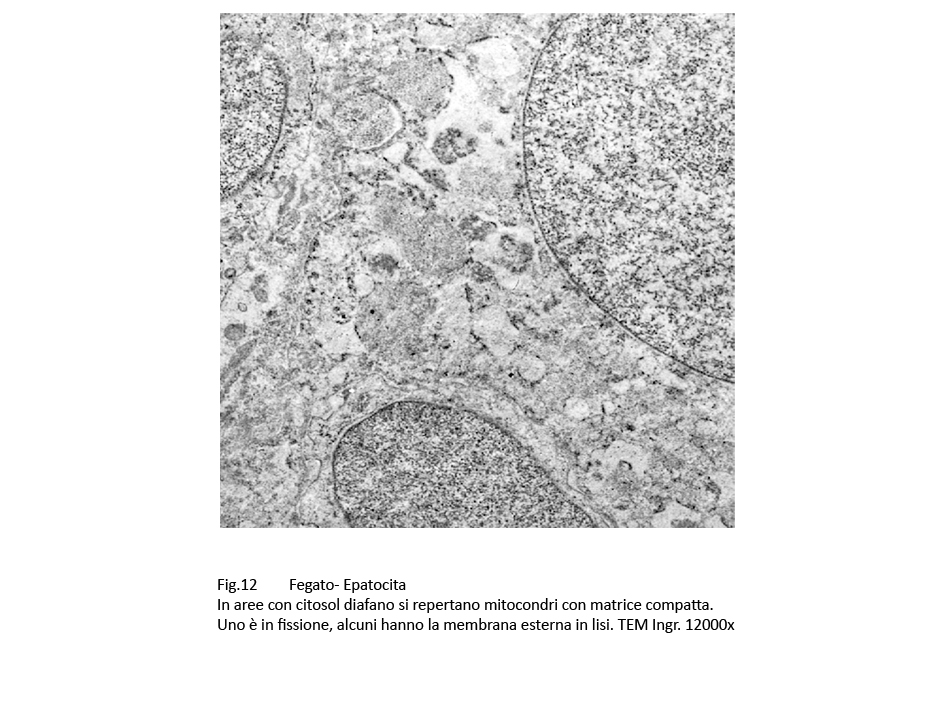 Fig.12bis Fig.12bis
Fig.13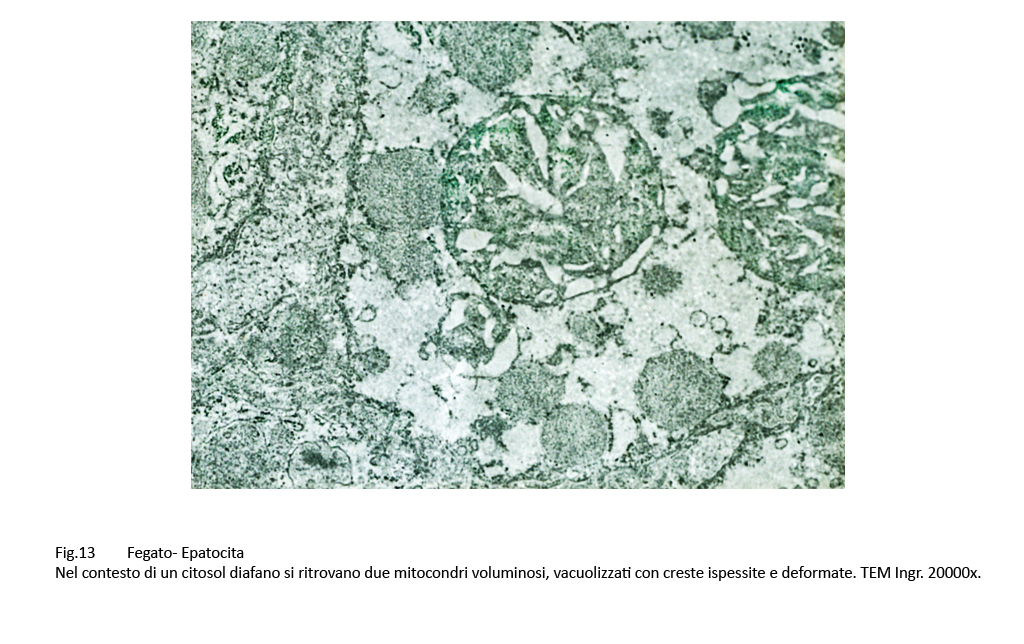 Fig.14 Fig.14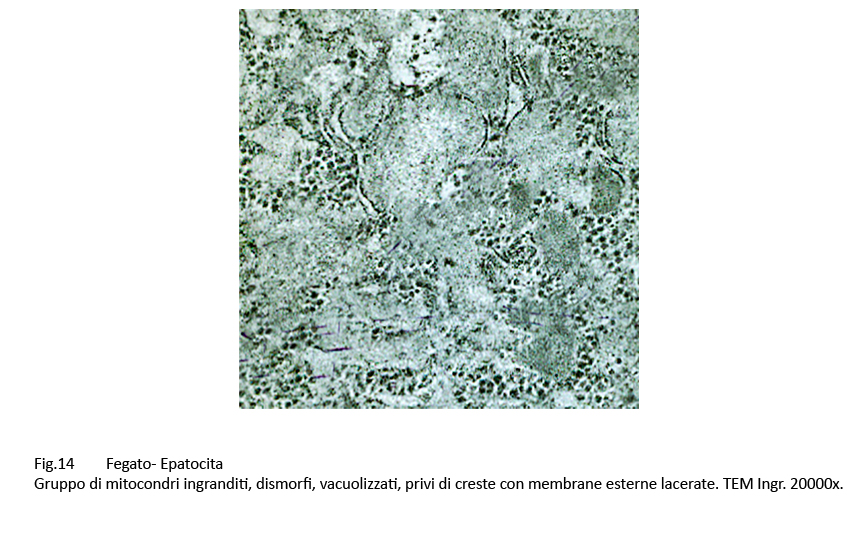
Spesso, loro membrana esterna è spesso lacerata, frammentata o addirittura cancellata da un processo di lisi con deiscenza del contenuto mitocondriale nel citosol.
Fig.15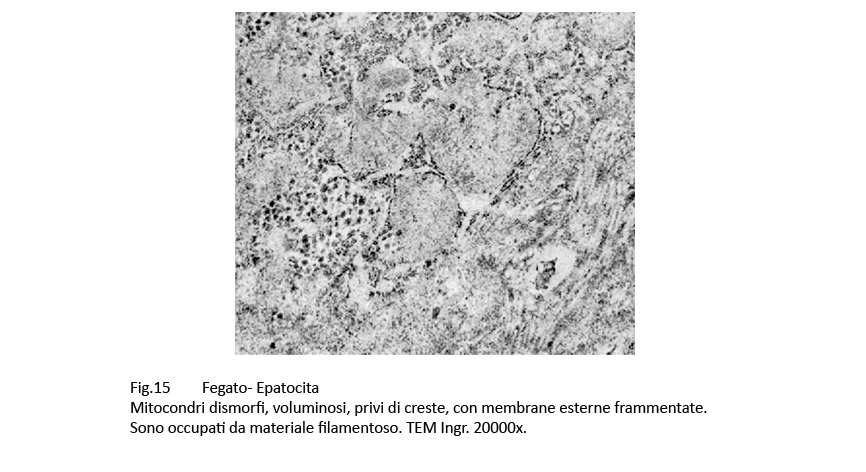
Non mancano reperti di mitocondri demarcati in modo parziale o in modo completo di una membrana a doppio contorno; si vengono così a configurare immagini diagnosticabili come focolai di fagofore o di autofagia selettiva (mitofagia).
Fig.16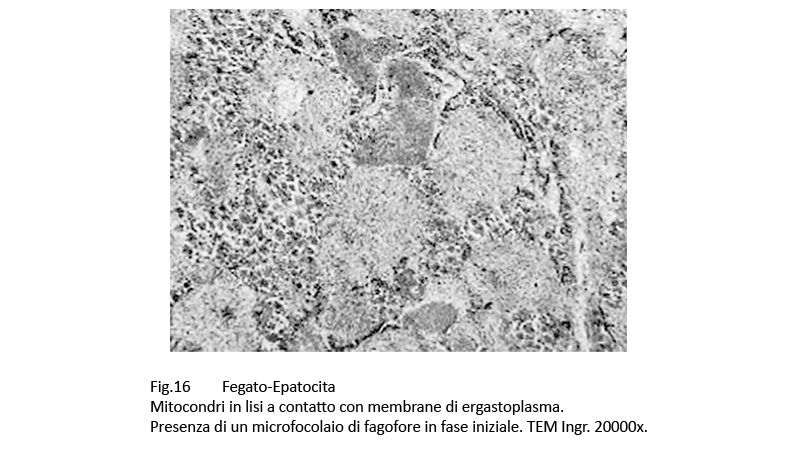 Fig.17 Fig.17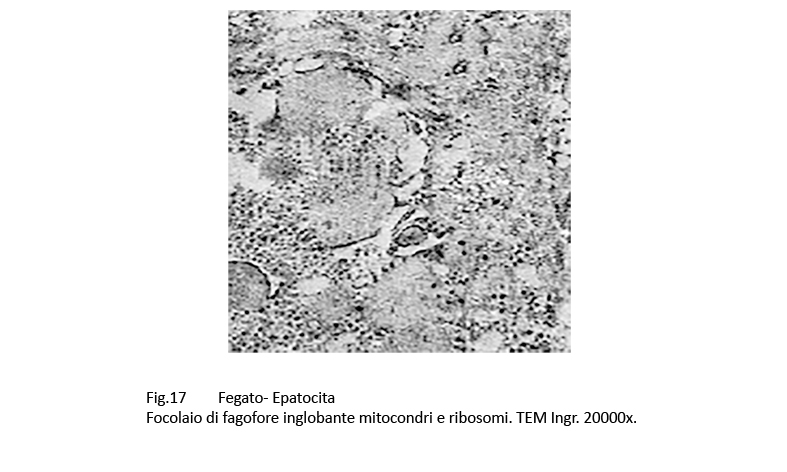 Fig.18 Fig.18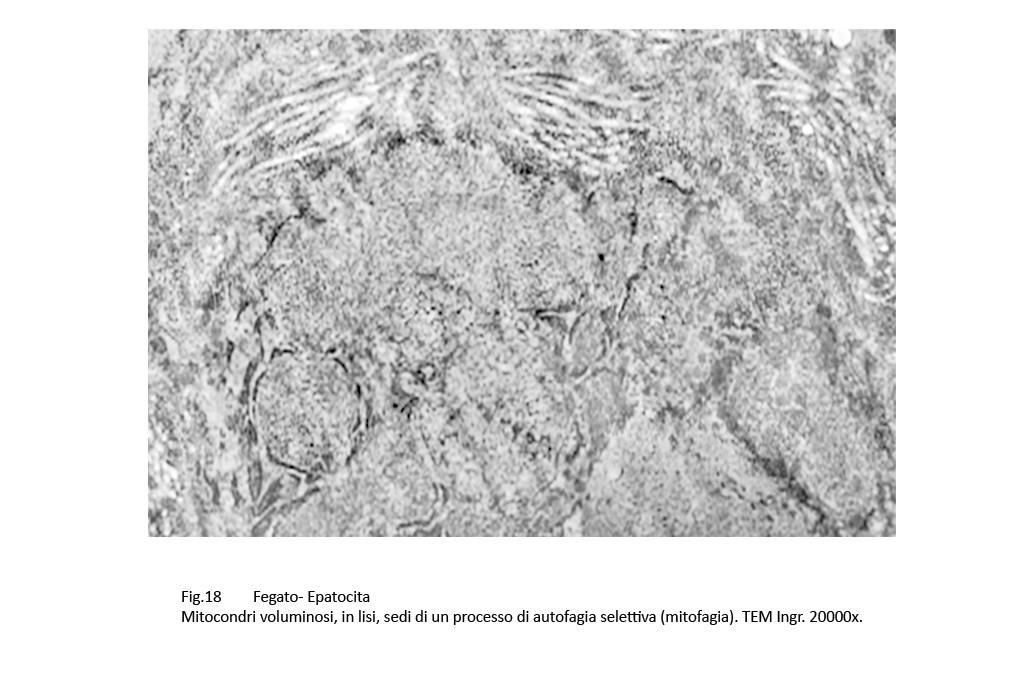
Nelle aree citoplasmatiche occupate da ergastoplasma e mitocondri gravemente danneggiati sono presenti focolai di fagofore e di autofagia. I primi si riconoscono per la presenza di una membrana a doppio contorno in via di formazione e incompleta; i secondi appaiono quali formazioni ben definite, in quanto sono delimitate di una membrana a doppio contorno che provvede a separarli dall’ambiente citoplasmatico circostante. Il loro cargo è costituito da ribosomi, da detriti citoplasmatici e da frammenti di membrana del reticolo endoplasmico.
Fig.19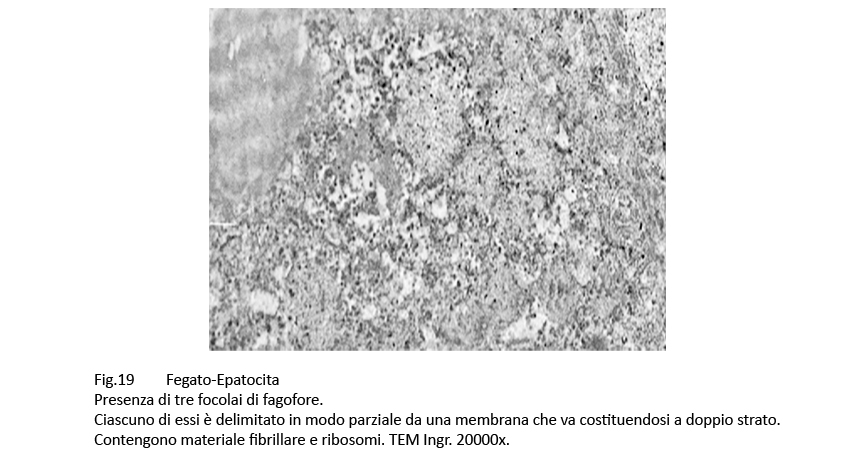 Fig.20 Fig.20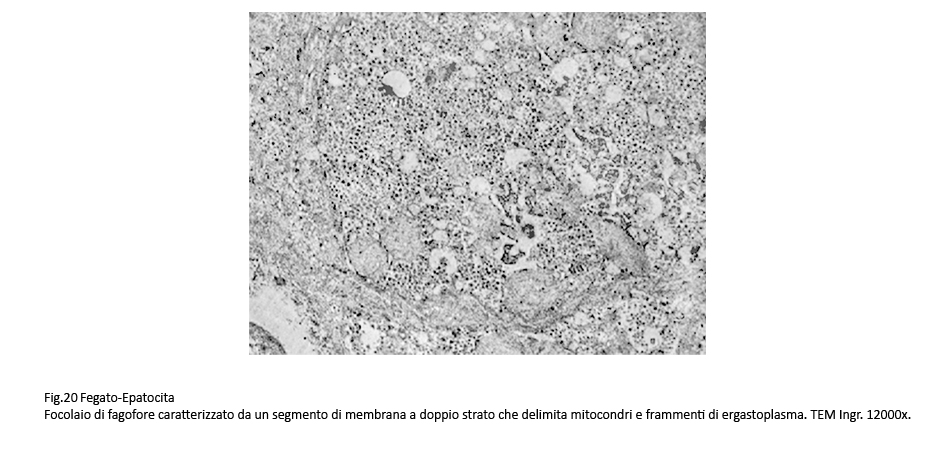 Fig.21 Fig.21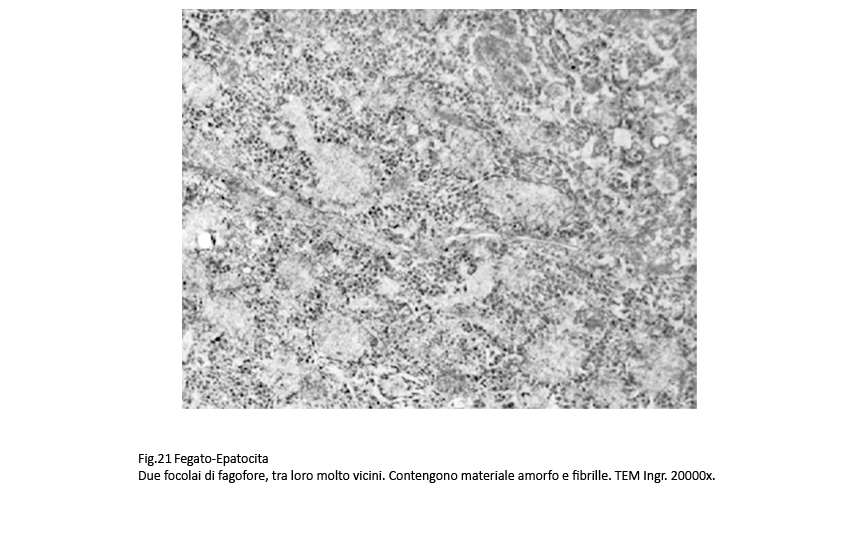
Fig.22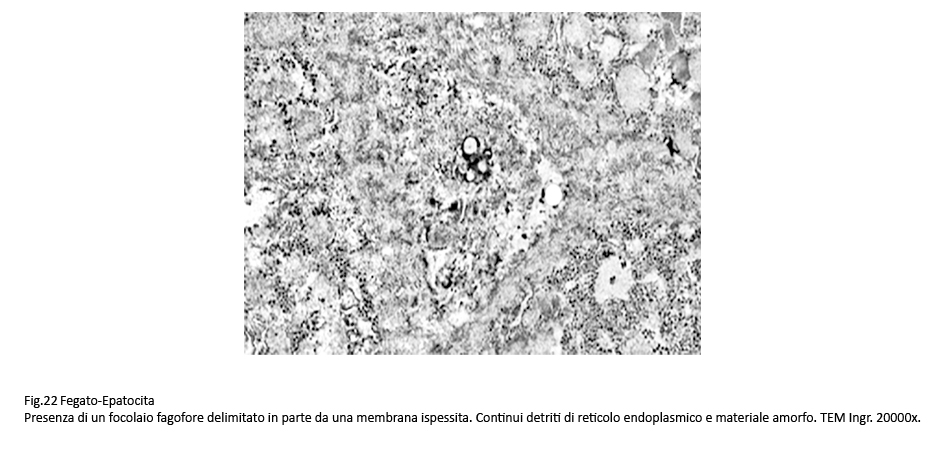 Fig.23 Fig.23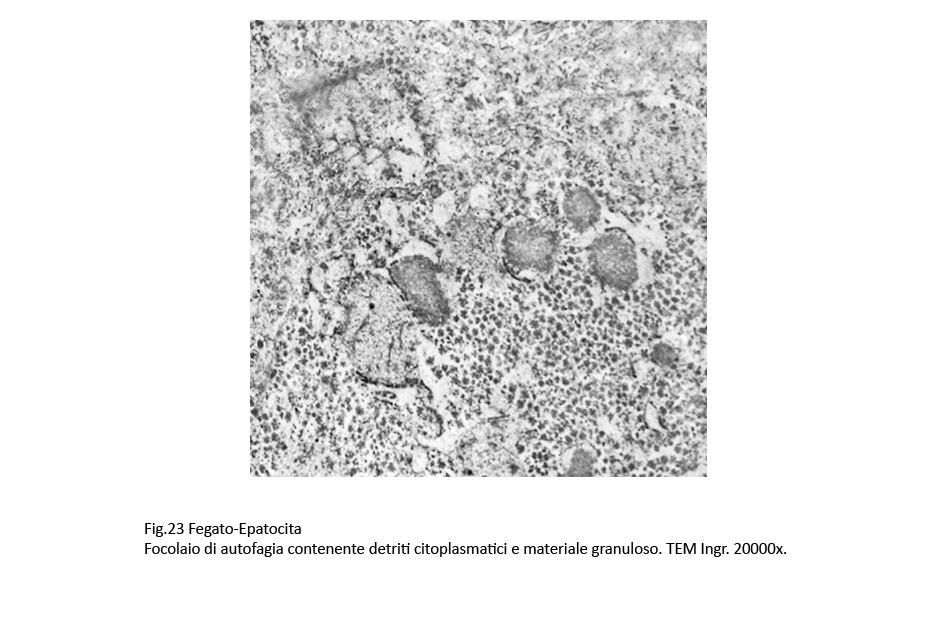
COMMENTO
Le osservazioni al microscopio elettronico circa lesioni degli epatociti da alcolismo cronico possono essere considerate parte integrante di quelle ottenute al microscopio luce.
Queste ultime, codificate in letteratura, sono determinanti per la definizione del quadro anatomo-clinico e per la sua stadiazione in riferimento alla fase cirrotico-carcinomatosa.
I reperti ricavati mediante la microscopia elettronica sono utilizzabili per meglio acquisire dati circa la patogenesi e l’istogenesi delle lesioni indotte dall’uso cronico di alcool. Questi reperti sono l’espressione plastica di quanto già accertato e documentato mediante indagini biochimiche e metaboliche.
Il danno degli epatociti, non coinvolti da steatosi, da degenerazione balloniforme, non apoptotici, né travolti da necro-flogosi, è dato inizialmente da alterazioni del reticolo endoplasmico e dai mitocondri; ovvero, è colpito il sistema di sintesi delle proteine e quello delle attività energetiche delle cellule.
I mitocondri svolgono un ruolo importante nel metabolismo e nelle attività bio-energetiche degli epatociti; pertanto i danni mitocondriali acquisiscono una valenza importante nella patogenesi delle malattie epatiche da alcol.
La connessione tra ER e mitocondri è fondamentale per conservare l’omeostasi delle cellule e per correggere eventuali danni in situazioni di stress e può essere verosimile che il danno ergastolasma-mitocondri sia una fase importante ( non documentabile alla microscopia luce,e ancora reversibile,) dei destruenti processi necrotico-flogistici evolventi verso la fibrosi e la cirrosi.
Lo stato di ER-stress e i mitocondri danneggiati innescano alterazioni negli altri organelli in considerazione delle interconnessioni e delle comunicazioni biologiche esistenti nella unitarietà dello apparato cellulare.
Queste alterazioni attivano il meccanismo dell’autofagia atto a rimuovere i cumuli di proteine , di lipidi, degli organelli danneggiati e recuperare l’omeostasi. Un ruolo particolare importanza è svolto dai processi di mitofagia in considerazione che nell’etilismo si ha un incremento del ROS provocando ossidazione delle proteine mitocondriali e frammentazione del mtDNA. Questo meccanismo può rivelarsi insufficiente oppure essere inadeguato per mancanza della fase di degradazione lisosomiale; in tali situazioni il corpo cellulare subisce l’apoptosi.
La morfopatologia, pur così ricca nelle sue versioni di istopatologia e di microscopia elettronica nelle acquisizioni sperimentali e umane, non ha caratteri di specificità . I reperti delle epatopatie da alcool sono simili a quelli riscontrati nelle epatopatie non alcooliche; la diagnosi differenziale può essere tracciata solo su basi anamnestiche e cliniche.
|
