Helicobacter Pylori,
adesioni alla mucosa gastrica
(Osservazioni al microscopio elettronico)
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica dell'Università della Campania "Luigi Vanvitelli"
L’Helicobacter Pilory (H Pylori) è un batterio Gram-negativo, piccolo microaerofilo, asporigeno, fornito di flagello,e mostra una forma spirale nella sua manifestazione vegetativa.
Esso non è invasivo o è debolmente invasivo; la sua azione patogena è legata alla secrezione di prodotti che penetrano nel citoplasma delle cellule ospiti, provocando alterazioni funzionali e morfologiche (PNAS 2011; 108: 14944-14949).
Acquisisce una forma coccoide allorquando le condizioni ambientali-nutrizionali non sono ottimali o diventano sfavorevoli; e nel passaggio dalla forma spirale-vegetativa a quella coccoide questo batterio passa attraverso forme “intermedie”aventi aspetti variamente ricurvi (U-shaped – L-shaped).
Sono state evidenziate diverse specie di H Pylori su la base del loro patrimonio genetico; questa varietà condiziona i gradi di virulenza, di replicazione, di trofismo e di adesione alle cellule dell’organismo ospite. Questa eterogeneità con la variabilità dei loro fattori di virulenza spiegano la molteplicità delle manifestazioni anatomo-cliniche (Folia Microbiol. (Praha) 2019; 64(3): 273-281).
Sono state repertate due linee di H Pylori su la base della loro incidenza epidemiologica: una colonizza in modo selettivo a livello della mucosa gastrica, della porzione inferiore dell’esofago e della porzione prossimale del duodeno; l’altra si annida in modo specifico a livello dell’ileo, del colon, delle vie biliari.
Gli H pylori che infettano lo stomaco nelle fasi iniziali si raccolgono negli strati di muco e la adesione agli epiteli avviene in modo successivo dopo aver superato due ostacoli: il primo è rappresentato dall’attraversamento degli strati mucinosi che ricoprono la superficie della mucosa gastrica; il secondo è legato alla necessità di aumentare il pH gastrico per rendere compatibile la sopravvivenza di questi batteri.
L’attraversamento dello sbarramento mucinoso avviene mediante la motilità degli H pylori e il superamento del pH acido si realizza mediante la secrezione dell’enzima ureasi che idrolizza l’acido urico in ammoniaca e bicarbonato. Inoltre,l’azione dell’ureasi fa decrescere la viscosità del materiale mucinoso,favorisce la motilità di questi batteri e agevola l’attraversamento del muco da parte degli H pylori (Proc. Nath. Acad. Sci. U.S.A. 2009; 105: 14321-14326). (Microbes Infect 2000; 2: 533-542) (Proc. Nath. Acad Sci U.S.A. 2009; 106: 14321-14326).
Gli H Pylori così colonizzati si dispongono a diretto contatto con gli epiteli di superficie e delle foveole della mucosa gastrica aderendo alla membrana plasmatica di tali cellule,privilegiando gli apici degli epiteli e le zone delle giunzioni (Gastroenterology 2007; 132: 1009-1023).
Queste adesioni sono stabili e resistono a forze sradicanti quali peristalsi, enzimi, pH non adeguati, etc. mettendo in evidenza un tropismo selettivo nel realizzare in modo valido la interazione tra H pylori gli epiteli. Mediante questo processo di adesione gli H pylori utilizzano i nutrienti derivanti dagli epiteli e provvedono a costruirsi un habitat adatto alla propria sopravvivenza (Science 2004; 305: 519-522) (World J. Gastroenterol. 2014; 20(36): 12767-12780).
. Il meccanismo che consente questa adesione è costituito dall’azione delle proteine OMPS della membrana esterna degli H Pylori (proteine OMPS: Outer Membrane Proteins) e di altre molecole, attualmente sconosciute o parzialmente conosciute. Di questo gruppo di proteine OMPs, codificate da un numero di geni superiore a 30, fanno parte le molecole Bab A, Sab A, Alp A/B, HopZ, OipA, QipH, ICCA (Cell Commun Signal 2011; 9: 28)(World J Gastroenterol.2014;20(36)12767-12780) (Front Cell Infect Microbiol 2016; 6; 159).
Tra queste proteine si ricordano, in questa breve esposizione, solo quelle maggiormente conosciute: la proteina BabA atta a favorire la colonizzazione e a svolgere funzioni patogenetiche; la proteina QipH inserita nei processi pro-infiammatori e le proteine ICCA che potenziano e stabilizzano i contatti tra gli H pylori e gli epiteli (J Immunol. 2002; 168: 3033-3041) (Clinical Microbiology Reviews 2006; 19: 449-490) (PLOS One 2012; 7: e30354).
La colonizzazione degli H pylori non è indotta e regolata solo da fattori elaborati e trasmessi da questi batteri ma è favorita e resa concreta mediante chemorecettori presenti a livello della membrana plasmatica degli epiteli quali il TlpA, TlpB, TlpC e il chemorecettore TlpD presente nel loro citoplasma (Infect.Immun.2012;80:3713-3720) (Front.Cell Infect.Microbiol.2016;6:159).
Da quanto viene riportato in letteratura l’azione patogena degli H pylori segue due principali percorsi,di questi uno è rappresentato da molecole solubili secrete direttamente dai batteri,l’altro si manifesta attraverso la formazione le vescicole OMVs.
I primo percorso si caratterizza per il rilascio nelle zone di “contatto” di molecole solubili, patogene, che sono internalizzate nel citoplasma delle cellule ospiti mediante il sistema T4SS (Type4 secretion system) (World J. Gastroenterol. 2014; 20 (36): 12767-12780). (Helicobacter 2019; 24(Suppl 1); e12638).
Il secondo percorso è costituito dalla formazione di vescicole nel periplasma per accumulo di peptidoglicani con successive rigonfiamento modificazioni della membrana esterna degli H pylori (Nature 2005; 437: 422-425).. (Microbes Infect 2000; 2(14): 1669-1674.).
Queste vescicole, denominate OMVs, (Outer Membrane vescicles), contengono prodotti biologici attivi che vengono internalizzati nel citosol delle cellule epiteliali mediante meccanismi prospettati in letteratura quali una transcitosi a livello base-laterale,una endocitosi clatrina dipendente, una endocitosi caveolina dipendente, o una micropinocitosi.(Cell Microbiol. 2010; 12: 372)(Helicobacter2019;(Suppl.1):e12638) (Microorganisms 2020;8(9):1328).
Queste vescicole, presenti in tutti i batteri Gram-negativi, sono di forma sferica, sono delimitate da una membrana a doppio strato, hanno un diametro variabile da 20-30 nm a 400-500nm..
Il loro sviluppo è correlato alle fasi di crescita dei batteri, al tipo di cultura, alle condizioni ambientali, ai metodi di isolamento dei batteri. alle situazioni di stress, all’ aumento della temperatura, alla mancanza di nutrienti (J. Bacteriol. 1982;151: 1523-1531) (Microorganisms 2020; 8(9): 1328).
Il contenuto delle OMVs, codificato da vari geni, è costituito da proteine, fosfatidi, cardiolipine, lipopolisaccaridi, porine, adesine,molecole regolanti la secrezione di chemochine, lipopolisaccaridi, peptoglicani, molecole di DNA, tossine, proteine pro-infiammatorie(J.Pathol. 1999;188:220) (Microbes Infect 2000; 2: 1669-1676). (Proteonics Clin. Appl. 2009; 3 (7): 785-796) (Front Microbiol. 2010; 1: 115).
Queste vescicole veicolano citotossine altamente lesive per le cellule ospiti e fattori flogistici quali espressione della virulenza degli H pylori (Proteomies Clin Appl. 2009: 3 (7): 785-796) (Microorganisms 2020; 8(9): 1328).
A livello dei punti di contatto H pylori-epiteli si osservano modificazioni morfologiche quali la riduzione e alterazioni dei microvilli, la invaginazione e lo ispessimento della membrana plasmatica, la neoformazione di spazi interepiteliali, la iperplasia del citoscheletro al di sotto della membrana plasmatica, la dilatazione delle cisterne del reticolo endoplasmico, la destrutturazione delle giunzioni intercellulari ( APMIS 2000; 108(6); 439-447).
Questa breve quanto incompleta rassegna su il ruolo determinante delle zone di”contatto” nella patogenesi delle lesioni da H pylori è propedeutica per illustrare una documentazione su questo tema ottenuta mediante osservazioni al microscopio elettronico di campioni bioptici di mucosa dell’antro gastrico di pazienti affetti da gastrite cronica da H pylori
REPERTI
I campioni bioptici in esame sono stati prelevati dalla mucosa dell’antro gastrico di soggetti affetti da gastrite cronica causata da Helicobacter Pylori.
Al microscopio elettronico, questi frammenti di mucosa gastrica appaiono ricoperti da strati di materiale mucinoso e sono cosparsi di colonie di H pylori coccoidi e ricurvi.
Fig.1 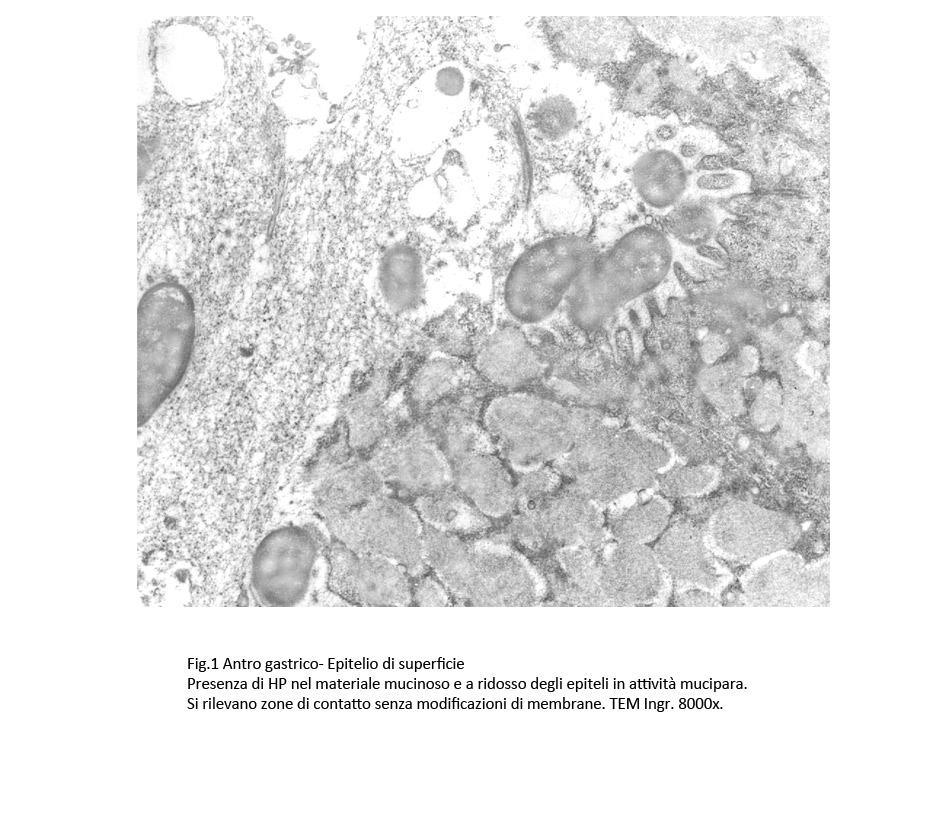
Questi batteri sono raccolti nelle maglie del reticolo mucinoso, sono distribuiti quasi a ridosso della superficie della mucosa o a “contatti” con gli epiteli di superficie e con quelli delle foveole secondo diverse configurazioni.
Fig.2 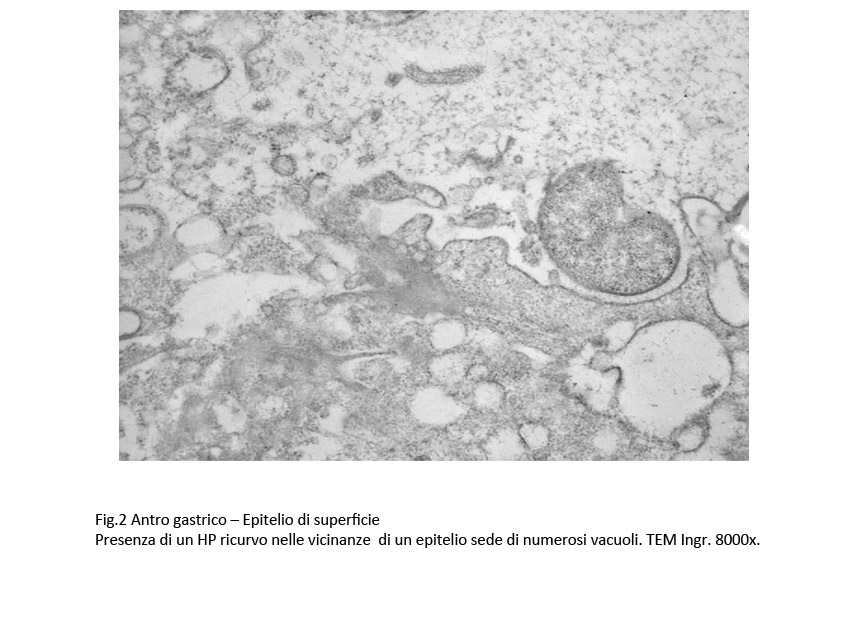 Fig.2 part
Fig.2 part 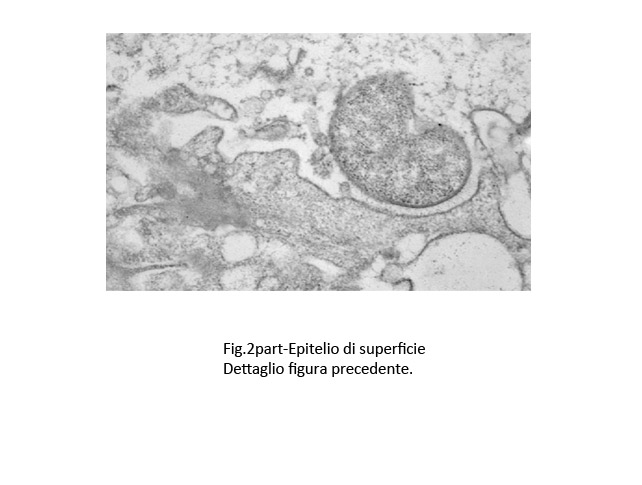 Fig.3
Fig.3 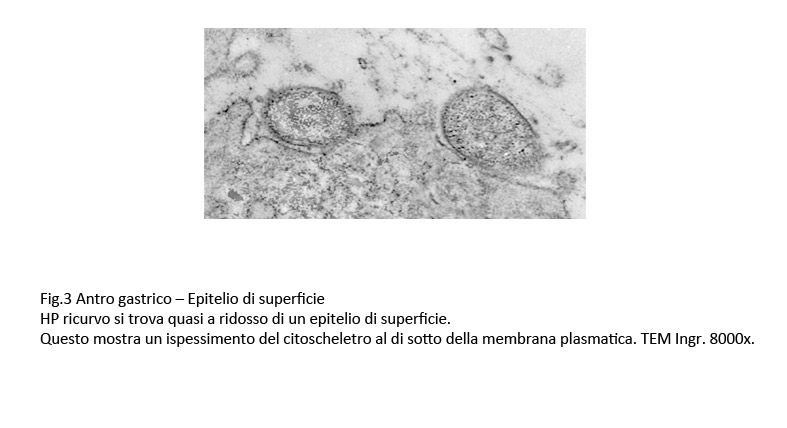
Si riscontrano “contatti” senza modifiche della membrana plasmatica degli epiteli accanto a contatti con incavo della stessa membrana o ancora contatti formatasi alla sommità di microvilli variamente slargati.
Fig.4 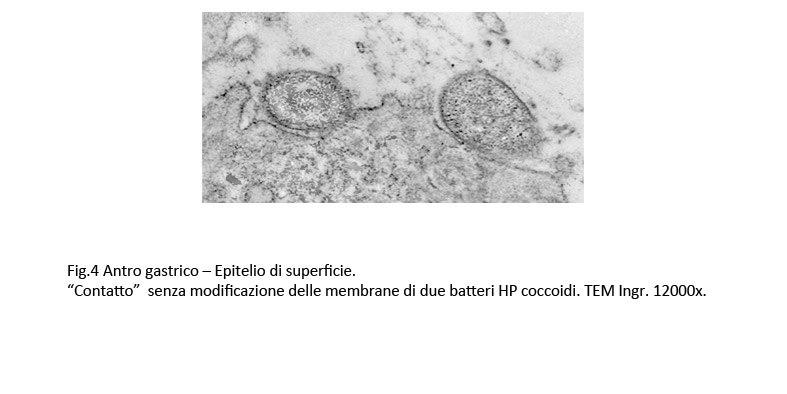 Fig.5
Fig.5 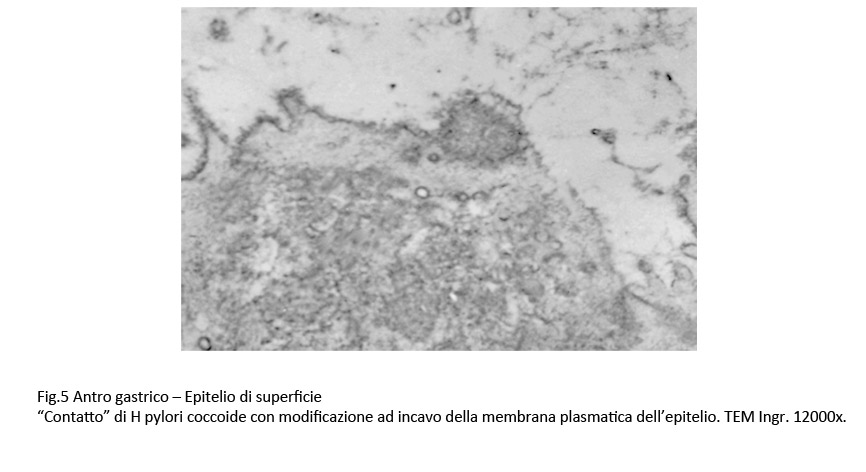 Fig.6
Fig.6 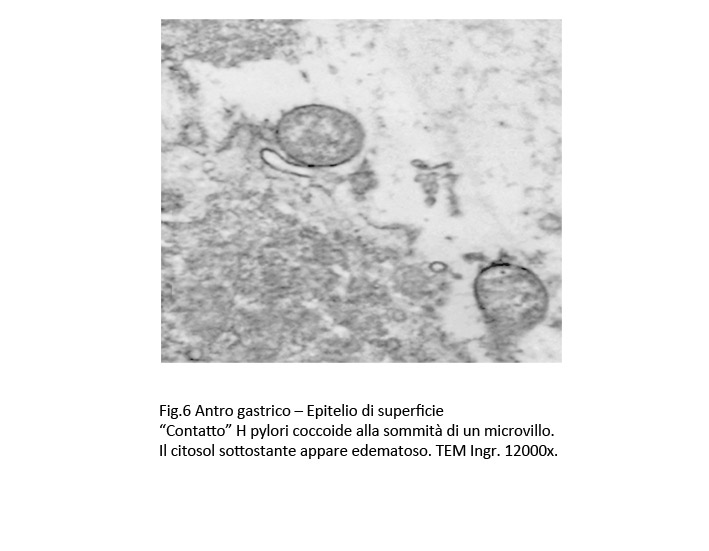
Inoltre,non sono rari i “contatti” a livello dei quali si determina una fusione della membrana esterna degli HP con la membrana plasmatica degli epiteli.
Fig.7 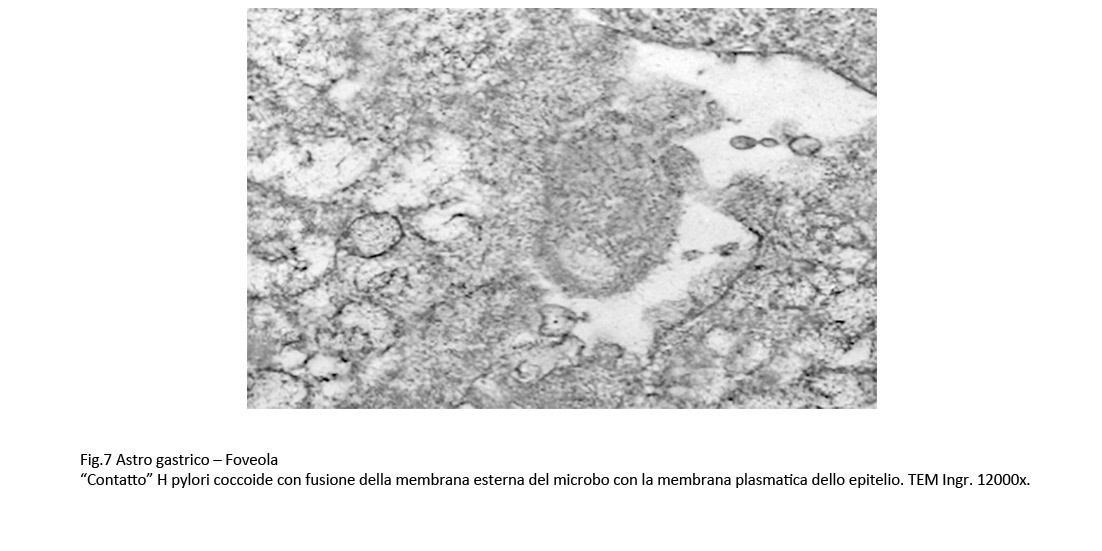
Di particolare interesse sono considerati i “contatti” a livello delle zone giunzionali,atti a indurre la rottura delle strutture giunzionali, formazione di spazi interepiteliali e penetrazione degli H pylori nella tonaca propria.
Fig.8 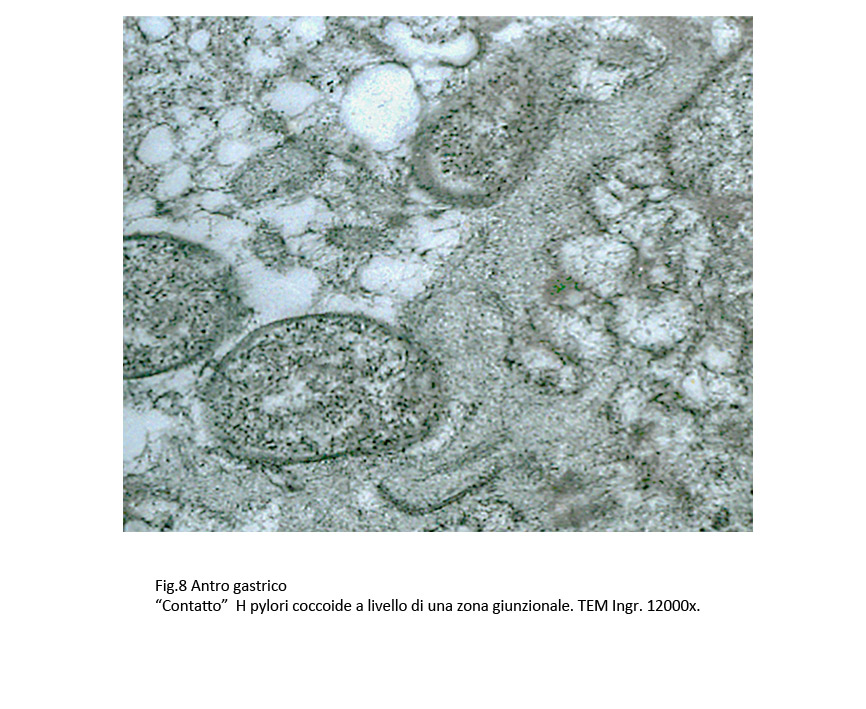 Fig.9
Fig.9 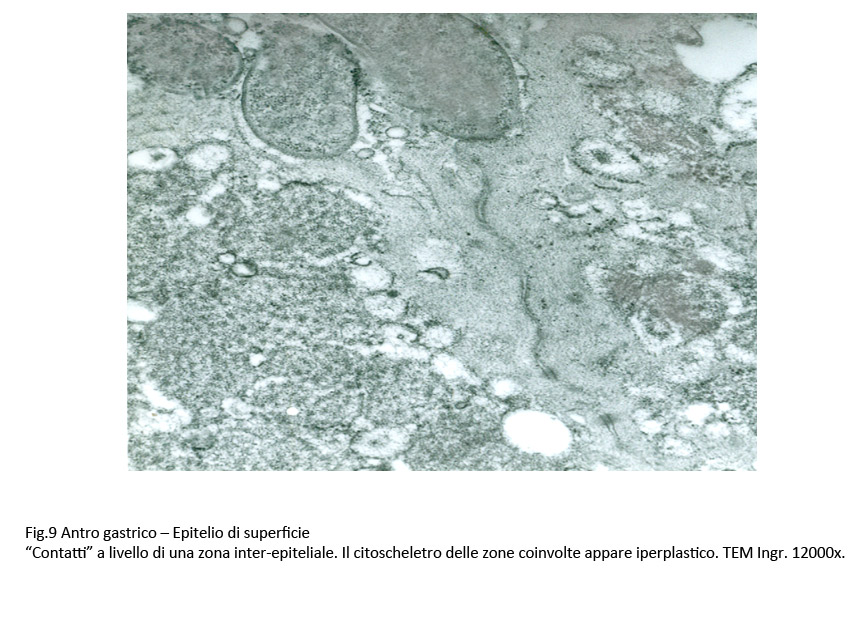
Il “contatto” adesivo degli H pylori agli epiteli di superficie e delle foveole è molto resistente, è perdurante nel corso dell’infezione e si reperta anche a livello degli epiteli gravemente danneggiati o in lisi.
Fig.10 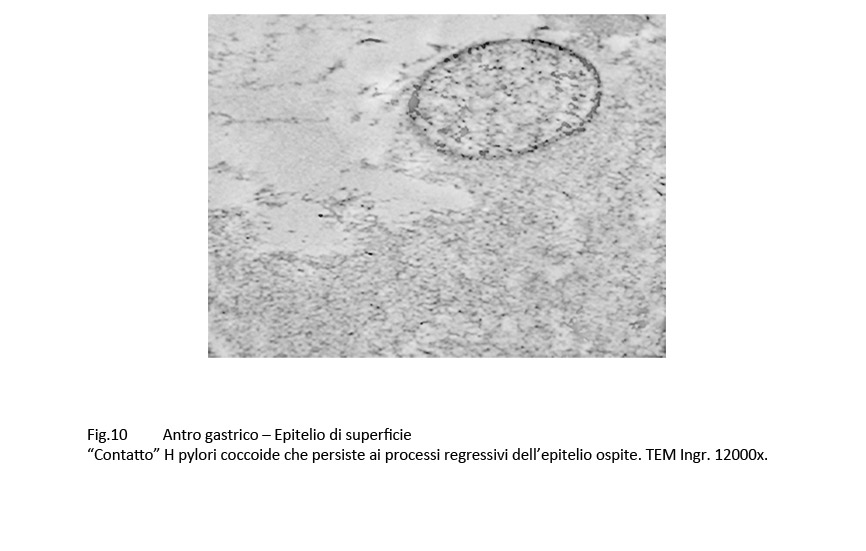 Fig.11
Fig.11 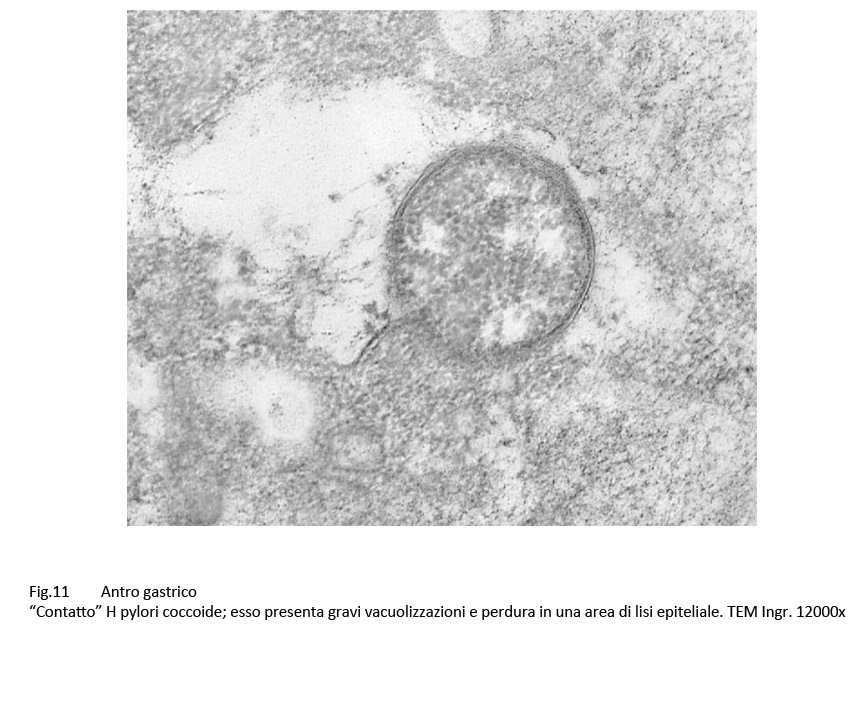
Fig.12 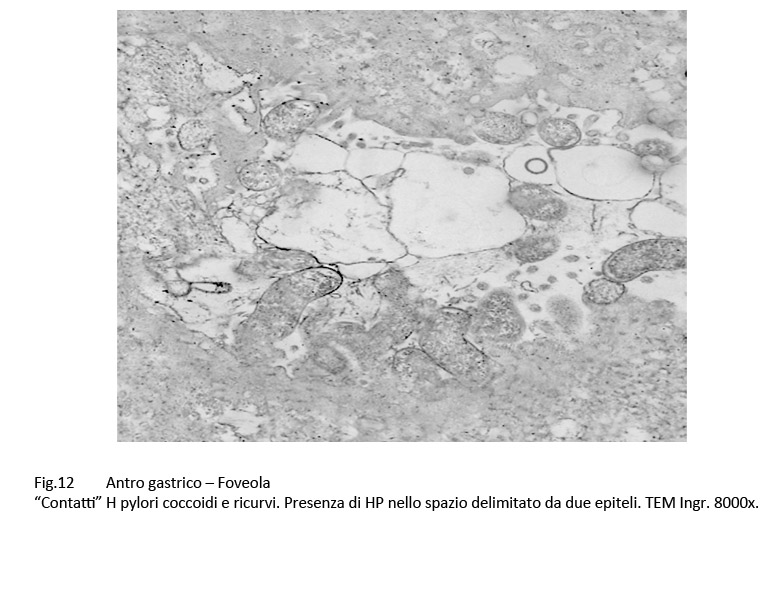 Fig.12part
Fig.12part 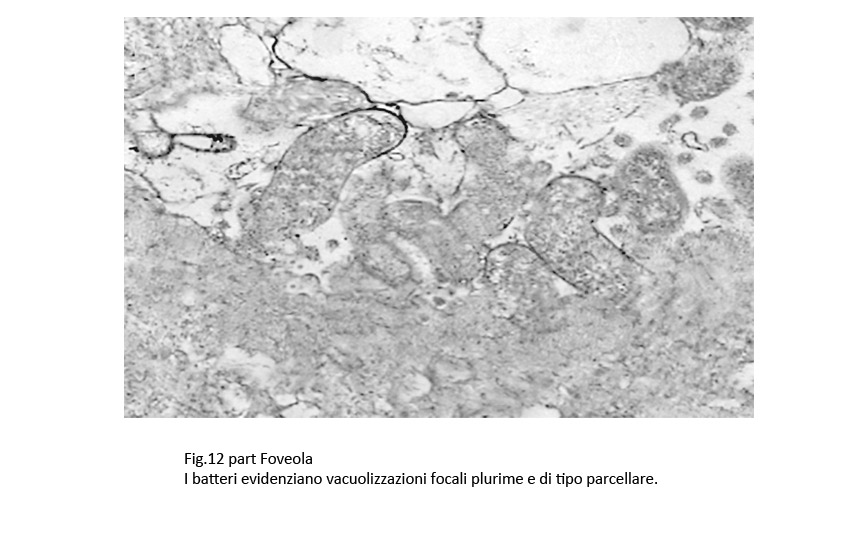
Infatti, questi “contatti” sono presenti a carico di H pylori colpiti da processi di vacuolizzazione di tipo focale, parcellare, subtotale, fino allo svuotamento dell’intero protoplasma;
Fig.13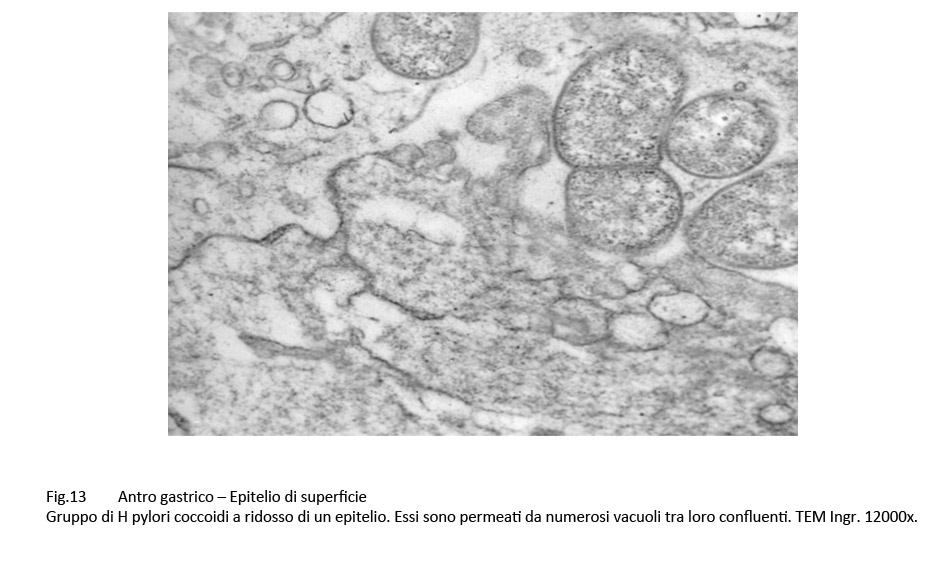 Fig.14
Fig.14 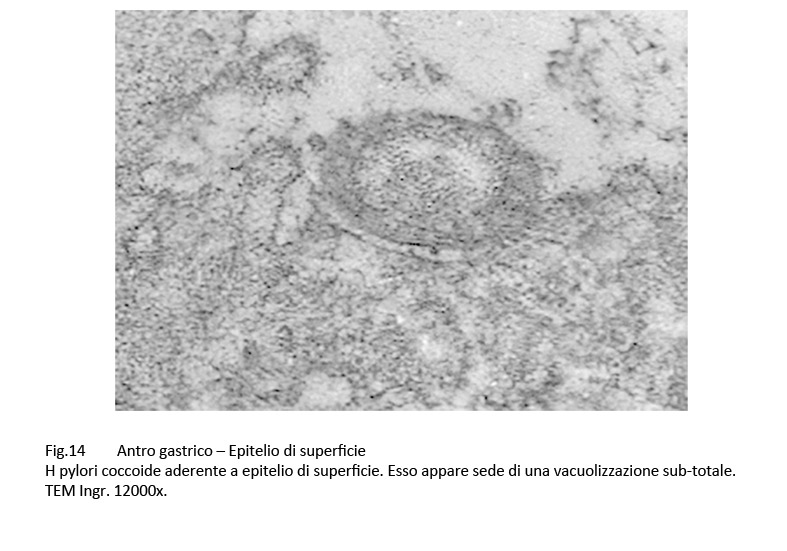 Fig.15
Fig.15 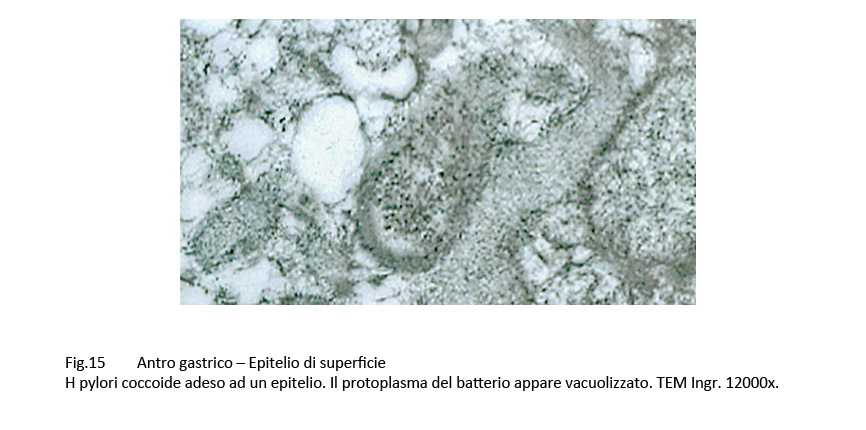
e si riscontrano a livello di epiteli con frammentazioni della membrana plasmatica, iperplasia disordinata delle fibrille del citoscheletro, edema del citosol, iperplasia e dilatazione delle cisterne del reticolo endoplasmico, o ancora alla lisi del citoplasma.
Fig.16 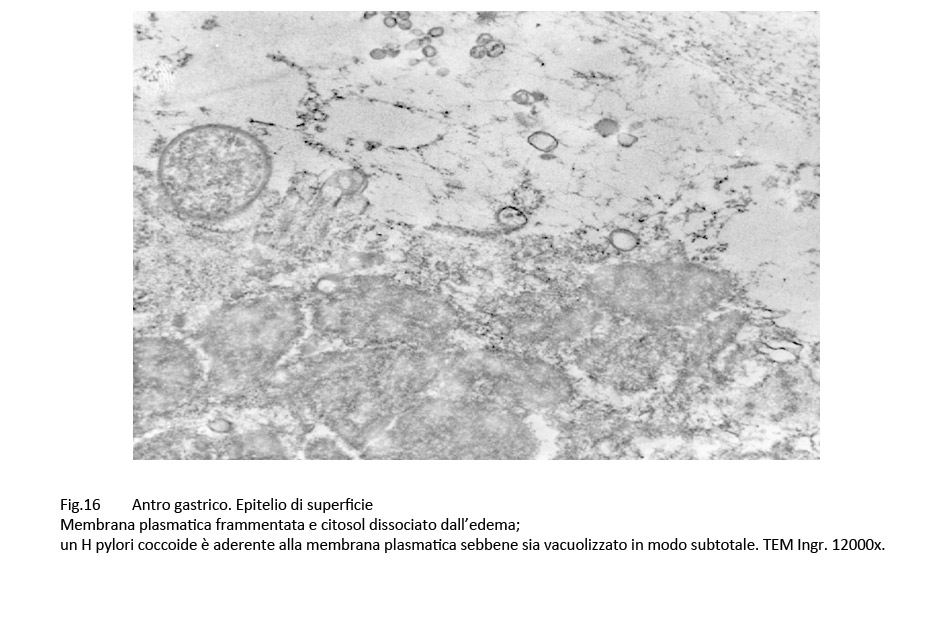 Fig.17
Fig.17 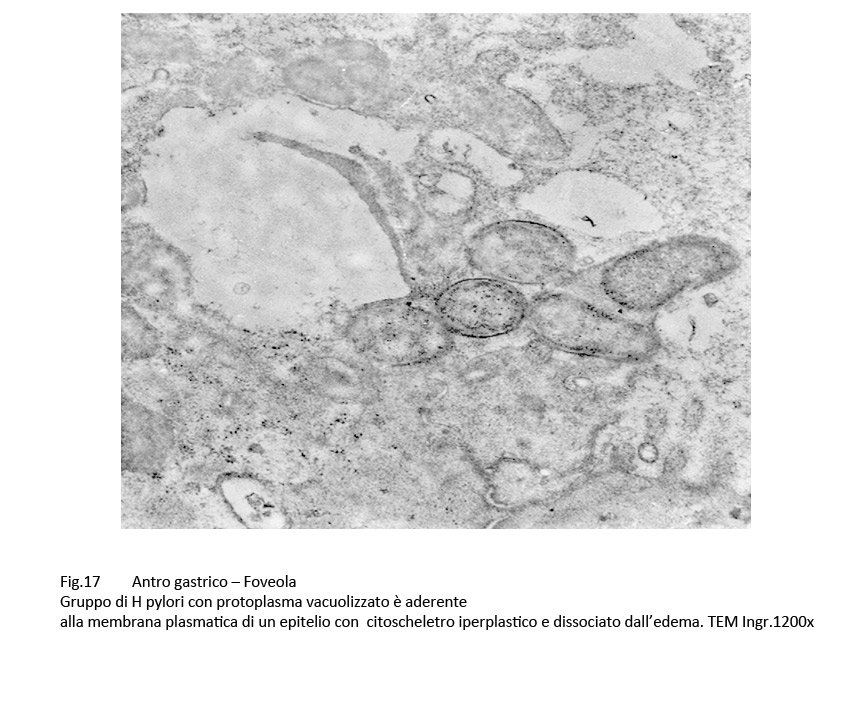 Fig.18
Fig.18 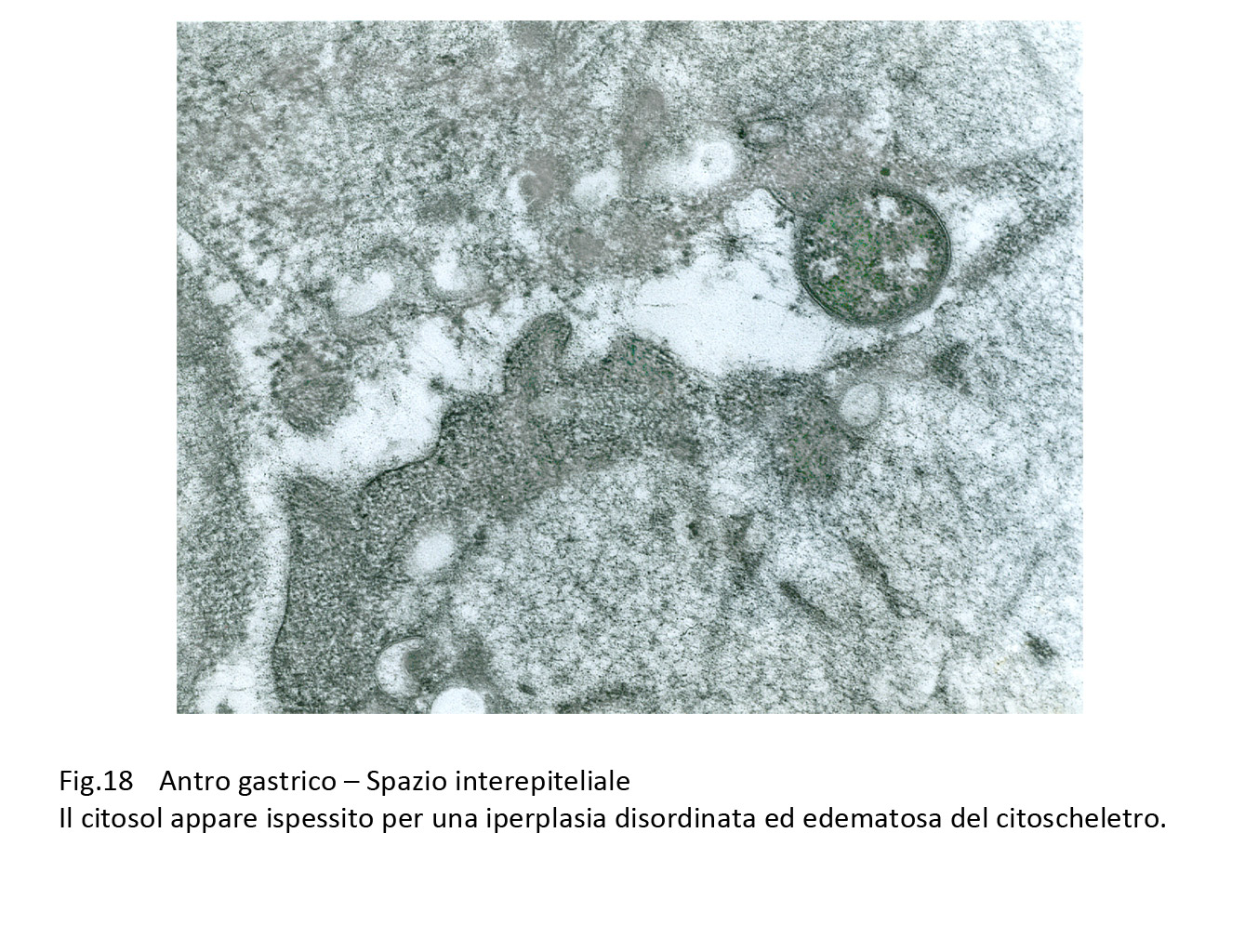
Fig.19 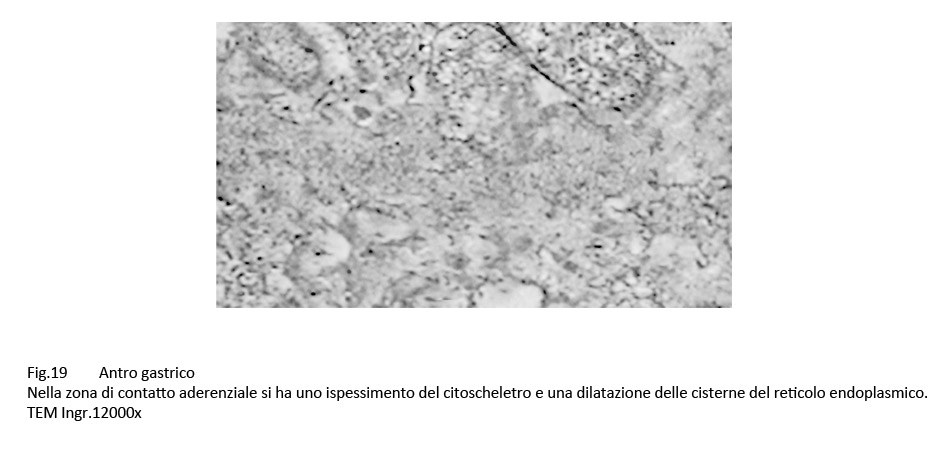 Fig.20
Fig.20 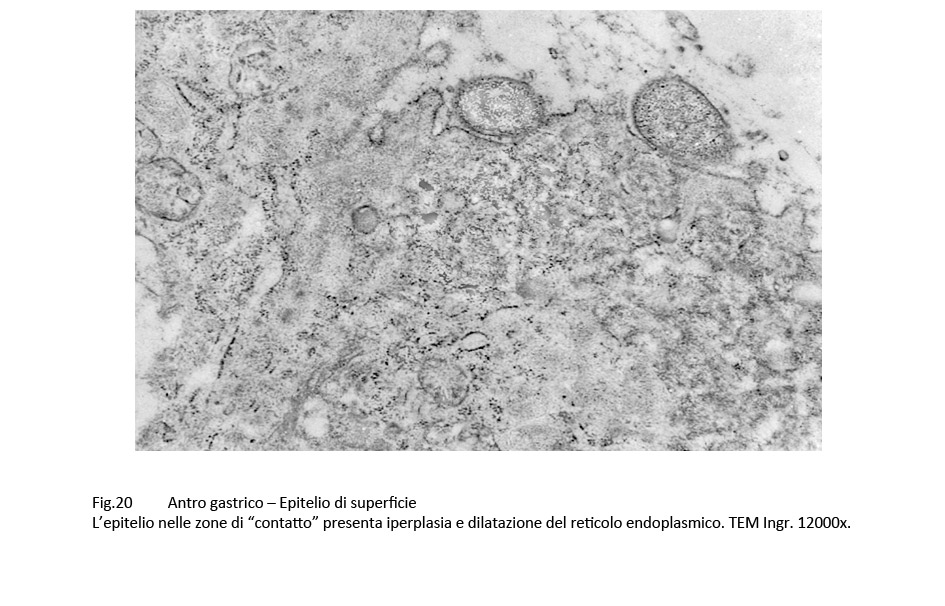 Fig.21
Fig.21 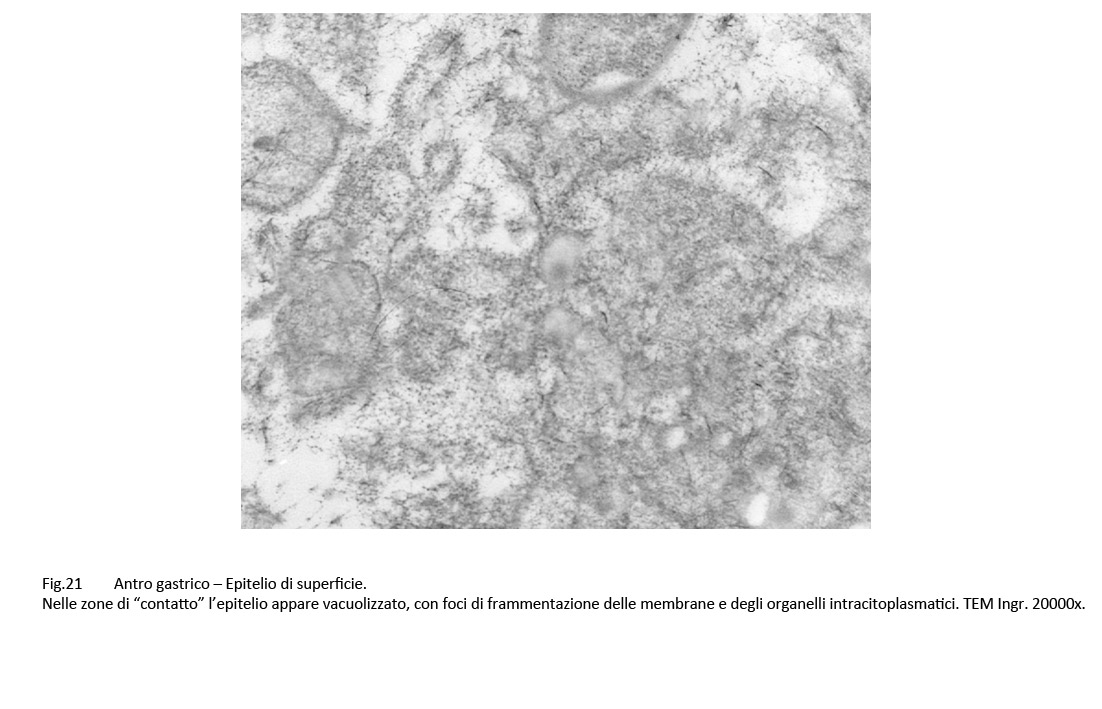
COMMENTO
I reperti dianzi descritti,nella loro univocità ultrastrutturale, consentono alcune valutazioni interpretative.
Le colonie riscontrate sono costituite da elementi coccoidi e di forma intermedia distribuiti negli strati di muco e a ridosso degli epiteli di superficie con presenza di zone di “contatto”.
La morfologia di questi “contatti” è varia,e probabilmente essa è espressione di fasi evolventi finalizzate alla fusione della membrana esterna degli H pylori con la membrana plasmatica degli epiteli.
Questi “contatti” sono molto stabili e permangono anche se gli epiteli mostrano fenomeni regressivi e necrobiotici e i batteri appaiono gravemente vacuolizzati.
Frequentemente, le zone di”contatto” si ritrovano a livello delle strutture giunzionali,quasi come un tropismo per scardinare queste strutture, aprire un percorso per raggiungere la tonaca propria.
In nessun campo sono stati repertati H pylori nell’interno del citoplasma degli epiteli; ciò conferma una loro azione patogena e flogogena indotta mediante la secrezione di molecole attive.
Nelle zone di “contatto” si riscontrano costantemente alterazioni delle strutture epiteliali,in particolare una dilatazione delle cisterne del reticolo endoplasmico e una iperplasia con rimaneggiamento del citoscheletro; questi reperti possono essere considerati come risposta reattiva alle molecole patogene e flogogene secrete da questi batteri.
I “contatti” appaiono costantemente stabili anche nei reperti caratterizzati da gravi vacuolizzazioni degli H pylori e da epiteli in lisi.
