GLIOSARCOMA
Luigi Cuccurullo
Il gliosarcoma è una variante del glioblastoma; esso è caratterizzato da un profilo morfologico bifasico per la presenza di una componente di cellule gliali e un’altra avente i caratteri fenotipici delle cellule mesenchimali (W.H.O.). La componente a cellule gliali conserva i propri caratteri di base sebbene gli elementi che la compongono siano atipici, pleomorfi e frequentemente anaplastici; invece la componente simil-mesenchimale, per imprevedibili processi di metaplasia, può appalesarsi in modo molto variabile acquisendo, a seconda dei casi, i caratteri morfologici ed immunoistochimici del fibrosarcoma, del condrosarcoma, dell’osteosarcoma, del rabdomiosarcoma, del leiosarcoma, del liposarcoma; in modo infrequente può simulare la morfologia di un carcinoma squamoso con perle cornee, di un adenocarcinoma o di un tumore neuroectodermico indifferenziato (P.N.E.T.).
Queste due componenti del gliosarcoma, nel corso della loro crescita, possono topograficamente disporsi in modo commisto e compenetrante oppure ritrovarsi in campi microscopici distinti o nettamente separati.
La diagnosi è complessa; essa richiede l’applicazione di metodiche istologiche, immunoistochimiche, ultrastrutturali e genetiche per caratterizzare i citotipi e porre una ragionata procedenza di diagnosi differenziale rispetto ad altre neoplasie apparentemente similari. Così, per esempio, è necessario distinguere le carie forme di gliosarcoma dai sarcomi primitivi dell’encefalo e delle leptomeningi; oppure riconoscere i veri gliosarcomi dai glioblastomi con elevata componente stromale (glioblastoma desmoplastico) o ancora dis-interpretare focolai metastatici con marcata reazione gliale per processi gliosarcomatosici primitivi.
L’iter diagnostico è scansionato innanzitutto da osservazioni strutturali e citologiche al microscopio luce; quando si provvede a effettuare una mappatura dell’assetto antigenico delle cellule per cercare linee di coerenza con la morfologia delle popolazioni cellulari; successivamente si procede ad una analisi dettagliata delle substrutture endocellulari per stabilire in modo indubitabile la loro presenza caratterizzante e attraverso di esse valutare il grado di maturazione delle cellule; infine, e non come ultima procedenza, si esamina l’assetto genetico delle popolazioni cellulari per stabilire le mutazioni genetiche specifiche ed attraverso di esse accertare la monoclonalità della neoplasia. Al microscopio luce, la componente gliale assomiglia al quadro pleomorfo dei glioblastomi; esso, come è noto, è dato da disordini strutturali con variazioni qualitative per la presenza di cellule di grande, media e piccola taglia, di elementi mononucleati, bninucleati, plurinucleati; queste popolazioni possono avere un profilo bipolare, genistocitico, altamente irregolare anaplastico; se si passa a valutazioni semiquantitative si rileva la presenza di aggregati di diversa densità, di varia estensione e con indici proliferativi tra loro non confrontabili.
Fig.1 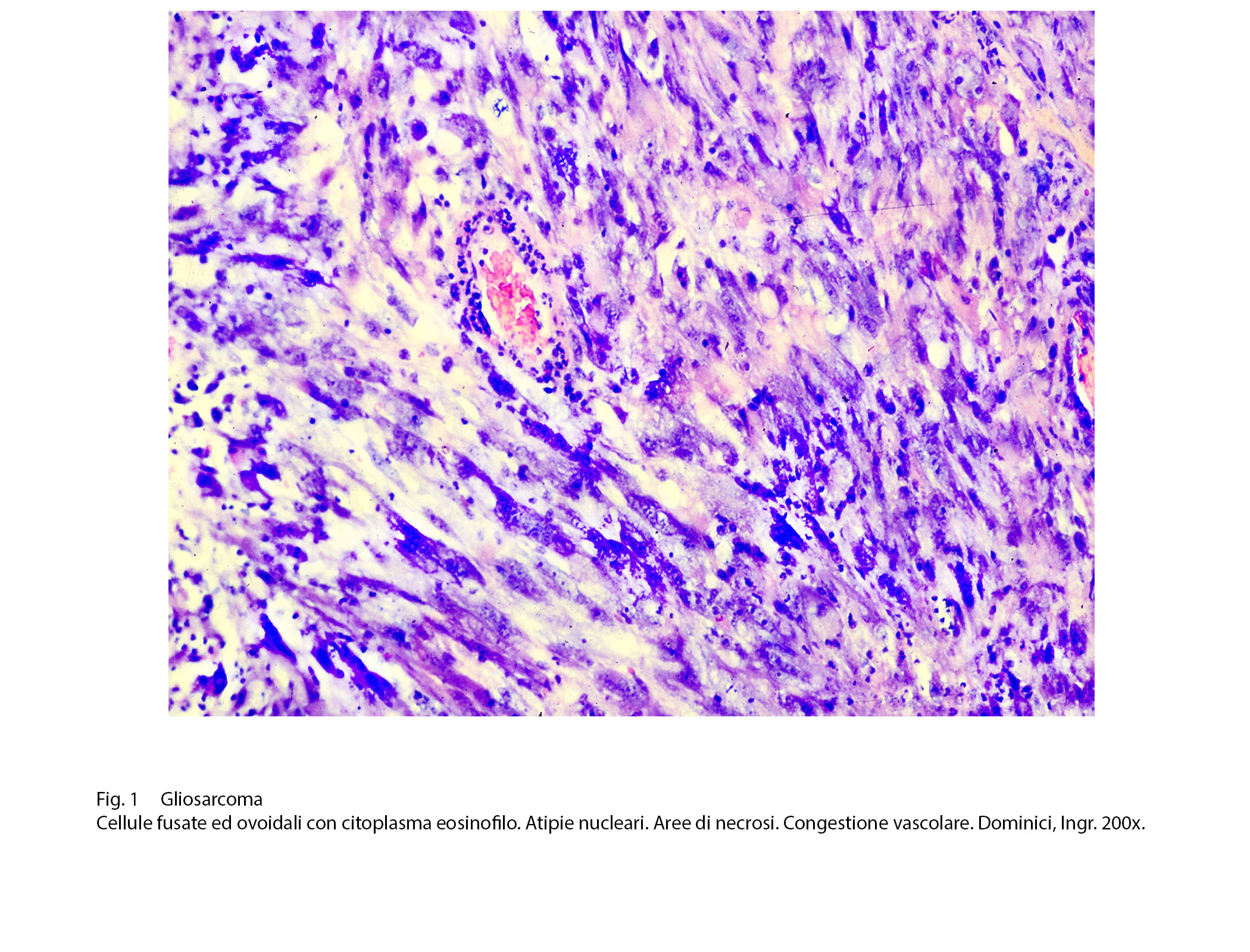 Fig.2
Fig.2 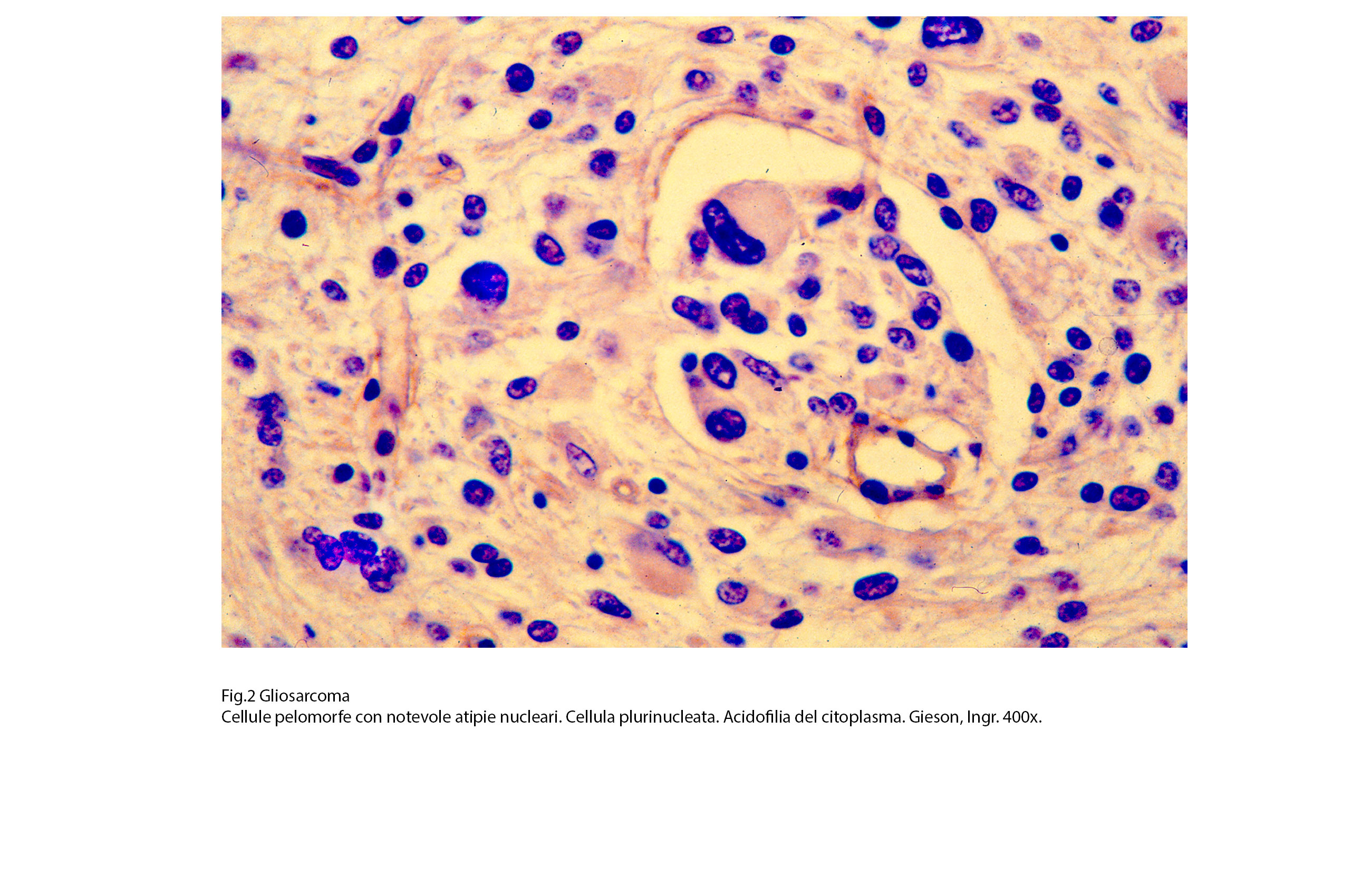 Fig.2bis
Fig.2bis 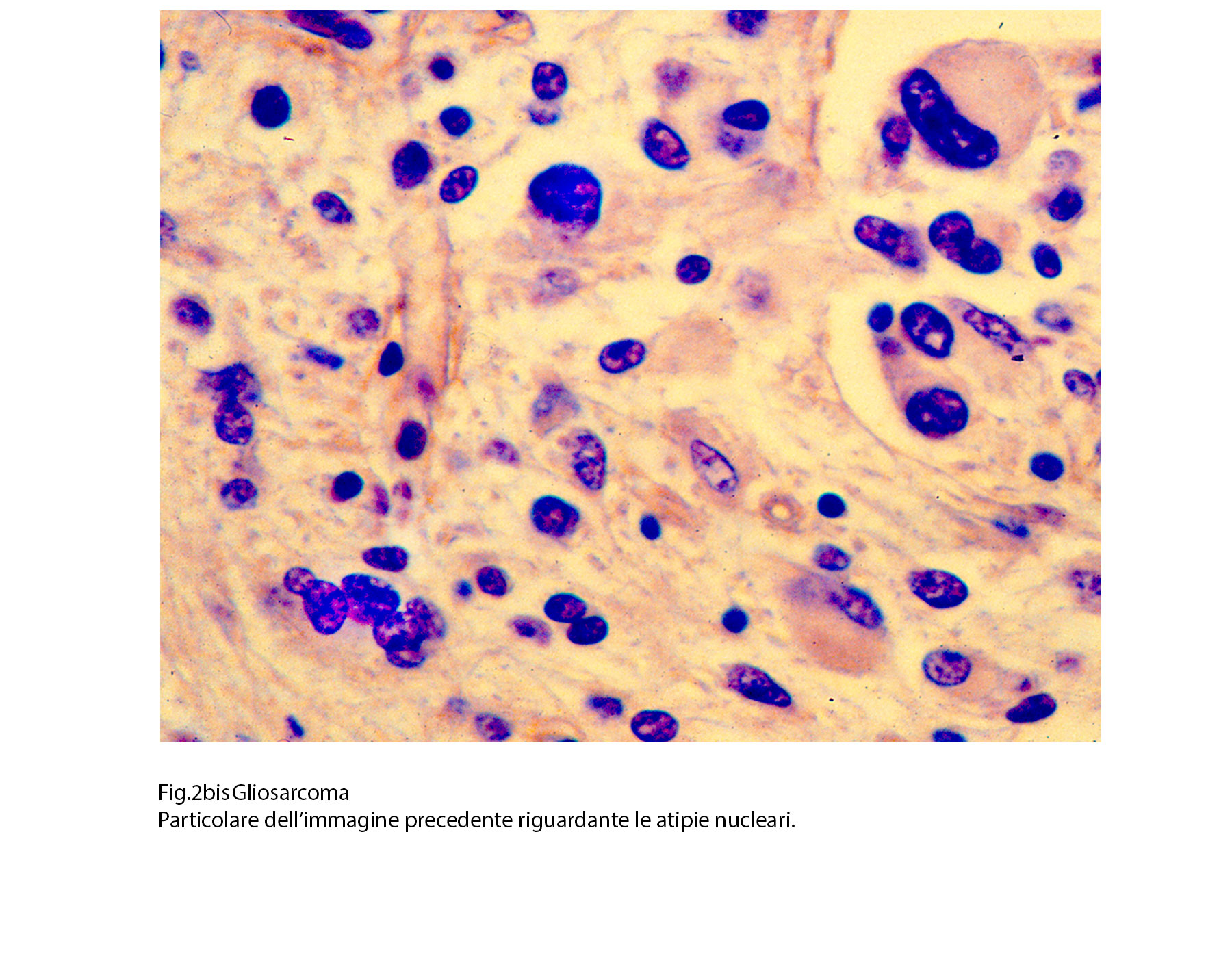
Fig.3 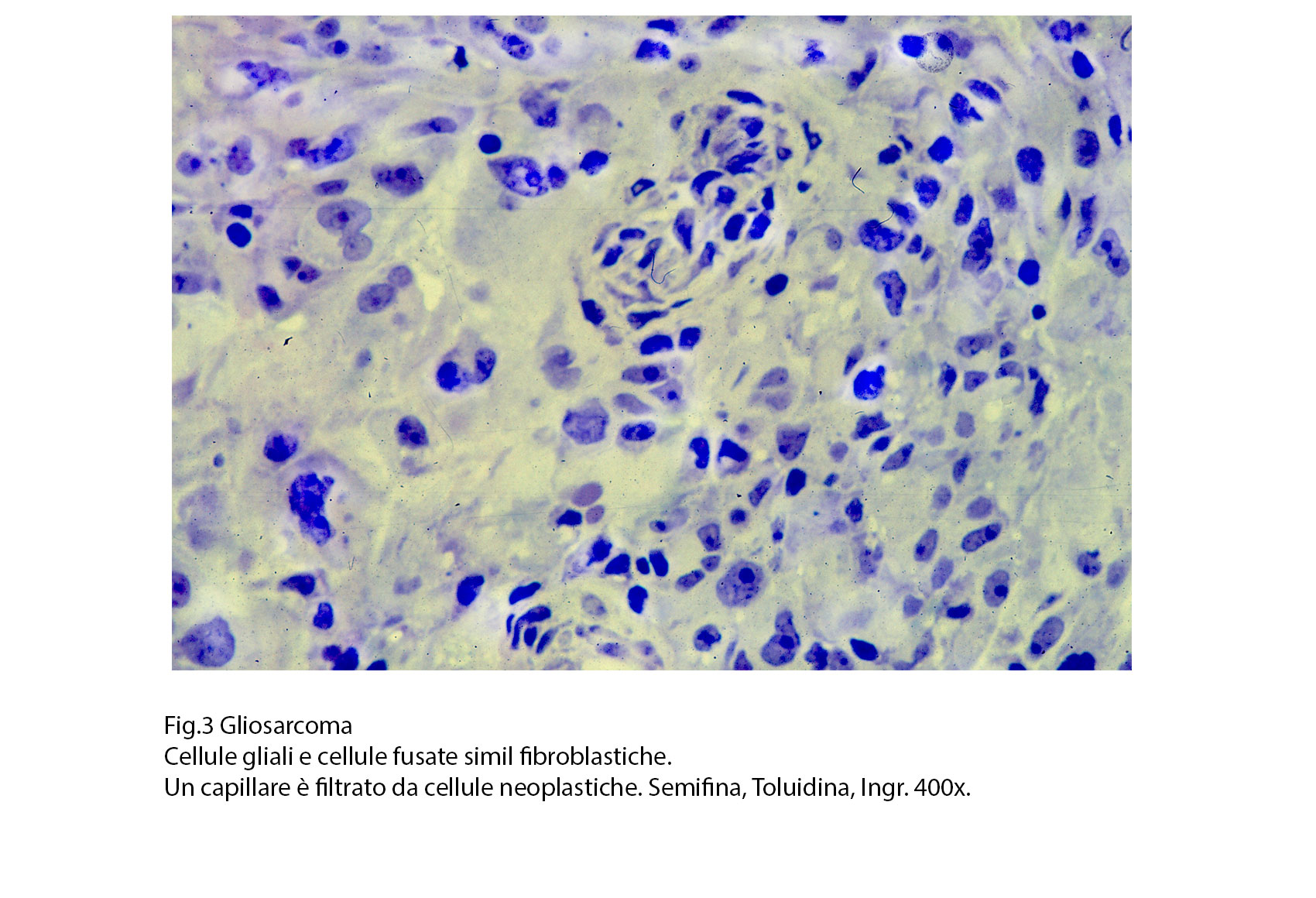 Fig.3bis
Fig.3bis 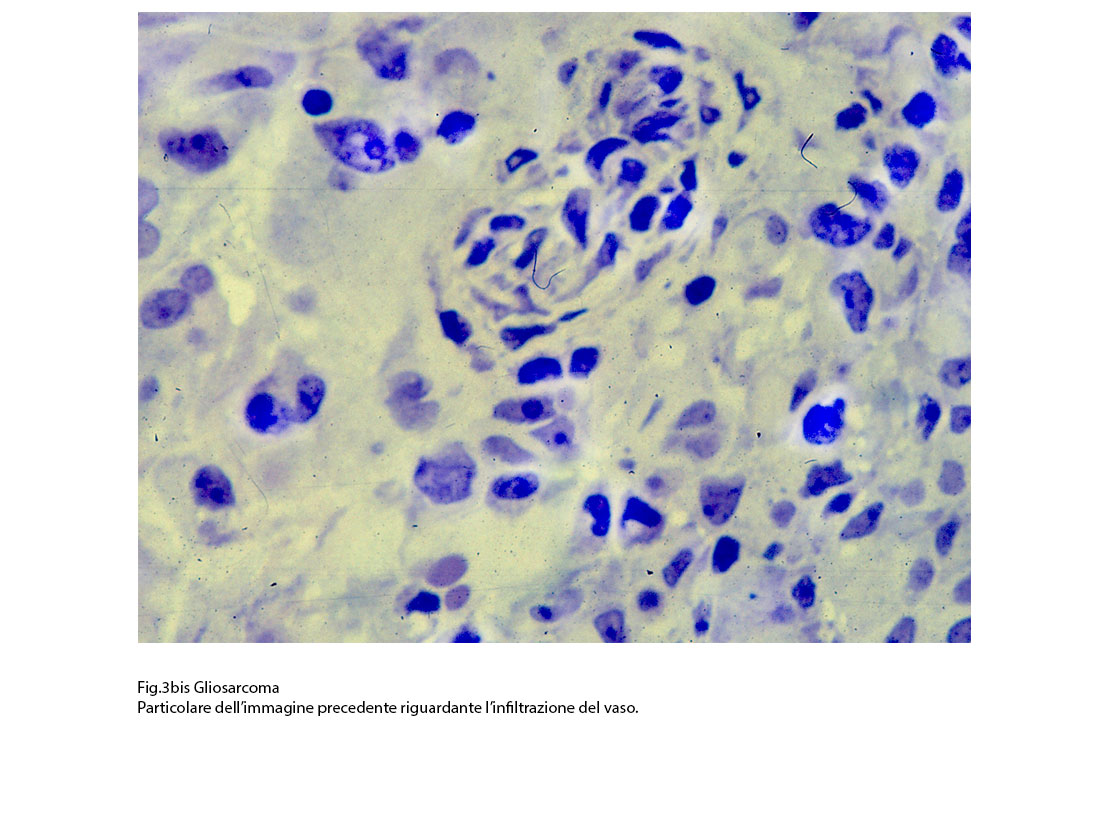 Fig.4
Fig.4 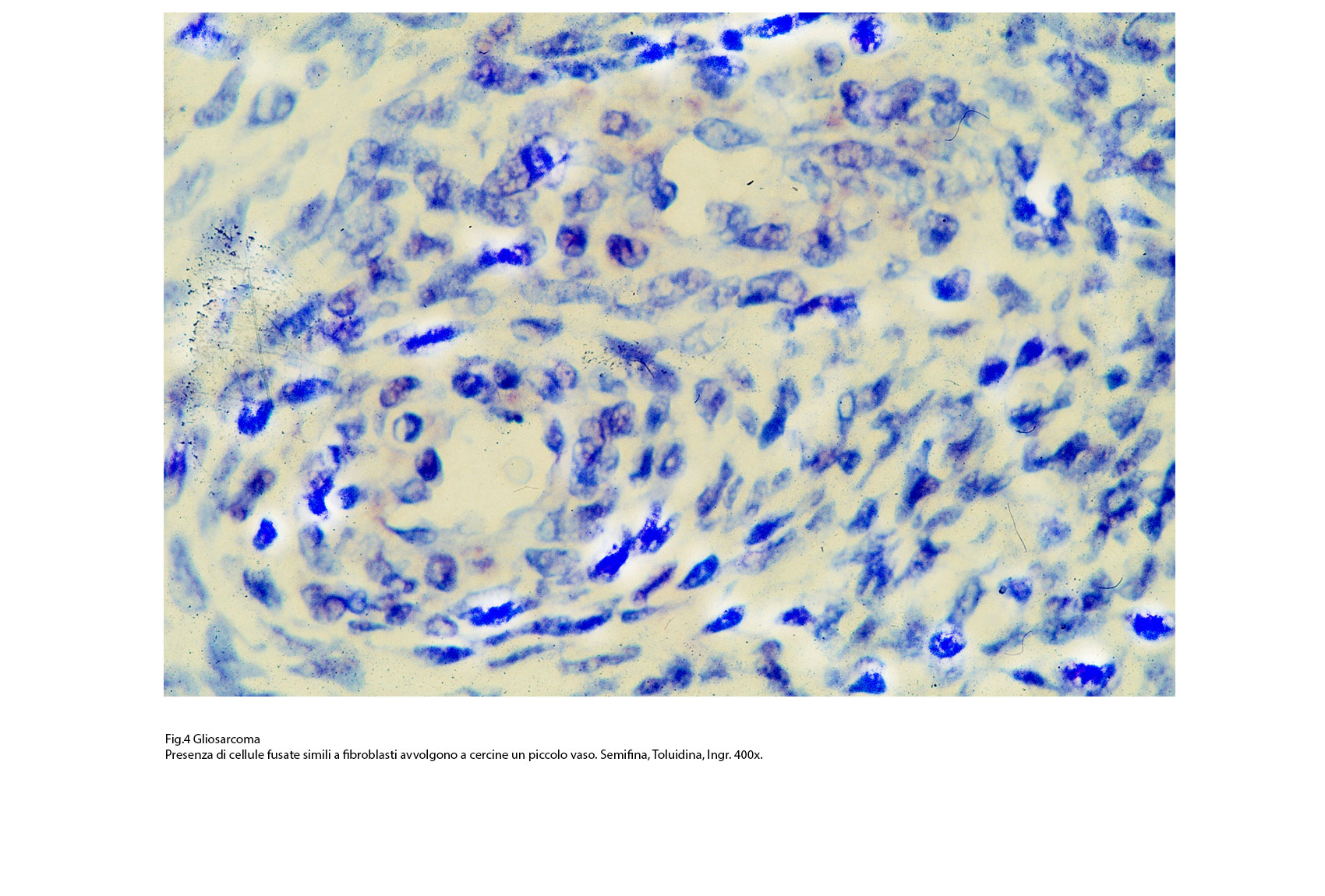
Fig.4bis 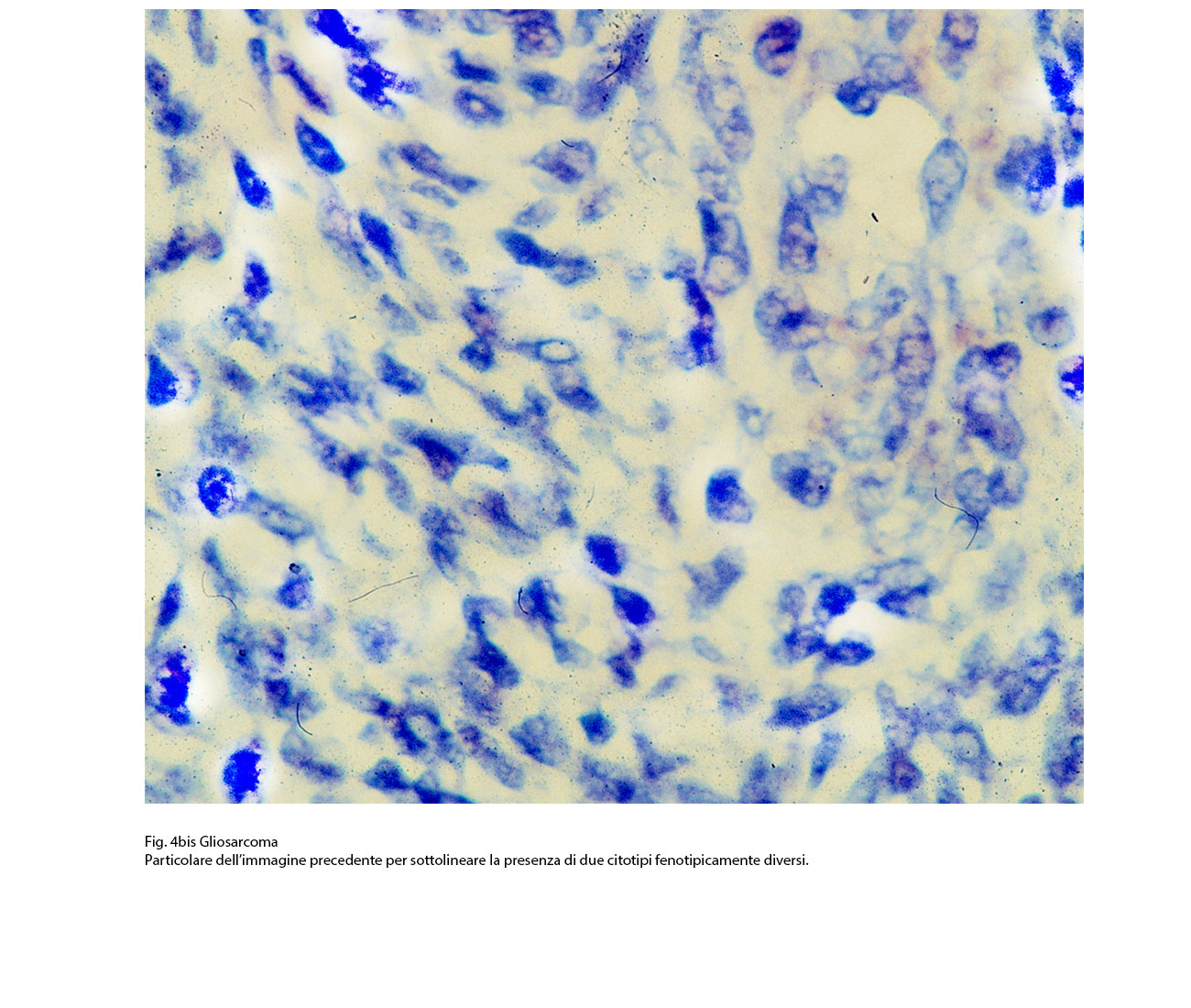 Fig.5
Fig.5 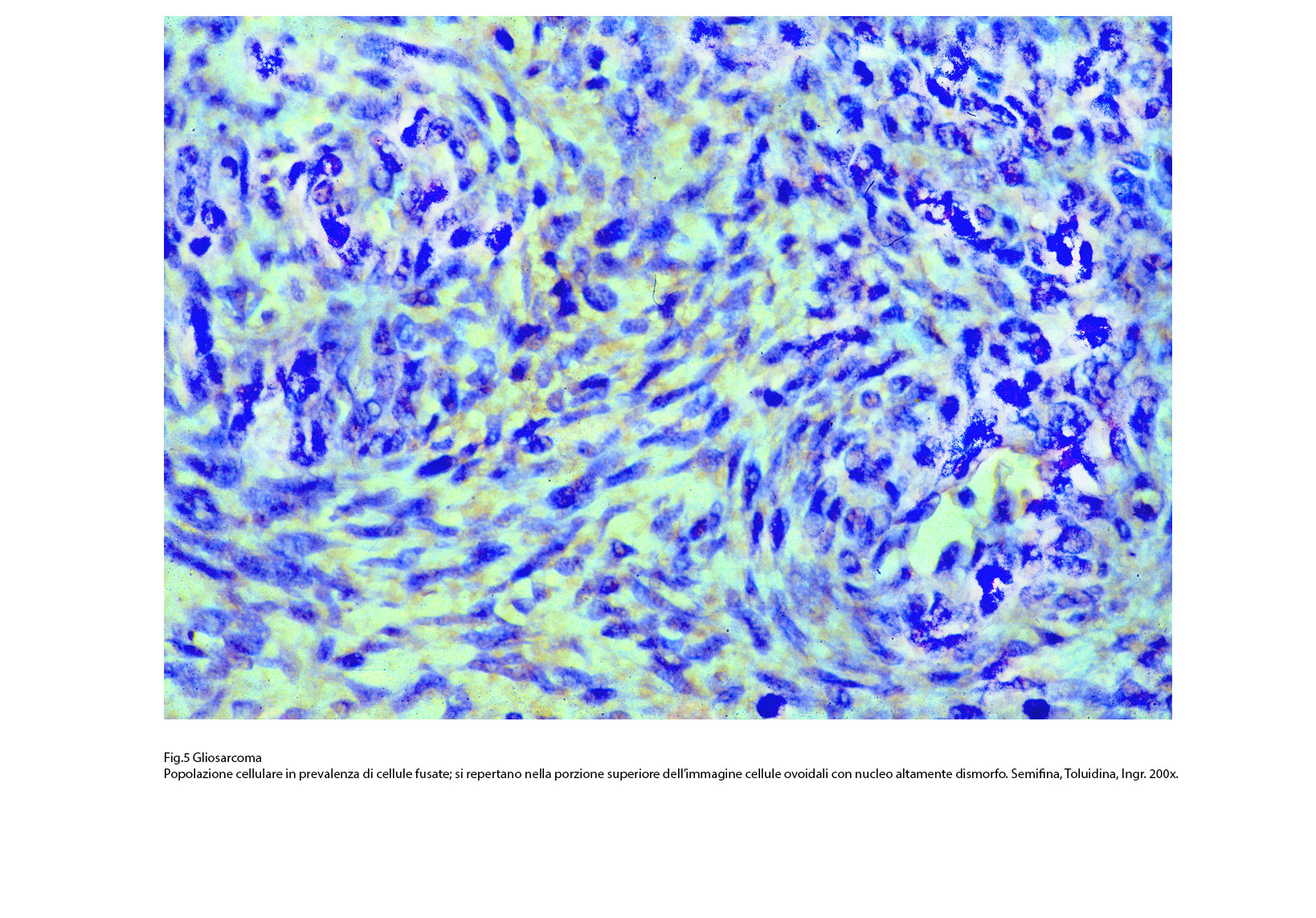 Fig.5bis
Fig.5bis 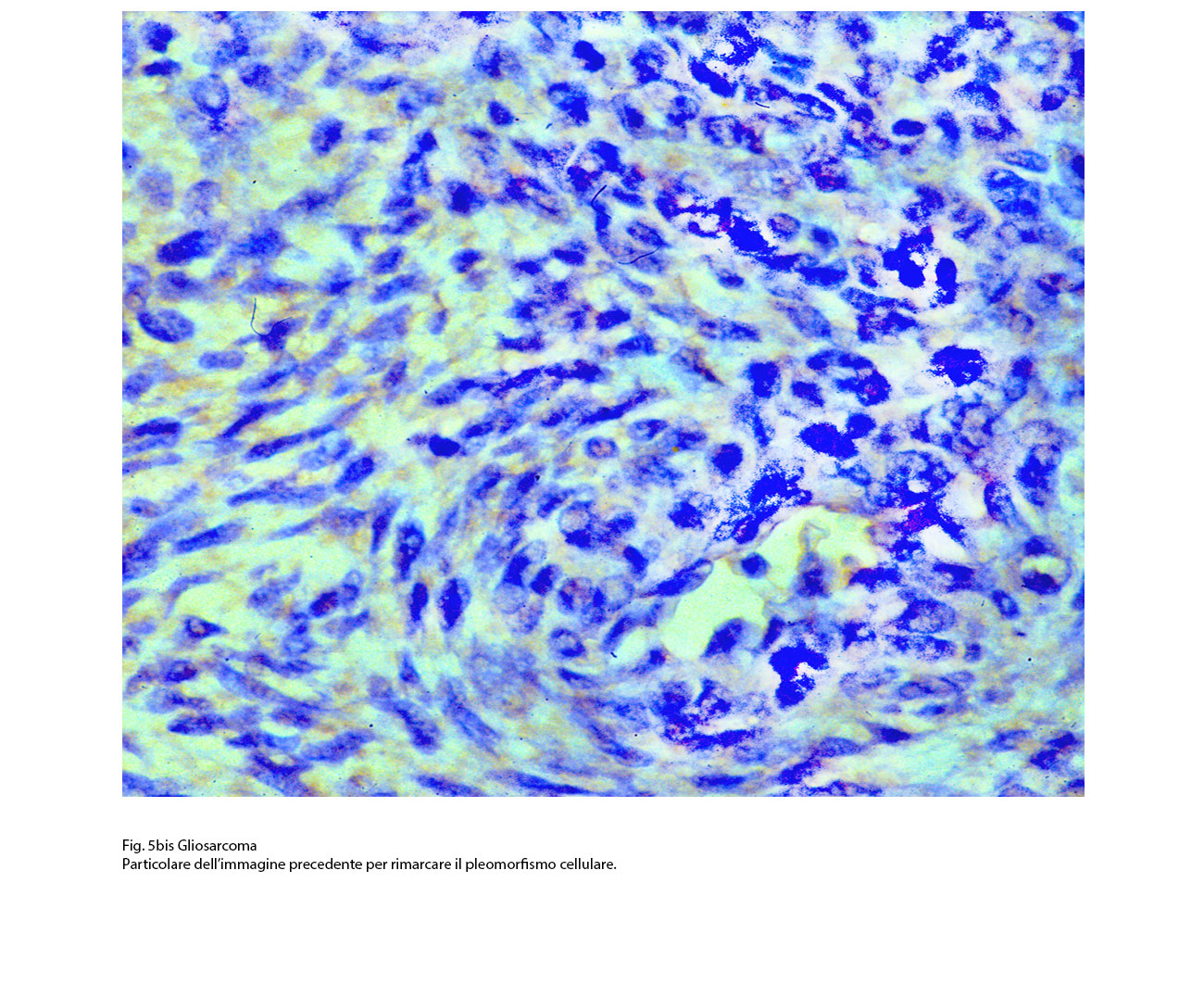
Fig.6 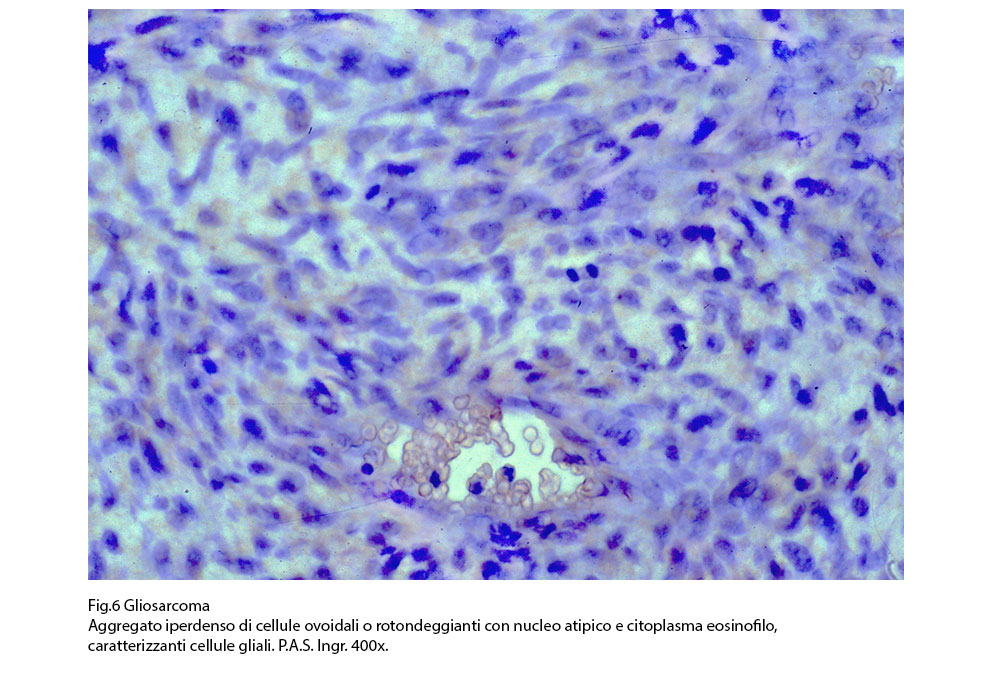 Fig.7
Fig.7 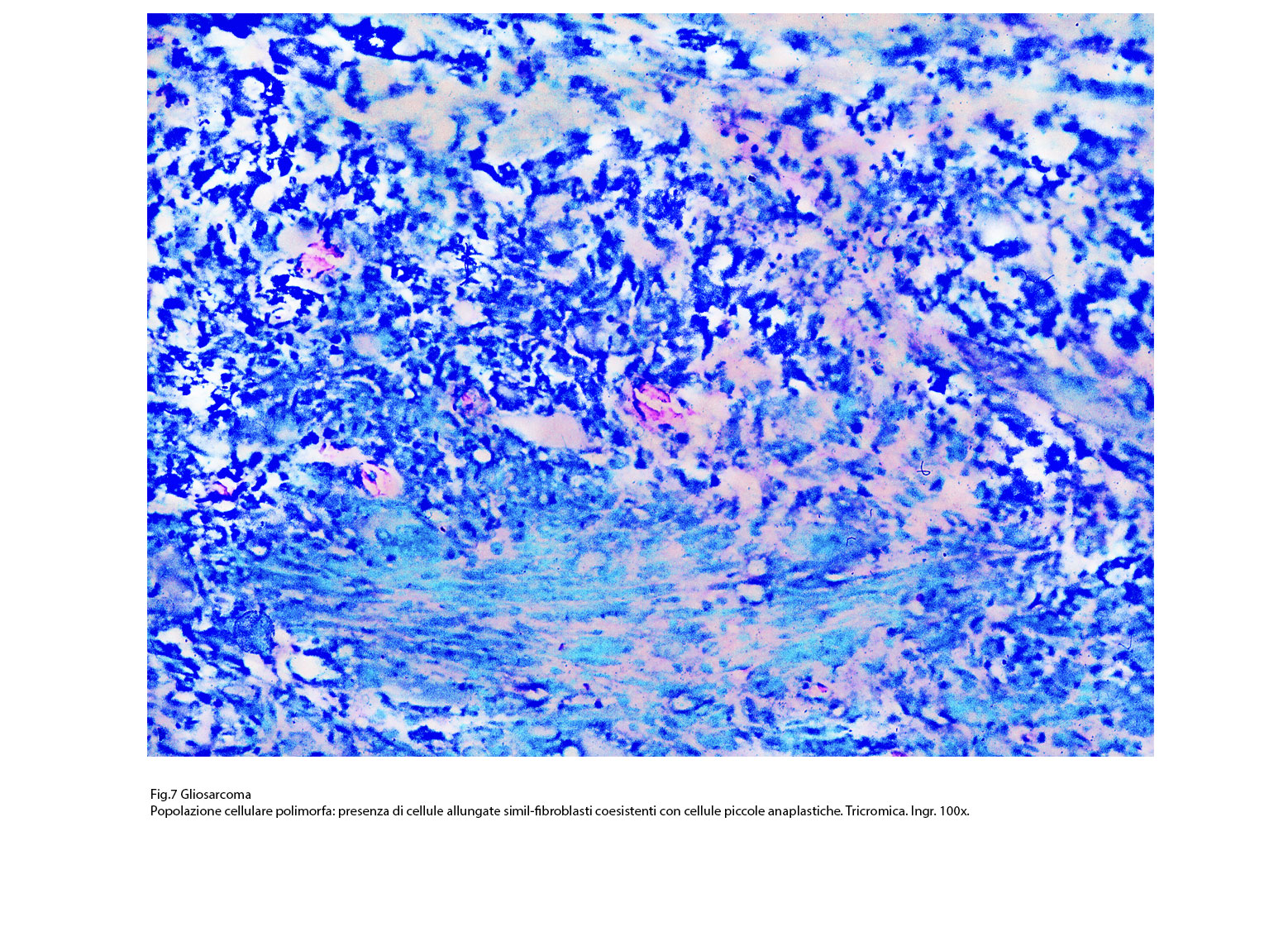 Fig.7bis
Fig.7bis 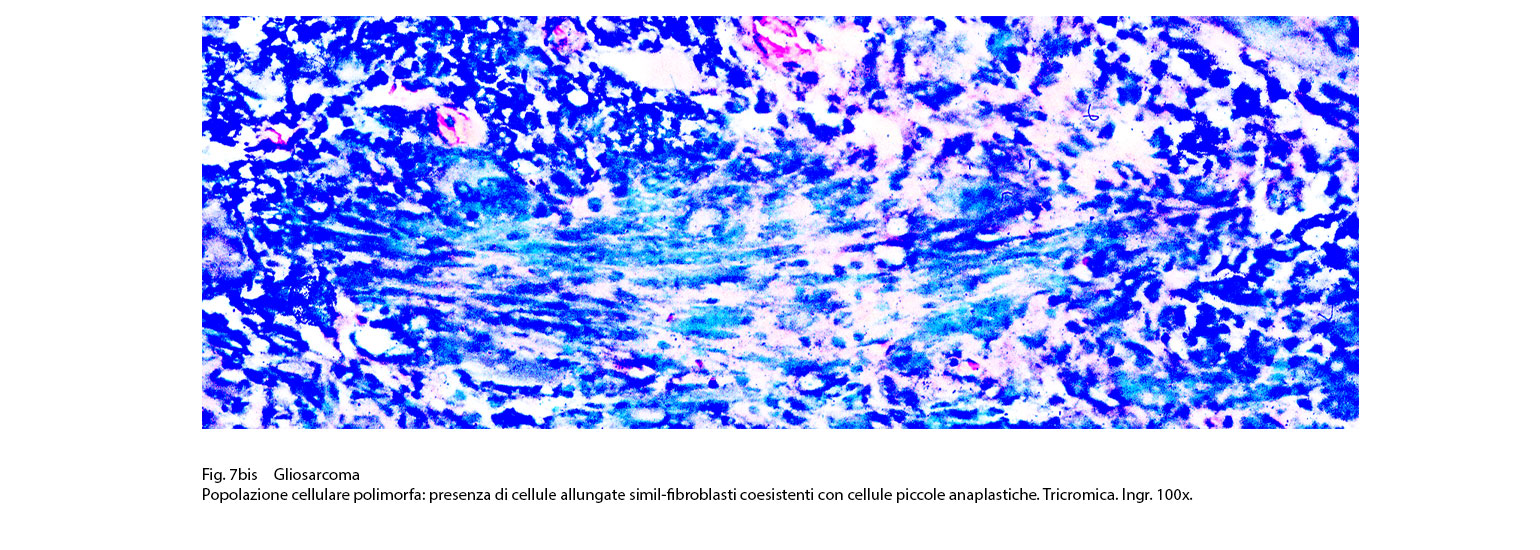
Fig.8 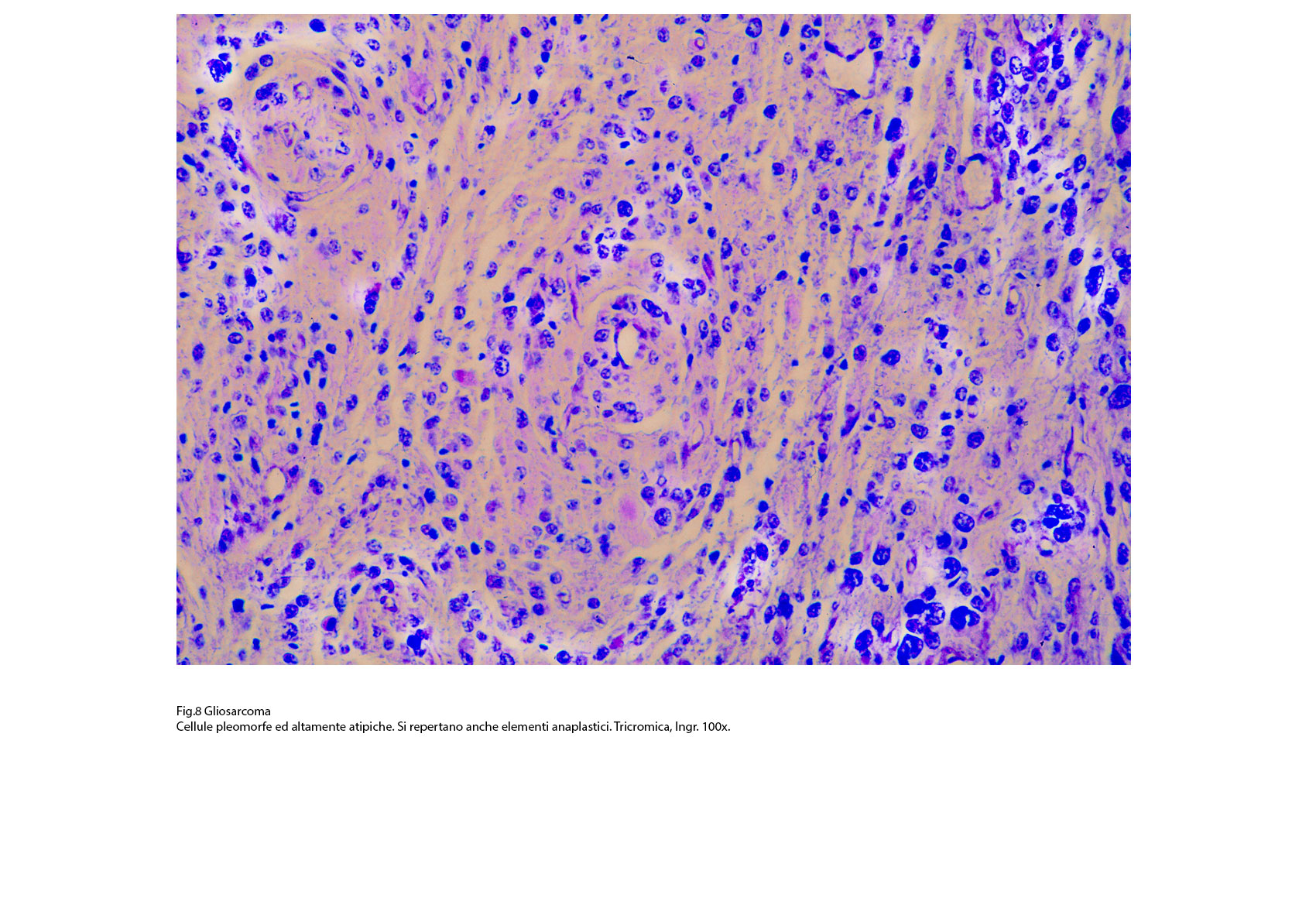 Fig.8bis
Fig.8bis 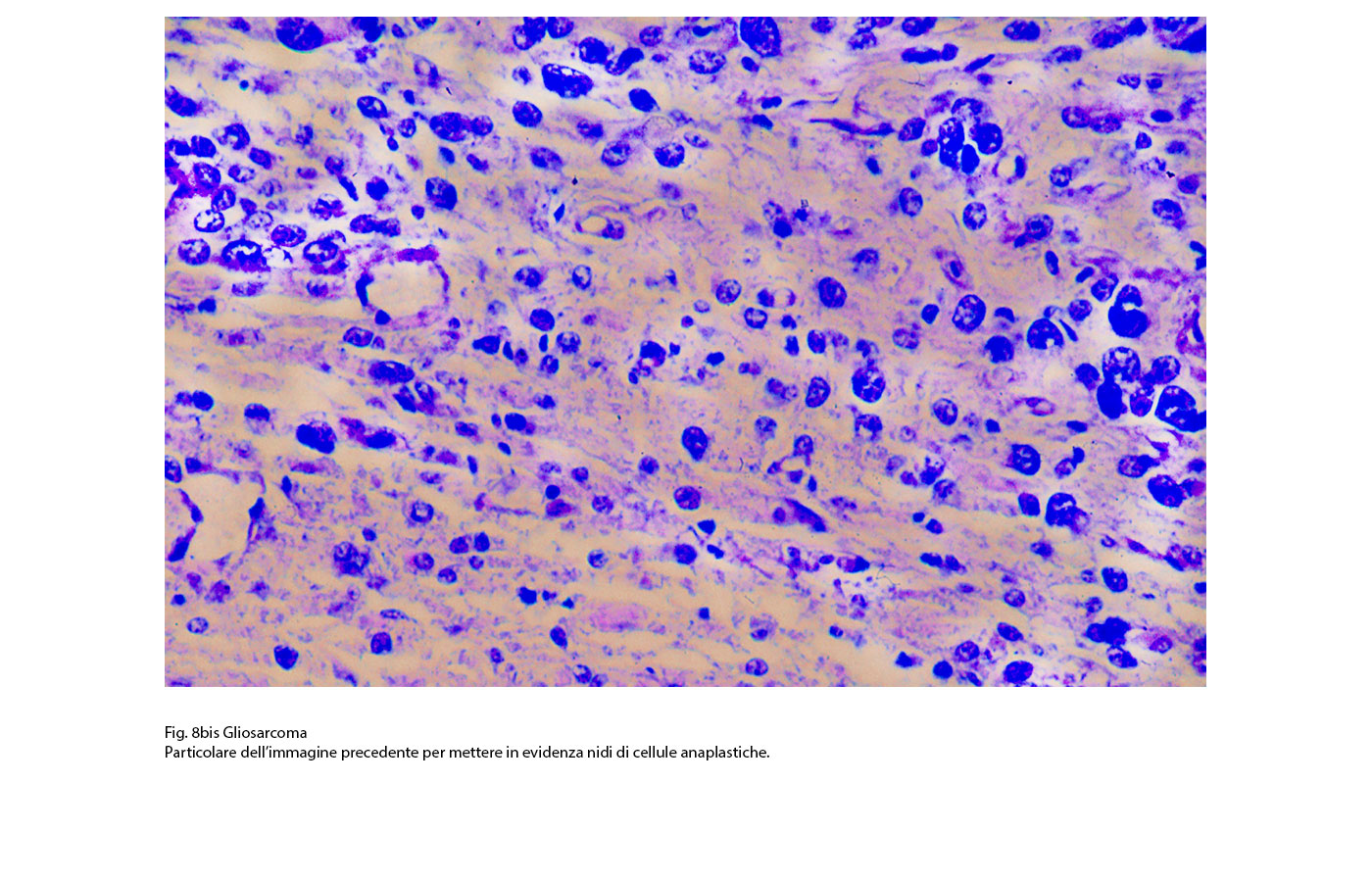 Fig.9
Fig.9 
Fig.9bis 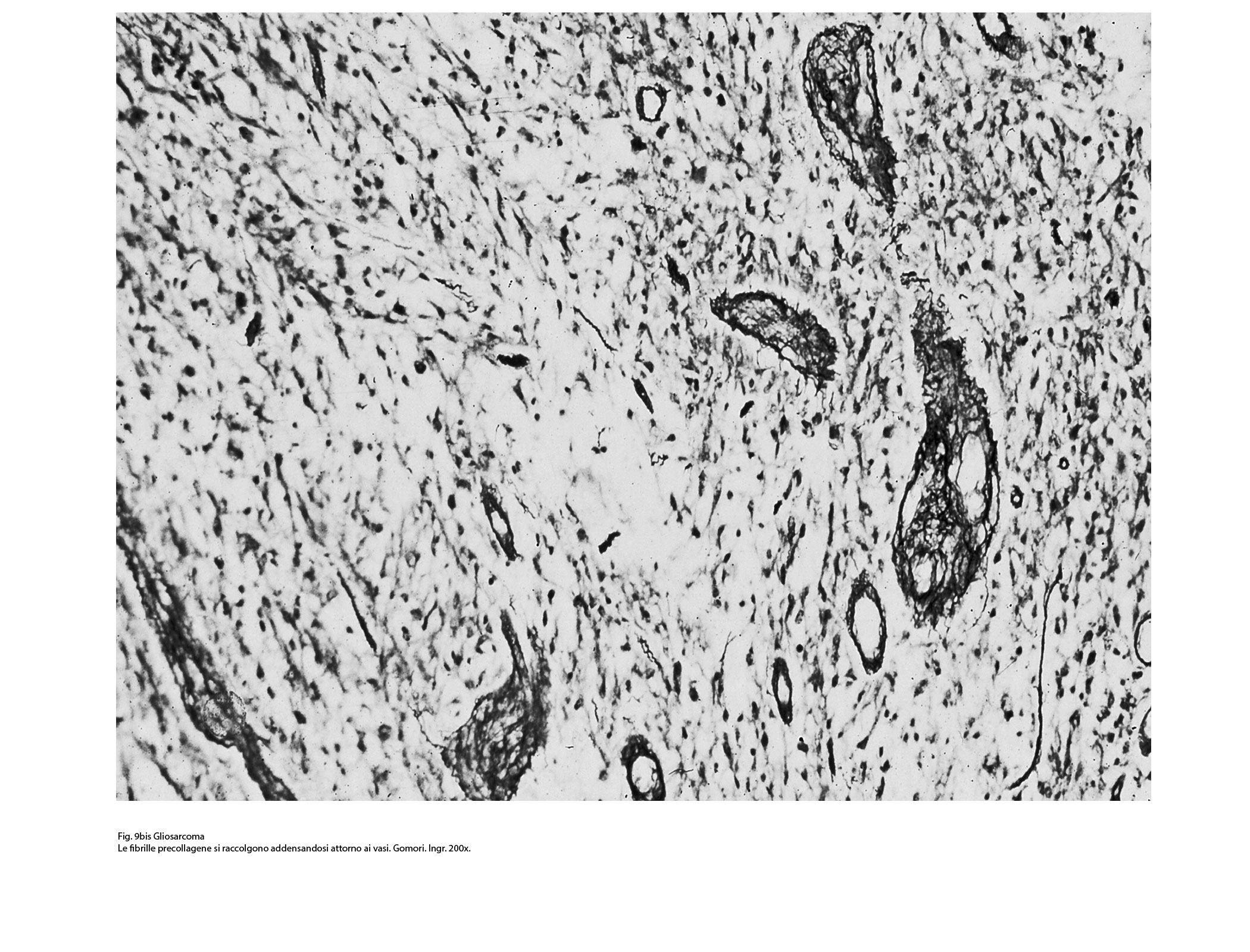
Questo quadro morfologico, considerato come primitivo può essere profondamente modificato per il sovrapporsi di eventi secondari quali necrosi, emorragia, edema, flogodi di varia entità. Il profilo immunoistochimico si rivela diverso a seconda delle quote tissutali sottoposte a marcatura antigenica. La componente a cellule gliali evidenzia, pur tenendo di conto i livelli di differenziazione, una diffusa immunoespressività per la proteina GFAP, per la proteina S-100 e solo zonalmente per la Vimentina.
Fig.10 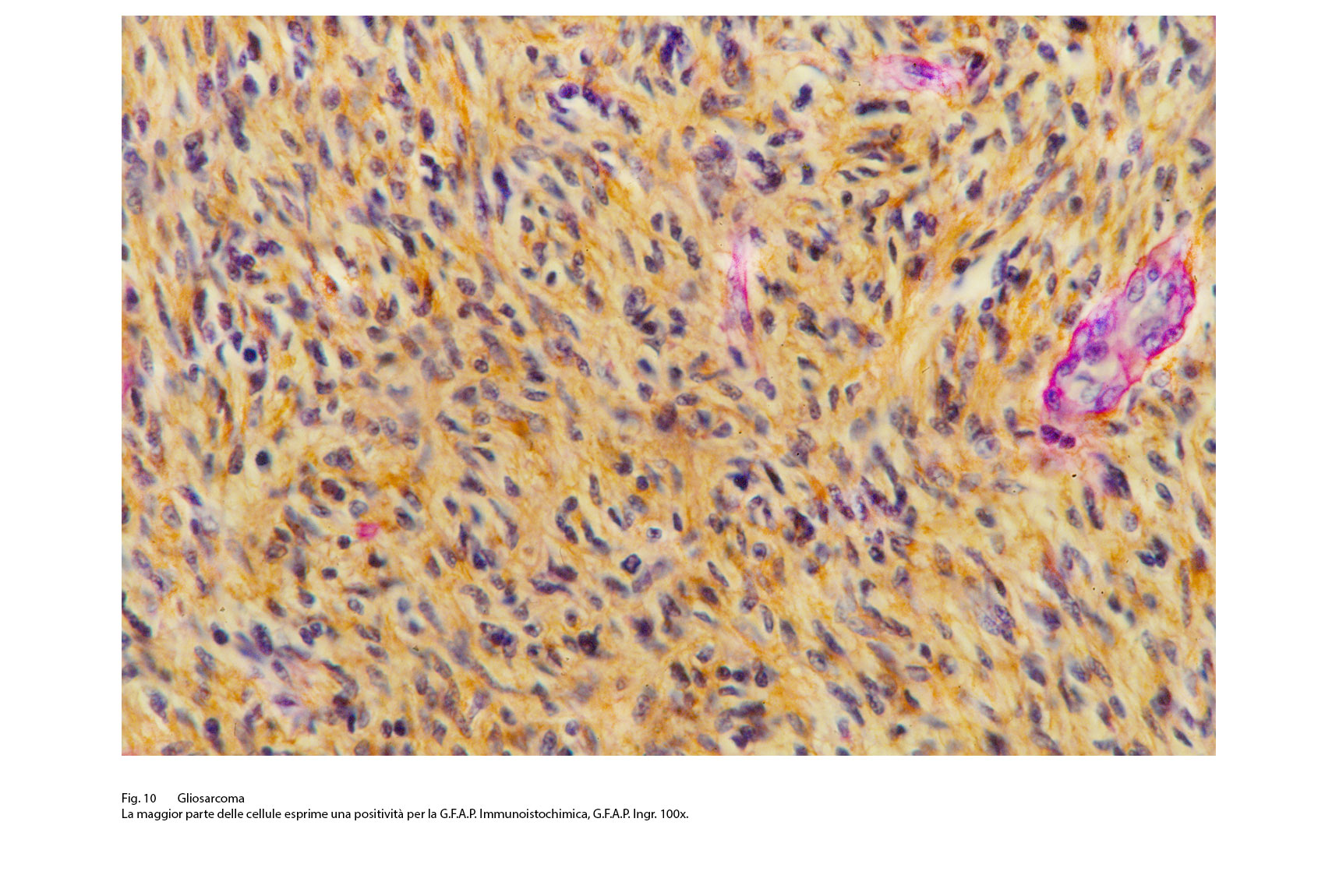 Fig.11
Fig.11 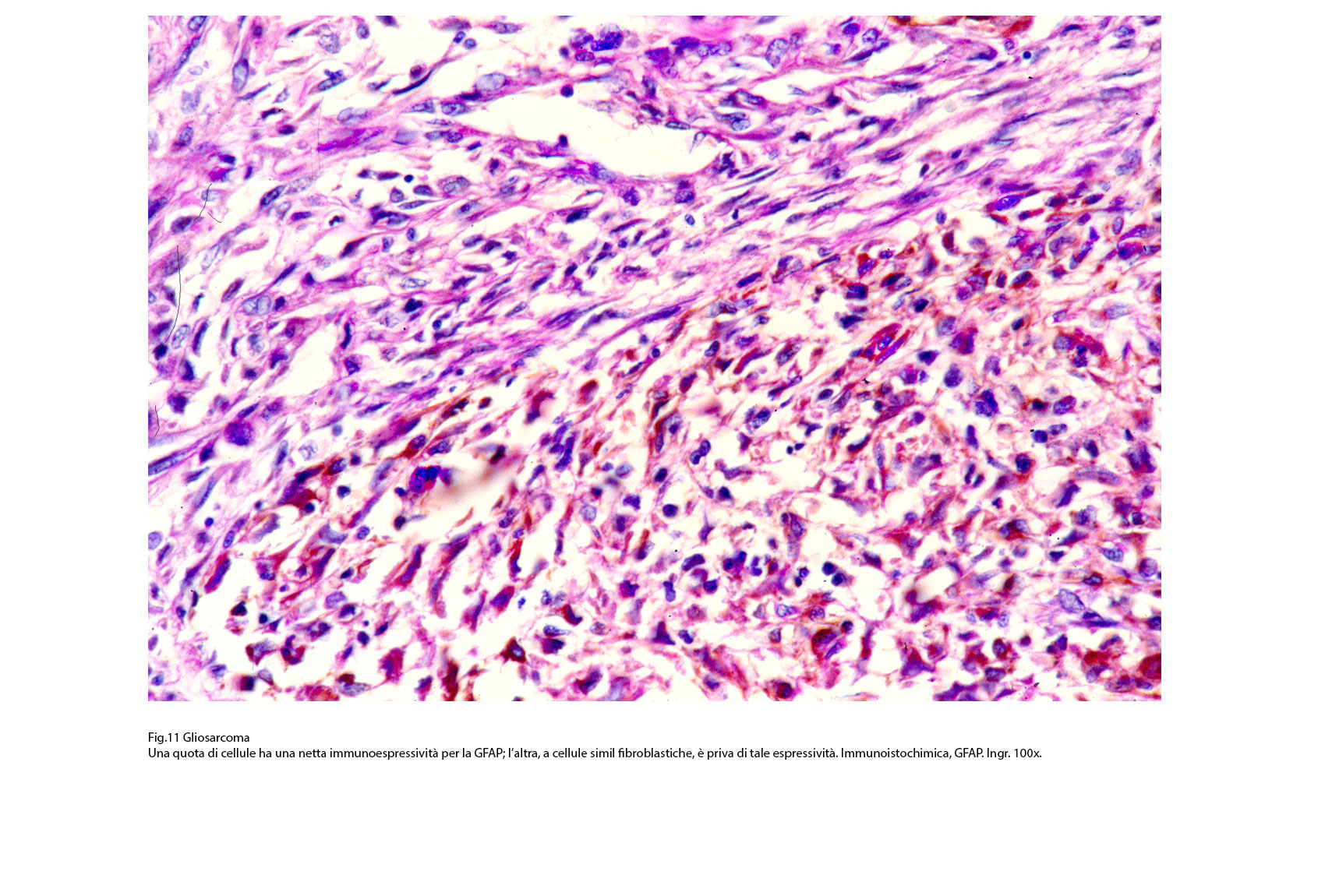
La componente fenotipicamente mesenchimale esprime una risposta immunologica che è coerente con il listotipo derivante dal processo metaplasico.
Così, per portare degli esempi, se sono presenti elementi riferibili al fibrosarcoma si evidenzia una immunoespressività per la fibronectina; se si repertano aree con cellule simil-muscolari si riscontra una immunopositività per la desmina, la mioglobina, la miogenina. Se il processo di mataplasia è orientato a produrre elementi epitelio-simili si può rilevare una espressività immunologica per le citocheratine a basso peso molecolare. Se si applica il metodo della doppia marcatura su la stessa sezione ottenuta dal microtomo si ottiene una doppia positività, e ciascuna di esse è correlata al citotipo ivi presente.
Fig.12 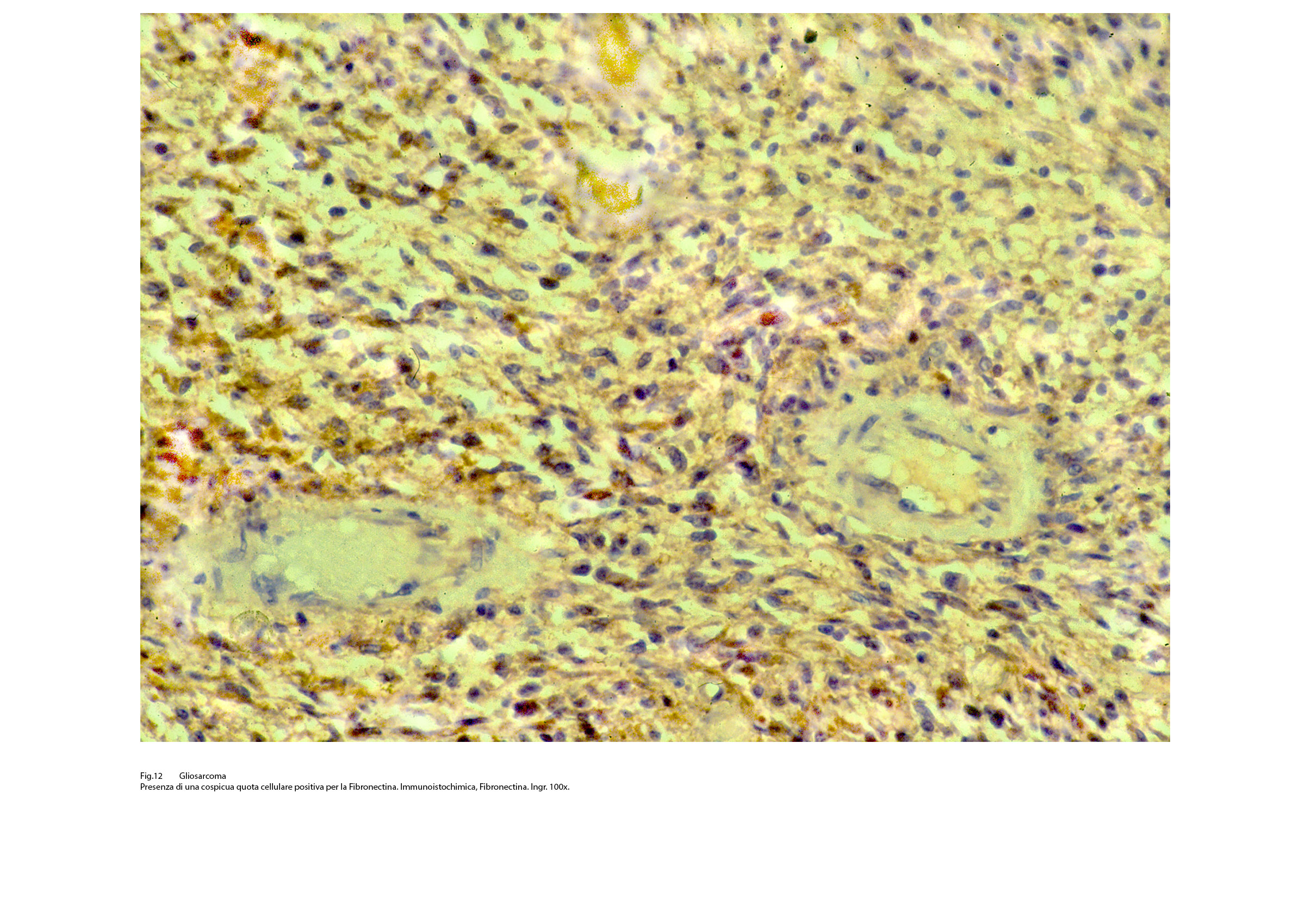 Fig.13
Fig.13 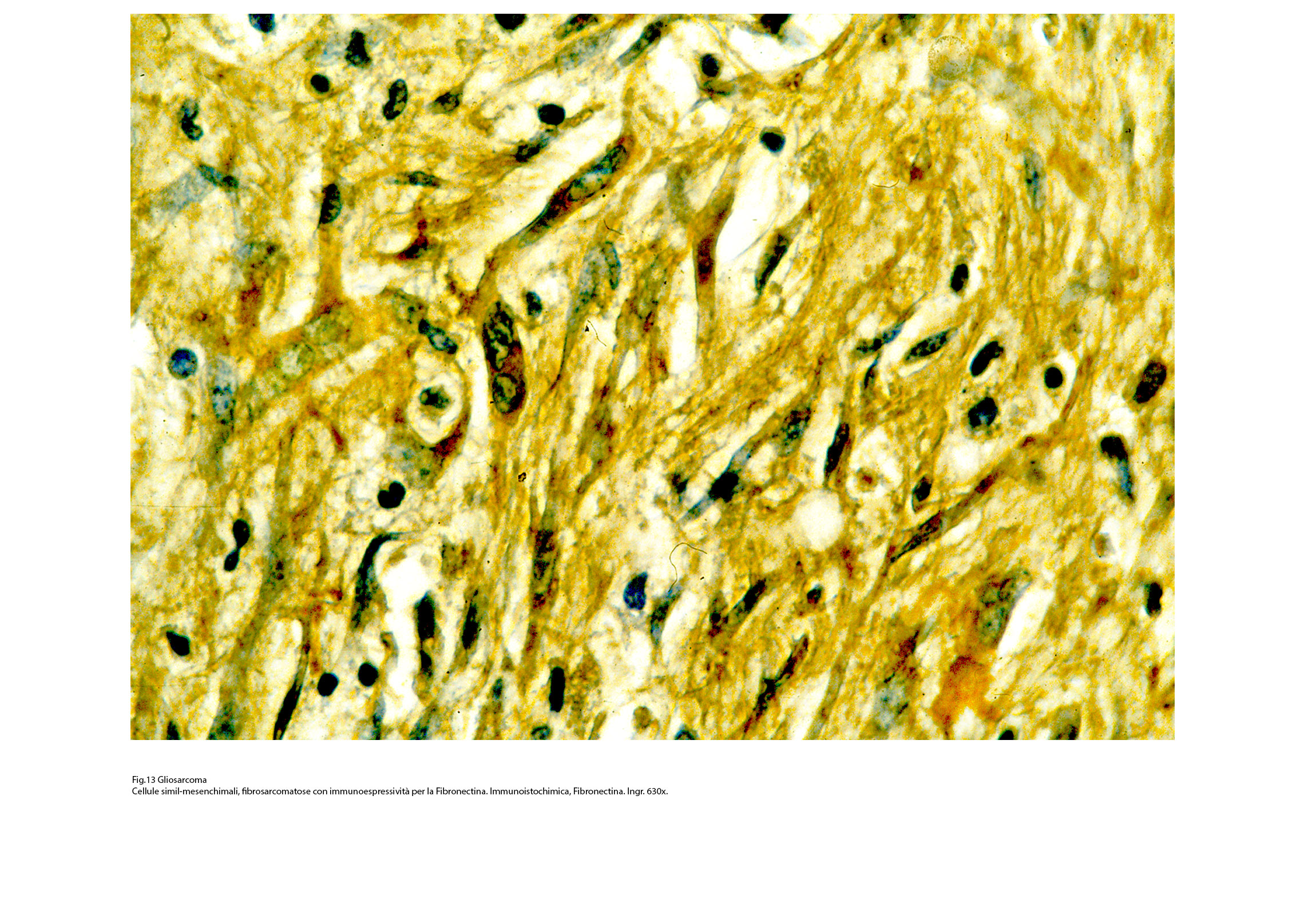 Fig.14
Fig.14 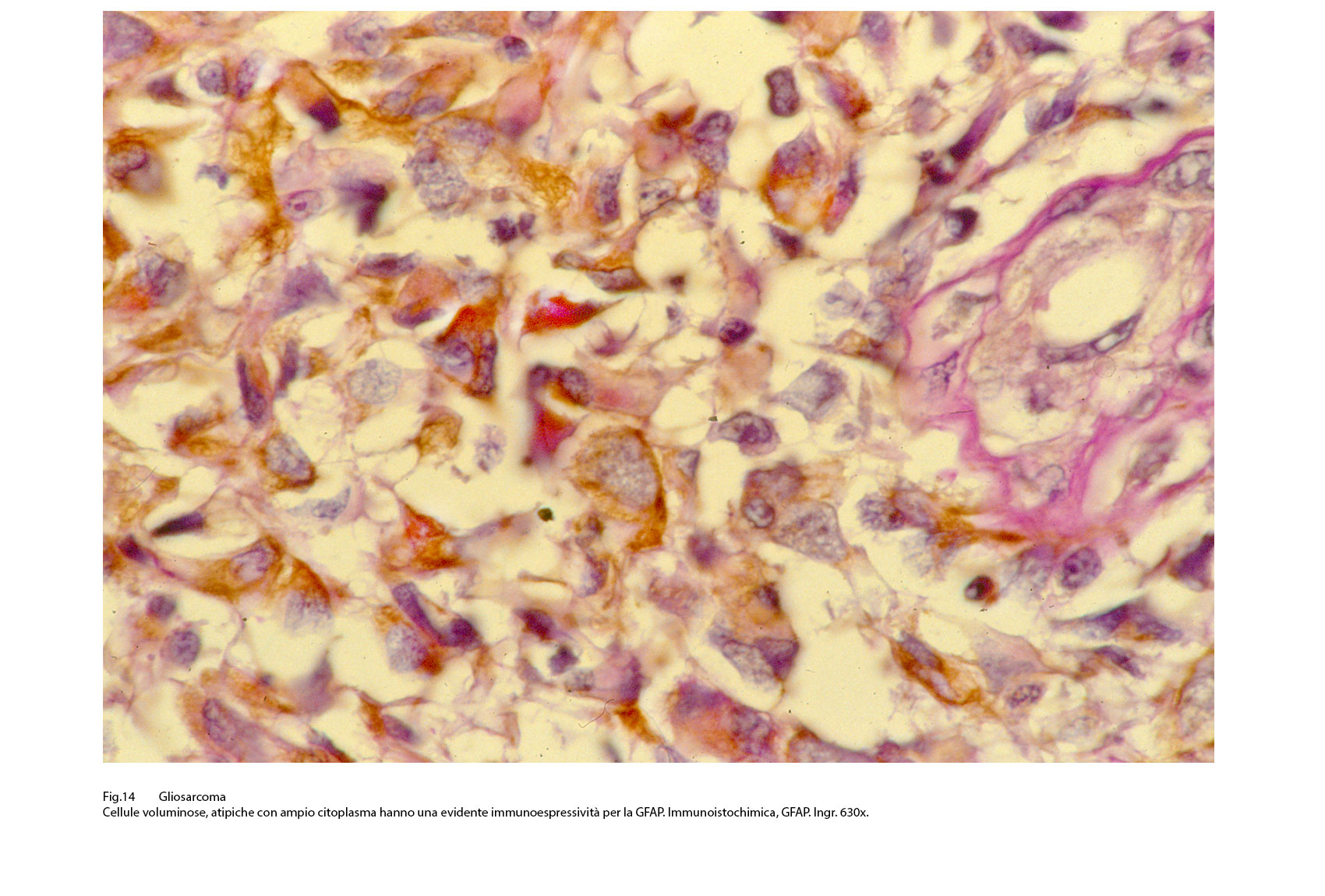
Fig.15 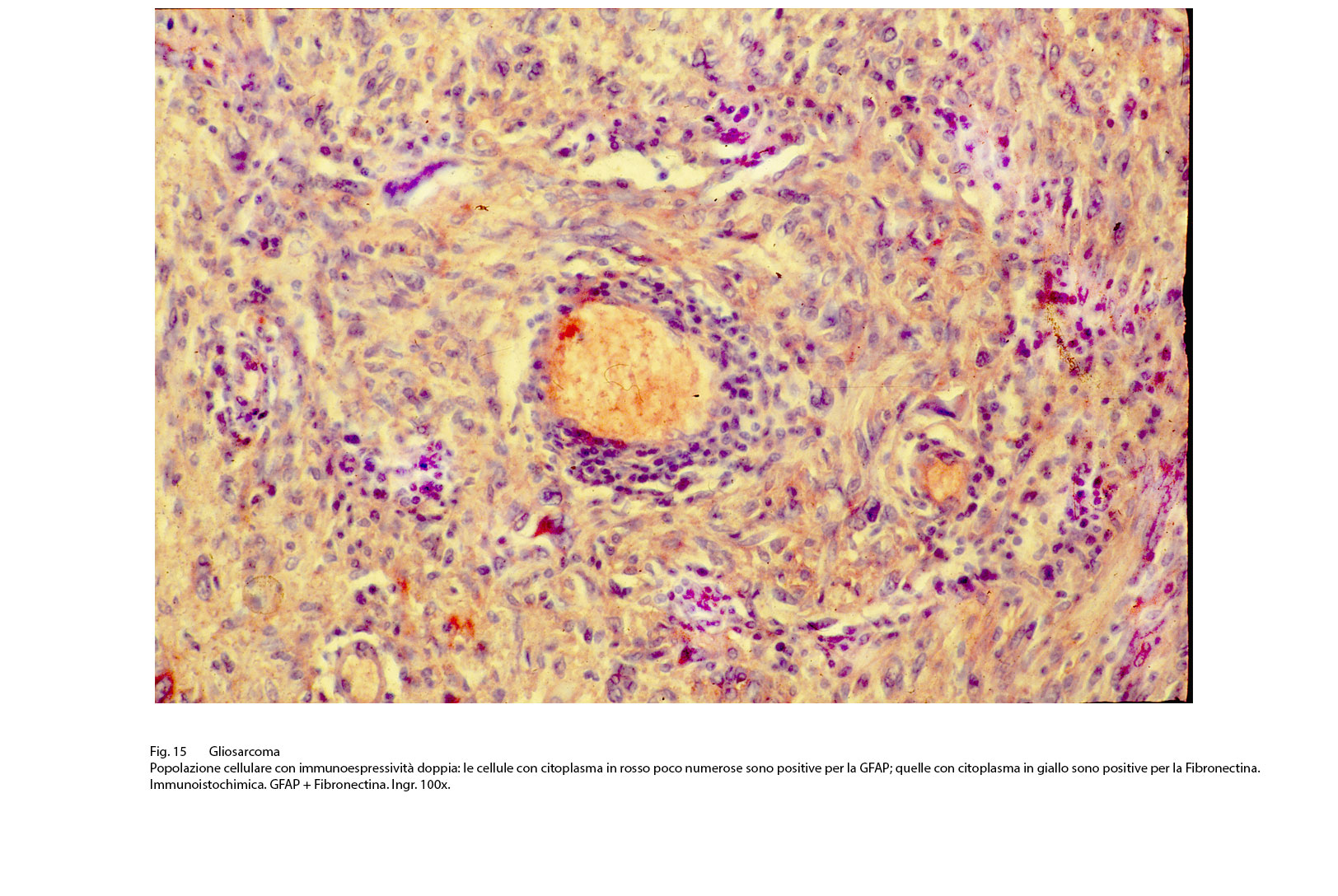 Fig.16
Fig.16 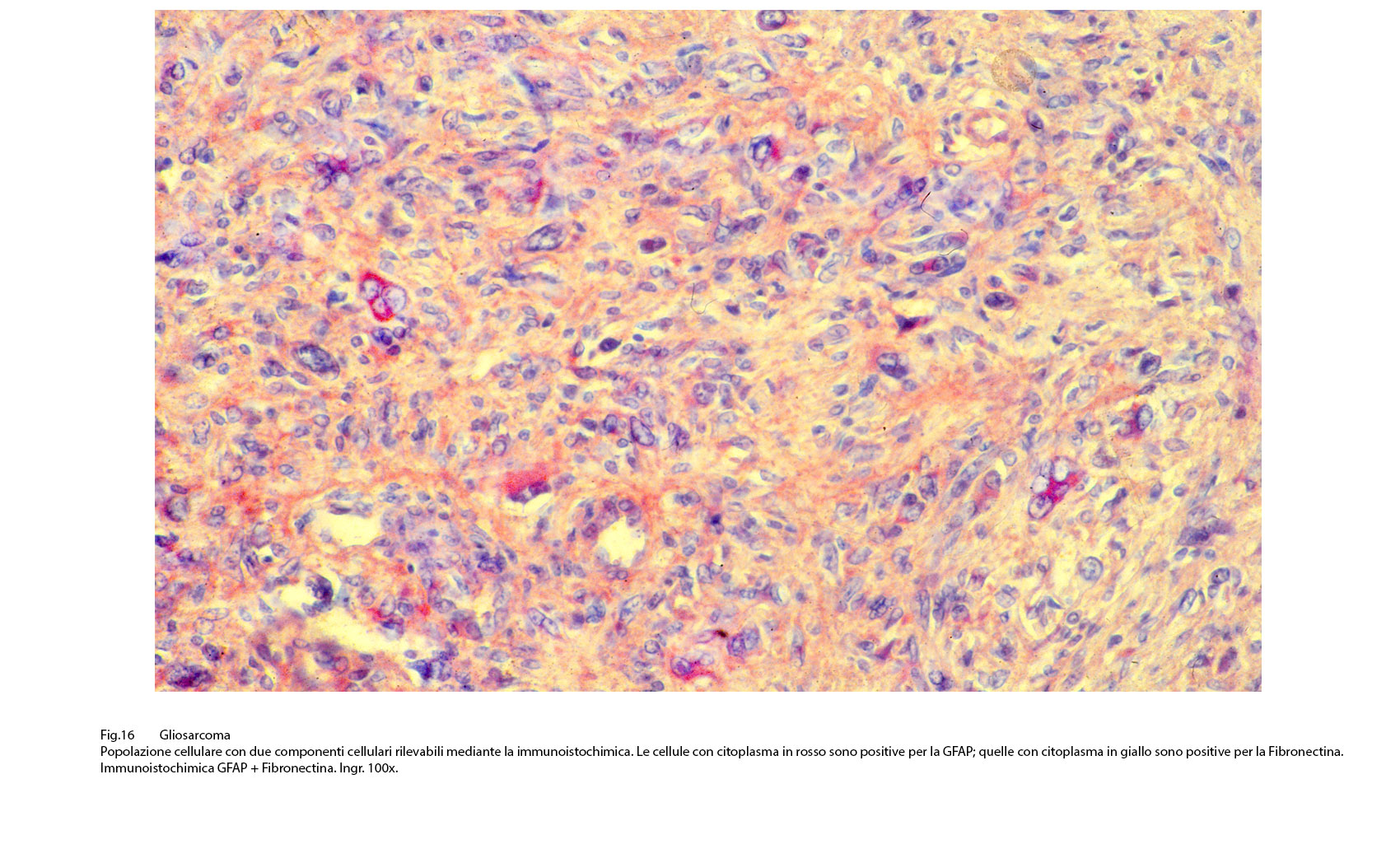 Fig.17
Fig.17 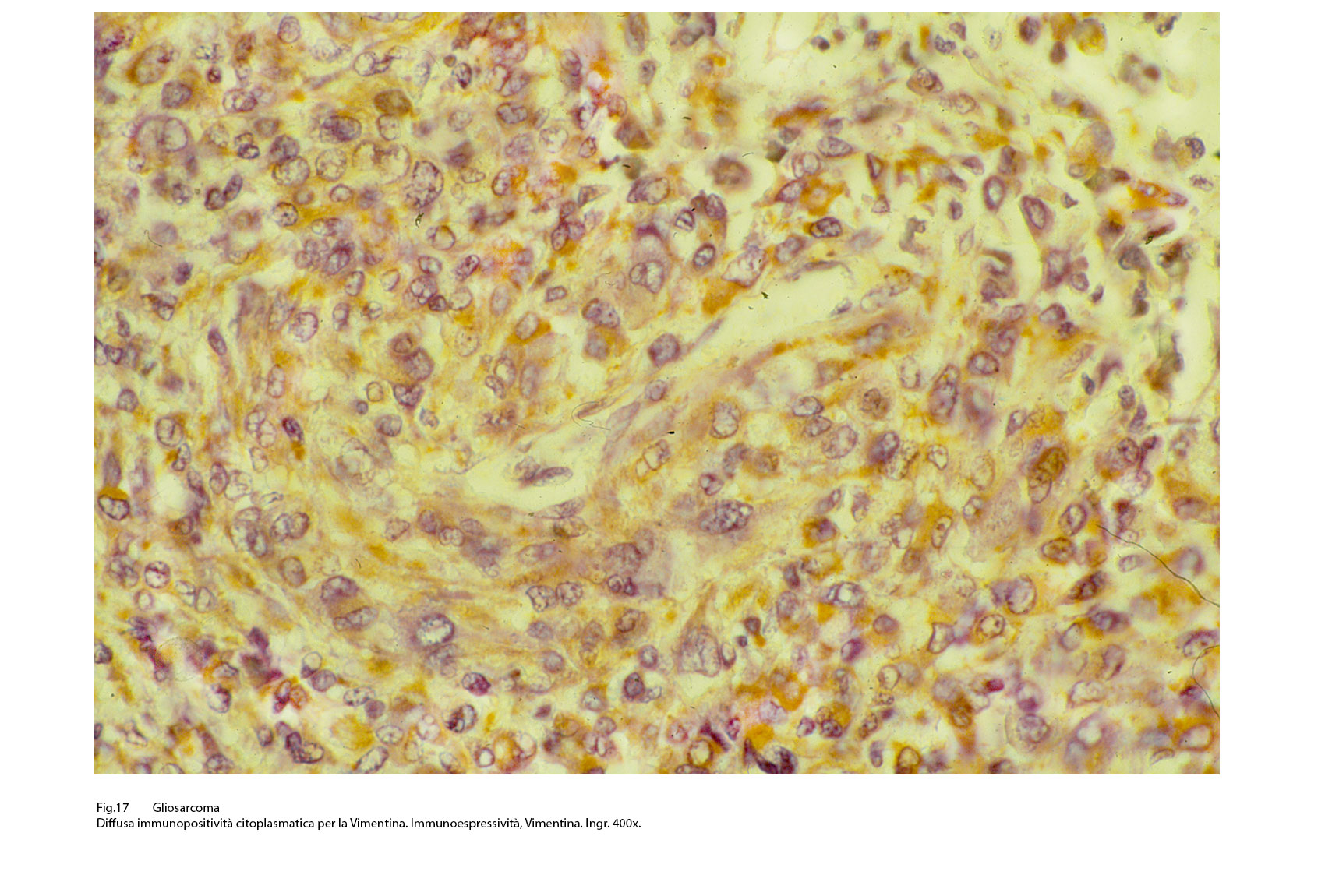
Fig.18 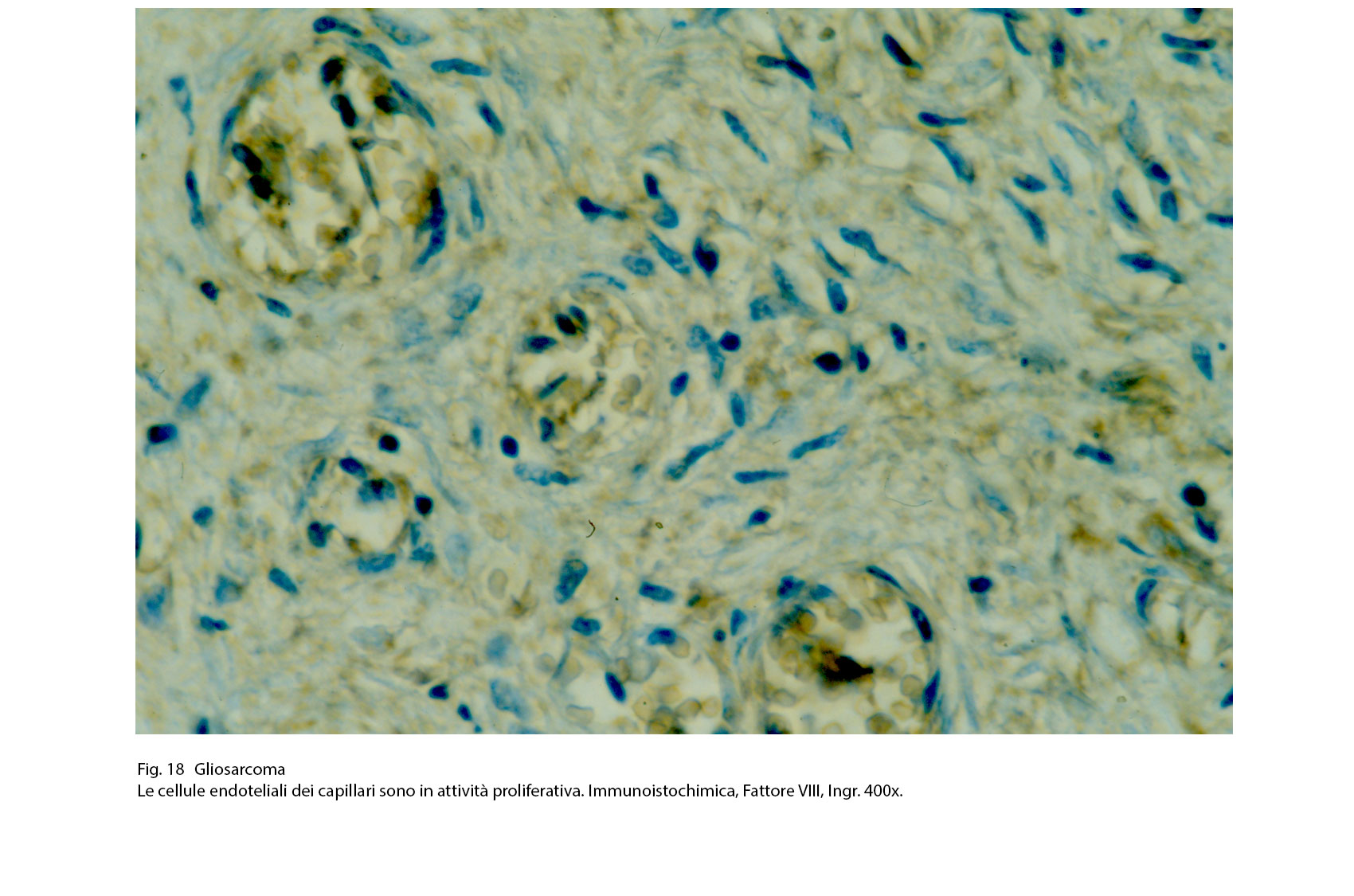 Fig.19
Fig.19 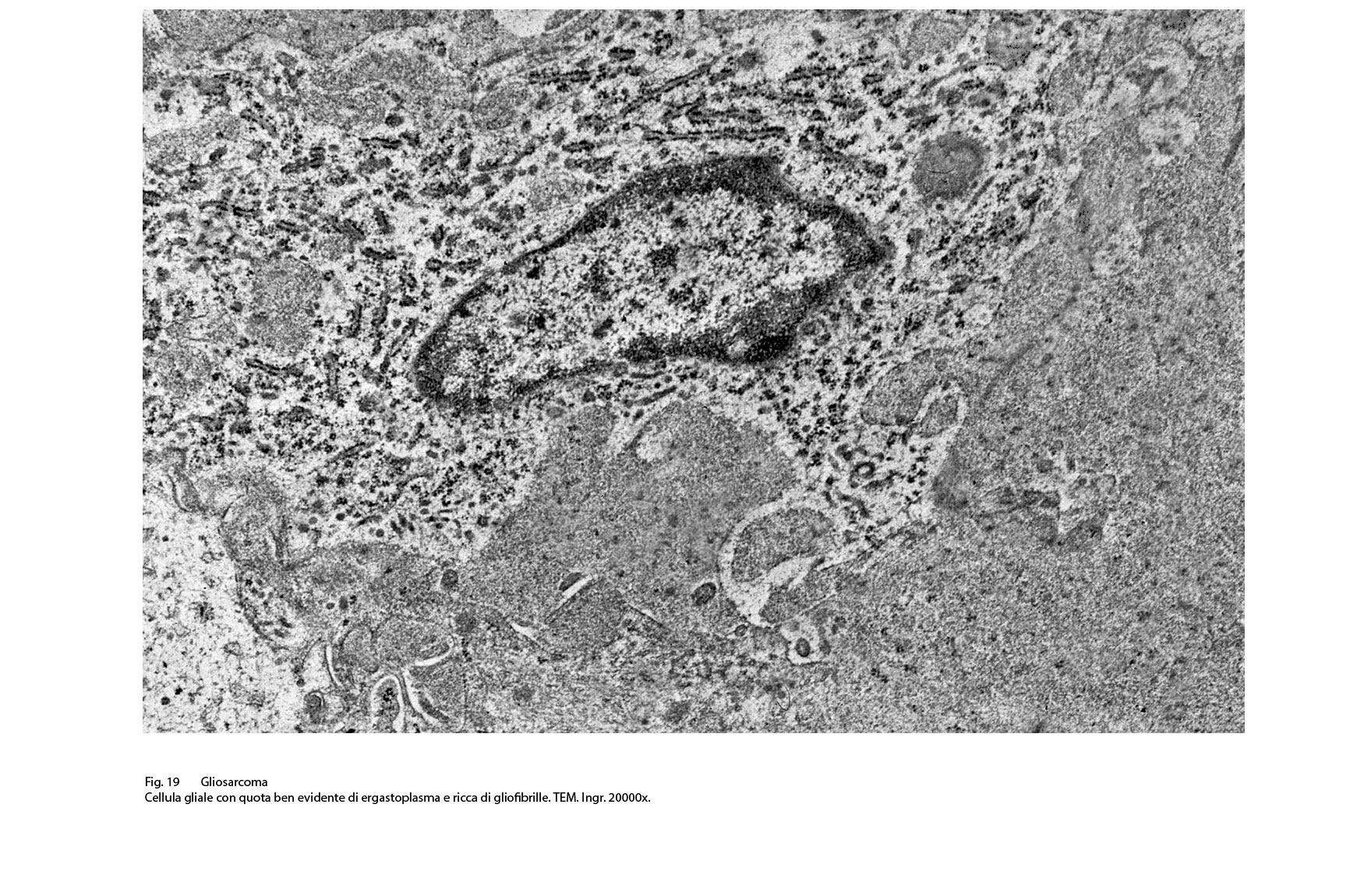 Fig.19bis
Fig.19bis 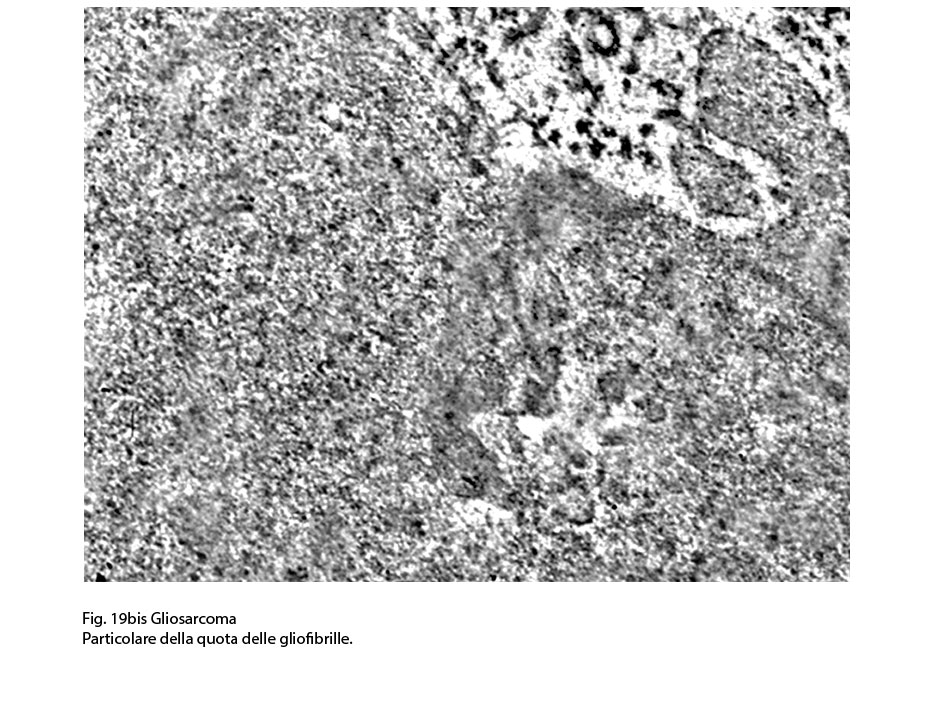
In sintesi, è possibile affermare che si rilevano tante espressività immunoistochimiche in senso qualitativo e quantitativo quanto sono i numerosi processi metaplasici; in questa valutazione è opportuno tener presente che la risposta immunoistochimica può essere negativa o con basso livello di espressività se le quote cellulari sono anaplastiche e pertanto sono prive di antigeni specifici. L’indice di attività proliferativa viene valutato mediante il grado di espressività del MID-1; in letteratura esso è riportato del 10-30 % a livello della componente gliale e del 60-70 % a livello della componente simil-mesenchimale.
Le indagini genetiche applicate a casi di gliosarcoma hanno documentato le medesime mutazioni sia a carico delle quote gliali sia a carico delle quote simil-mesenchimali. Sono state riportate mutazioni sovrapponibili per la PTEN, la TP53 e in modo infrequente una amplificazione dell’EGFR (W.H.O.). Questi risultati ricalcano quelli ottenibili nei casi di glioblastoma multiforme privo di ogni segno morfologico di varianti. Tali dati consentono di affermare la monoclonalità dei casi di gliosarcoma e il loro riconoscimento nell’alveo dei glioblastomi.
I caratteri ultrastrutturali delle due componenti sono distinguibili per alcuni dettagli intracitoplasmatici e tra questi ha notevole rilevanza il riscontro delle glio-fibrille o delle fibrille di procollagene (Fig.19).
Questi caratteri di differenziazione possono essere alterati o cancellati da processi regressivi o necrotici intrinseci primitivamente nelle cellule o indotti secondariamente dall’ambiente extracellulare o vascolare. Le metodiche genetiche sono state dirimenti per definire la natura di questo tumore morfologicamente bifasico.
Fig.20 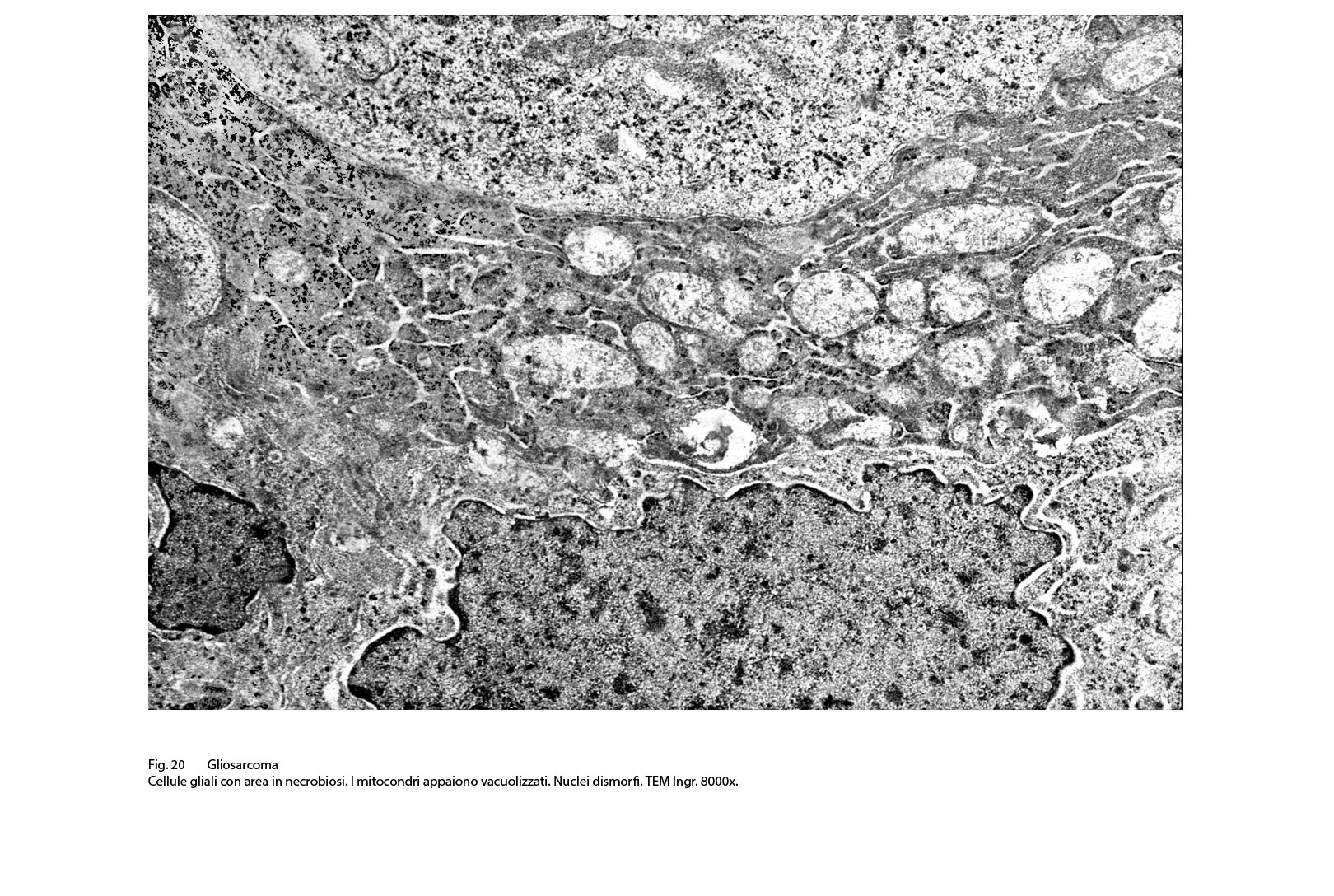 Fig.21
Fig.21 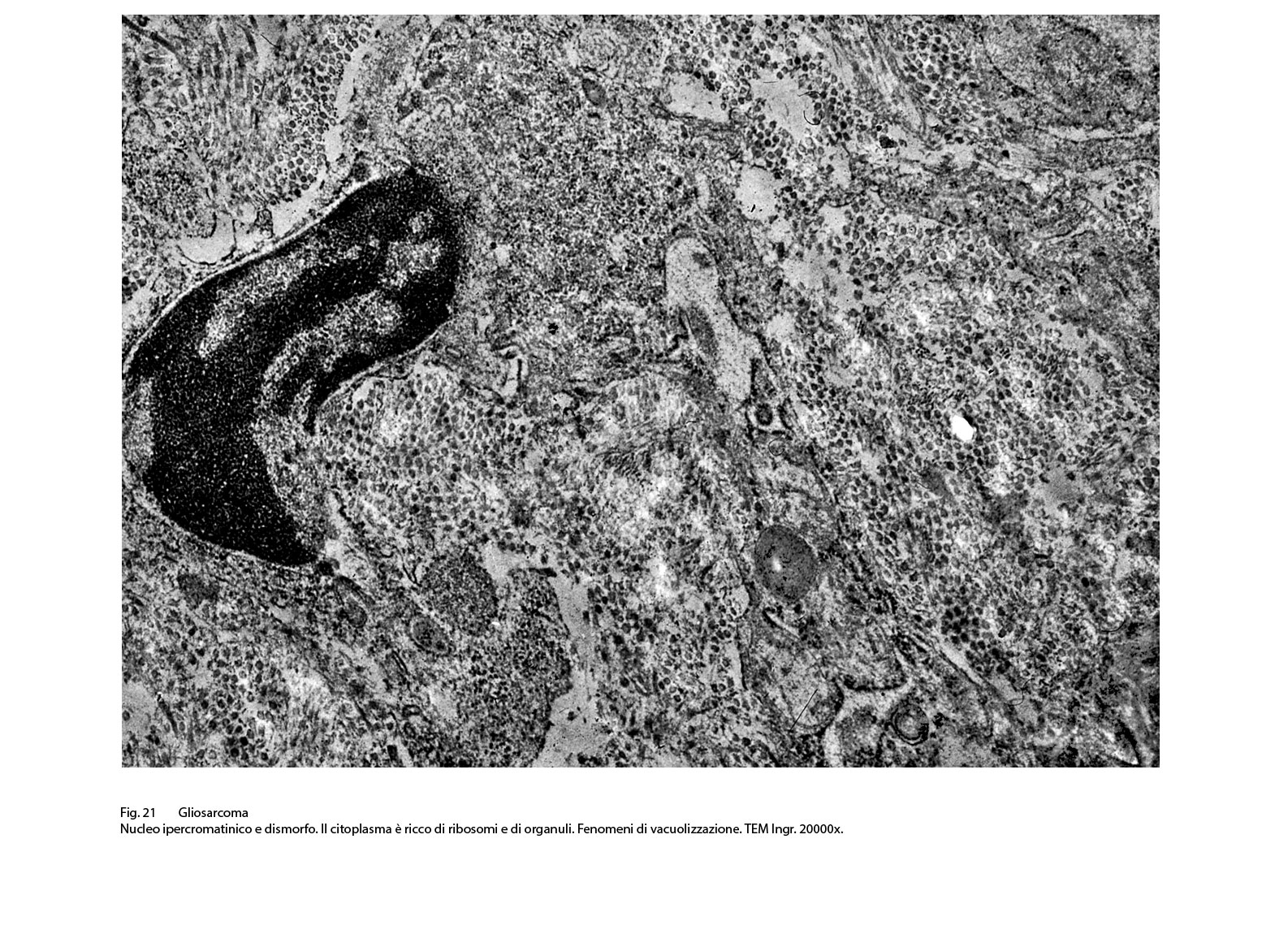 Fig.22
Fig.22 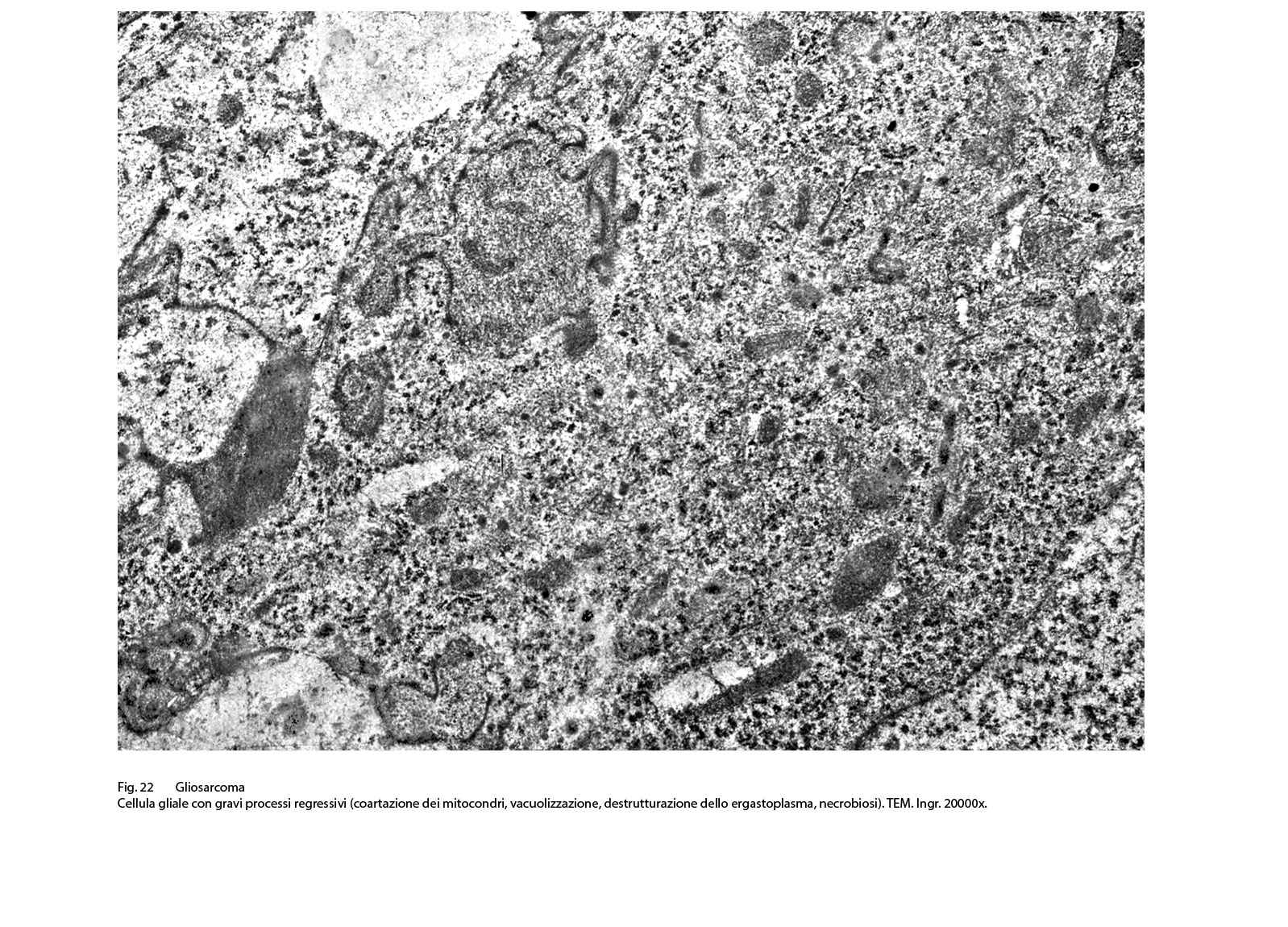
Fig.22bis 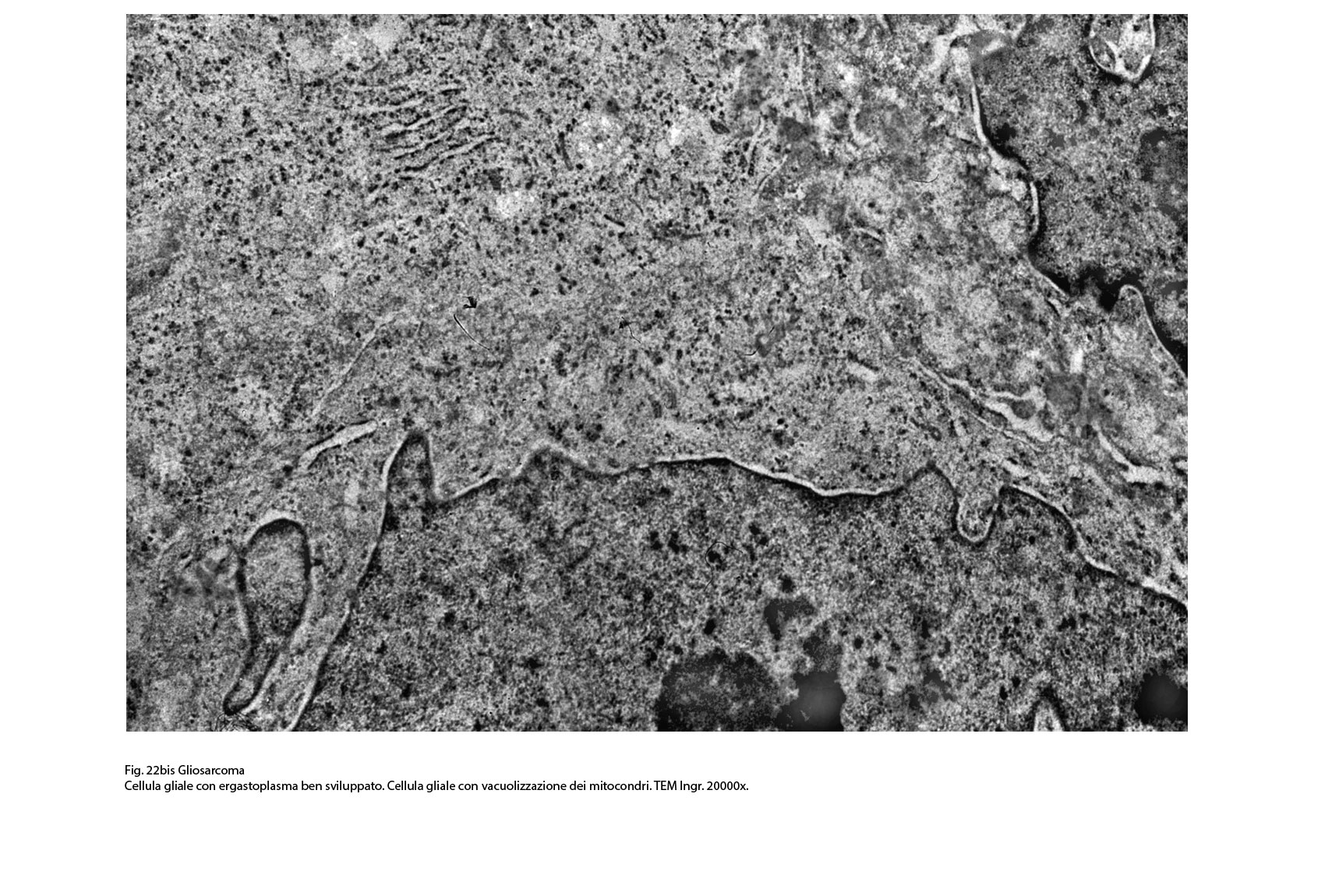 Fig.23
Fig.23 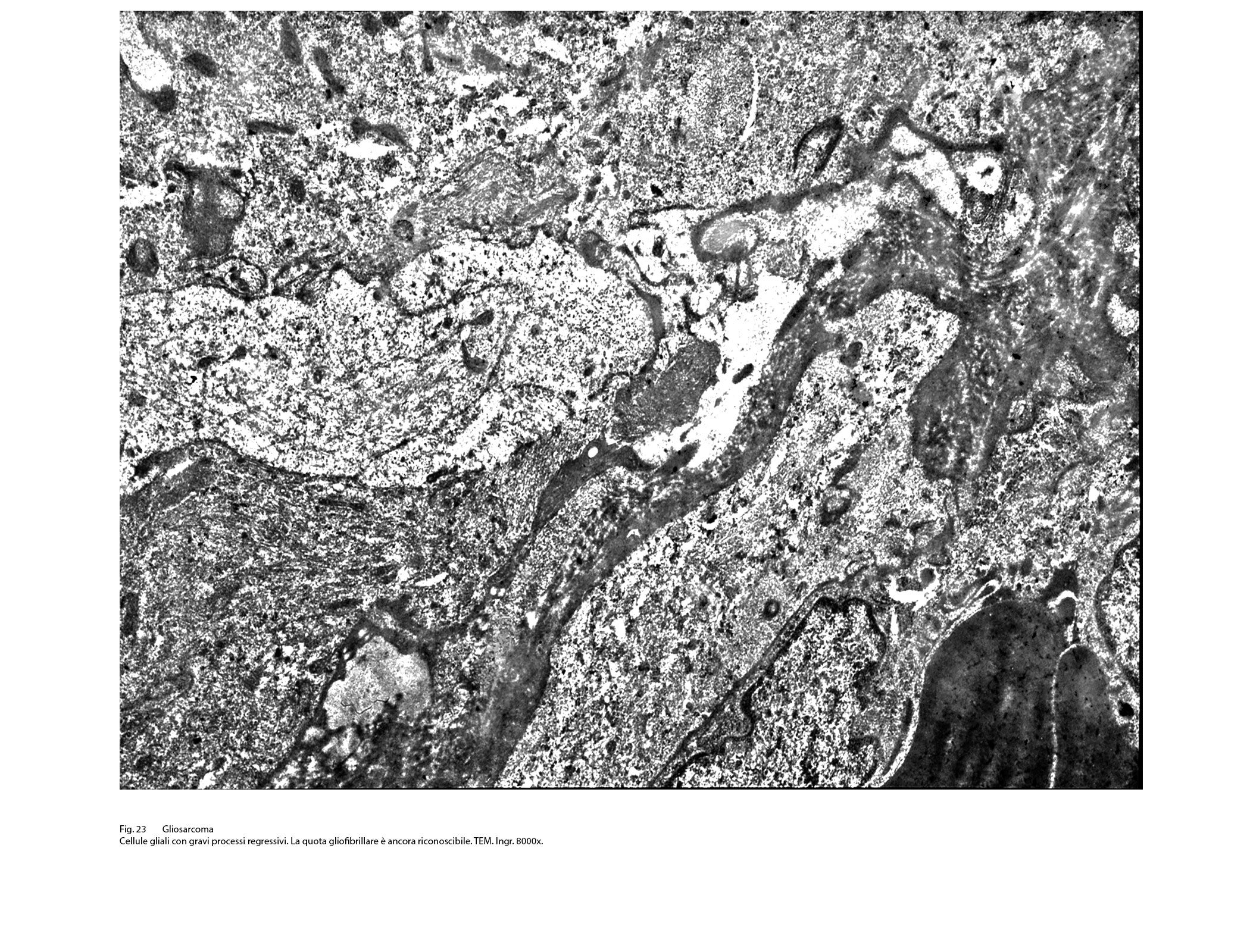 Fig.23bis
Fig.23bis 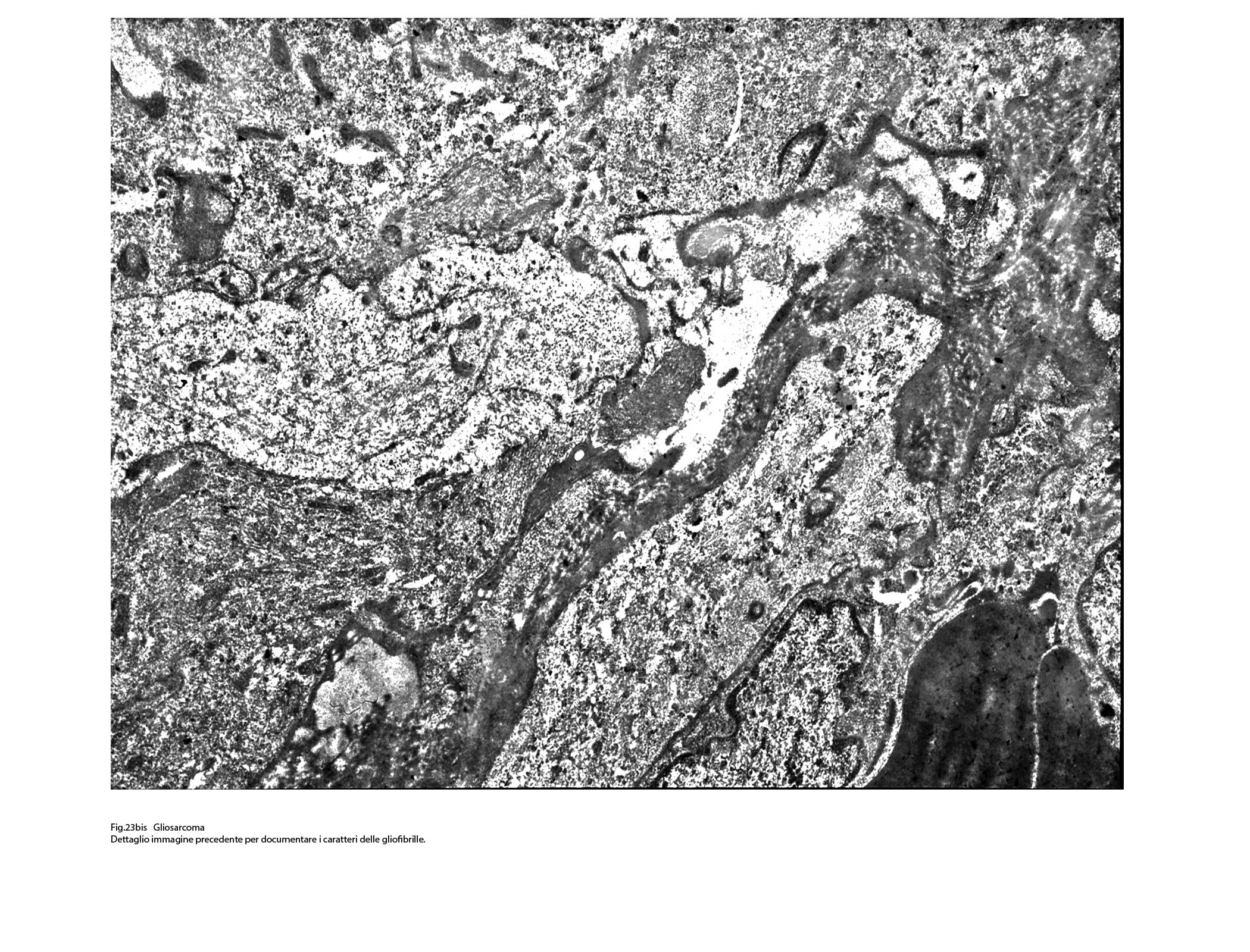
Fig.24 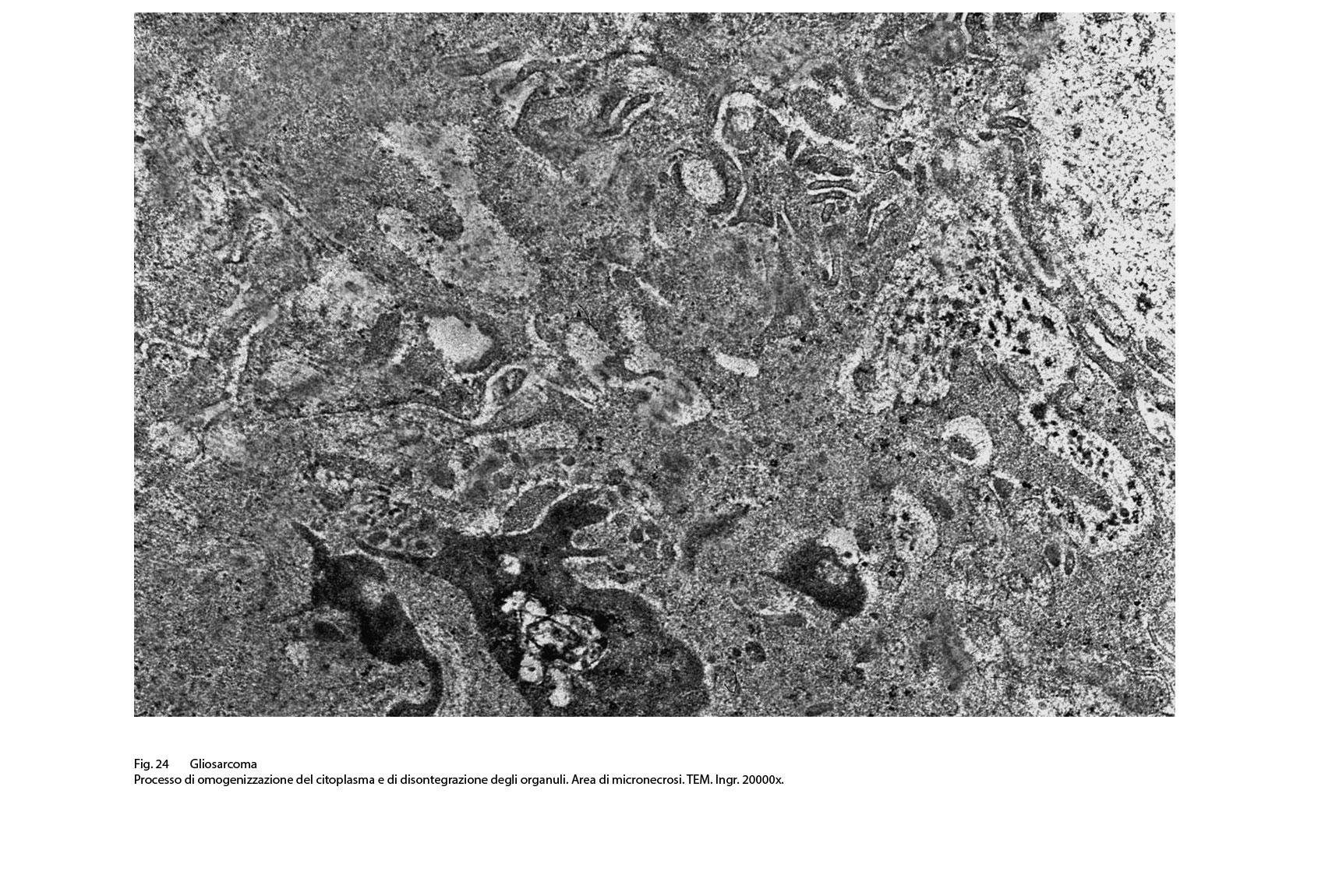 Fig.25
Fig.25 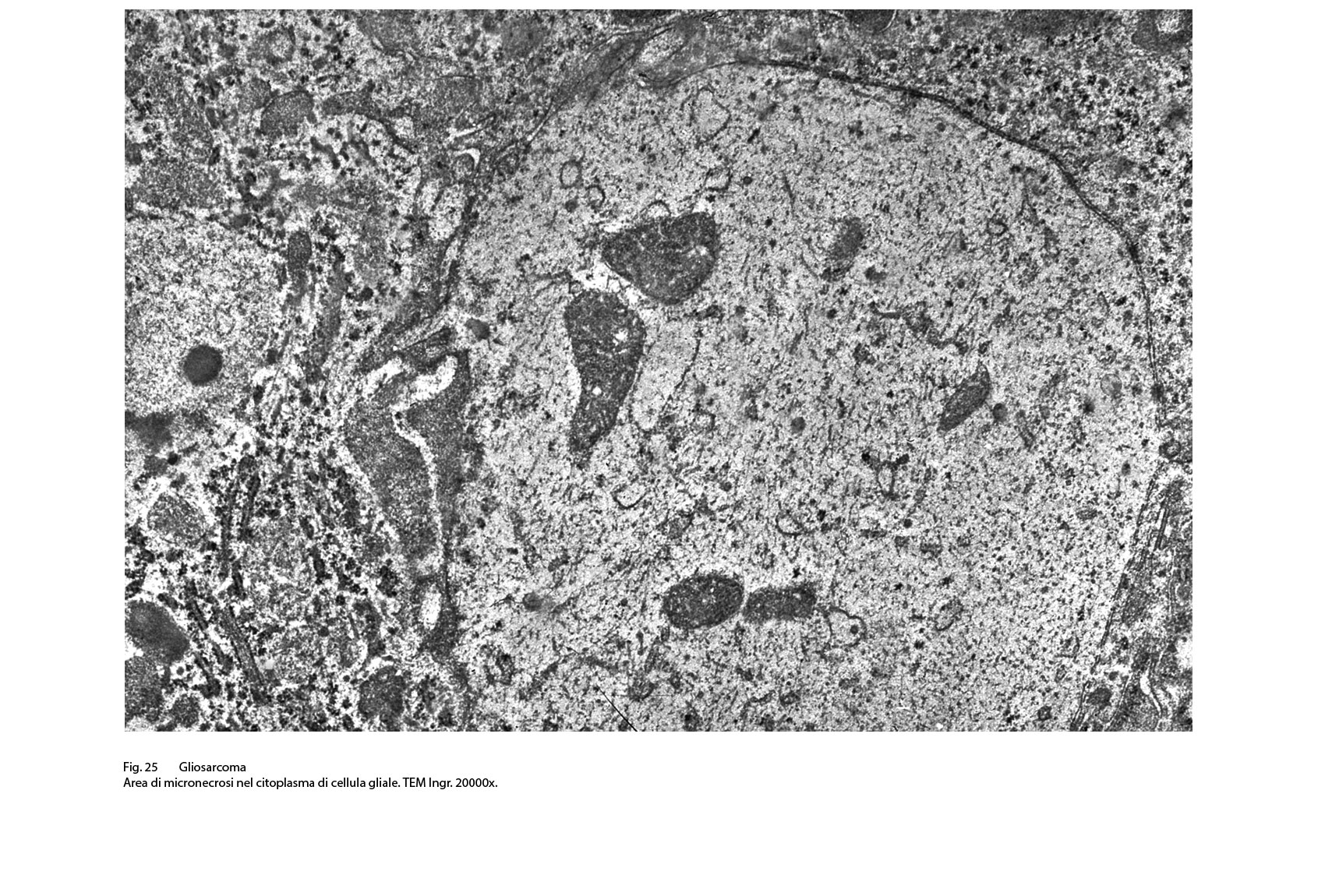 Fig.25bis
Fig.25bis 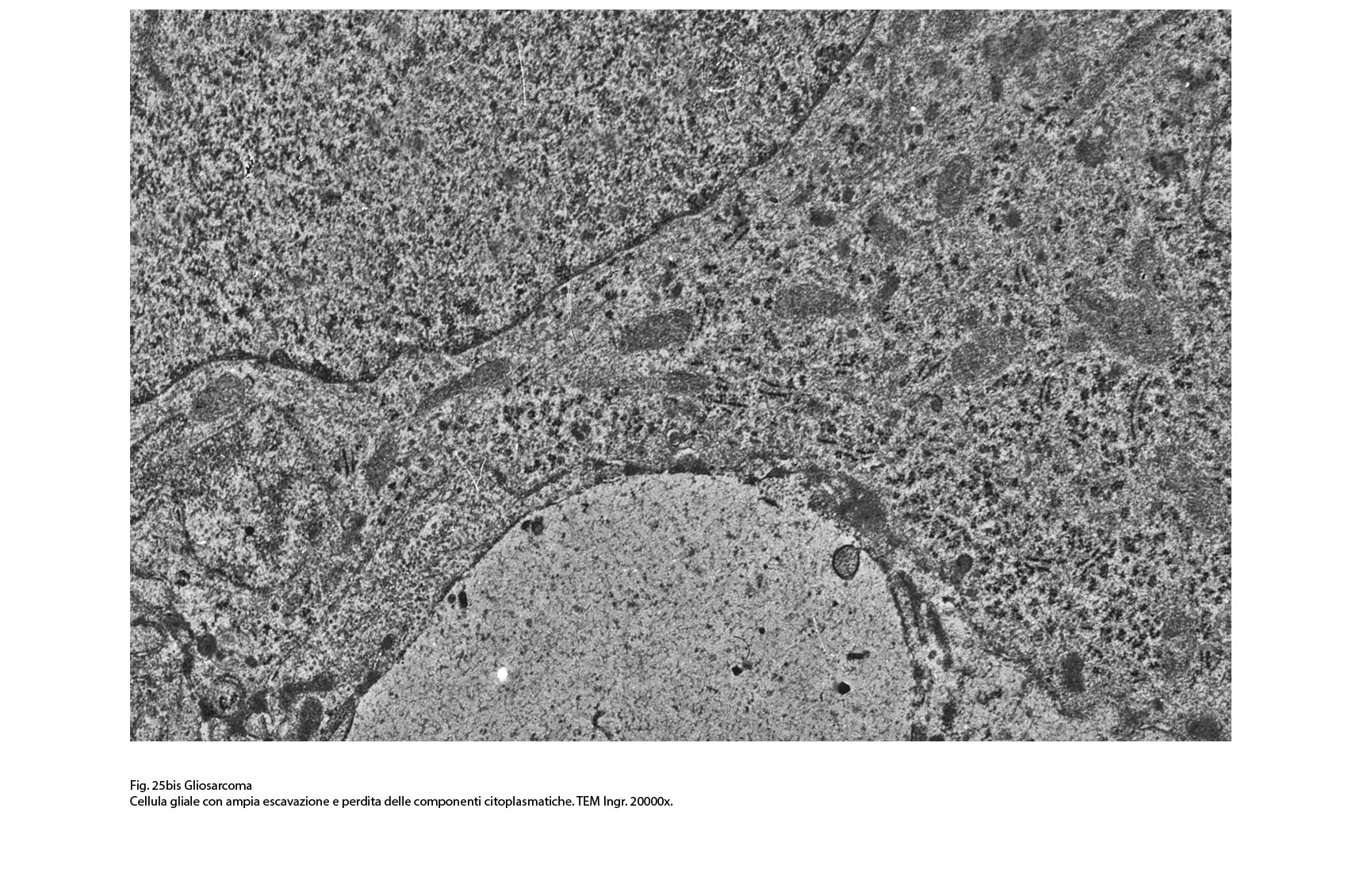
Fig.26 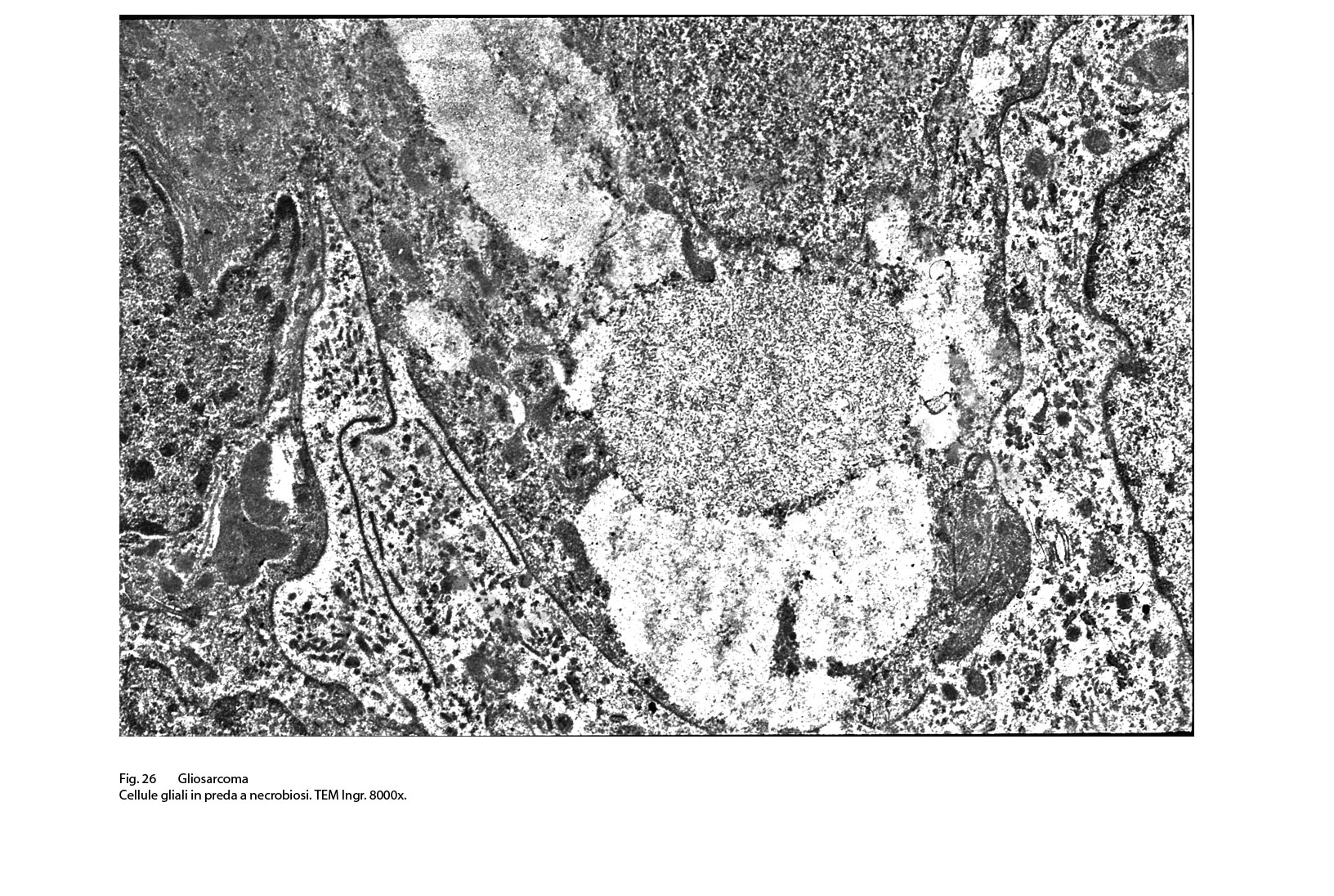 Fig.27
Fig.27 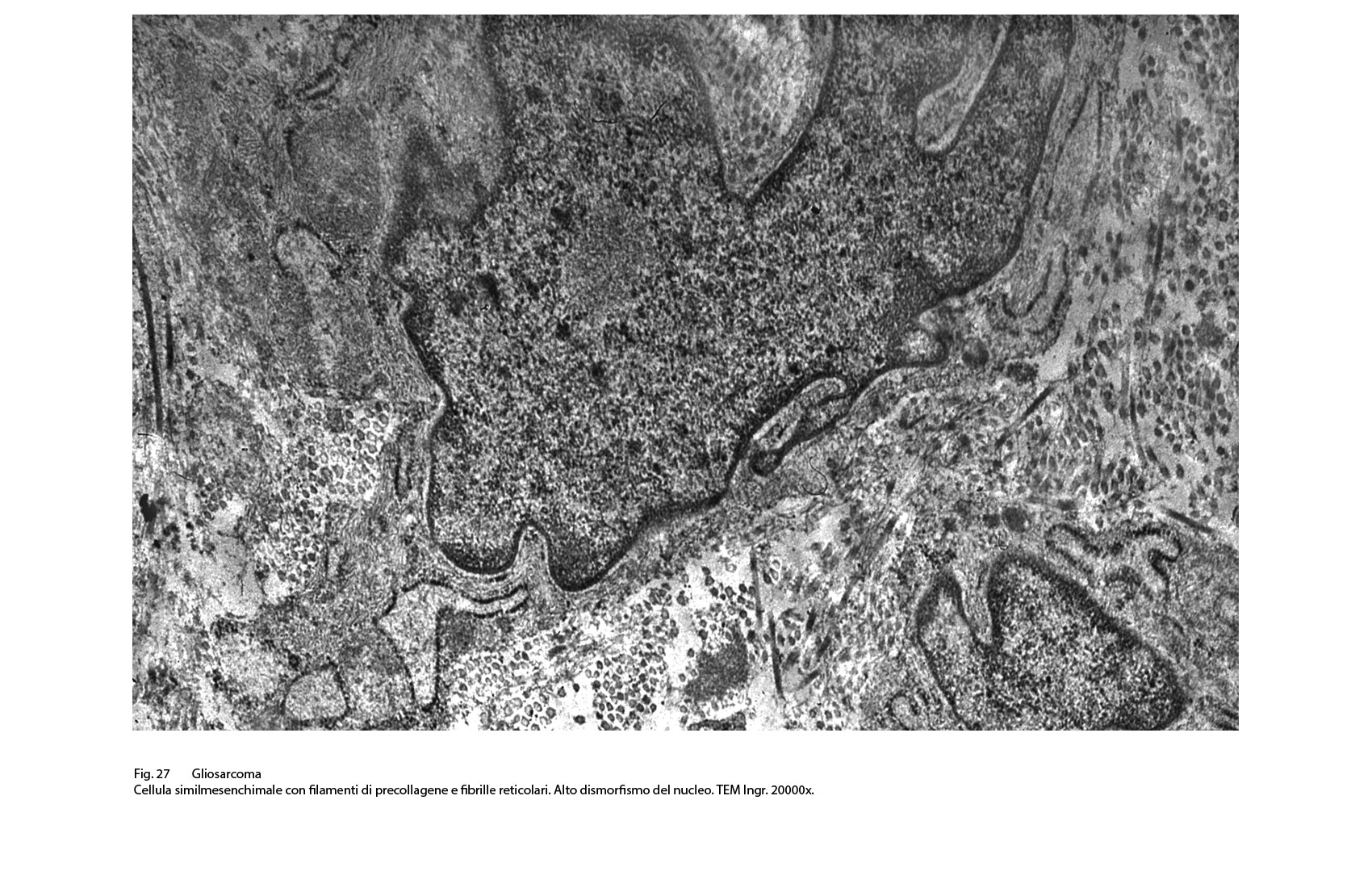 Fig.27bis
Fig.27bis 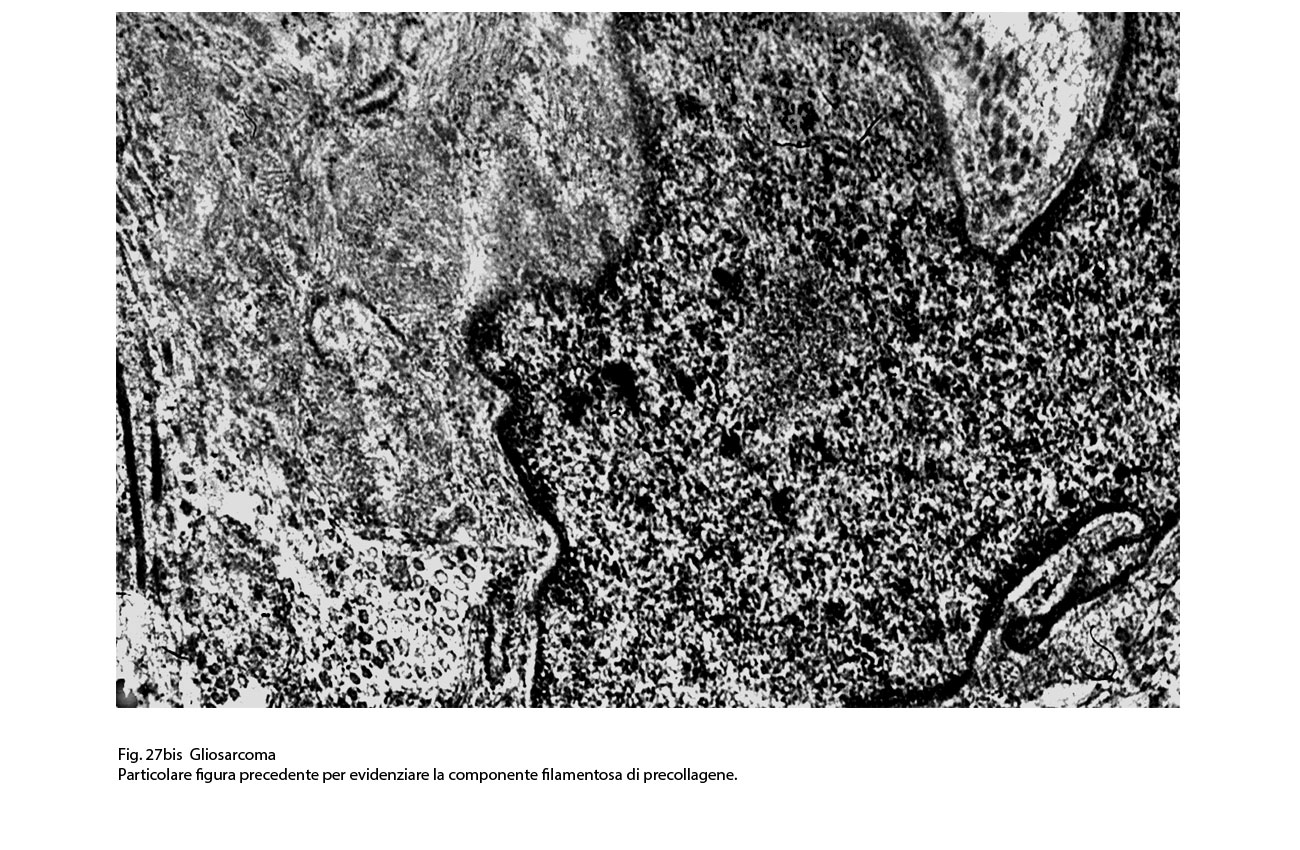
Fig.28 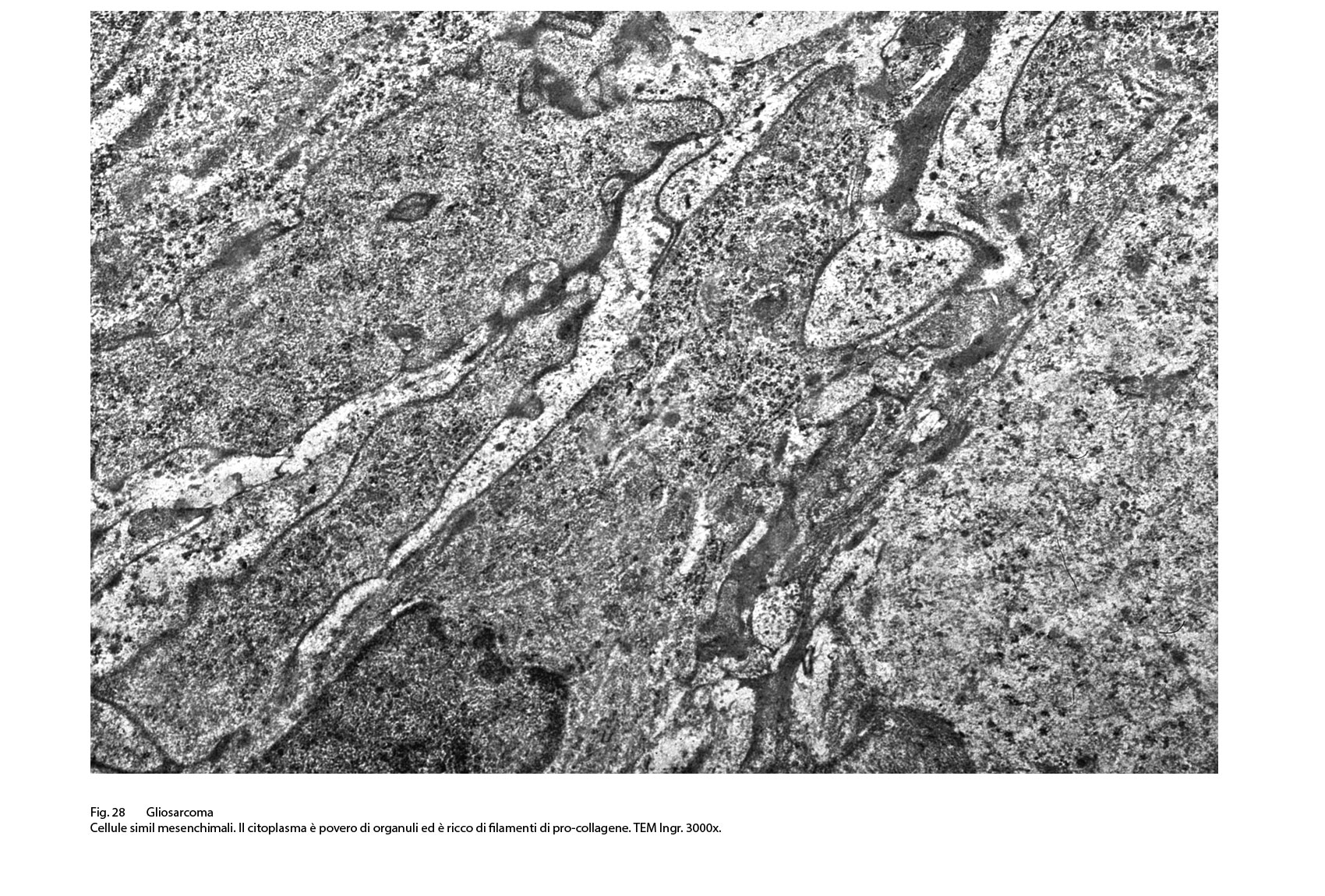 Fig.28bis
Fig.28bis 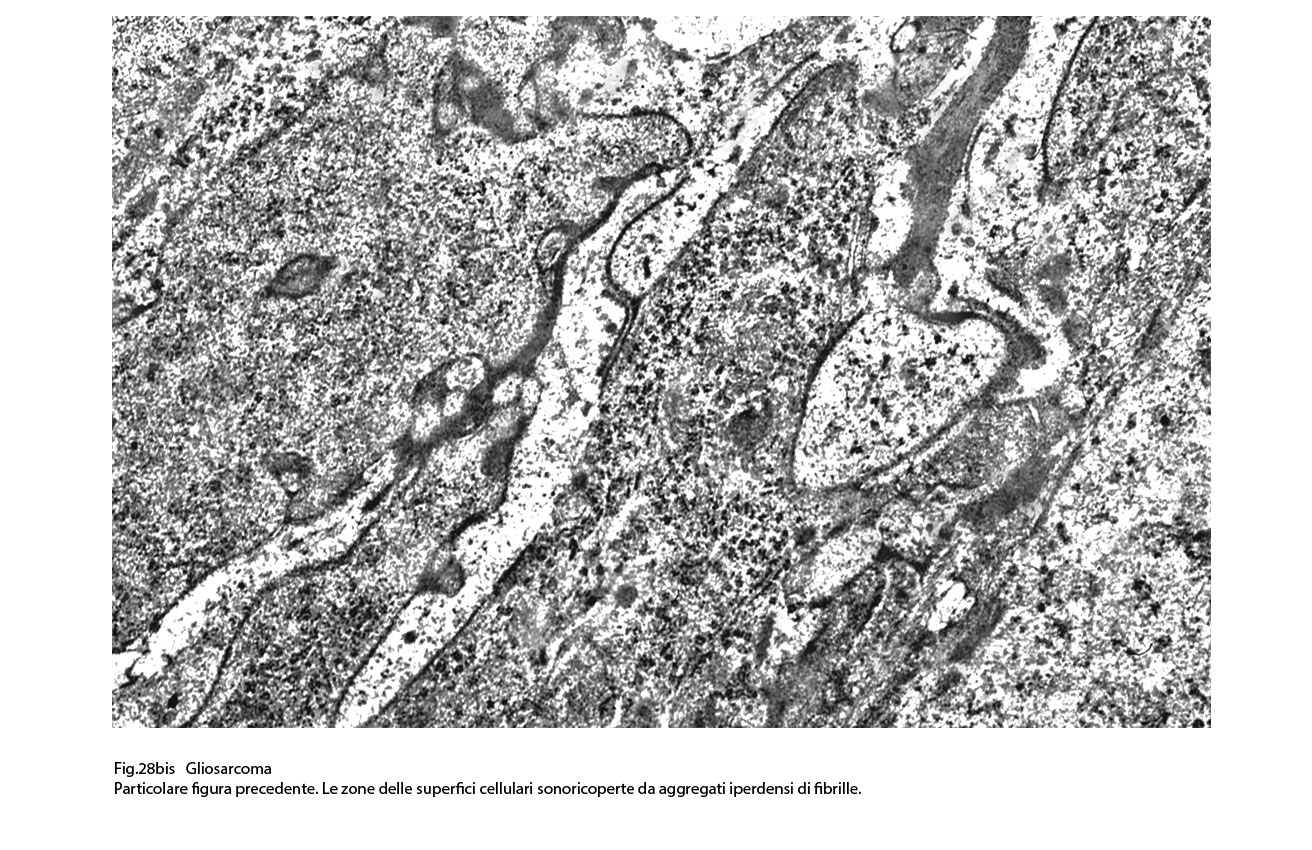 Fig.29
Fig.29 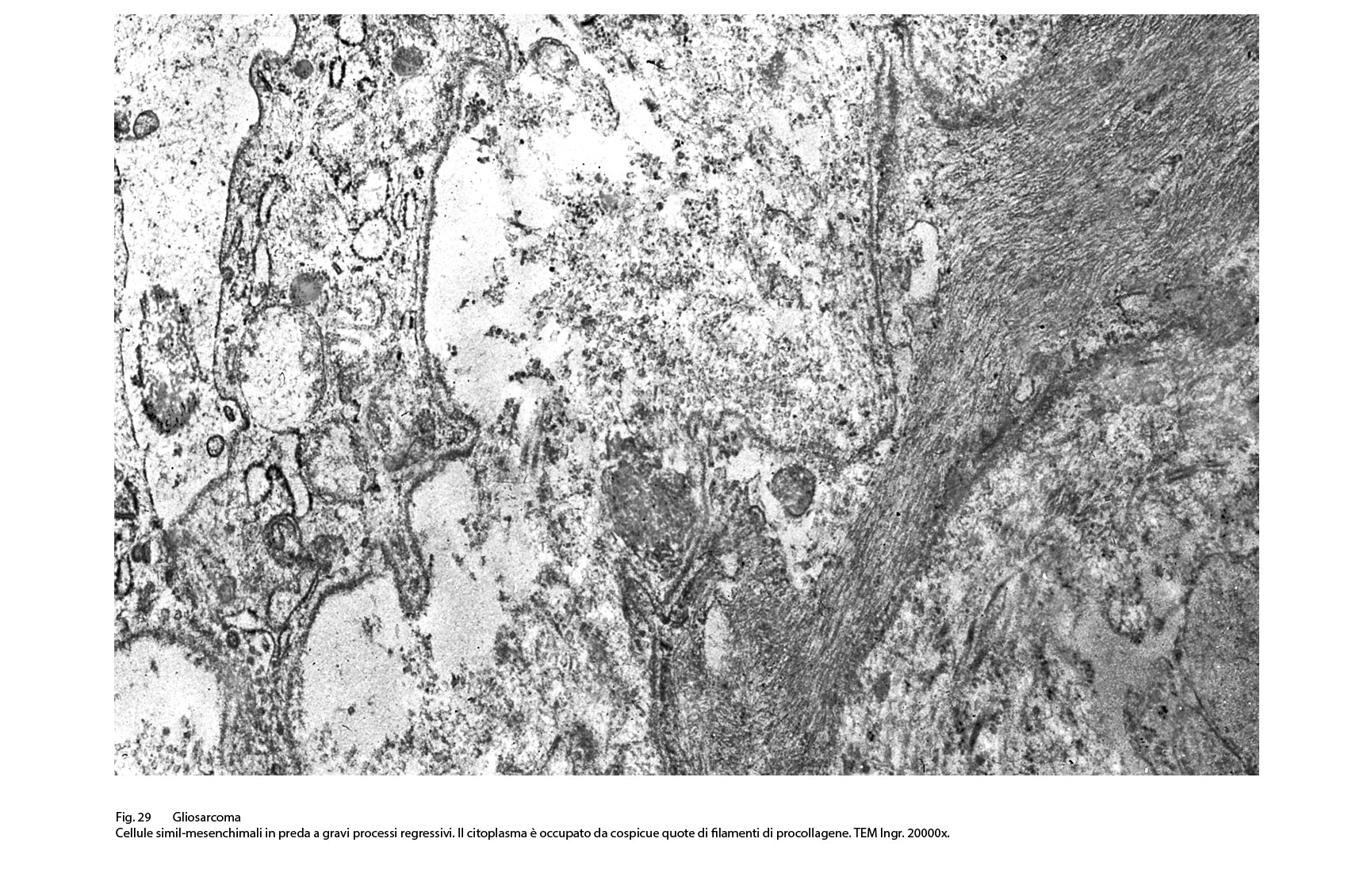
Fig.30 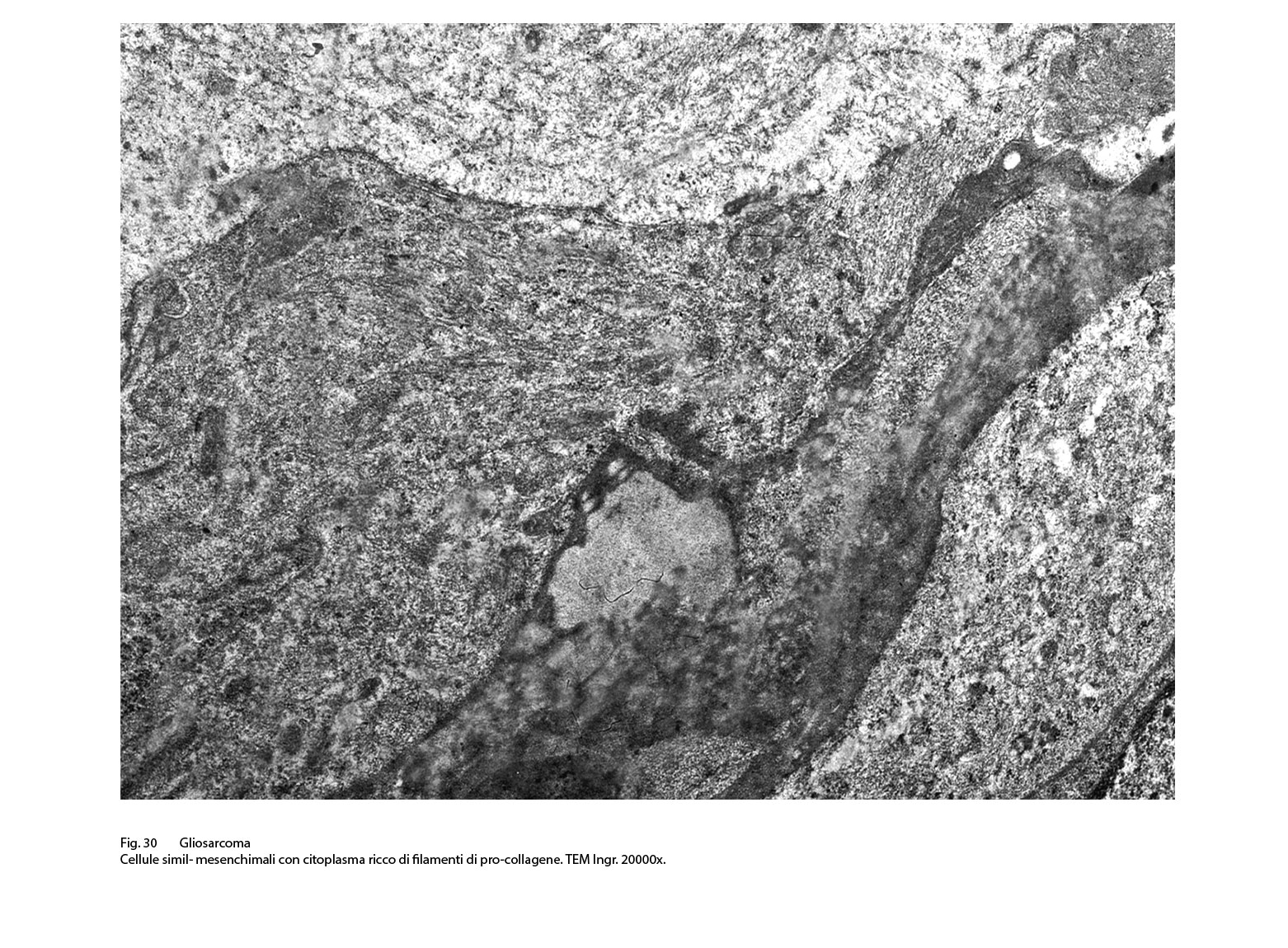 Fig.30bis
Fig.30bis 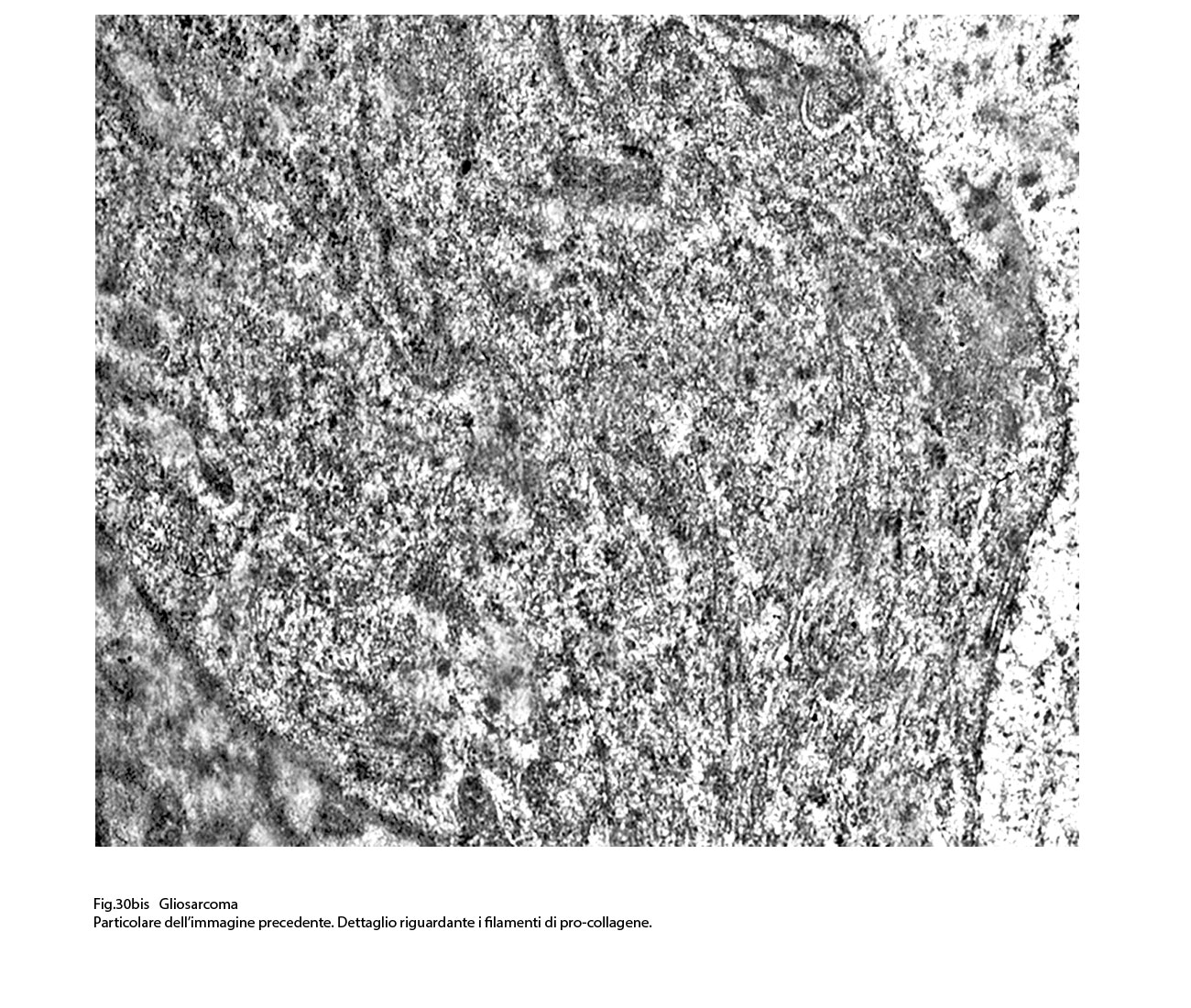 Fig.31
Fig.31 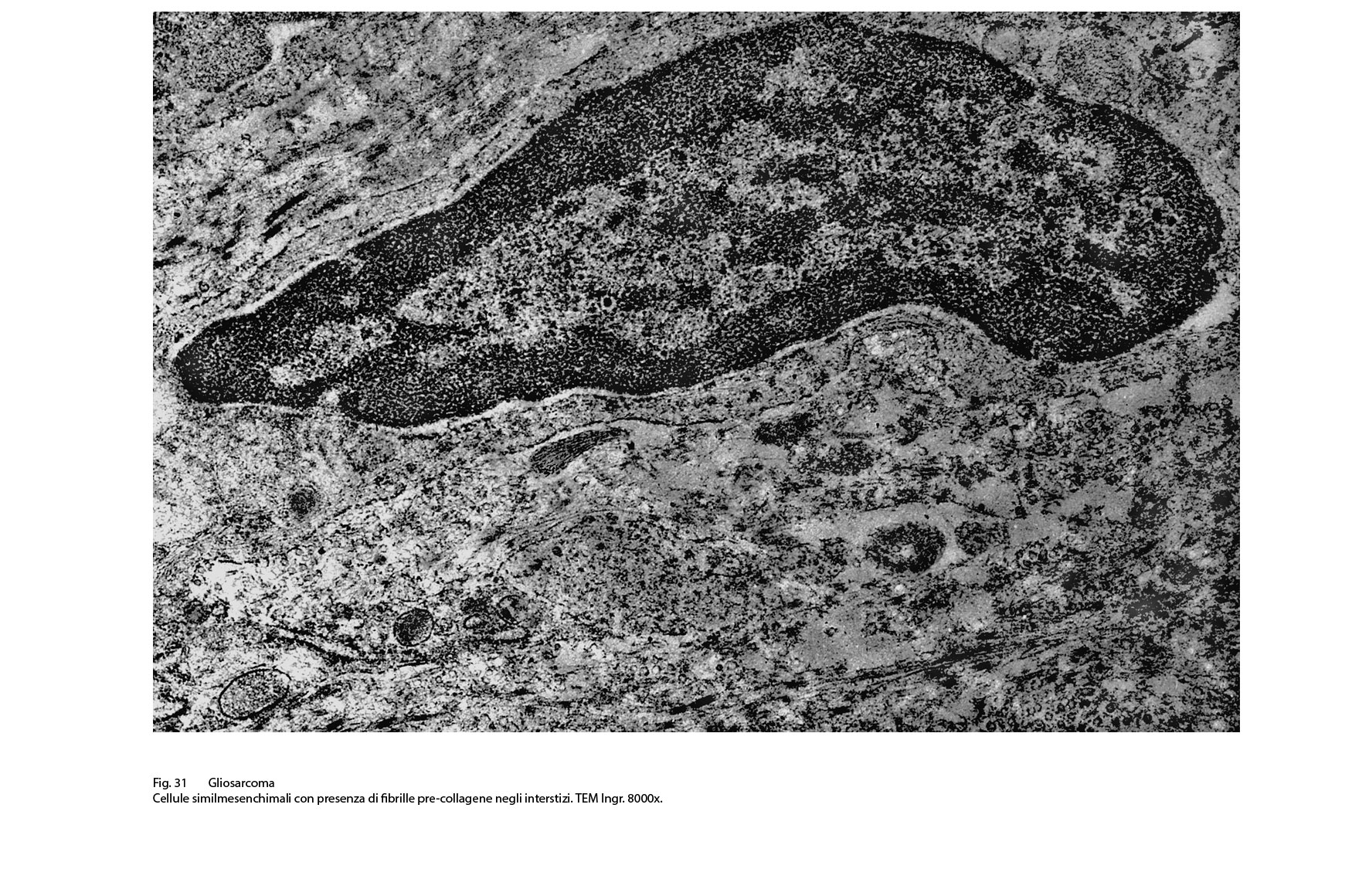
In passato, il gliosarcoma era considerato una neoplasia da “collisione” oppure una neoformazione maligna con una componente mesenchimale vera avente origine dai vasi o dalle cellule perivascolari. Queste difficoltà circa la istogenesi del gliosarcoma sono dovute alla variabilità dei processi di metaplasia, variabilità strettamente derivante dalla plasticità morfologica degli astrociti. Queste cellule rivelano una modulazione morfologica e funzionale strettamente adattata e finalizzata alle esigenze fisiologiche para- fisiologiche o patologiche del sistema nervoso.
Questa plasticità morfo-funzionale degli astrociti si potenzia notevolmente nei processi proliferativi maligni e si esprime attraverso manifestazioni fenotiche che richiamano tessuti mesenchimali o cellule epiteliomorfe. Questi processi di metaplasia non sono superficiali o semplicemente approssimativi; essi investono l’assetto citologico, la componente antigenica e i caratteri sub-cellulari. A fronte i questi reperti così varianti i caratteri genetici sono rimasti univoci. Infatti la definitiva interpretazione istogenetica del gliosarcoma è dovuta al contributo chiarificatore delle determinazioni genetiche. Queste hanno documentato mutazioni identiche sia a livello della quota a cellula gliali sia a carico della quota simil- mesenchimale, confermando così la natura monoclonale della neoplasia. Inoltre queste mutazioni genetiche sono sovrapponibili a quelle caratterizzanti il glioblastoma multiforme; questo ultimo dato permette di concludere essere il gliosarcoma una variante del glioblastoma multiforme.

