GLIOSARCOMA ULTRASTRUTTURALE
Luigi Cuccurullo
Il gliosarcoma è una variante del glioblastoma multiforme. Esso ha una struttura bifasica, espressa da una componente gliale e da una componente fenotipica mesenchimale con aspetti varianti (WHO, 2007).
Queste due componenti, formate da popolazioni cellulari atipiche disposte in modo disordinato,o variamente commiste, sono distinguibili mediante metodiche morfologiche ed immunoistochimiche.
La componente gliomatosa è ipercellulata, pleomorfa, anaplastica; essa è permeata da numerosi vasi neoformati ed è sede di focolai degenerativo-necrotici; nell’insieme rivela i caratteri istologici e citologici del glioblastoma multiforme.
La componente fenotipico-mesenchimale si appalesa anch’essa come neoplasia maligna di alto grado e mostra indici di notevole attività proliferativa. Questa componente ha acquisito a livello fenotipico i caratteri di sarcoma e a seconda dei casi si manifesta con immagini di fibrosarcoma, di liposarcoma, di condrosarcoma, di osteosarcoma, di leiomiosarcoma, di rabdomiosarcoma o di sarcoma indifferenziato.
Questa componente a cellule mesenchimali frequentemente si incestella in una rete di fibrille reticolari e/o collagene neo- formate o è immersa in depositi di materiali amorfi (Am. J. Surg. Pathol. 2015, 39, 573-80).
Con incidenza più rara a questa componente mesenchimale si sostituiscono gruppi o aggregati di elementi simil-epiteliali i quali hanno acquisito una morfologia squamosa o adeno-carcinomatosa.
Nel contesto di ambedue le suddette popolazioni (gliale e mesenchimale) si repertano cellule stem, riconoscibili per la loro forma e il loro volume (Stem cells, 2010, 28, 181-190).
La disposizione spaziale delle due componenti glio-sarcomatosiche può variare a seconda dei casi: si possono riscontrare reperti a focolai distinti e separati; oppure si ritrovano casi ad aggregati con cellularità mista; o ancora neoplasie gliosarcomatose formate dalla presenza nello stesso caso delle due modalità sopra indicate.
Questo processo di trasformazione in senso mesenchimale non riguarda solo l’aspetto morfologico ma anche i markers citologici; infatti gli elementi mesenchimali hanno perduto i propri originari markers gliali e hanno acquisito quelli specifici delle cellule mesenchimali (fibronectina, Vimentina) (Cancers 2012, 4, 523-30) (Clin. Neuropathol. 2013, 32, 508-14) (J. Biol. Chem. 2015, 290, 145-53).
Questo processo di transizione è possibile per la esistenza di processi di plasticità delle cellule e in particolare per un rimodellamento e una riorganizzazione del citoscheletro;in tale ri-sistemazione, spesso molto composita,di questa impalcatura citologica un ruolo importante è svolto dai filamenti intermedi. (Tissue Erg. Part. B. Rev., 2012, 18, 436-44).
Questi elementi con caratteri mesenchimali acquisiscono anche funzioni specifiche come quelle di sintetizzare fibre collagene e materiale extracellulare;al di là della loro morfologia questi elementi manifestano una accentuata aggressività biologica sia per l’elevata attività proliferativa sia per la loro invasività. (Onco targets 2014, 7, 1933-44) (Med. Sci 2015, 31, 68-74).
Tali diversità fenotipiche morfologiche e immunoistochimiche sono state ridimensionate,superate e svuotate di significato nosologico per la scoperta della esistenza di un medesimo assetto genetico-molecolare nelle due componenti del gliosarcoma, confermando in modo definitivo la natura unitaria di questa neoplasia. (Brain Tumor Pathology 2014, 31, 40-46).
Queste modificazioni sono inerenti la plasticità degli elementi cellulari, ossia la loro facoltà di acquisire a seconda delle situazioni fisiologiche e patologiche caratteri morfofunzionali corrispondenti e finalizzati a specifiche e particolari esigenze. L’espressività di questa plasticità,etichettata come
transizione fenotipica, è documentabile anche mediante osservazioni a livello ultrastrutturale per il manifestarsi di modificazioni degli organuli citoplasmatici, per una nuova strutturazione dei componenti il citoscheletro e per una ricomposizione dei contenuti degli spazi intercellulari.
L’applicazione dei criteri ultrastrutturali non solo fornisce i suddetti dati sub-microscopici , ma rende più agevole documentare sia in senso qualitativo sia in quello quantitativo la presenza di cellule stem .
Attraverso le osservazioni al microscopio elettronico è possibile in alcuni casi riconoscere i sottotipi della quota mesenchimale; così,per es, in casi di gliosarcoma con una componente di tipo fibrosarcomatosa è possibile far emergere aspetti riferibili a
fibrosarcoma mixoide, fibro-istiocitoma maligno, sarcoma miofibroblastico, fibrosarcoma epitelioide sclerosante, sarcoma di lieve grado. (Ultrastruct. Pathol. 2004, 28, 67-73) (Ultrastruct Pathol. 2013, 37, 9-14).
Un esempio limitato rispetto alle variabili e complesse estrinsecazioni della componente mesenchimale dei gliosarcomi viene qui di seguito proposto; esso si riferisce all’istotipo più frequente rappresentato da una quota gliomatosa e una quota fenotipica fibrosarcomatosa:
La maggior parte di questi elementi sono di forma fusata con due poli assottigliati alle estremità; essi sono aggregati a fascetti paralleli, sono tra loro a mutuo contatto ma non sono visibili strutture giunzionali.
Fig.1 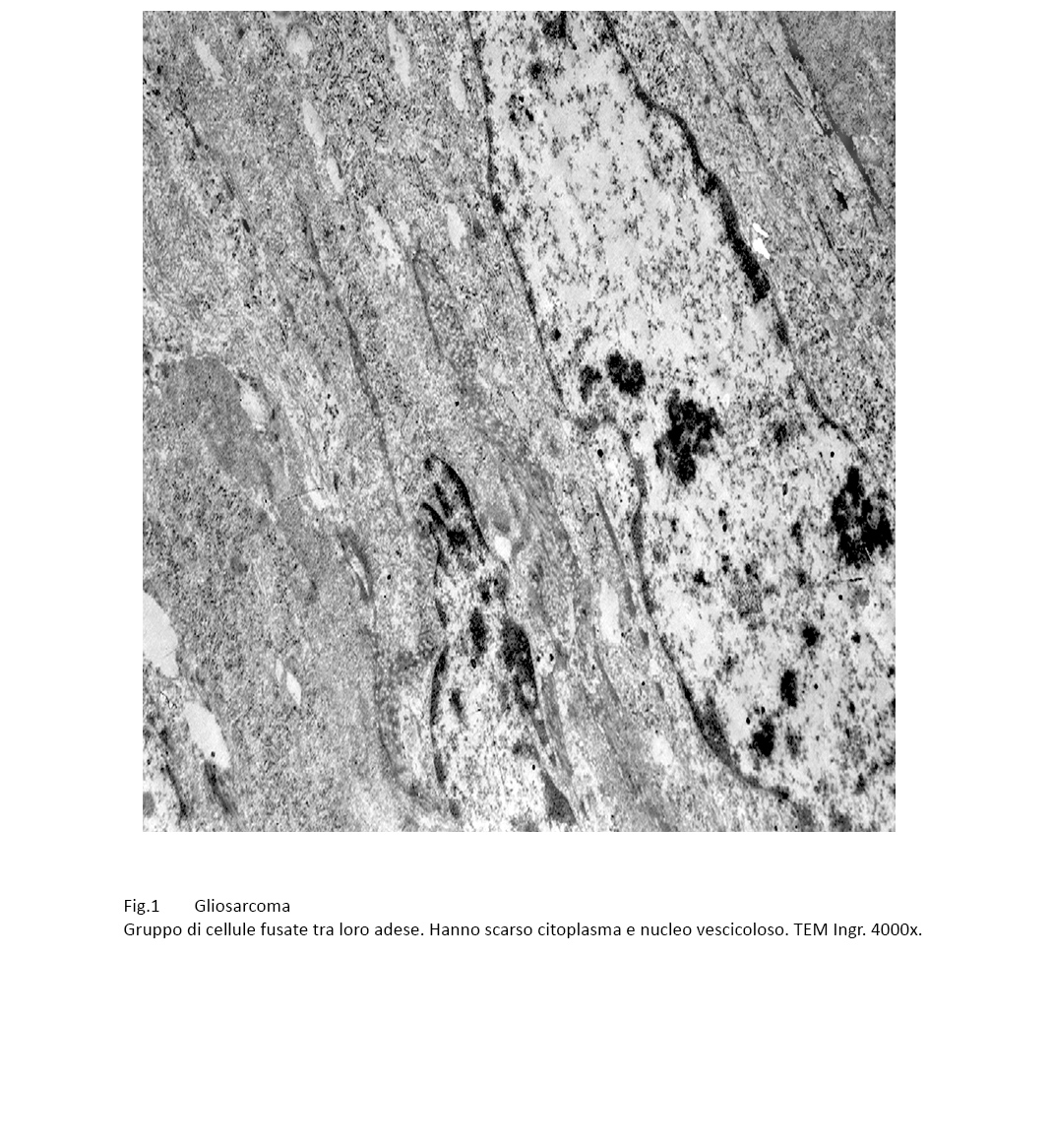
Non mancano, anche se di rado, cellule di forma irregolare, rotondeggiante o in abbozzo poligonale.
Fig.2 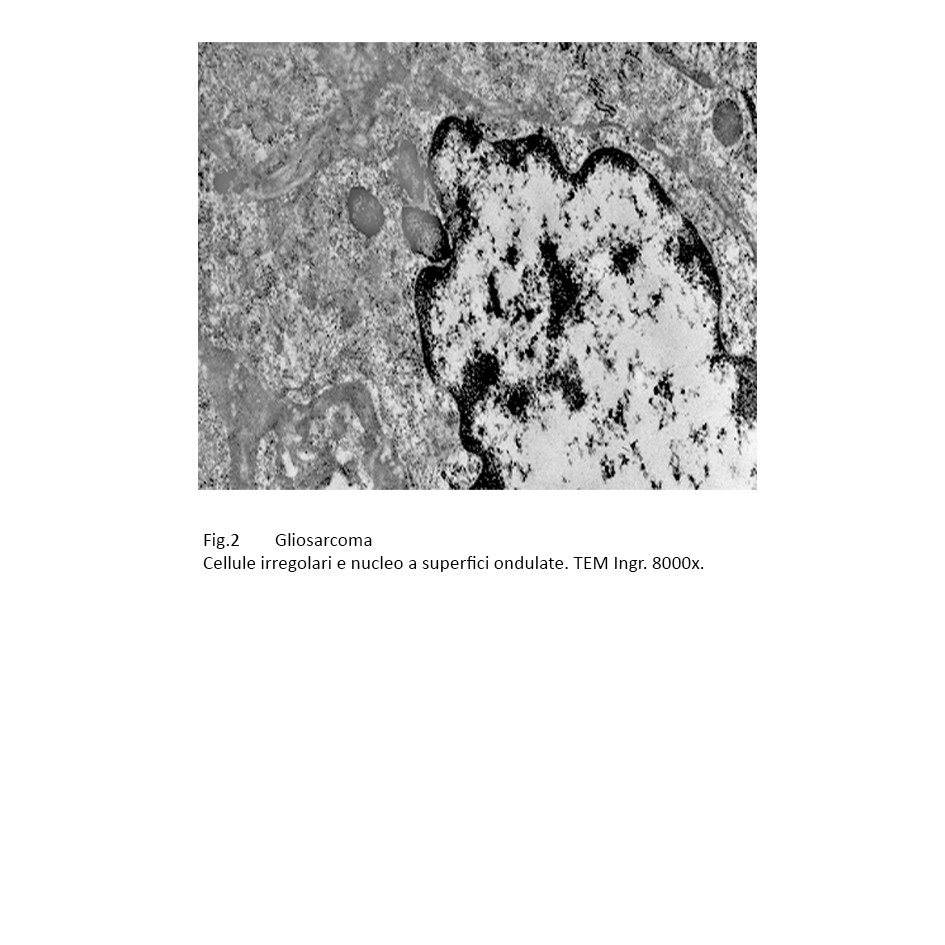
Ciascun elemento, pur in una variabile statistica, ha un sottile lembo di citoplasma ed è centrato da un nucleo voluminoso che si plasma a seconda della forma cellulare.
Il citoplasma è delimitato da una sottile membrana, ha una matrice ipodensa ed è fornito di quote di organuli distribuiti in modo diffuso. Questi sono rappresentati da rari mitocondri, da corte strutture ergastoplasmatiche,da molti microtubuli e da una quota ben rappresentata di filamenti intermedi , gliofibrille.
Fig.3 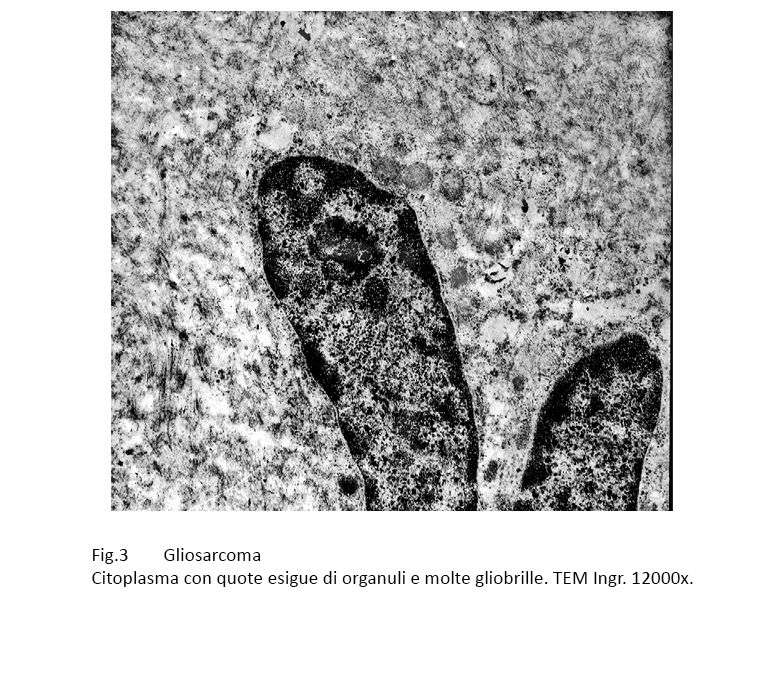 Fig.4
Fig.4 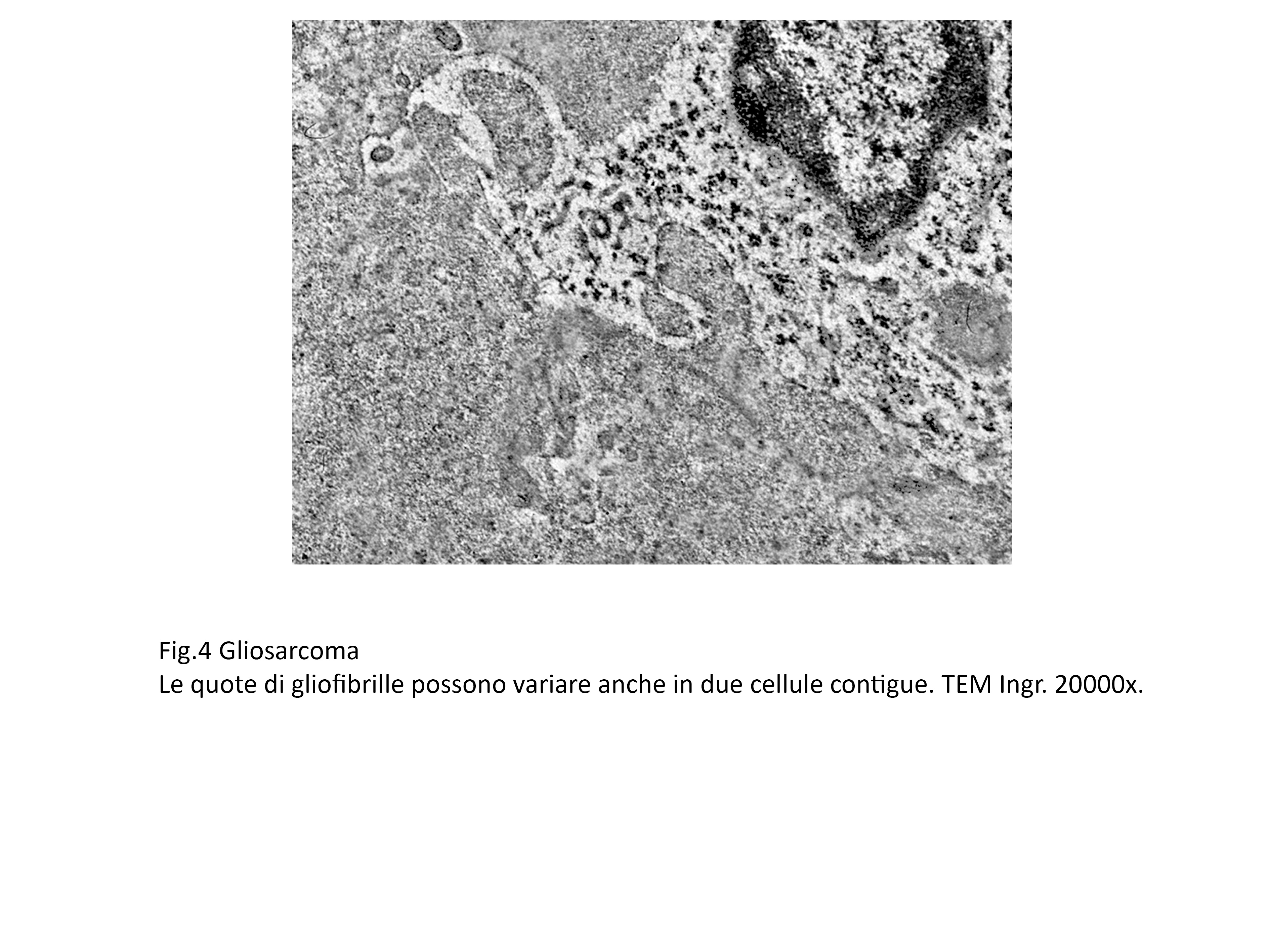 Fig.4bis
Fig.4bis 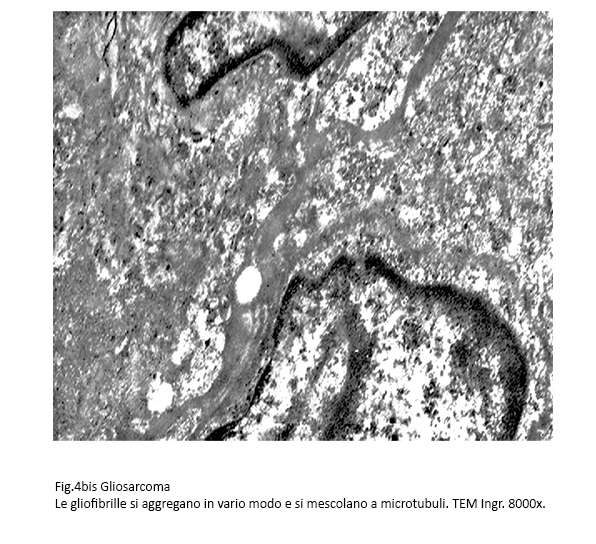
Fig.5 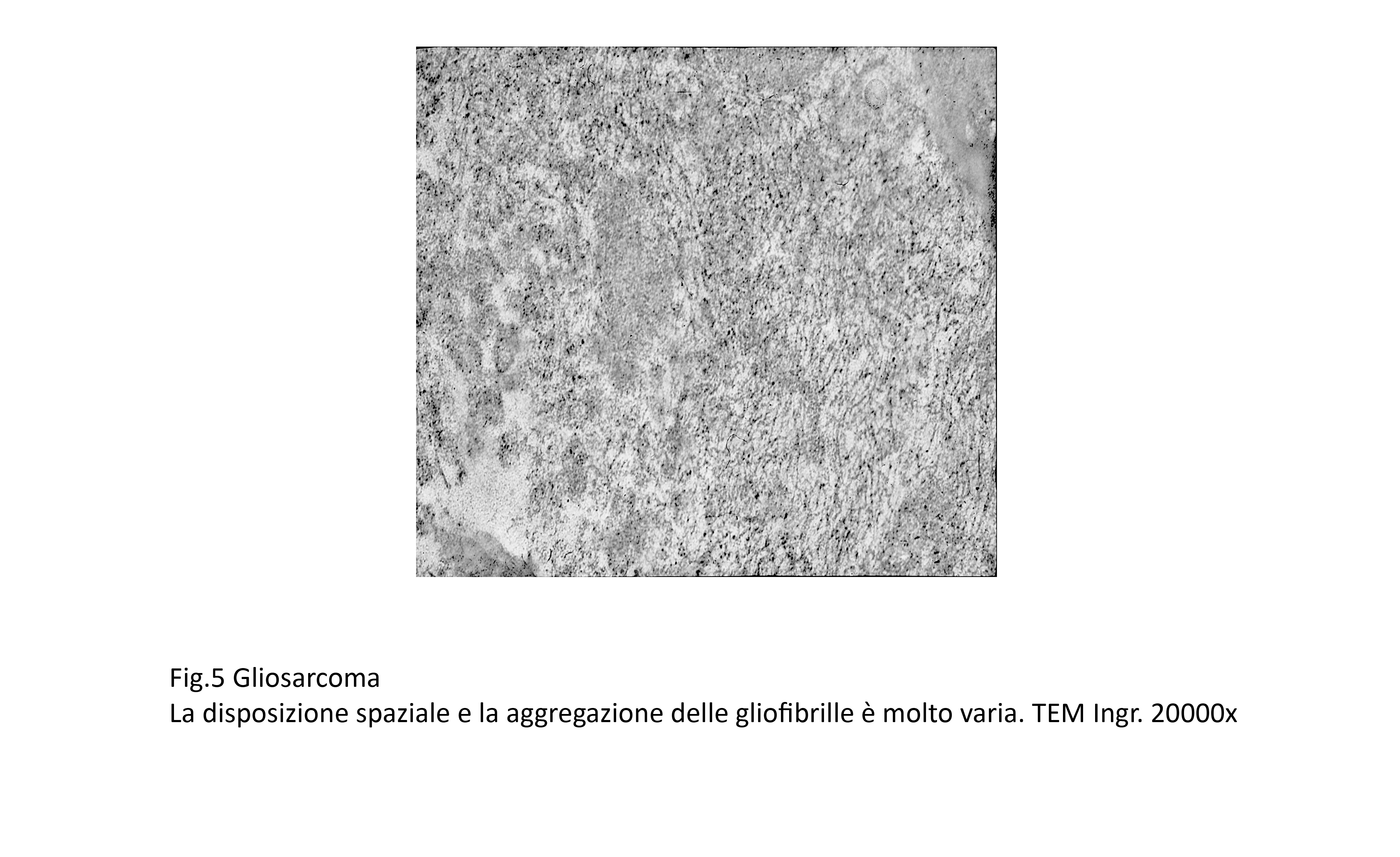
Questi filamenti sono presenti in tutta la matrice citoplasmatica e in quantità elevate lungo le fasce periferiche del citoplasma e a livello dei poli cellulari.
Il nucleo appare vescicoloso, ha un profilo irregolarmente ovoidale, spesso rivela contorni dentellati ed è fornito di etero-cromatine a zolle.
Gli spazi intercellulari sono virtuali oppure sono occupati da una sottile stria di materiale amorfo che si stende su le superfici esterne delle cellule seguendone i ripiegamenti , le flessuosità e gli intrecci con gli elementi vicini.
Fig.6 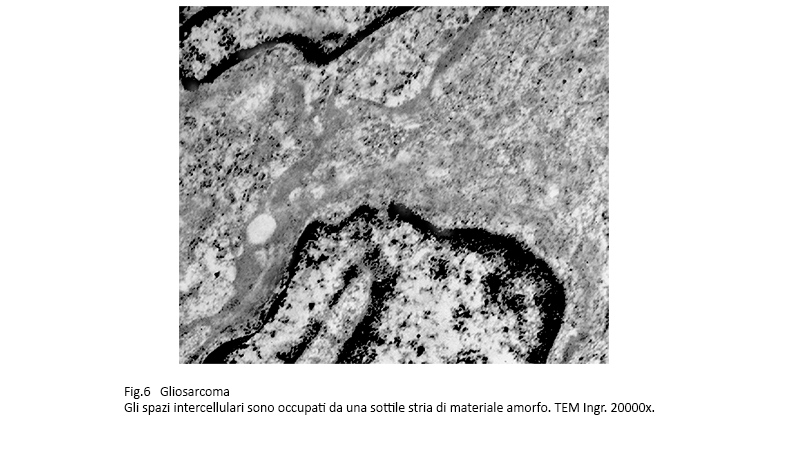
I capillari e i piccoli vasi delle pareti sottili e semplificate sono compressi, deformati ed infiltrati dalla progressiva ed invadente proliferazione cellulare.
Fig.7 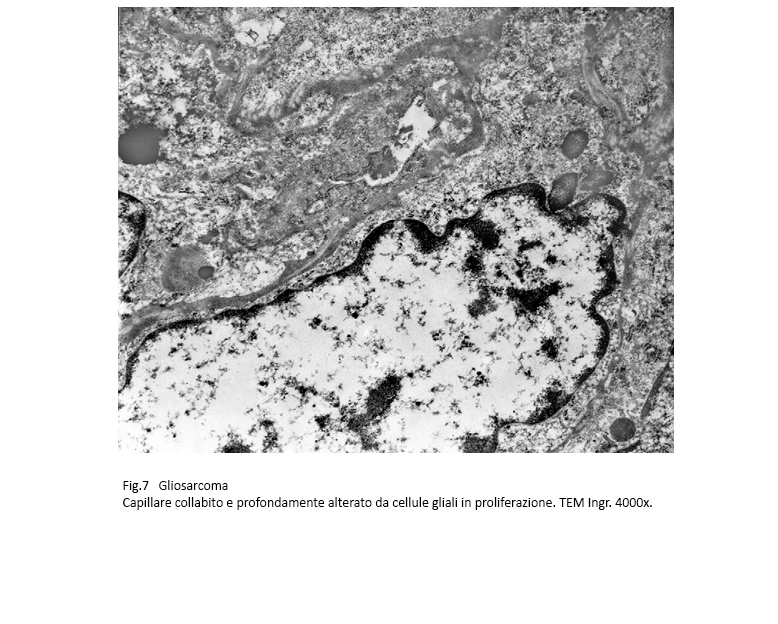
Frequente è il riscontro di focolai degenerativi espressi soprattutto da processi di vacuolizzazione progressiva, fino alla lisi del citoplasma oppure da microfoci di necrosi coagulativa del citoplasma.
Fig.8 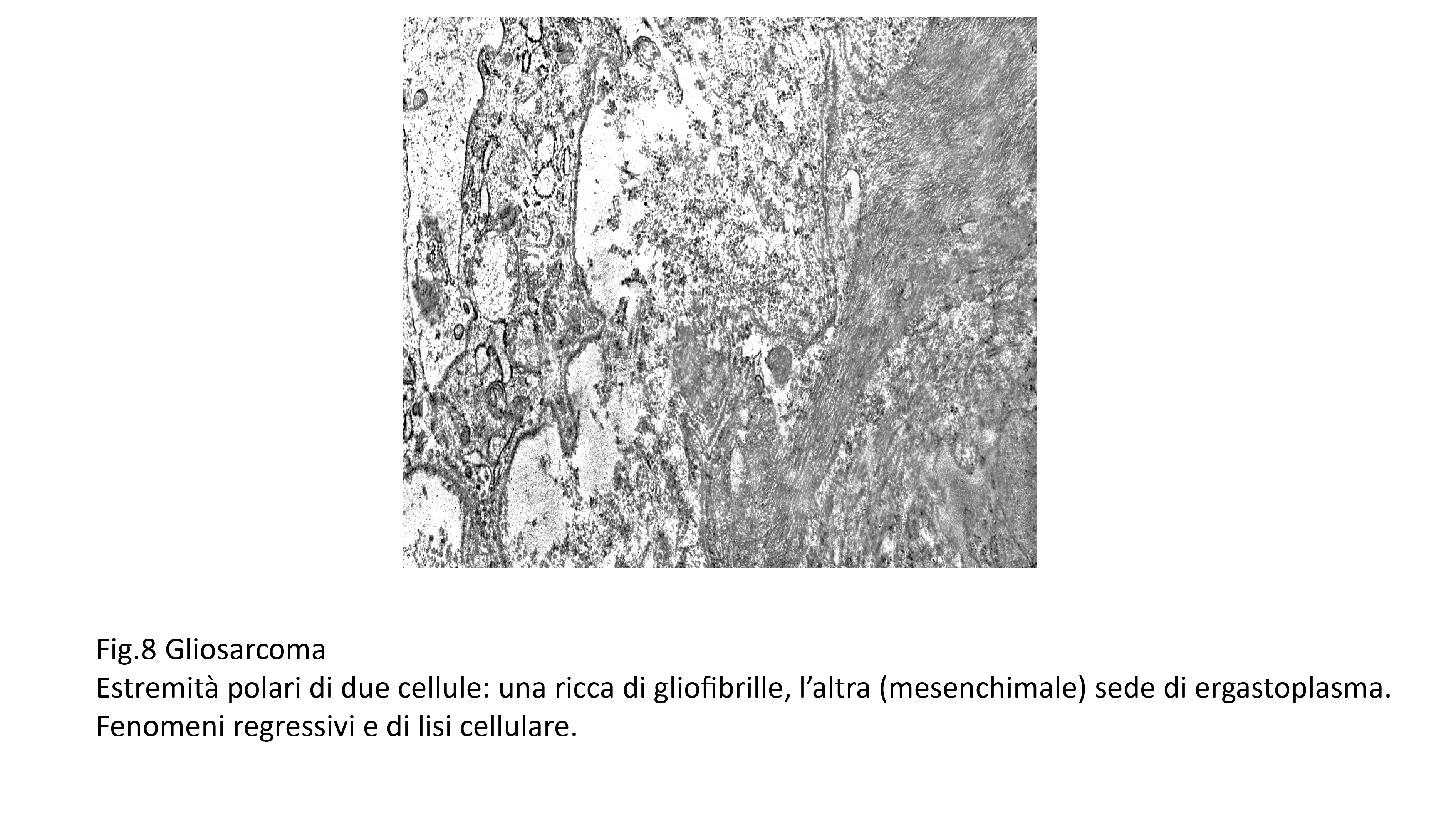 Fig.9
Fig.9 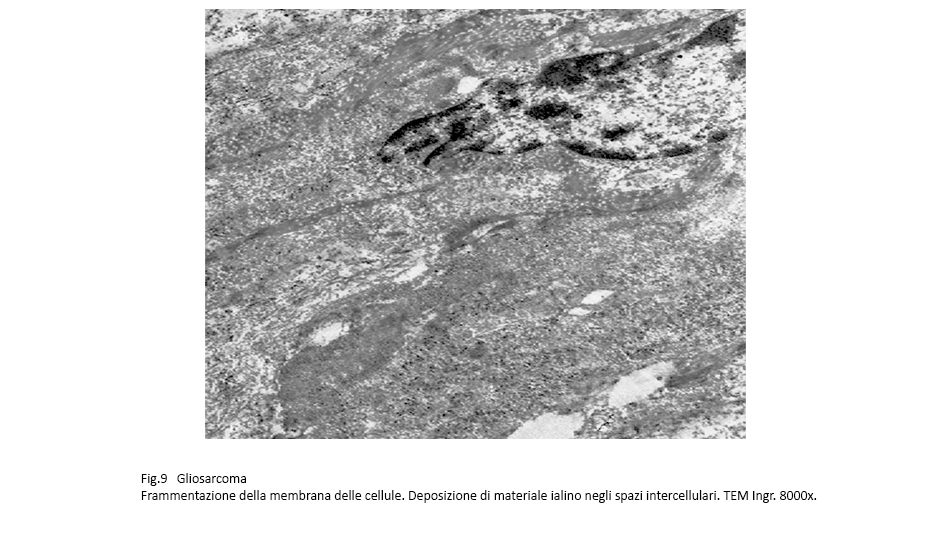 Fig.10
Fig.10 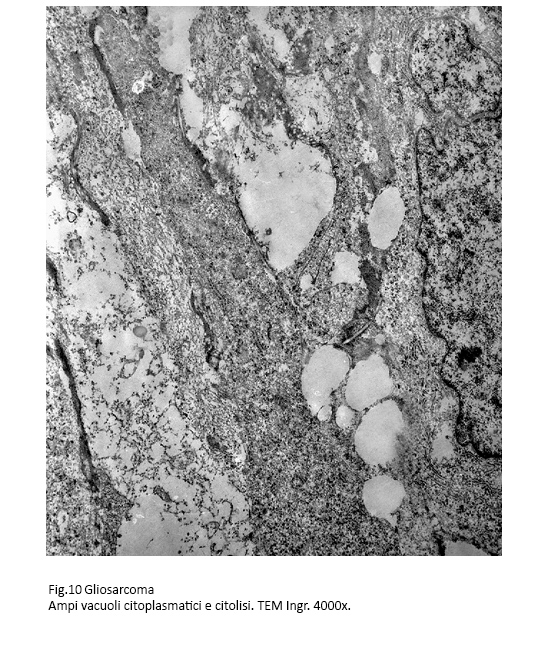
Fig.11  Fig.12
Fig.12 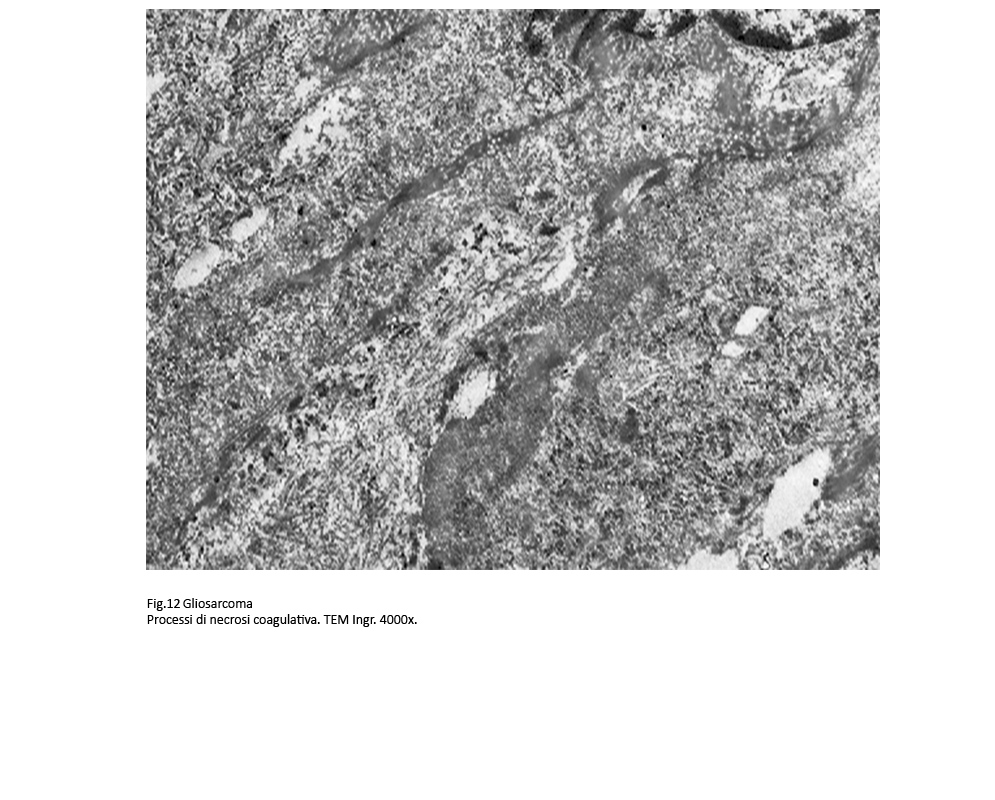
Il secondo citotipo ,presente nei casi osservati, è dato da elementi riferibili a fibrosarcoma.
Essi hanno quasi sempre una forma fusata e sono riuniti in fascetti disposti in modo parallelo.
Fig.13 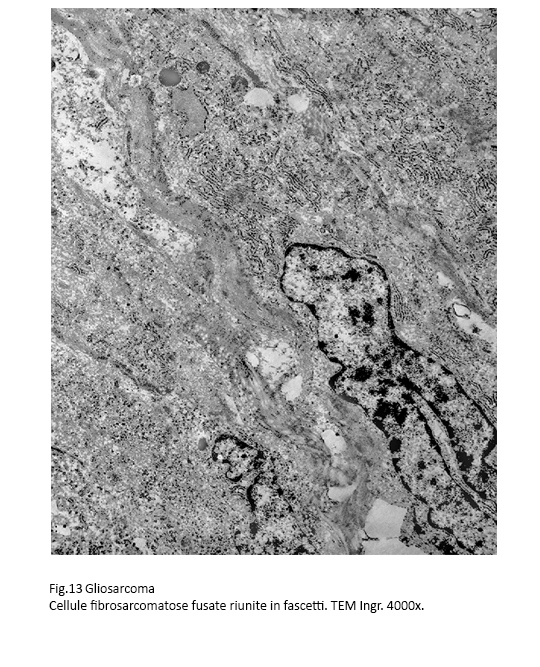 Fig.14
Fig.14 
Hanno un citoplasma in quantità variabili e sono occupati da nuclei oblunghi, vescicolosi con cromatina a zolle raccolte soprattutto alla periferia e a ridosso della membrana nucleare.
Fig.15 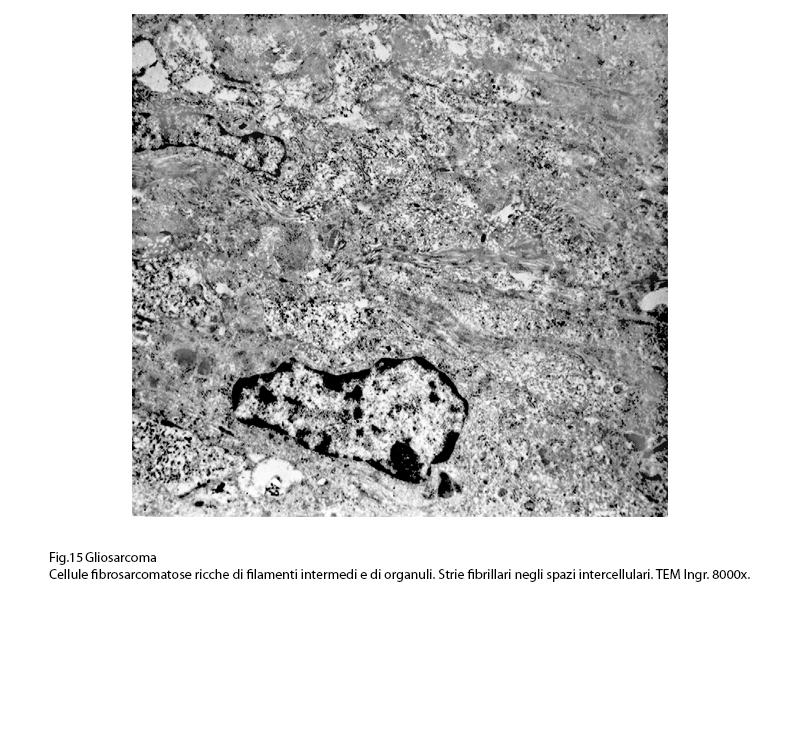 Fig.16
Fig.16 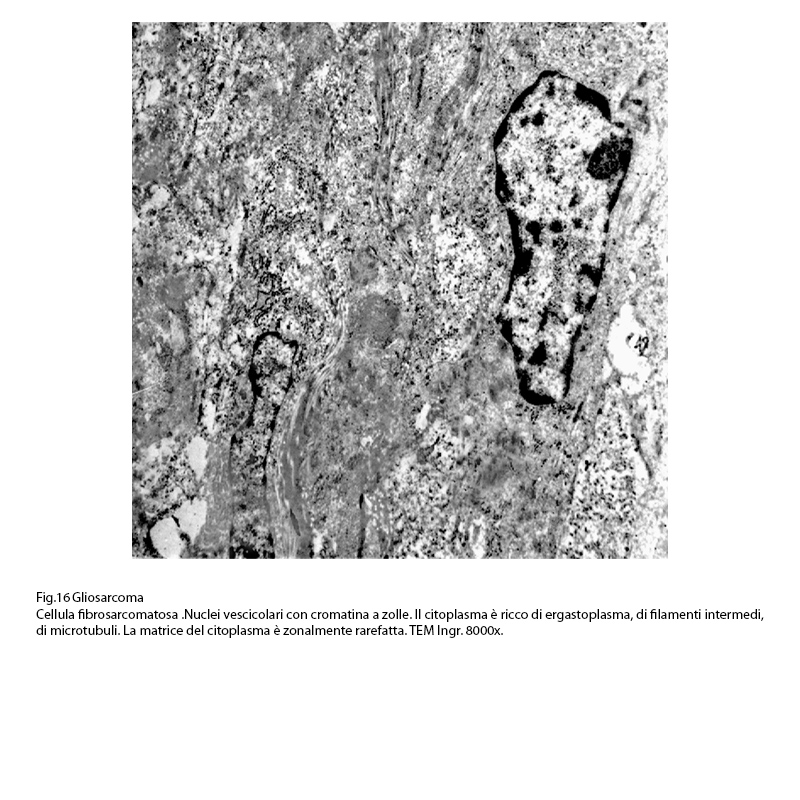
La matrice citoplasmatica, poco compatta, accoglie quote ben sviluppate di ergastoplasma rugoso con cisterne ectasiche o microcistiche e diversi mitocondri spesso vacuolizzati e con creste spezzettate.
Fig.17 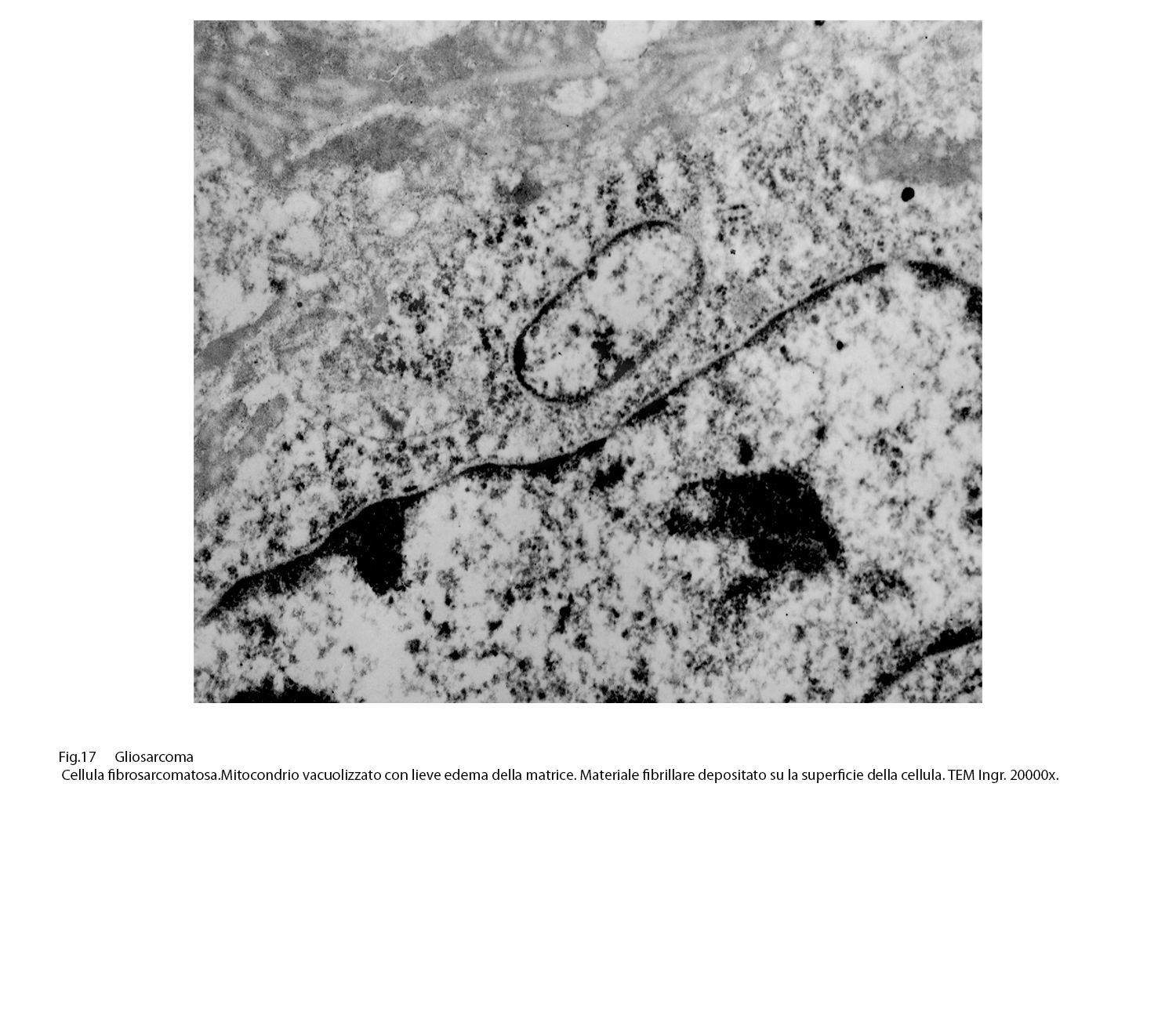
Inoltre sono evidenziabili quote cospicue di microtubuli e di fibrille; i primi si raccolgono soprattutto nelle sedi periferiche del citoplasma e soprattutto a livello a ridosso della membrana cellulare; invece le sub strutture fibrillari sono riunite in fascetti di vario spessore e sono presenti sopratutto in sede peri-nucleare e alle estremità polari delle cellule .
Alla periferia delle cellule si repertano fibrille , corpi densi , organuli in quantità crescenti in rapporto alla loro attività proliferativa. (Ultrastruct.Pathol. 2004,28,67-78) (Ultrastruct. Pathol. 2014, 38, 387-98).
Fig.18 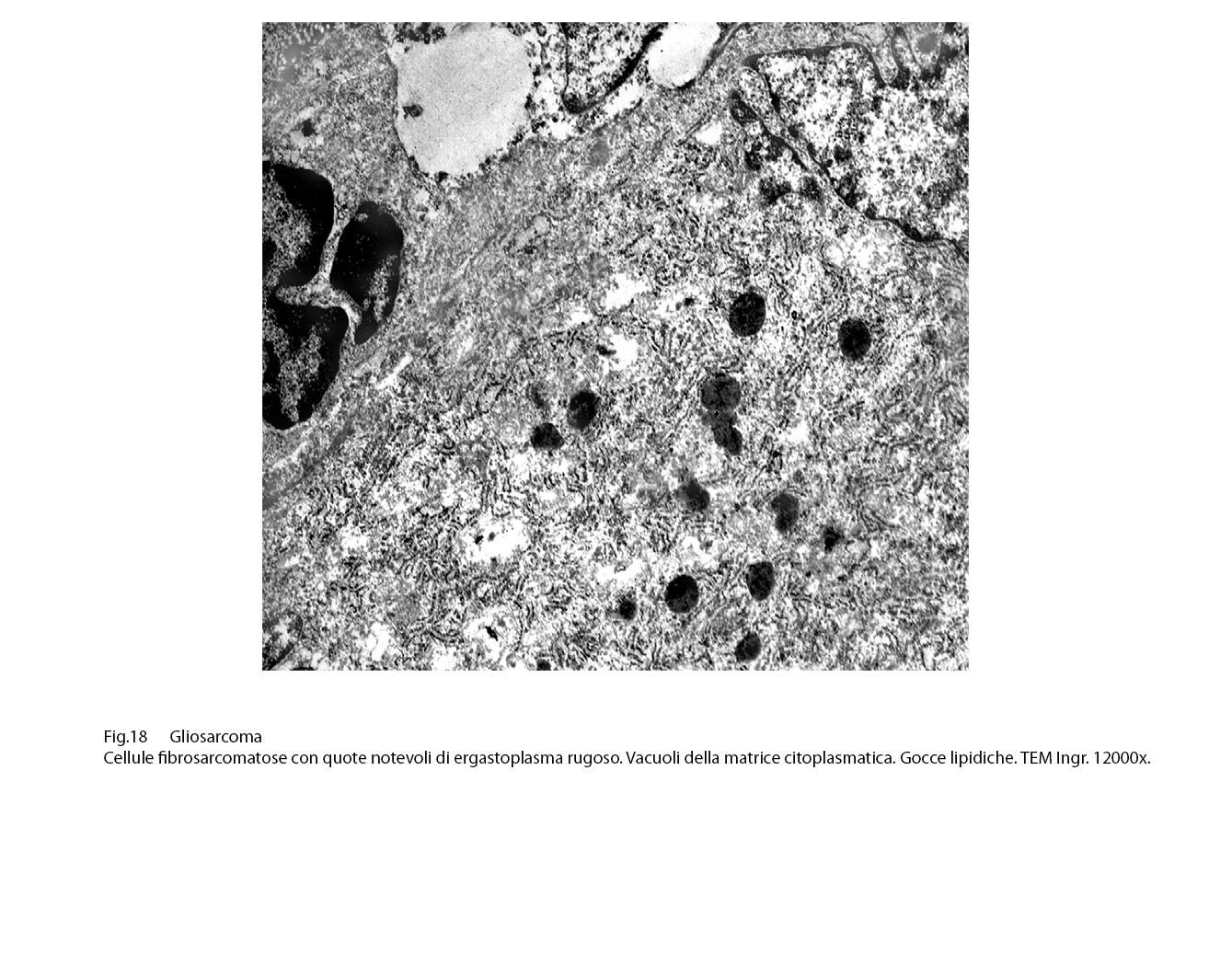
In quantità molto esigue e distribuite in modo apparentemente casuale si riscontrano elementi dismorfi, irregolari, voluminosi, e centrati da nuclei lobulati, marcatamente ipercromatinici oppure occupati da due formazioni nucleari (cellule binucleate).
Fig.19 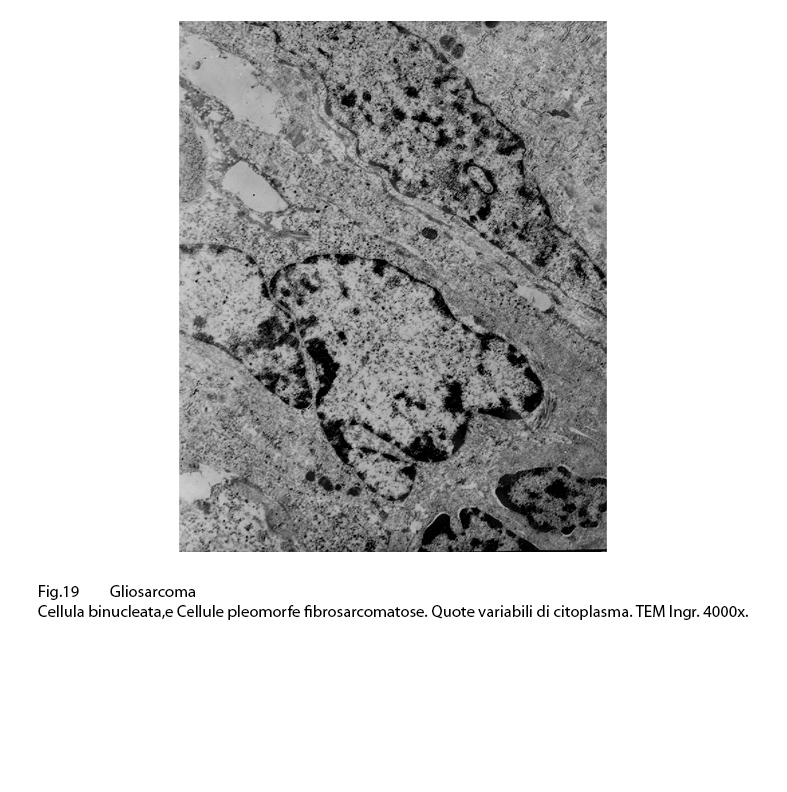
Questi elementi, sebbene pleomorfi, ripetono le medesime sub-strutture citologiche dianzi descritte e pertanto sono da considerare quali cellule con caratteri fibro-sarcomatosi.
Fig.20 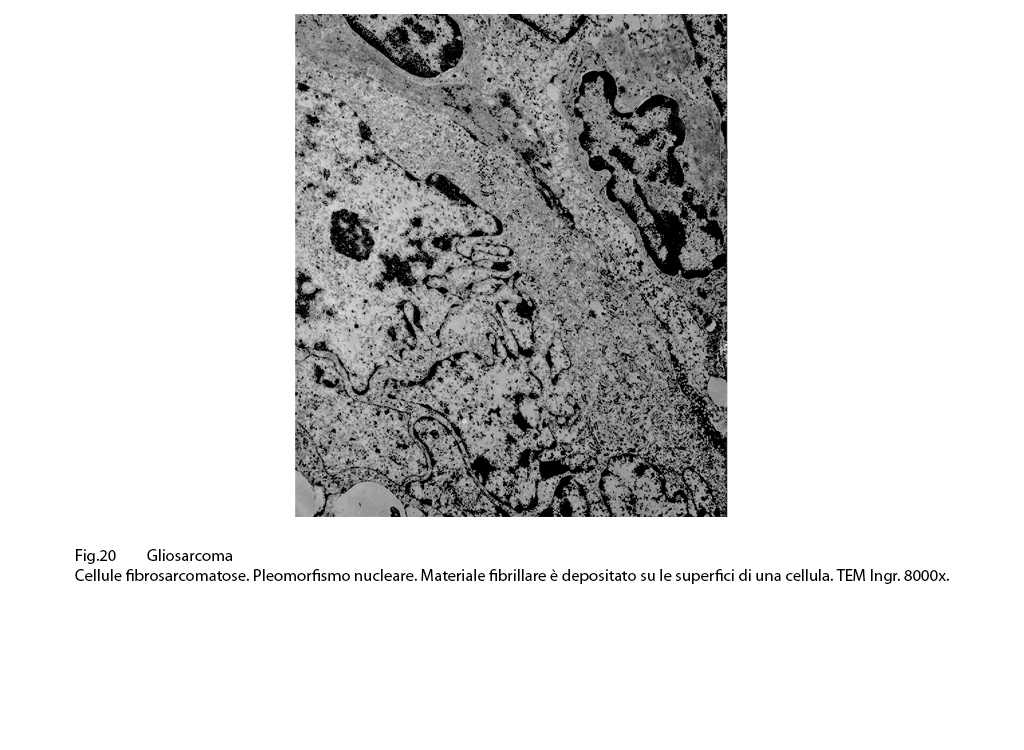
Le superfici esterne delle cellule sono cosparse in alcuni punti da materiale fibrillare denso e la localizzazione di questo materiale è in corrispondenza di gruppi di microtubuli sub-membrane fornendo così immagini simili a strutture “fibronexus”.
Fig.21 
Gli spazi intercellulari possono apparire virtuali per adesione tra le cellule oppure essere occupati da sottili fibrille reticolari.
Fig.22 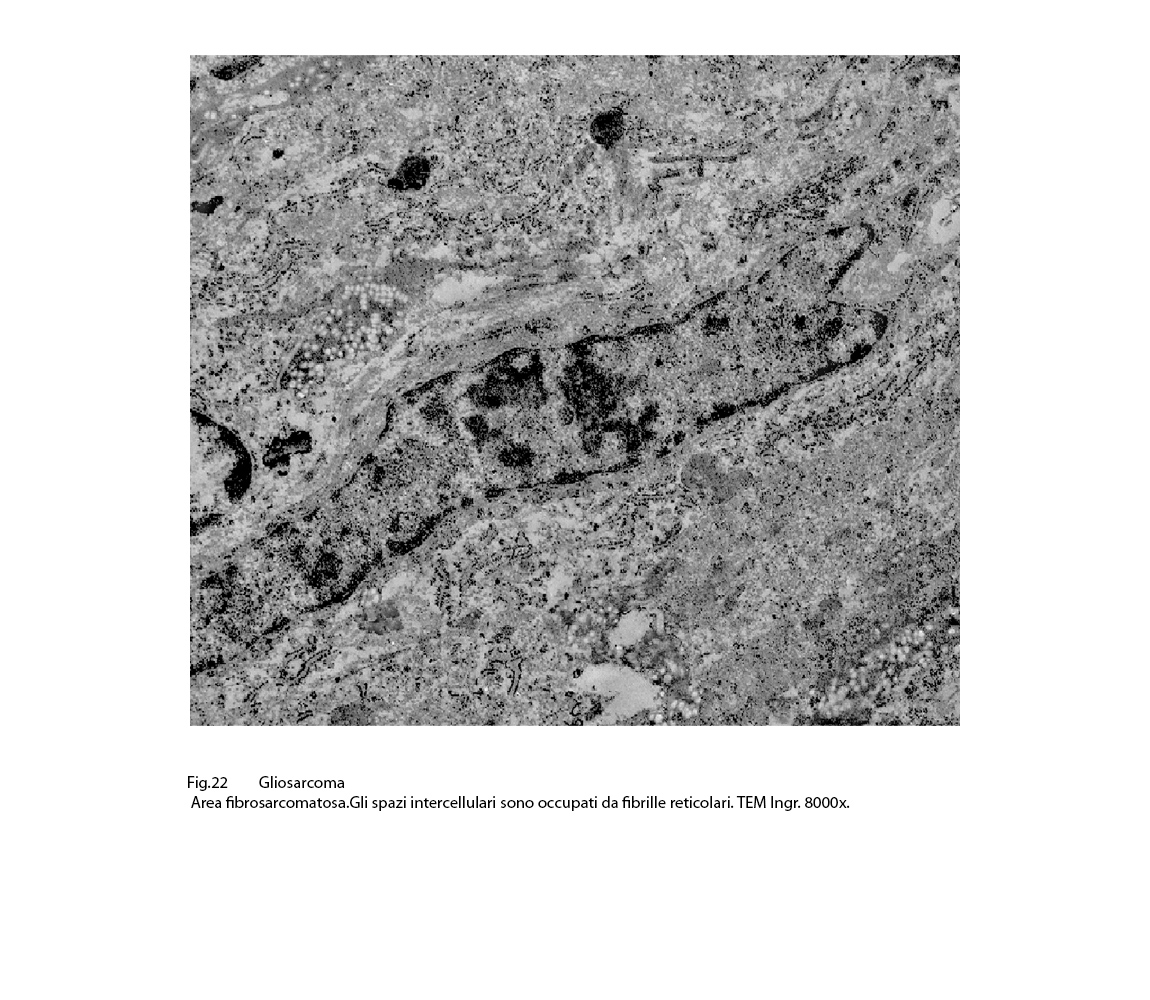
Sono presenti fenomeni regressivi di varia entità fino alla necrosi cellulare; i processi regressivi qui riportati si riferiscono a rarefazione e vacuolizzazione idropica del citoplasma e a processi di steatosi.
Fig.23 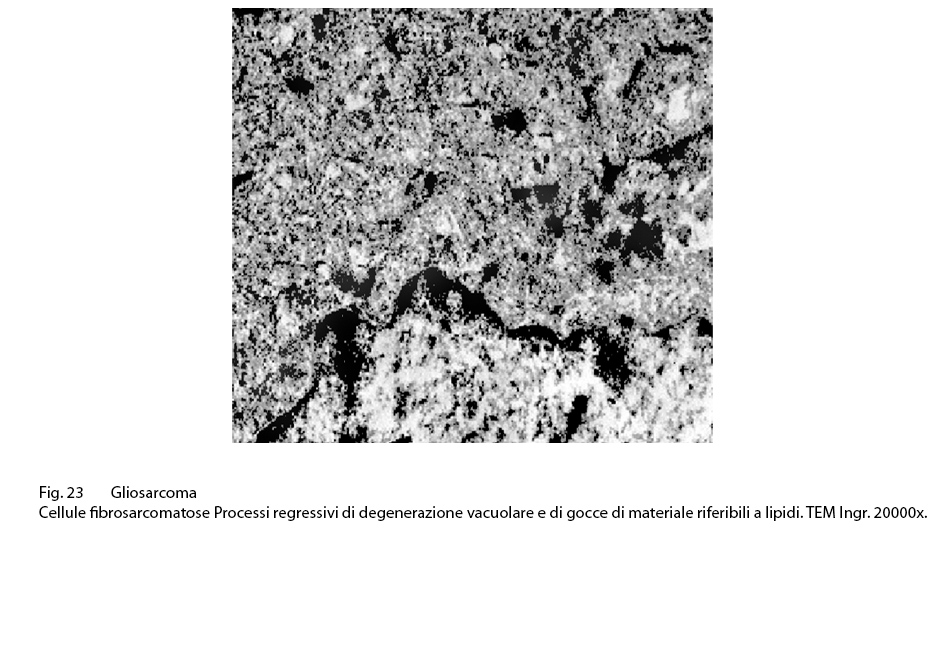
Nel contesto della popolazione glio-sarcomatosa e distribuite nelle aree di maggiore densità cellulare per processi in attività proliferativa si riconosce la presenza di cellule stem.
Queste sono selezionabili con difficoltà ma si riconoscono per la loro precisa identità morfologica:
Sono di piccola taglia, hanno forma rotondeggiante e sono fornite di uno scarso alone citoplasmatico che è in contrasto con la grossa massa nucleare. La matrice citoplasmatica, ben delimitata da una membrana contiene rari organuli, quote discrete di microtubuli e molti ribosomi e poliribosomi.
Fig.24 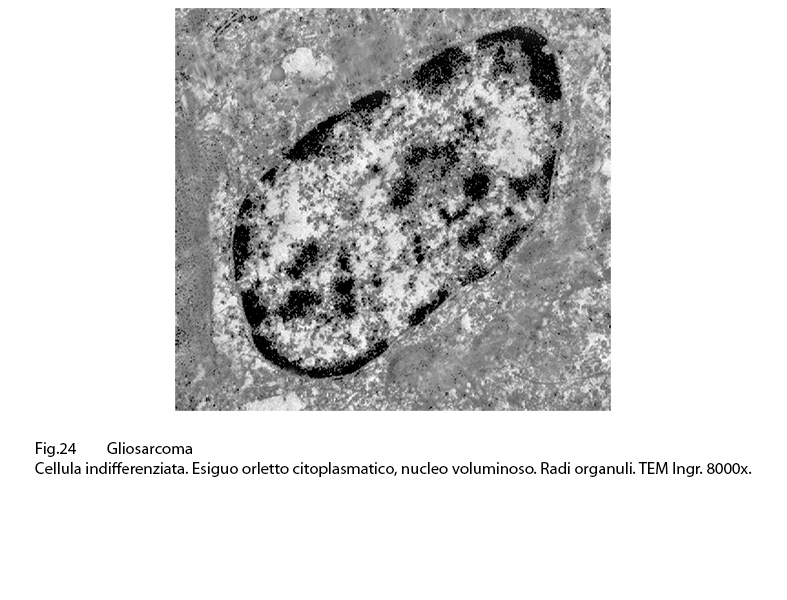 Fig.25
Fig.25 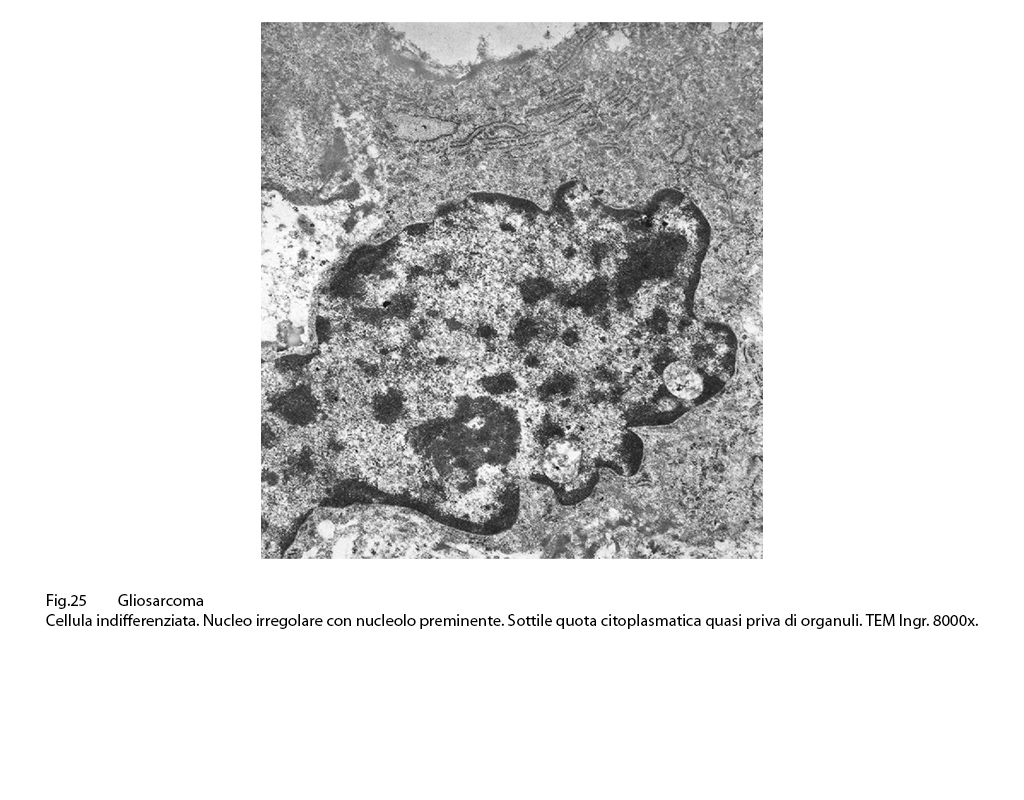 Fig.26
Fig.26 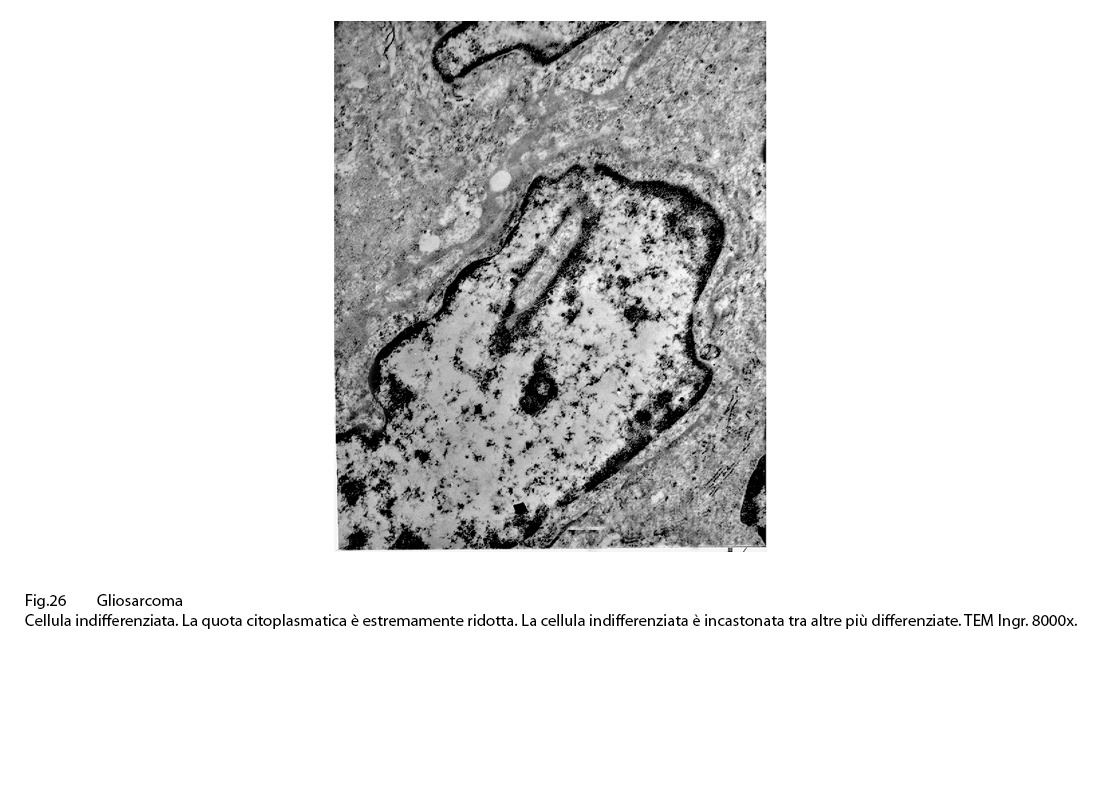
Il nucleo di questi elementi ha un profilo irregolare,anfrattuoso o ripiegato in se stesso, è vescicoloso e mostra zolle di cromatina addensate alla periferia. Frequentemente questi elementi sono in preda a degenerazione idropica con conseguente frammentazione della membrana cellulare.
Un esame ultrastrutturale analitico , dettagliato dei gliosarcomi mette in evidenza una popolazione cellulare composita oltre i tre citotipi dianzi descritti,quali quote dominanti e caratterizzanti la neoplasia,si repertano in piccole quantità elementi cellule identificabili con difficoltà.Tra questi due citotipi sono qui segnalati:
- Elementi cellulari in corso di differenziazione aventi un profilo ultrastrutturale incerto, non definibile.
- Il riscontro di elementi cellulari con citoplasma ricolmo da quote iperdense di gliofibrille. Tale dato ultrastrutturale lascia aperta l’ipotesi che siano elementi astrocitari reattivi coinvolti nel processo neoplastico.
L’istogenesi del gliosarcoma in passato è stata incerta; si riteneva che questa neoplasia fosse un tumore da collisione. Le ricerche genetico-molecolari hanno messo in evidenza e hanno confermato la unitarietà della neoplasia.
In questi ultimi anni è stata prospettata l’ipotesi essere il gliosarcoma un tumore espresso secondo i processi di transizione epitelio-mesenchimale “Epitelial-Mesenchimal Transition” (EMT)
(Brain Pathol, 2012, 22, 670-6)
(Int J. Oncol., 2015, 46, 2515-25)
L’EMT è un processo bio-morfologico complesso mediante il quale le cellule epiteliali subiscono una transizione verso i caratteri morfologici immunoistochimici e funzionali delle cellule mesenchimali.
In conseguenza di ciò le cellule epiteliali perdono la loro polarità, riducono la loro coesione intercellulare, si staccano dalla membrana basale, sono private dei loro specifici markers; contestualmente gli stessi elementi acquisiscono la forma, le modalità funzionali, la plasticità, i markers delle cellule mesenchimali (Clin. Neuropathol. 2013, 32, 508-14)
(Onco Targets 2014, 7, 1933-44).
L’EMT è presente nello sviluppo embrionale, nei processi di riparazione dei tessuti, e in quelli sclerosanti degli organi; esso svolge un ruolo importante nella moltiplicazione e crescita delle cellule stesse, nella progressione delle neoplasie maligne e nei meccanismi e regolano la loro metastatizzazione.
(Sci Signal 2014, 7 (344) ):re 8
Durante tale transizione si ha perdita delle citocheratine, della E-cadherina, della occludina, delle proteine giunzionali ed acquisizione di Vimentina, fibronectina, di FSP-1, di N-Cadherina, di actina muscolo liscio, di desmoplakina, di beta-catenina, di TGF-beta1, di Smail1, Smail2/Slug, di TWIST.
(Int. J. Oncol. 2015, 46, 2515-25)
(Biomed Rep. 2015, 3, 603-10)
Nel corso dei processi di EMT i filamenti intermedi acquisiscono i caratteri di tipo III, in quanto sono specifici delle cellule mesenchimali. (Nat. Cell Biol. 2006, 8, 156-62).
In questi processi di EMT sono coinvolti diversi geni tra i quali si vogliono ricordare i YKL-40, TNC, CD105 e i geni TWIST che codificano la proteina TWIST1 e la proteina TWIST2.
La proteina TWIST1 regola diverse proteine correlate con l’EMT e si ha una correlazione tra l’espressività di questa proteina e il grado del tumore.
Essa non solo attiva i processi di EMT ma induce quelli della invasività e delle metastasi. La proteina TWIST2 promuove la proliferazione delle cellule Stem. D’altra parte è stato rilevato che i glioni di alto grado, i glioblastomi multiformi e le cellule mesenchimali presenti nei gliosarcomi, le cellule stem dei glioblastomi e dei gliosarcomi, hanno gli stessi fattori genetici che promuovono l’EMT quali l’YKL-40, il CD105, i TWIST, il TNC, SOX2, Msi-1.
(Neuro Oncol. 2014, 16, 671-85)
(Brain Tumor Pathol. 2014, 31, 40-46)
E’ stato accertato che il gene TWIST regola diverse proteine che partecipano al processo EMT controllando lo sviluppo della neoangiogenesi, della proliferazione delle cellule stem e favorendo la diffusione delle metastasi. (Cell, 2004, 118, 277-79) (Cancer Res., 2008, 68, 257-60)
E’ stato riportato anche che il fattore TWIST è codificato da due geni con sintesi di due proteine TWIST1 e TWIST2. (J. Genet. Syndr. Gene Ther 2013, 4, ). Molto frequentemente le cellule stem presenti nei gliosarcomi evidenziano markers mesenchimali quali CD29, CD44, CD90, CD105, YKL 40, TNC. (Onco Targets, 2014, 7, 1933-44).
Nei gliomi di alto grado e in particolare nei gliosarcomi è stato documentata la presenza della proteina TWIST (codificata dal gene specifico TWIST), la riduzione della E-Cadherina e un aumento della N-Cadherina; inoltre nelle cellule mesenchimali del gliosarcoma è stata evidenziata la espressività di Slug, di MMP2, di MMP9, di (ZEB).
(Neuro Oncol. 2014, 16, 671-85).
L’interpretazione istogenetica dei gliosarcomi secondo i processi di trascrizione dell’EMT è molto suggestiva e poggia su reperti di immunoistochimica e di indagini genetico-molecolari.
Inoltre permette di considerare questa neoplasia apparentemente bifasica quale manifestazione eclatante di un processo biologico-morfologico che è esistente ,anche se con modalità e gradualità diverse, in altre neoplasie.
Allo stesso modo la conoscenza dei processi di EMT consente di intuire la esistenza di una unica realtà biologica che si snoda secondo gli stessi paradigmi nella embriogenesi, nella bio-morfologia fisiologica della crescita, nei processi riparativi e nei processi neoplastici.

