Gastrite da Helicobacter-Pylori
(Osservazioni al microscopio elettronico)
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica
.
-
Gli H-Pylori fanno parte della specie Helicobacter gastrici, Gram-negativi e si caratterizzano per essere ureasi positivi e per essere mobili mediante un flagello (Microbes Infect 2000; 2: 55-60) (Clin. Microbiol. 2001; 14:59-97).
Come tutti i batteri Gram-negativi,gli H.pylori sono forniti di una doppia membrana di contorno; quella interna è costituita da fosfolipidi, quella esterna (indicata con l’acronimo OMPs (Outer Membrane proteins) è formata da proteine, lipoproteine, porine, adesine, proteine regolatrici del ferro.
Queste proteine sono molto numerose, garantiscono la struttura della membrana, regolano il transito trans-membranoso delle molecole, determinano la adesione dei batteri alla superficie degli epiteli, formano le vescicole OMVs (Outer Membrane vescicles) (Mol. Microbiol. 2018; 107(6): 676-687).
Gli H-Pylori sono dispersi nel materiale mucinoso del lume gastrico, e si depositano su la superficie della mucosa e nelle foveole mediante un tropismo selettivo (World J. Gastroenterol. 2014; 20(36): 12767-12780).
Questi batteri aderiscono su la superficie di tali cellule mediante le adesine BabA (Blood group antigen-binding adhesion). Questa aderenza ha i caratteri dell’ancoraggio in quanto resiste alla motilità peristaltica, alle perturbazioni del pH, all’arrivo dei nutrienti, alle variazioni delle secrezioni gastriche ed evidenziano una elevata tendenza all’adattamento ambientale (Front Cell Infect Microbiol 2016; 6: 159).
Le gastriti acute e croniche indotte dagli H-Pylori sono attivate mediante due meccanismi patogeni:
1. Il primo è conseguente al diretto contatto tra i batteri e le cellule ospiti per il rilascio da parte di queste ultime di citochine e chemochine pro-flogogene.
2. Il secondo meccanismo è dato dai fattori di virulenza secreti dai batteri che danneggiano le cellule bersaglio.
Questi fattori di virulenza sono molteplici, sono solubili e sono internalizzati con il sistema T4SS (Type 4 Secretory System),attraverso la via dell’endocitosi, mediante le vescicole OMVs (Outer Membrane vescicles) (Int. J. Mol. Sci .2018; 19(10): 2891) (Helicobacter 2019; 24(Suppl.1): e12638).
Queste vescicole sintetizzate dagli H. pylori, derivano dalla membrana e sono prodotte da questi batteri durante la loro fase di crescita mediante un controllo genetico. Esse variano per grandezza e contenuti,in rapporto al ceppo batterico, alla fase di crescita, ai differenti terreni di cultura, e alle condizioni ambientali (Mol. Microbiol. 2010; 77: 1539-1555) ( Microorganisms 2020; 8(9): 1328).
Contengono fattori di virulenza quali adesine, proteasi, tossine, numerosi tipi di proteine, lipidi, acidi nucleici, peptoglicani (Semin. Immunopathol. 2011; 33: 395-408) (Protenics 2018; 19: e1800209). La loro internalizzazione nelle cellule avviene mediante il processo di endocitosi clatrina-dipendente e clatrina-indipendente, aggregandosi successivamente agli endosomi e ai lisosomi (Microorganisms 2020; 8(9): 1328). Svolgono importanti azioni patogene in particolare provocano danni regressivi e partecipano in modo attivo alla istogenesi dei processi displastico-neoplastici (Microbes Infect. 2000; 2: 1669-1676).
I fattori di virulenza secreti dagli H.pylori sono molteplici,quelli maggiormente noti sono i seguenti : VacA, CagA, DupA, OipA, BabA.
Tra questi, i fattori VacA e CagA svolgono importanti e complesse attività patogene,sono bene conosciuti e sono qui di seguito segnalati:
A) La tossina VacA (Vacuolating citotoxin A) è una proteina secreta dagli H-Pylori, costituita da due sub-unità: 33/A e 55kDa; la prima di queste determina pori a livello della membrana plasmatica degli epiteli, la seconda si lega agli organelli intra-citoplasmatici provocando blocco della esocitosi, alterazioni del citoscheletro, disturbi dei segnali di trasduzione, necrosi cellulare. ( Rev. Mol. Cell. Biol. 2001; 2: 530-537).(J. Biol. Clem. 2003; 278: 12101-12108) (Nat. Rev. Microbiol. 2005; 3: 320-322) (Ann. Rev. Pathol. 2006; 1: 63-96) (World J. Gastroenterol. 2014; 20(36: 12767-12780).
Questa tossina è secreta come proteina solubile, si deposita su la superficie degli epiteli, si raccoglie negli spazi extracellulari e viene internalizzata nel citoplasma delle cellule ospiti mediante i meccanismi dell’endocitosi e del sistema T4SS (Type 4 Secretory System) (Gut Microbes 2010; 1(6): 392-395).
Presente nel citosol, danneggia la struttura del citoscheletro, induce la formazione di vacuoli che variano per estensione, numero e distruzione dell’area interessata, si accumula nelle vescicole degli endosomi e da queste raggiunge le membrane dei mitocondri (EMBO 2000; 19: 48-56) (Mol. Biol. Chem. 2004; 15: 1946-1959).
A carico dei mitocondri questa tossina forma pori e canali nelle membrane esterne ed interne alterando la loro permeabilità; tale variazione comporta un rigonfiamento e vacuolizzazione di questi organelli, una riduzione del potenziale di membrana, e rilascio del citocromo C.
B) La proteina CagA (Citotoxin associated gene A) è sintetizzata dagli H-Pylori e viene internalizzata nel citoplasma degli epiteli della mucosa gastrica mediante il sistema T4SS (Type 4 Secretory System).
Questo fattore è molto virulento e i ceppi di H-Pylori CagA positivi determinano gravi lesioni quali l’ulcera peptica e il carcinoma gastrico (Science 2000; 287: 1497-1500) (Helicobacter 2011; 16:19-25).
La sua azione patogena è molteplice; essa attiva in modo indiretto processi flogistici a livello della tonaca propria, si raccoglie a livello delle strutture giunzionali alterando le molecole delle giunzioni occludenti e aderenti con il risultato della loro frammentazione e lisi, altera la polarità delle cellule, agisce su i processi di differenziazione epiteliale, provoca danni simili a quelli indotti dal ROS (Reactive Oxygen Species), stimola i meccanismi della mitosi con conseguente aumento delle attività proliferative e favorisce la devianza cellulare in senso displasico e neoplastico( Scand. J. Gastroenterol. 2001;36: 247-250) (Nature 2007; 447: 330-333) (Gut 2015; 64: 720-730).
REPERTI
I campioni, osservati al microscopio elettronico a trasmissione, sono stati ottenuti da frammenti appartenenti ad agobiopsie della mucosa del corpo gastrico di soggetti affetti da gastrite cronica causata da H.pylori.
I reperti evidenziati consentono la seguente breve esposizione:
La membrana plasmatica,nelle zone di contatto con gli H-Pylori, appare ispessita,discontinua; il citosol sottostante è rarefatto ed è occupato da fibrille frammentate del citoscheletro; in alcuni campi, questo reperto è associato a vacuoli e a vescicole di endocitosi.
-
Fig.1 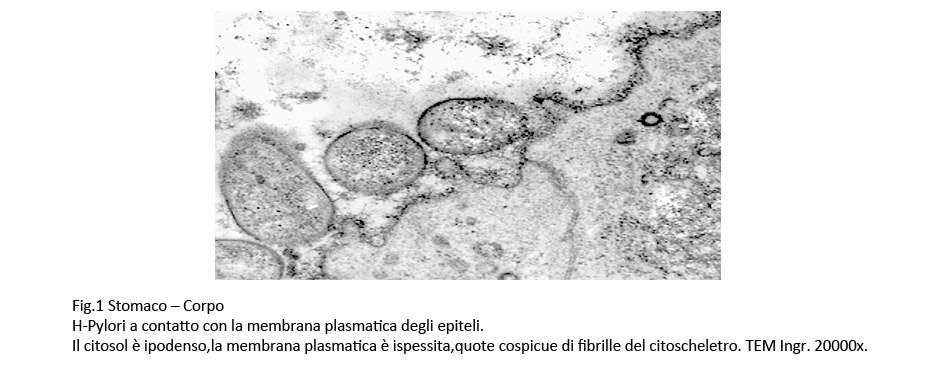 Fig.2 Fig.2 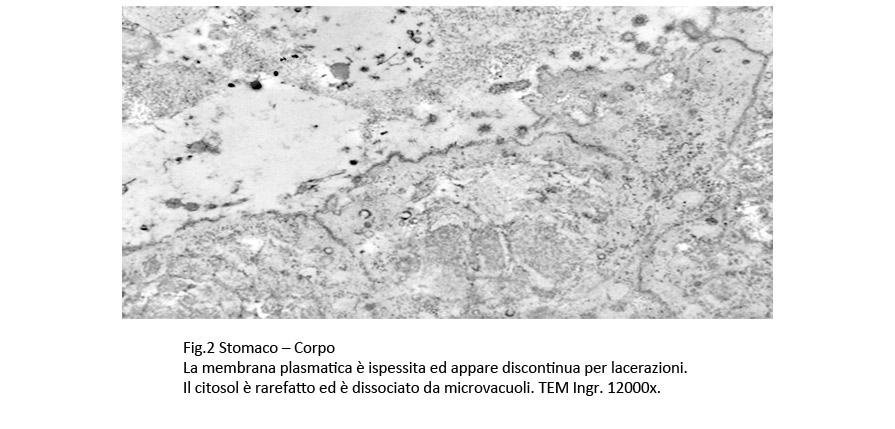 Fig.3 Fig.3 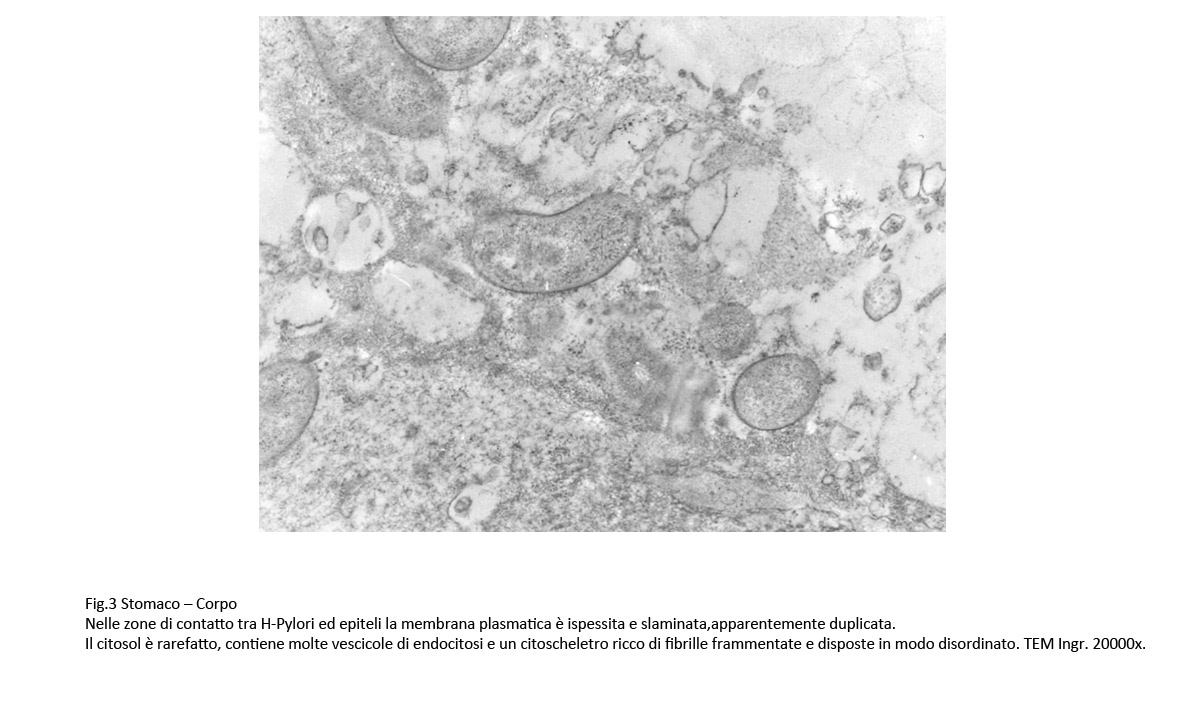
A livello delle foveole occupate da H.pylori, la membrana plasmatica mostra aspetti diversificati per spessore, e frequentemente è interrotta o cancellata. Lo strato superficiale degli epiteli presenta aree addensate per accumulo di fibrille del citoscheletro associato a numerosi vacuoli tra loro confluenti in parte occupati da materiale granulo-filamentoso oppure amorfo. Accanto a questi reperti si ritrovano aggregati di cisterne del reticolo endoplasmico dilatate contenenti materiale amorfo e mitocondri rigonfi, vacuolizzati, con lisi delle creste.
-
Fig.4 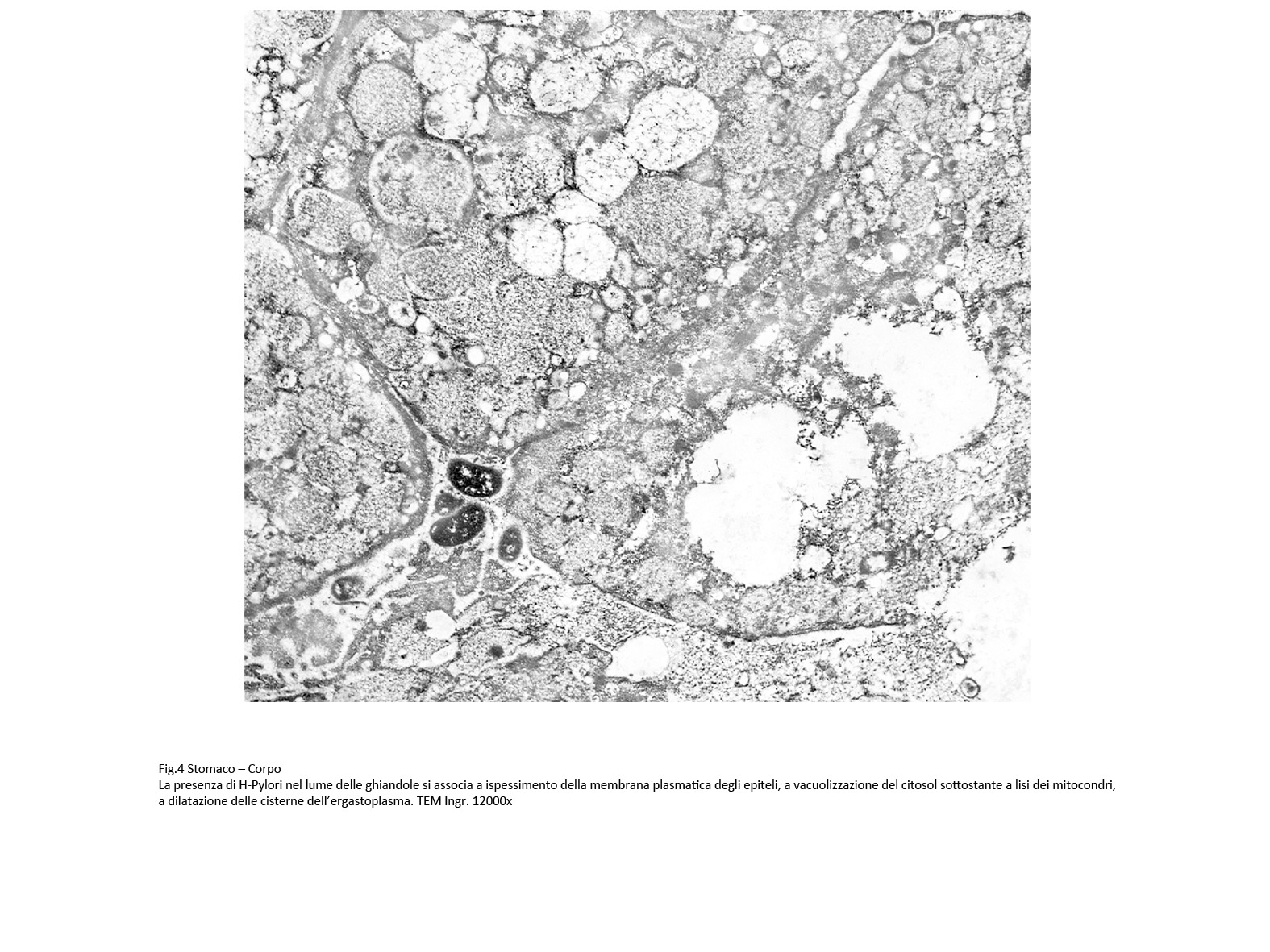 Fig.5 Fig.5 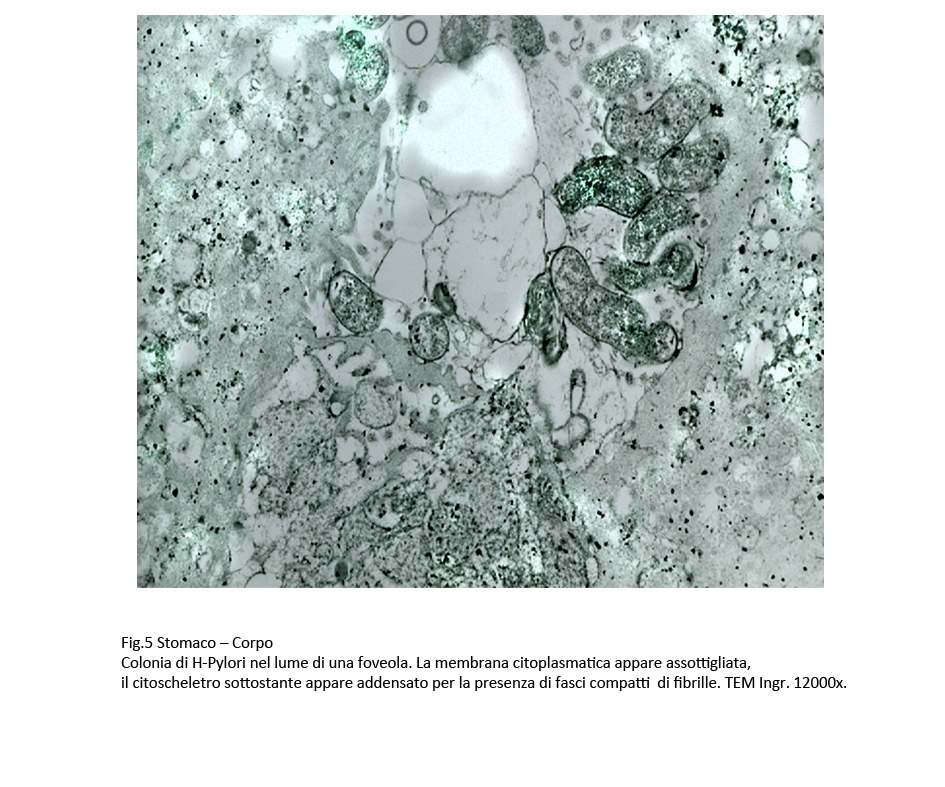 Fig.6 Fig.6 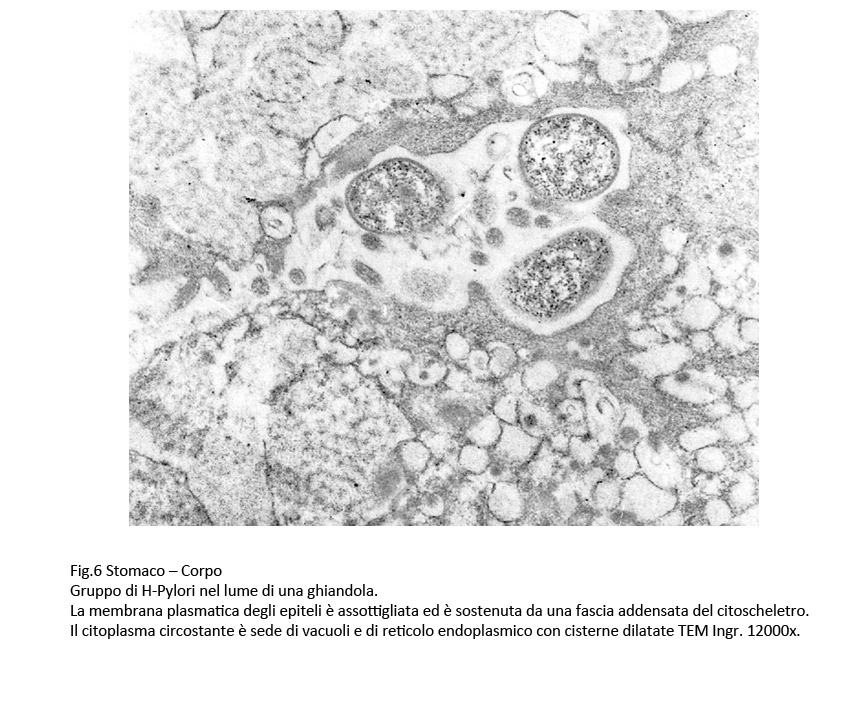
-
Fig.7 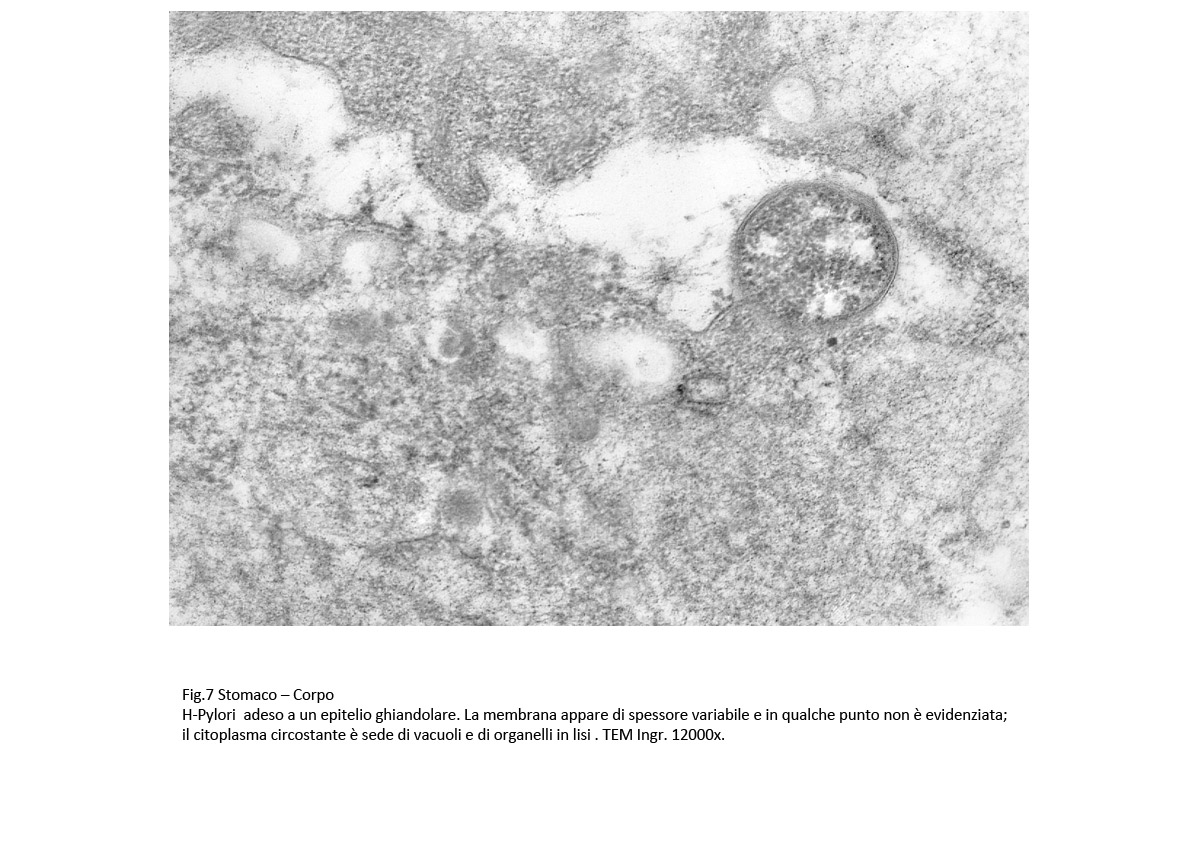 Fig.8 Fig.8 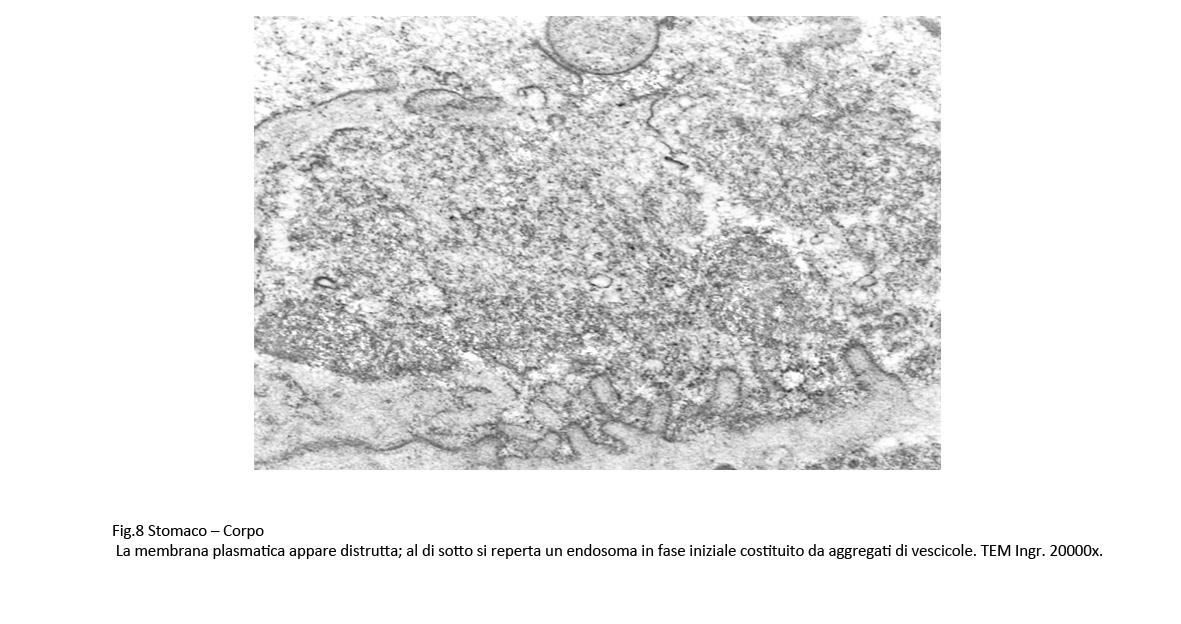 Fig.9 Fig.9 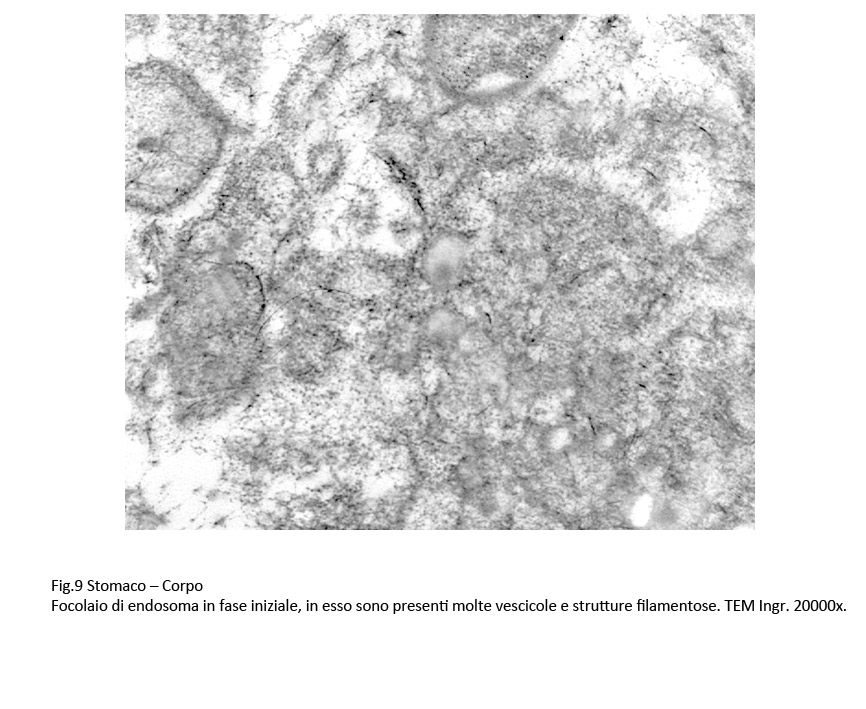
Le strutture giunzionali presentano alterazioni di diversa gravità: Quelle occludenti, a contatto con H-Pylori, presentano microaree di frammentazione alternate ad altre slargate e il citosol peri-giunzionale appare compatto per la presenza di fibrille del citoscheletro addensate.
-
Fig.10 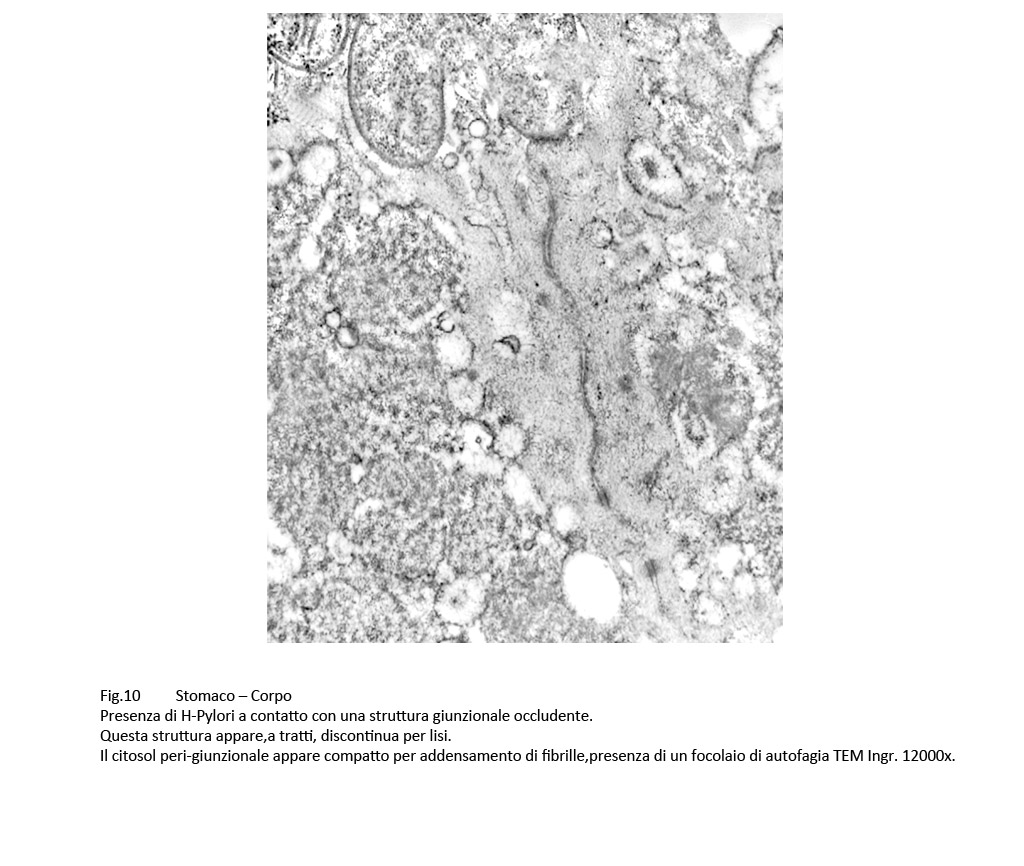
Le giunzioni aderenti appaiono slargate, sono occupate da fibrille o materiale amorfo; esse sono delimitate da placche plasmatiche ispessite e da citosol occupato da numerosi vacuoli contenenti materiale amorfo.
-
Fig.11 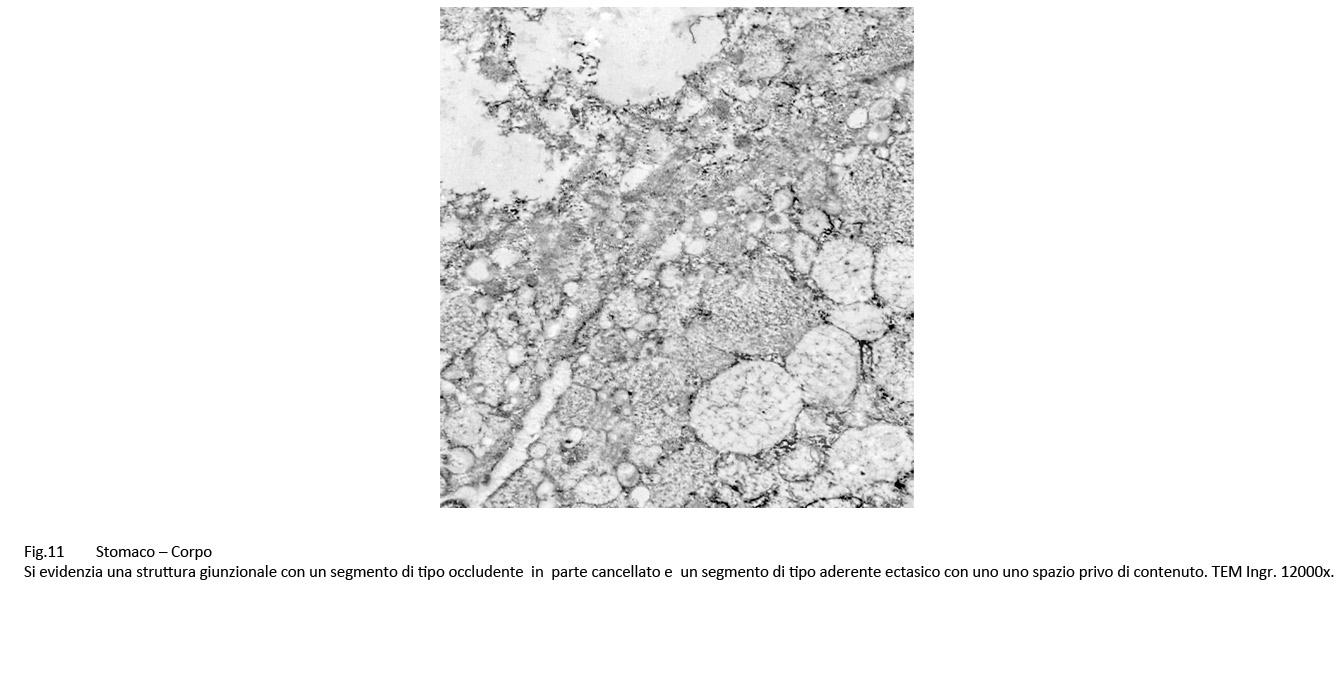 Fig.12 Fig.12 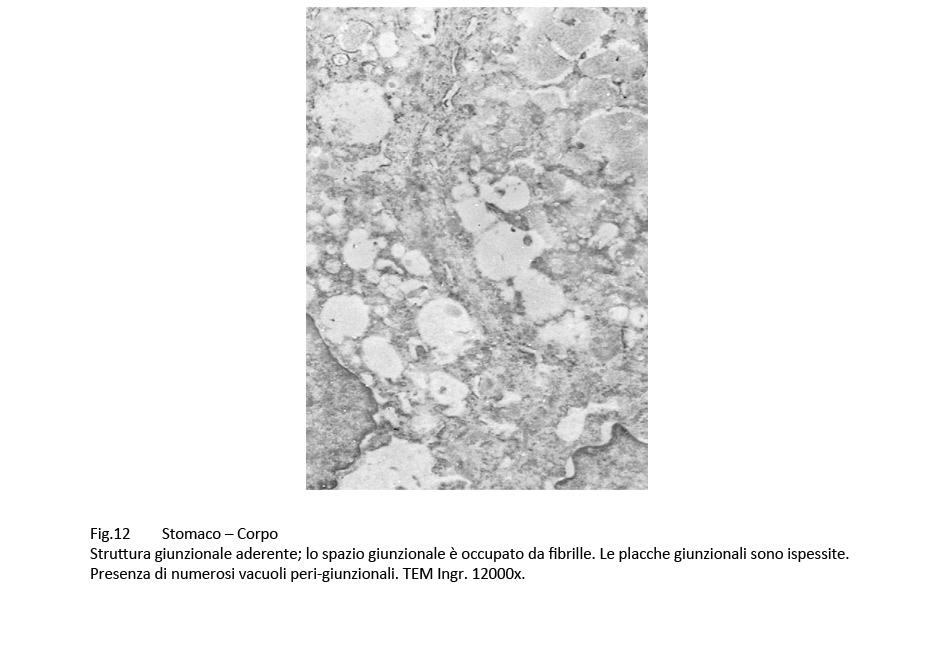 Fig.13 Fig.13 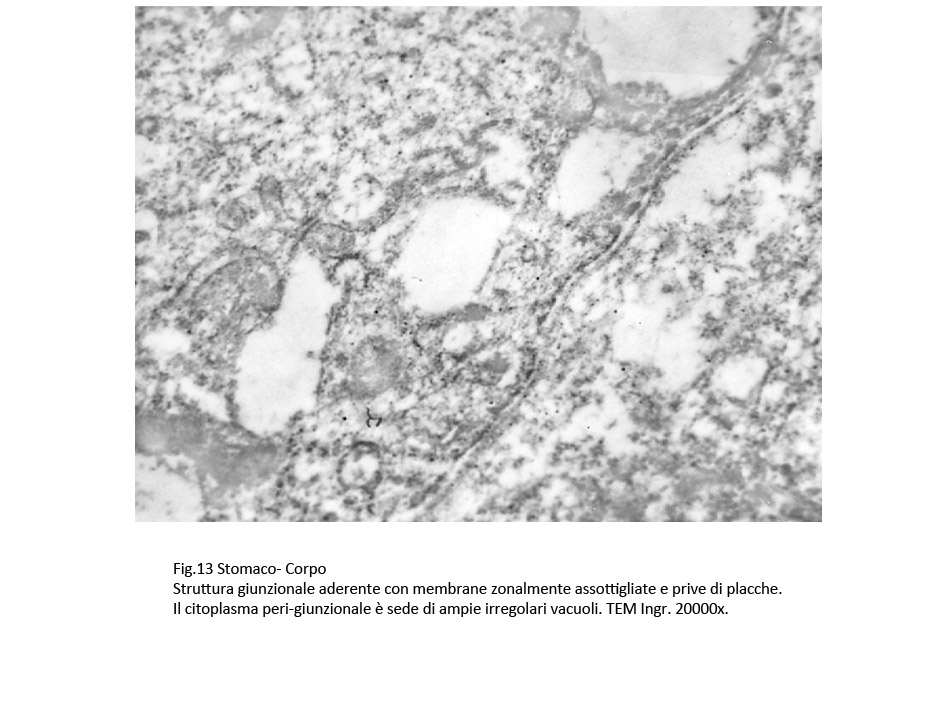
Sono presenti anche strutture giunzionali aderenti le quali, in qualche segmento si presentano destrutturate e sono costeggiate da filiere di fibrille del citoscheletro e da microvescicole.
-
Fig.14 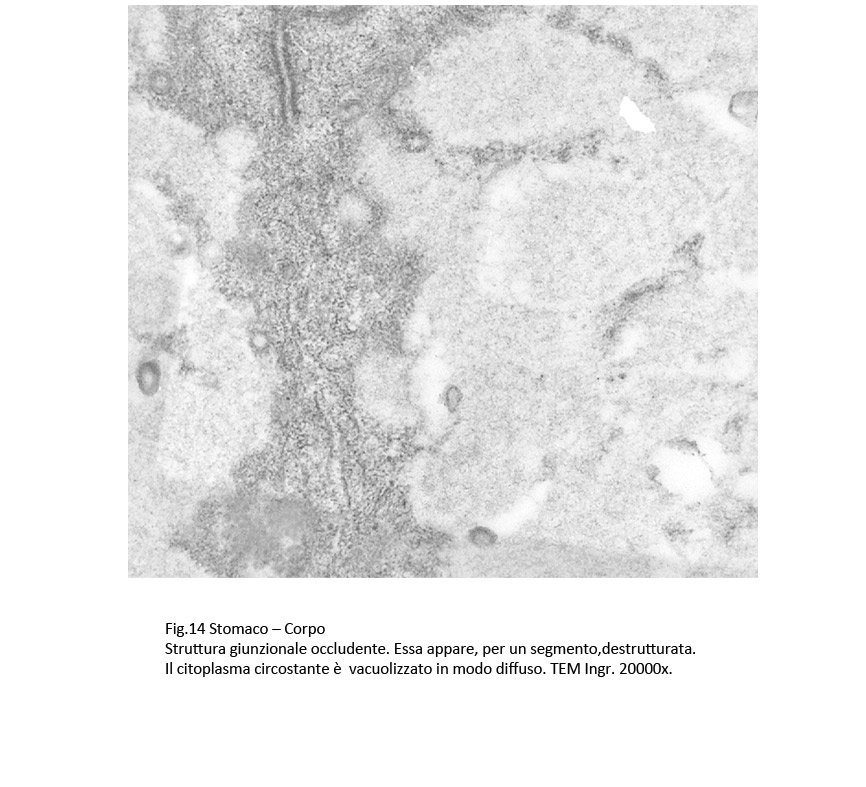
Il carattere più significativo presente nella popolazione cellulare è rappresentato dalla presenza nel citoplasma di vacuoli. Questi sono distribuiti in tutti i compartimenti del citoplasma, sono di varia grandezza, sono presenti in modo apparentemente casuale; se sono disposti in modo contiguo, confluiscono formando ampi spazi lacunari. I vacuoli di piccole dimensioni sono forniti di una membrana di contorno, spesso frammentata; quelli molto ampi sono privi di rivestimento, verosimilmente sono scavati direttamente nel citosol.
-
Fig.15 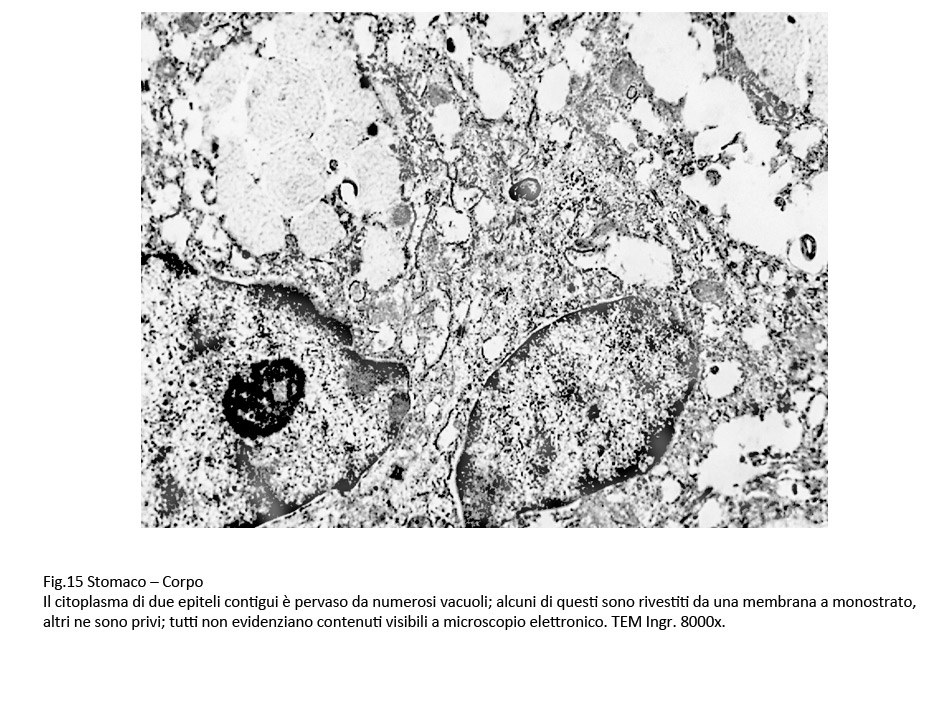 Fig.16 Fig.16 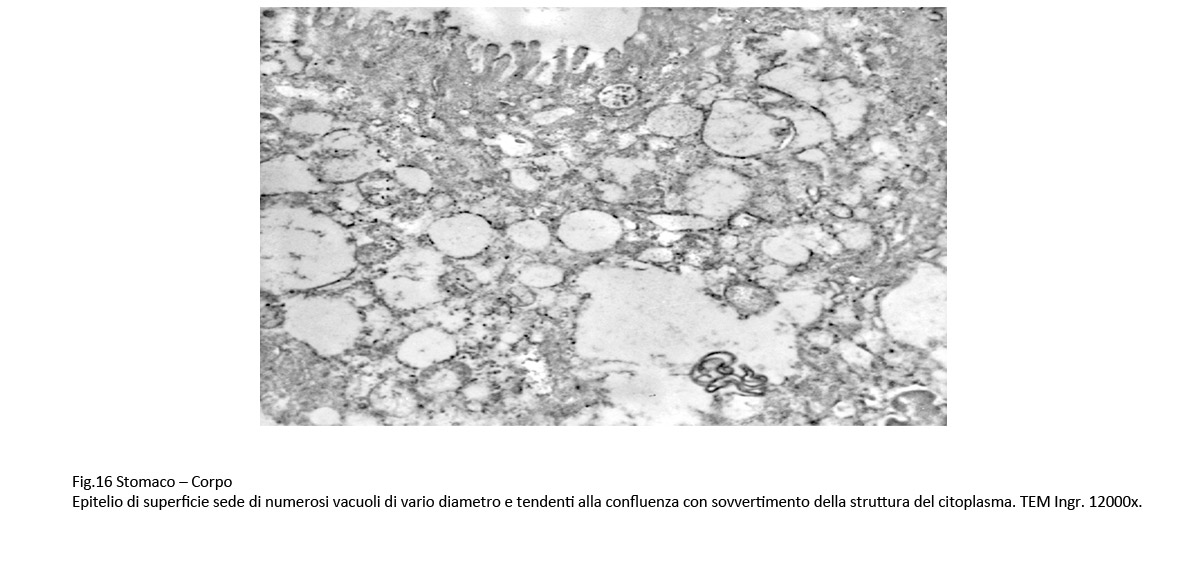
Se il processo di vacuolizzazione è esteso all’intera massa citoplasmatica si ha destrutturazione della cellula con frammentazione delle membrane del reticolo endoplasmico, e formazione di ampie escavazioni occupate da piccoli ammassi di materiale amorfo.
-
Fig.17 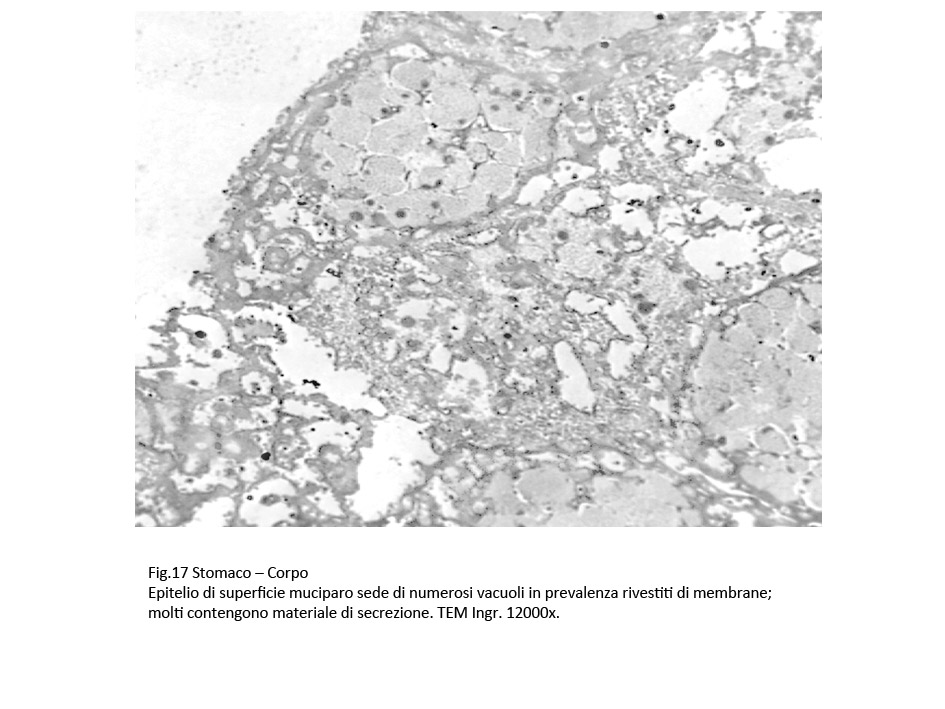 Fig.18 Fig.18 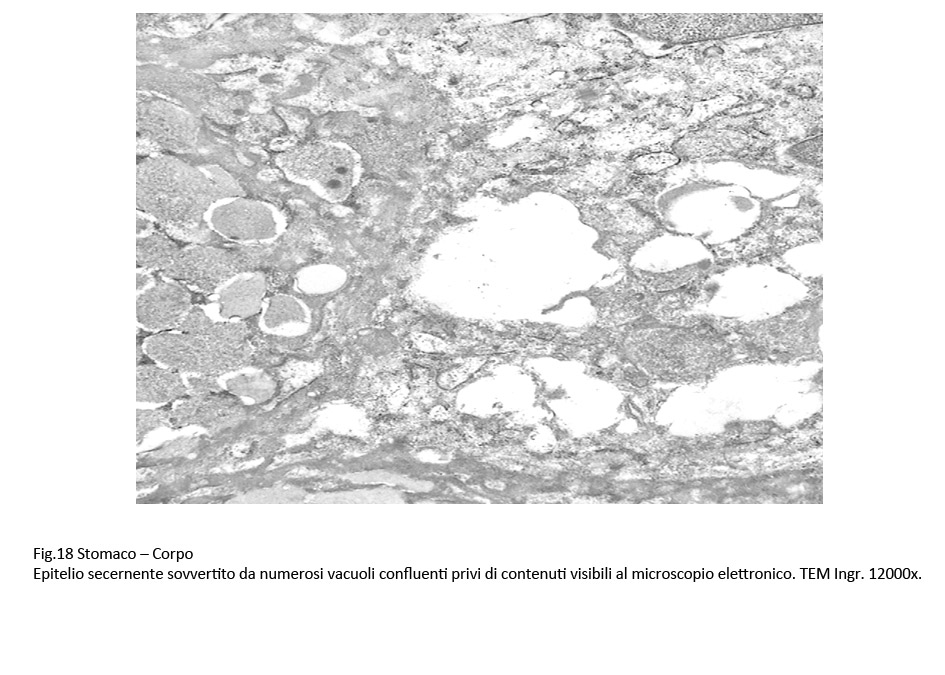 Fig.19 Fig.19 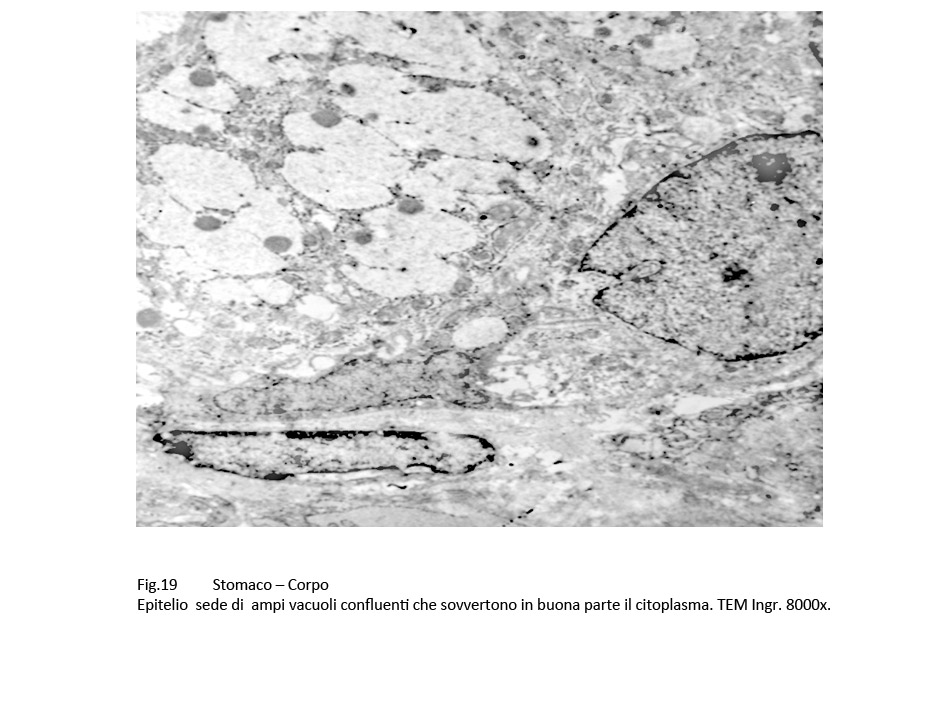
-
Fig. 20 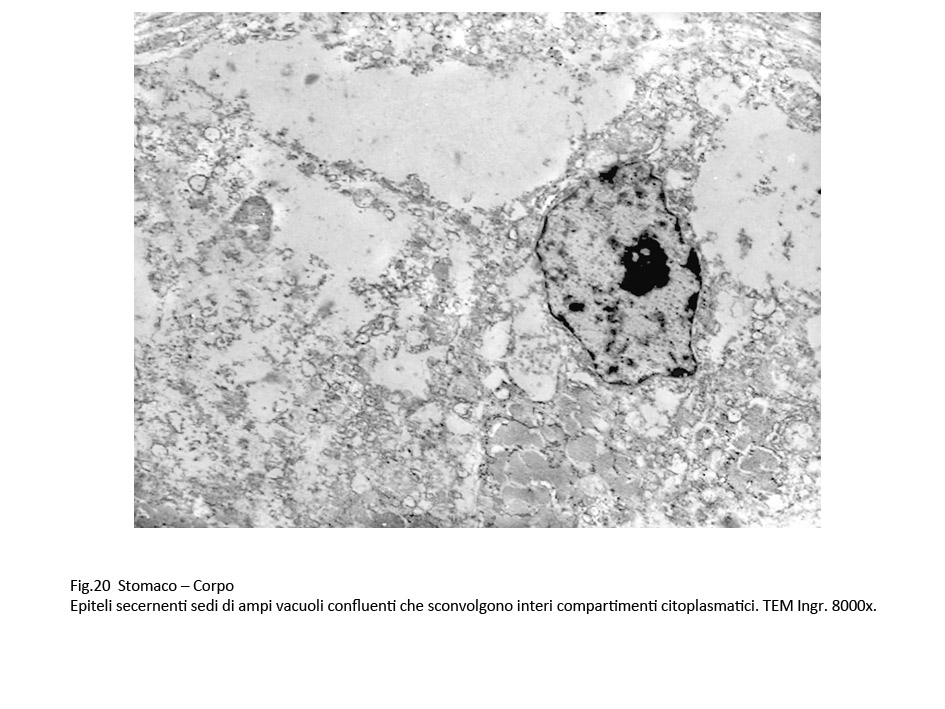 Fig.21 Fig.21 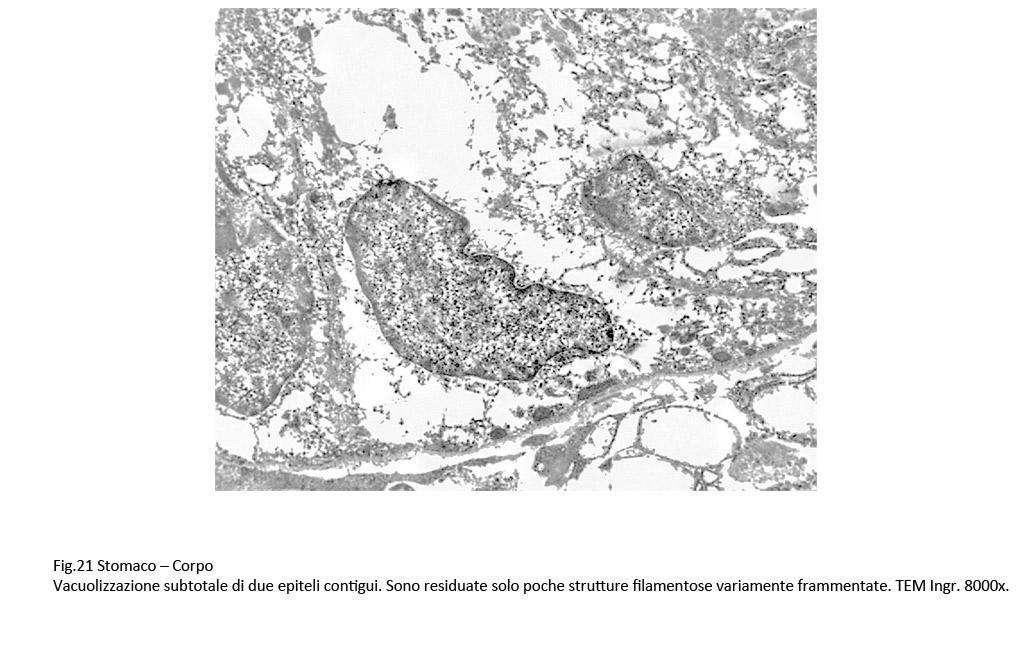
Il processo di vacuolizzazione coinvolge anche le cellule mesenchimali presenti a livello della tonaca propria; esse si sono trasformate in ampie plaghe di vacuoli confluenti, apparentemente privi contenuti. Questo processo di vacuolizzazione si estende anche agli spazi extra-cellulari, formando ampi spazi lacunari deprivati dei normali confini delle cellule.
-
Fig.22 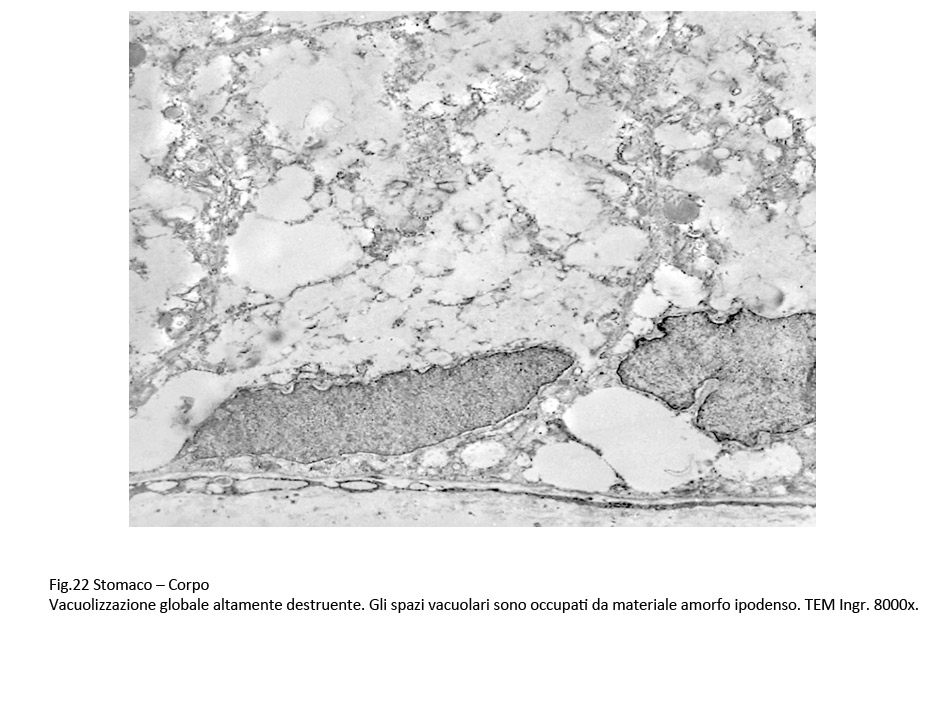 Fig.23 Fig.23 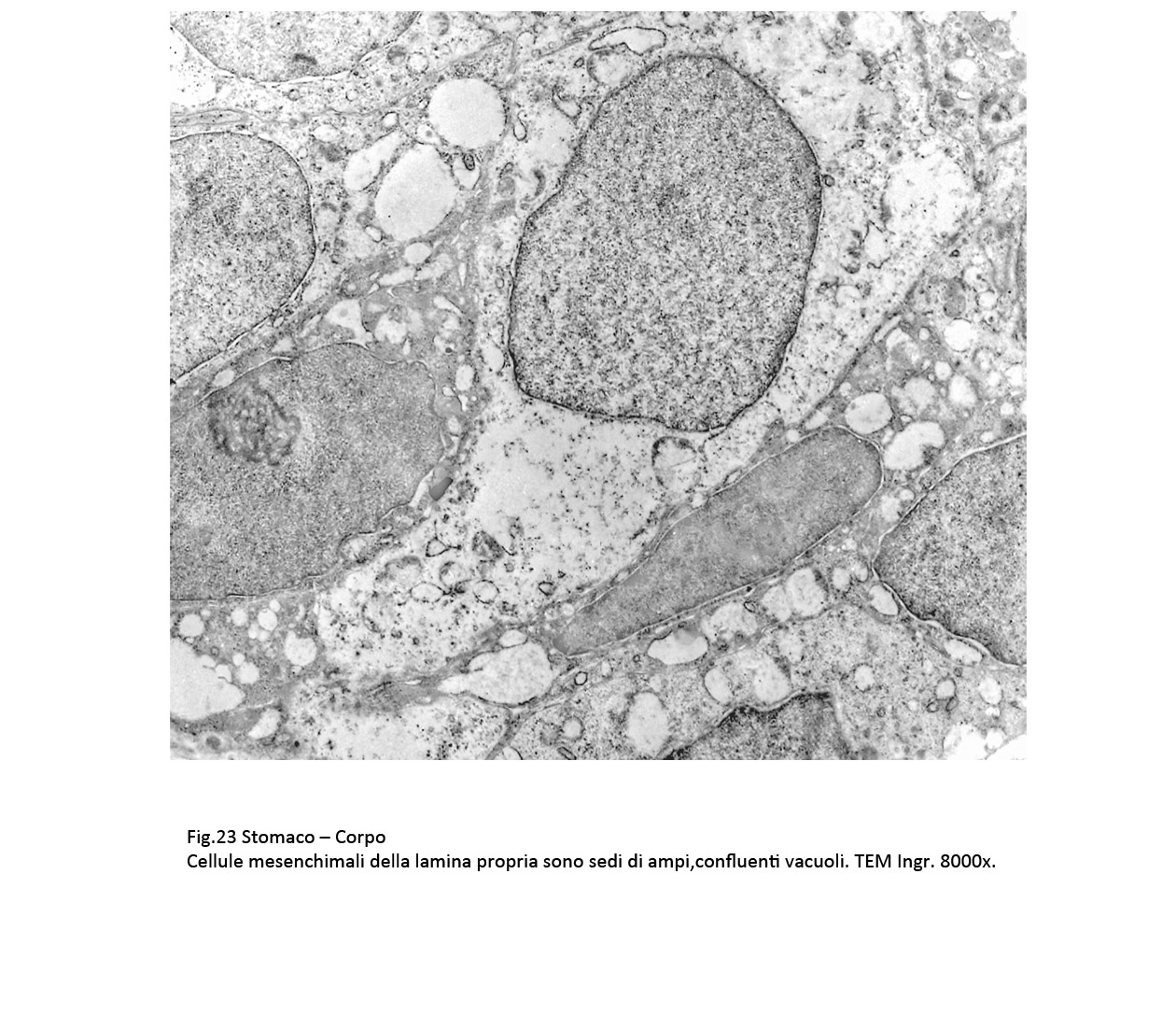
A livello degli epiteli non destrutturati dal processo di vacuolizzazione sono presenti danni regressivi riguardanti tutti gli organelli, e in modo più accentuato a livello dei mitocondri e del reticolo endoplasmico.
I mitocondri sono rigonfi, vacuolizzati, poveri o privi di creste oppure in lisi. Il reticolo endoplasmico si presenta con cisterne molto dilatate, spesso tra loro confluenti per rottura delle membrane; il lume delle cisterne è occupato quasi sempre, in quantità variabile, da materiale amorfo.
-
Fig.24 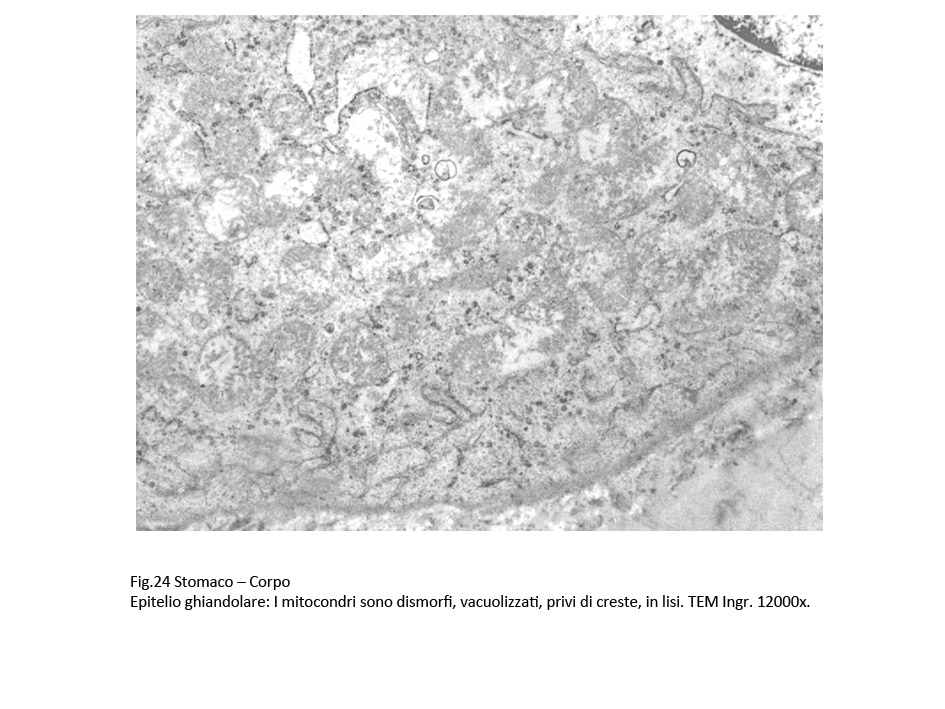 Fig.24bis Fig.24bis 
-
Fig.25 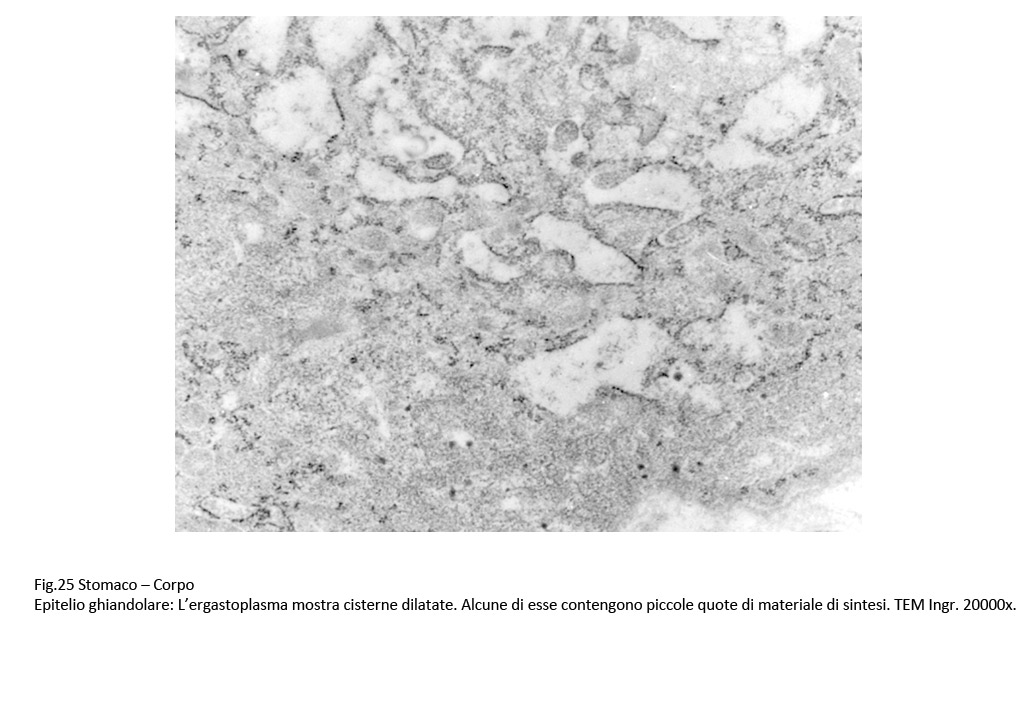 Fig.26 Fig.26 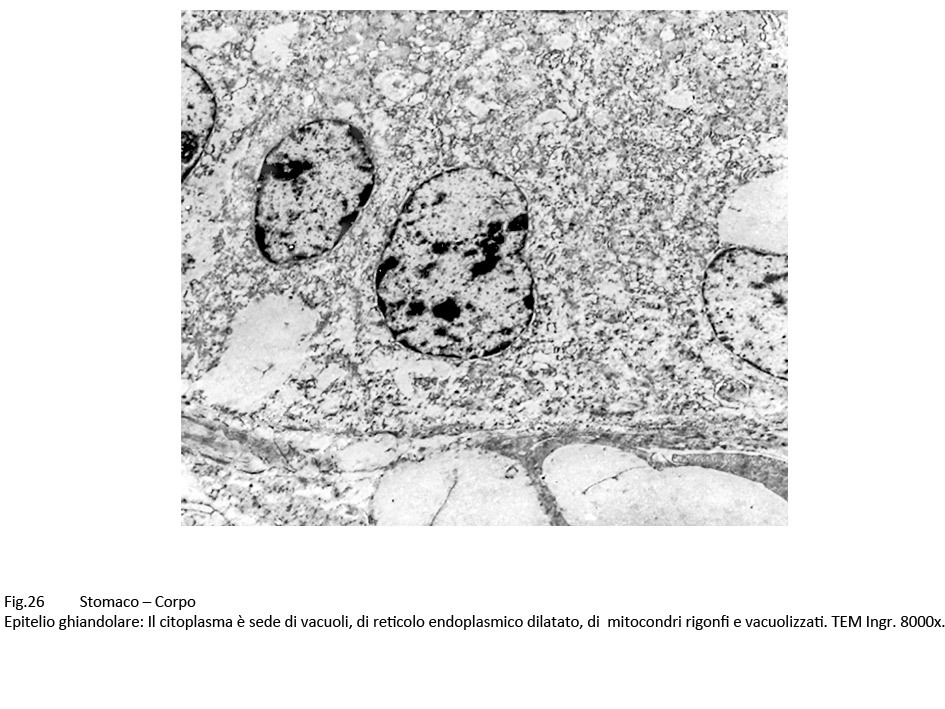 Fig.26bis Fig.26bis 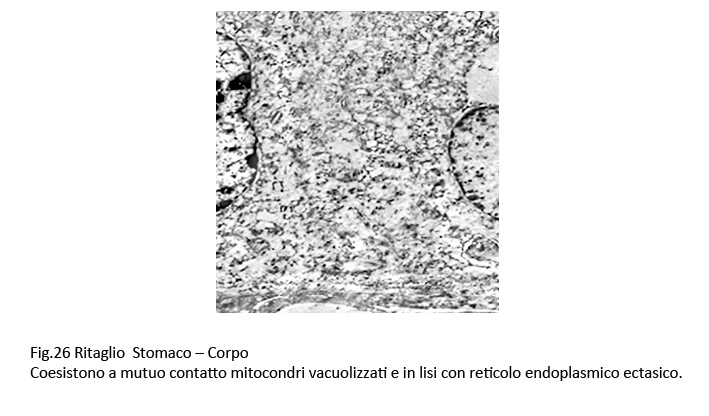
Gli epiteli interessati da vacuoli e da processi regressivi hanno perduto il loro profilo strutturale e appaiono costituiti da membrane frammentate e orientate in modo disordinato, da escavazioni irregolari di diversa ampiezza, prive di membrana di contorno. In immagini d’insieme, si appalesa una totale disorganizzazione del citoplasma.
-
Fig.27 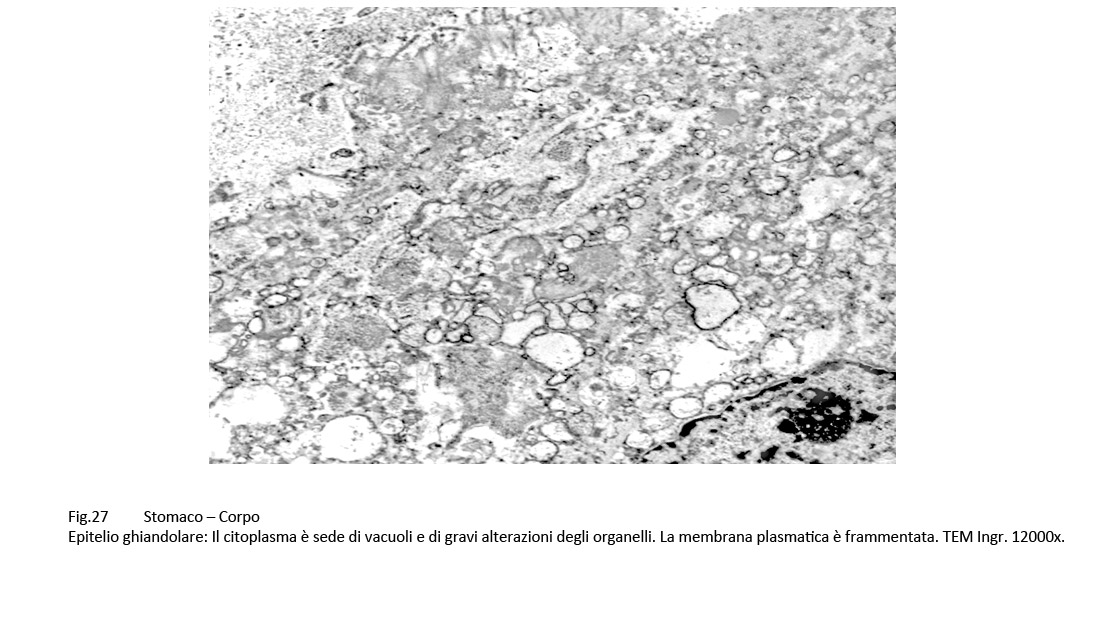 Fig.28 Fig.28 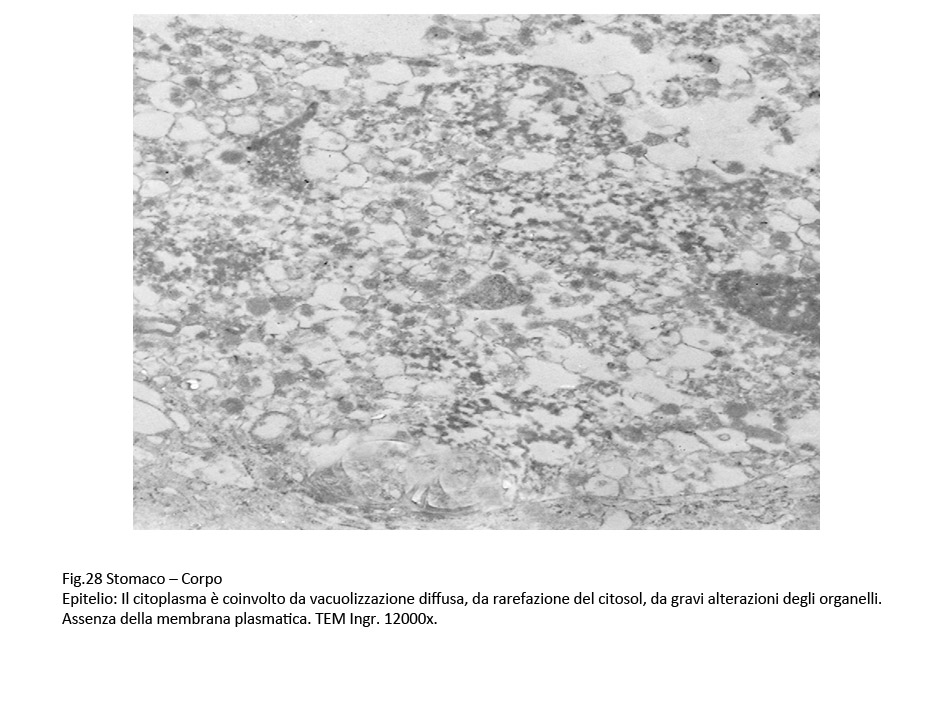 Fig.29 Fig.29 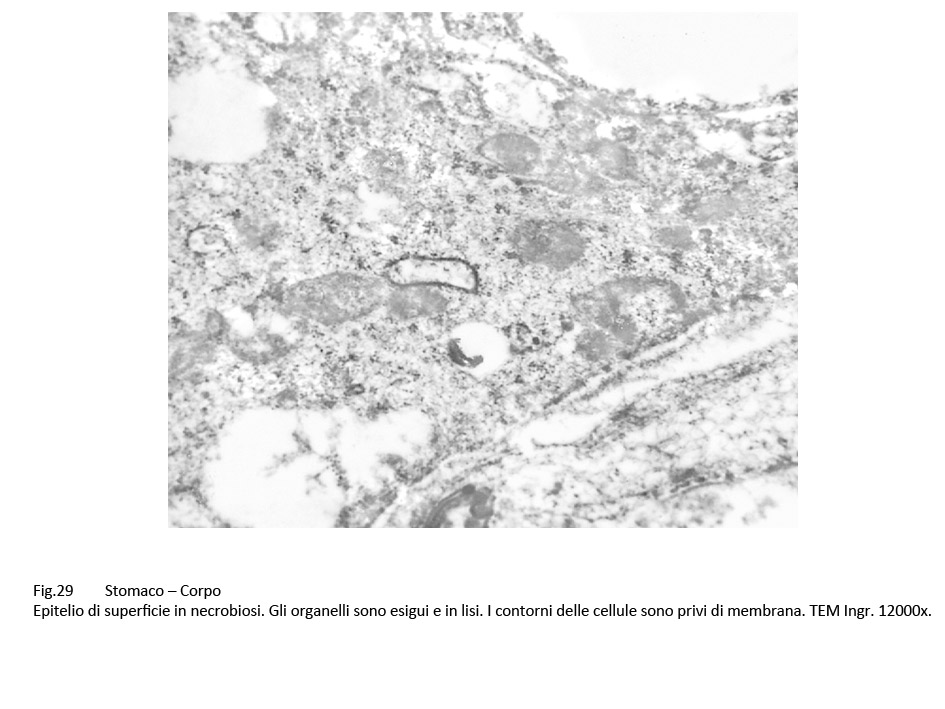
La sovrapposizione di processi di vacuolizzazione e di processi regressivi degli organelli citoplasmatici si conclude con un processo di necrosi, caratterizzato da destrutturazione del citoplasma, rottura delle membrane citoplasmatiche, lisi degli organelli, e conglutinazione di ampie zone del citoplasma.
-
Fig.30 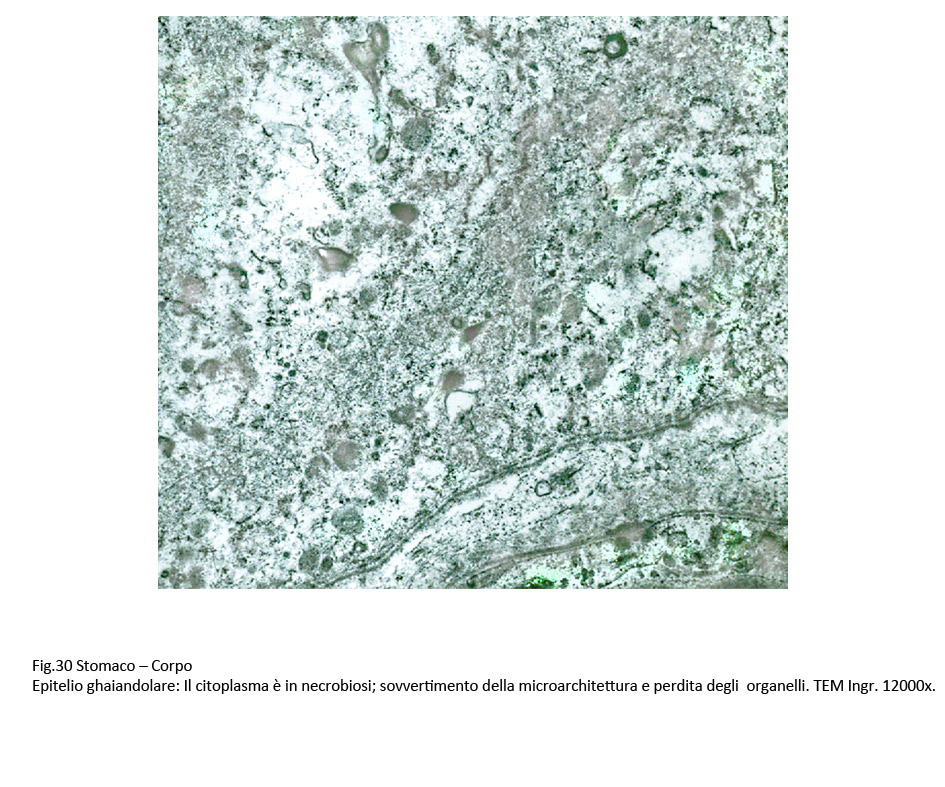 Fig.31 Fig.31 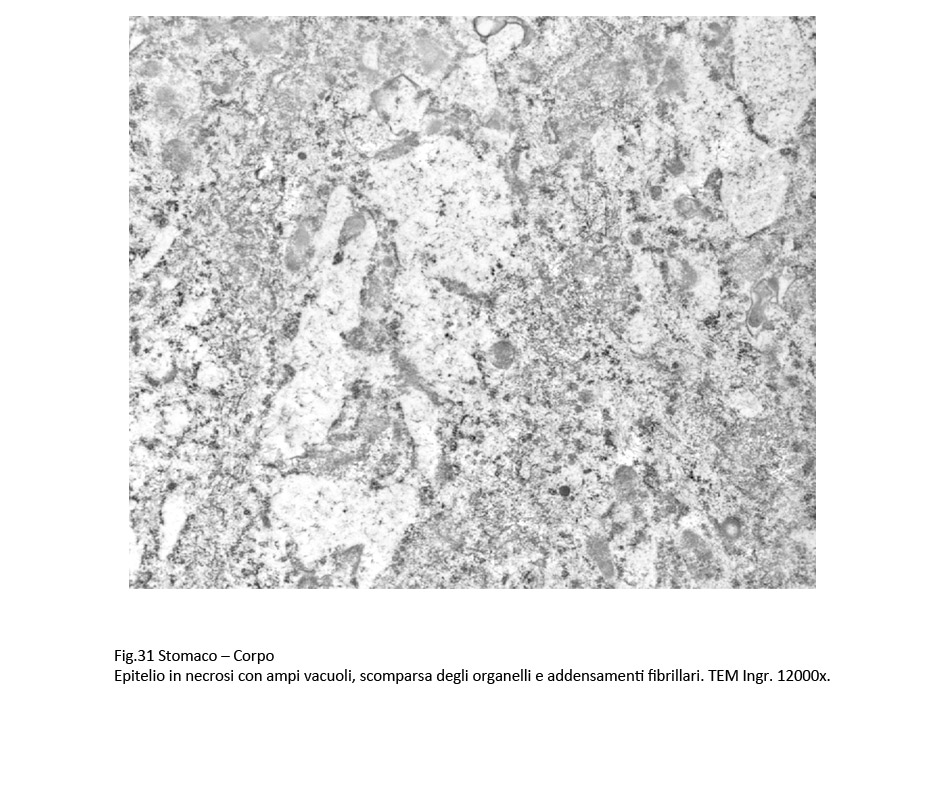 Fig.32 Fig.32 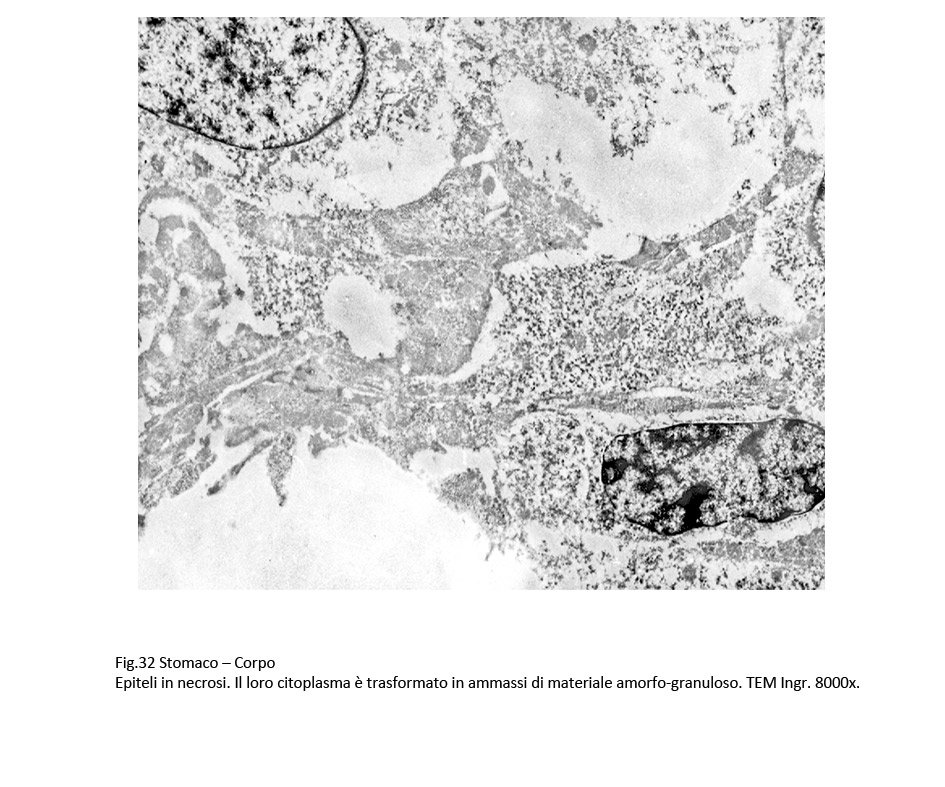
COMMENTO
Mediante la microscopia elettronica si evidenziano nei dettagli le lesioni intracitoplasmatiche indotte dagli H.Pylori.
Queste sono molteplici, progressive e si concludono con la morte delle cellule. Non presentano caratteri di specificità e rientrano, a livello morfologico, nel quadro delle lesioni indotte dai batteri Gram-negativi.
Nei campioni osservati non sono stati repertati H-Pylori localizzati all’interno delle cellule , ma adesi alle superfici degli epiteli di superficie o degli epiteli ghiandolari.
Nei punti di adesione degli H-Pylori la membrana plasmatica degli epiteli appare ispessita, rinforzata da fibrille e il citosol sottostante appare ipodenso e ricco di vescicole ed è occupato da una ricca componente fibrillare del citoscheletro. Questi reperti lasciano ritenere che nei contatti tra gli H.pylori e le superfici epiteliali si attivino risposte reattive-protettive da parte delle cellule ospiti.
Le alterazioni citoplasmatiche sono ascrivibili all’azione dei fattori di virulenza VacA e CagA.; queste non riguardano solo gli epiteli ma si estendono anche a carico delle cellule mesenchimali della tonaca propria.
L’azione lesiva del fattore VacA si ritrova nelle manifestazioni di vacuolizzazione del citoplasma; esse sono progressive, confluenti fino a estendersi all’intero corpo cellulare, destrutturandolo, distruggendo gli organelli, e infine provocando la necrosi. Commiste alle precedenti si repertano epiteli non vacuolizzati e sedi di gravi processi regressivi dei mitocondri e del reticolo endoplasmico con danno al sistema energetico e metabolico delle cellule.
La virulenza del fattore CagA viene desunta dallo stato del sistema giunzionale. Questo sistema risulta danneggiato a livello delle giunzioni occludenti e aderenti con rottura delle coesioni intercellulari e apertura di corridoi attraverso i quali gli H.Pylori raggiungono la tonaca propria.
Questi due fattori svolgono le loro azioni virulenti in modo sinergico, e per determinare la risultante dei danni è necessario tener prendere in considerazione il ceppo degli H.pylori infettante, le preesistenti condizioni degli epiteli,e le componenti epigenetiche in atto e in fieri.
|
