Gastrite cronica da Helicobacter-Pylori
(profilo istopatologico)
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica
.
-
La diagnostica delle gastriti richiede l’applicazione di diverse metodologie, quali l’esame endoscopico, gli accertamenti istopatologici, le indagini di diagnostica clinica . (Digestive and Liver Disease 2011; 435: 5373-5384).
L’esame endoscopico descrive lo stato mascroscopico delle mucose gastrica e lo stato di elasticità delle pareti; strettamente connesso a questa valutazione si eseguono i prelievi bioptici.
Questa connessione è stata tracciata dal Sydney System che prevede l’applicazione di una procedura di biopsie multiple della mucosa gastrica; biopsie da effettuarsi a livello dell’antro, della zona di transizione antro-corpo, dell’ incisura angularis, del corpo, oltre a quelle da eseguire in corrispondenza di eventuali lesioni macroscopicamente apprezzabili. (Am. J. Surg. Pathol. 1996; 20(10): 1161 – 1181) (Gut 2015; 64: 1-15).
Ciascuno dei prelievi bioptici deve “contenere” un frammento di mucosa gastrica a tutto spessore,dalla linea epiteliale di superficie alla muscolaris mucosa;la valutazione istopatologica richiede un esame analitico dello stato degli epiteli di superficie, del patrimonio ghiandolare, degli infiltrati flogistici a livello della lamina propria, dello stato dei capillari e della componente stromale.
Nei dettagli,il protocollo di questo esame analitico richiede di valutare la deplezione del materiale mucinoso stratificato sulla mucosa,il danno degli epiteli di superficie, lo stato delle ghiandole, la presenza la tipologia e la gravità delle metaplasie,le condizioni delle cellule endocrine, la presenza di follicoli linfoidi, la attività dei neutrofili, l’intensità della flogosi sostenuta dai mononucleati, le condizioni del sistema vasculo-stromale.
Questo esame si conclude con un giudizio diagnostico che include anche una valutazione semiquantitativa del danno utile stabilire il grading del quadro morfopatologico
Questi dati devono essere riferiti alla regione gastrica in cui è stata eseguita la biopsia; pertanto la classificazione istopatologica delle gastriti deve includere anche questo elemento topografico,e su tale base si distinguono le seguenti classi:
1. Gastriti preponderanti dell’antro;
2. Gastriti preponderanti del corpo.
3. Gastriti diffuse (pangastriti)
(Acta Biomed 2018; 89 (Suppl 8) : 93-99)
La gastrite indotta dagli H.pylori viene riportata tra le forme infettive da cause batteriche. Essi inabitano la superficie degli epiteli e riescono a conservare la persistenza della infezione mediante meccanismi che favoriscono la loro crescita e quindi la loro colonizzazione (Helicobacter 2012; 17: 350-357) (Gut 2015; 64: 1353-1367),.
L’H-pylori è causa di gastriti acute e croniche. Quelle acute tendono alla guarigione e sono considerate self-limited; le gastriti croniche tendono a persistere nel tempo e si aggravano per il sovrapporsi di nuovi episodi di flogosi; ciò modifica profondamente la mucosa secondo una stadiazione progressiva,deostruente che viene valutata secondo i criteri del sistema OLGA (Operative Link on Gastrites Assessment) (Gastroenterology 2005; 36: 228-233).
Al microscopio luce, gli infiltrati flogistici occupano gli spazi interstiziali della tonaca propria, si raccolgono attorno ai capillari, si addensano a ridosso delle ghiandole, si stratificano al di sotto della linea epiteliale di superficie. Spesso, penetrano nel lume delle ghiandole, si insinuano tra gli epiteli di superficie e provocano processi regressivi fino alla necrosi della popolazione epiteliale. Questi infiltrati sono formati da mononucleati, da follicoli linfoidi, dai neutrofili; questi ultimi, se si raccolgono nel lume delle ghiandole, formano microascessi (World J. Gastroenterol. 2005;11(7):976-981) (Gastroenterol. (Res. Pract. 2013; 393015) (J. Microsc. Ultrastruct. 2016; 4(4): 167-174).
Gli H.pylori si raccolgono anche a livello delle strutture giunzionali ove provocano la frammentazione delle molecole che provvedono al mantenimento di questo sistema con conseguente grave compromissione della integrità della linea epiteliale.
Il processo flogistico cronicizzato ha il suo inevitabile sbocco in forme di atrofia della mucosa; atrofia che può acquisire il profilo morfologico fibrotico-cicatriziale oppure quello flogistico con le diverse forme di metaplasia.
La forma fibrotico-cicatriziale è caratterizzata dalla sostituzione dei linfociti, mononucleati e neutrofili con macrofagi, fibroblasti, istiociti e neoformazione di fibrille pre-collagene e collagene in evoluzione verso il quadro finale della sclerosi.
La forma di atrofia gastrica con reperti di manifestazioni di metaplasia sono evolutive e spesso acquisiscono caratteri iperplastico-proliferativi; di esse sono riportate in letteratura le seguenti forme morfologiche:
1. Metaplasia intestinale completa, fornita di epiteli con i caratteri morfologici dell’intestino tenue corredati da brush-border e da globet cells (J. Gastroenterol 2010; 105: 493-498) (Nat Rev Cancer 2017; 17(10): 594-604).
2.Metaplasia intestinale incompleta, data dalla presenza di epiteli di strutture ghiandolari fornite di epiteli mucipari simili a quelli della mucosa del colon (Human Pathology, 2005; 36: 228-233) (Gut 2007; 56: 631-363).
3.Metaplasia pseudopilorica, caratterizzata dalla presenza di ghiandole simili a quelle antro-piloriche. Questa forma è indicata come metaplasia SPEM (Spasmolytic Polypeptide Expressing Metaplasia) ed è fornita di mucine MUC6 e del fattore Trefoil Factor 2 (TFF2) (J. Dig. Dis. 2012; 13(1): 2-9).
.
Il processo iperplastico-proliferativo, associato alle manifestazioni di metaplasia gastrica, può acquisire i caratteri di displasia di vario grado con comparsa di ghiandole tortuose, allungate, rivestite di epiteli stratificati, privi di attività secernente, forniti di nuclei ipercromatinici, voluminosi, con nucleoli ben evidenti. Questi processi displastici, con possibile evoluzione verso l’adenocarcinoma, si manifestano soprattutto a livello di strutture con metaplasia intestinale incompleta (The American Journal of Surgical Pathology 2000; 24(2): 167-176).
La virulenza degli H.pylori si effettua mediante molecole internalizzate nel citosol degli epiteli in modo diretto o in modo indiretto tramite il sistema T4SS (Type 4 secretion system) (World J. Gastroenterol.2014;20(36):12767-12780).
Ceppi diversi di H.pylori hanno gradi di virulenza diversi, ciò è legato alle molecole secrete aventi diversi livelli di attività patogenetica. (Gut Microbes 2010; 1(6): 392-395)
Queste molecole sono molteplici e sono riportate in letteratura con i seguenti acronimi: CagA, VacA, DupA, IceA, OipH, DabH; tra queste,le molecole con maggiore virulenza sono le molecole CagA e VacA. (J.Dig.Dis.2013;14(7):341-349).
La proteina CagA (Cytotoxin Associated gene) induce la produzione di citochine pro-infiammatorie e tra queste la interleuchina IL-8. Questo fattore interagisce con numerose proteine intracellulari provocando risposte mitogene, perdita della polarità epiteliale, alterazioni delle strutture giunzionali, riduzione del grado di adesione tra gli epiteli,e stimolazione delle attività proliferative degli stessi (J. Clin. Pathol. 1994; 47: 61-66). (Mol. Cell. 2002; 10: 745). (Gastroenterology 2008; 134: 306-323).
La proteina VacA (Vacuolating citotoxin A) penetra nel citosol, provoca grave vacuolizzazione del citoplasma causando pori nelle membrane degli epiteli, determina gravi alterazioni dei mitocondri, del reticolo endoplasmico, del citoscheletro (Cell Microbiol 2004; 6: 143-154).69) (Med Microbiol 2005; 44: 143-150). Il danno mitocondriale coinvolgente le membrane interne è causa di apoptosi (Gut Microbes 2021; 13(1): 1-21). Questa proteina, se raggiunge la tonaca propria, interagisce anche con granulociti, monociti, linfociti B e T, ed esercita una azione inibitoria su i meccanismi di attivazione dei linfociti (J. Clin. Investig. 2001; 108: 1221-1228).
Questa breve introduzione riguardante l’ampio tema della patogenicità degli H.pylori rappresenta una premessa per descrivere le alterazioni osservabili al microscopio luce indotte da questi batteri. Queste osservazioni sono state condotte su la mucosa gastrica del corpo e dell’antro e la lettura dei reperti è stata effettuata applicando i parametri istopatologici innanzi riportati.
REPERTI
Gli epiteli di superficie evidenziano una marcata vacuolizzazione del citoplasma oppure una loro necrosi; essi sono dissociati da elementi della flogosi provenienti dalla tonaca propria.
Fig.1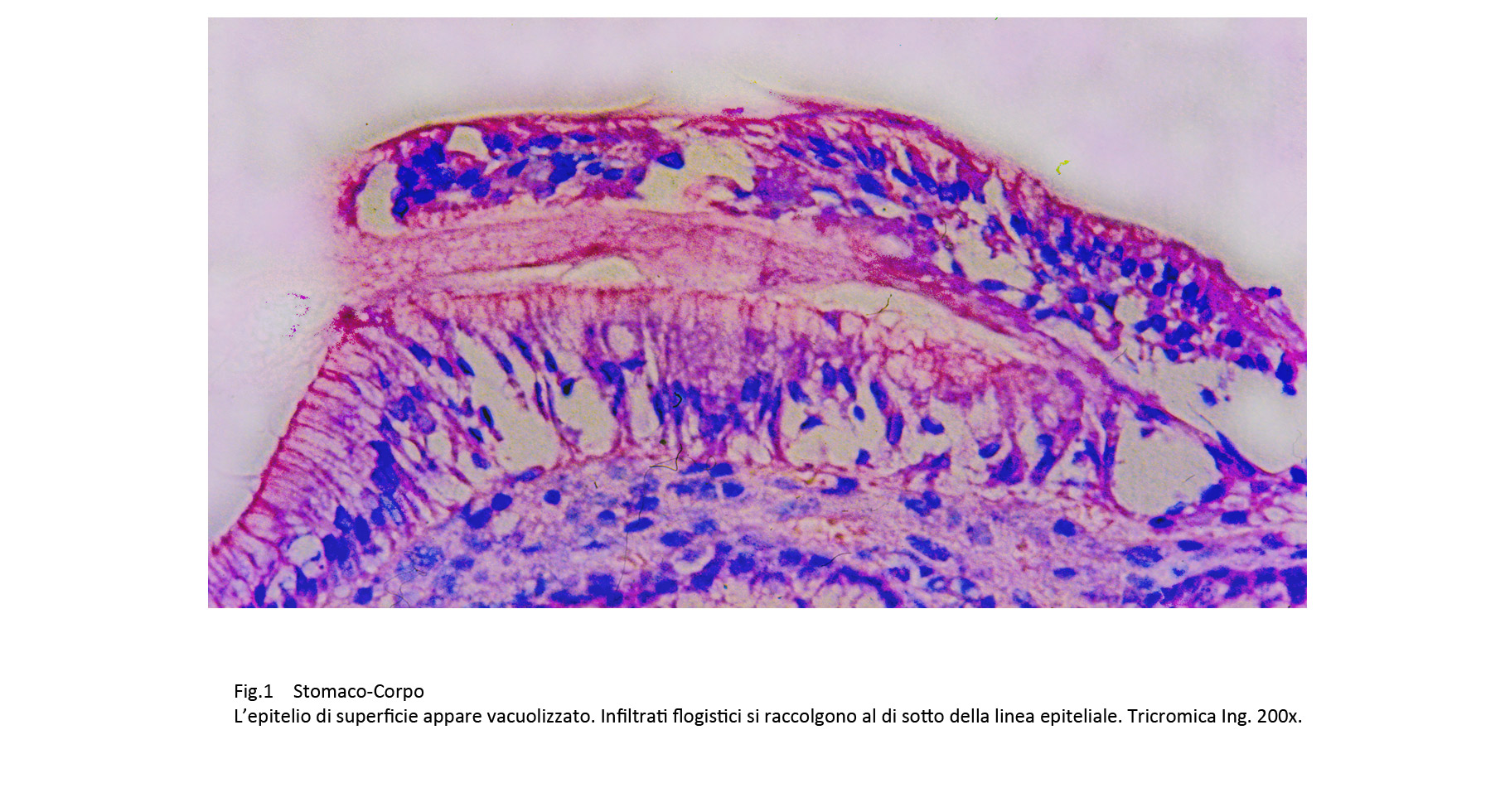 Fig.2 Fig.2 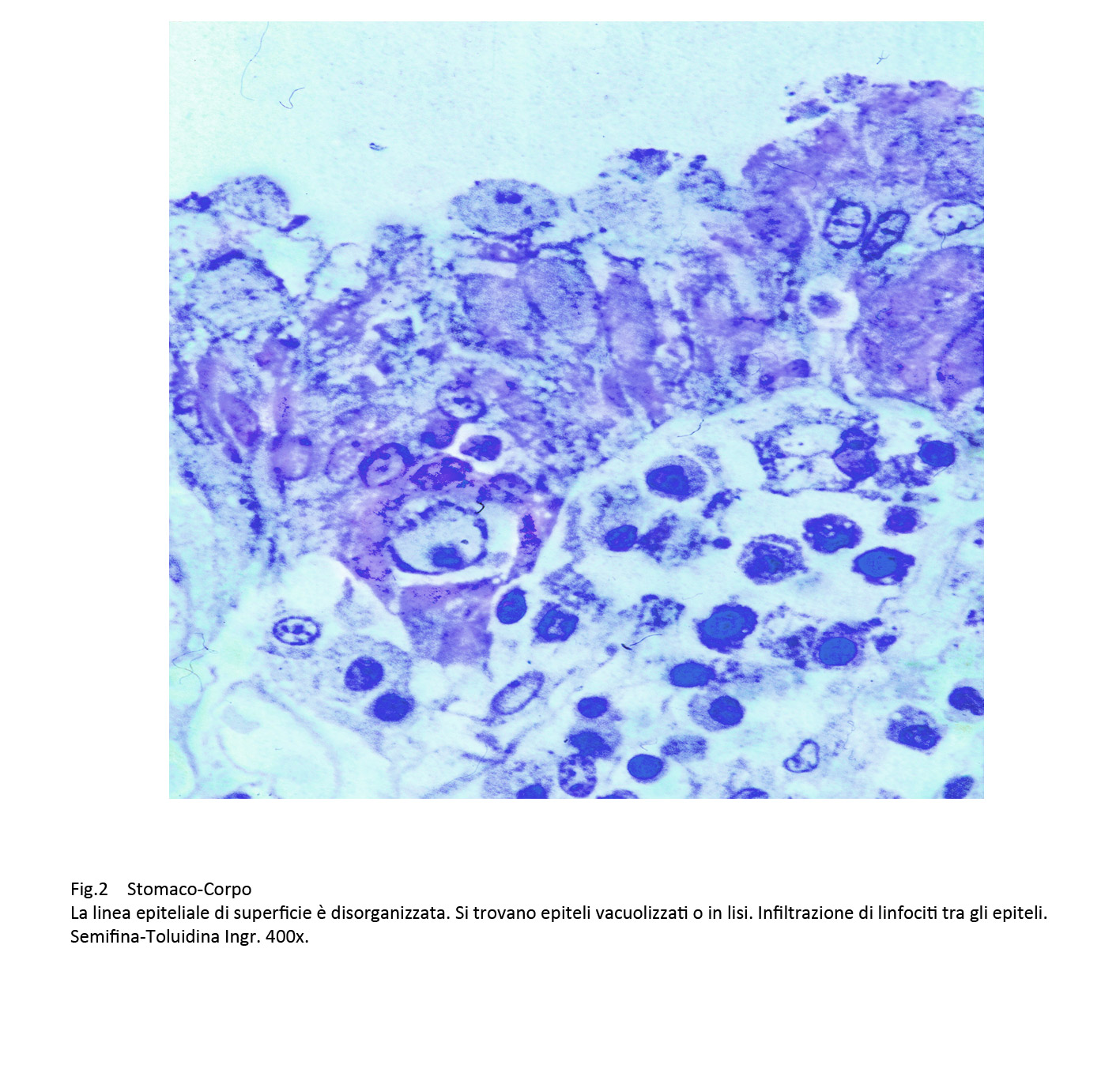
Coesistono microaree di erosioni e zone sedi di micro-ulcerazioni superficiali; il loro letto è occupato da grumi di fibrille contenenti elementi della flogosi. A livello di queste lesioni la tonaca propria è infiltrata in modo diffuso, oppure a banda, da linfociti, monociti, plasmacellule, ed eosinofili.
-
-
Il riscontro in tali aree flogistiche anche di neutrofili è indicativo di una fase di attivazione della flogosi.
Fig.5 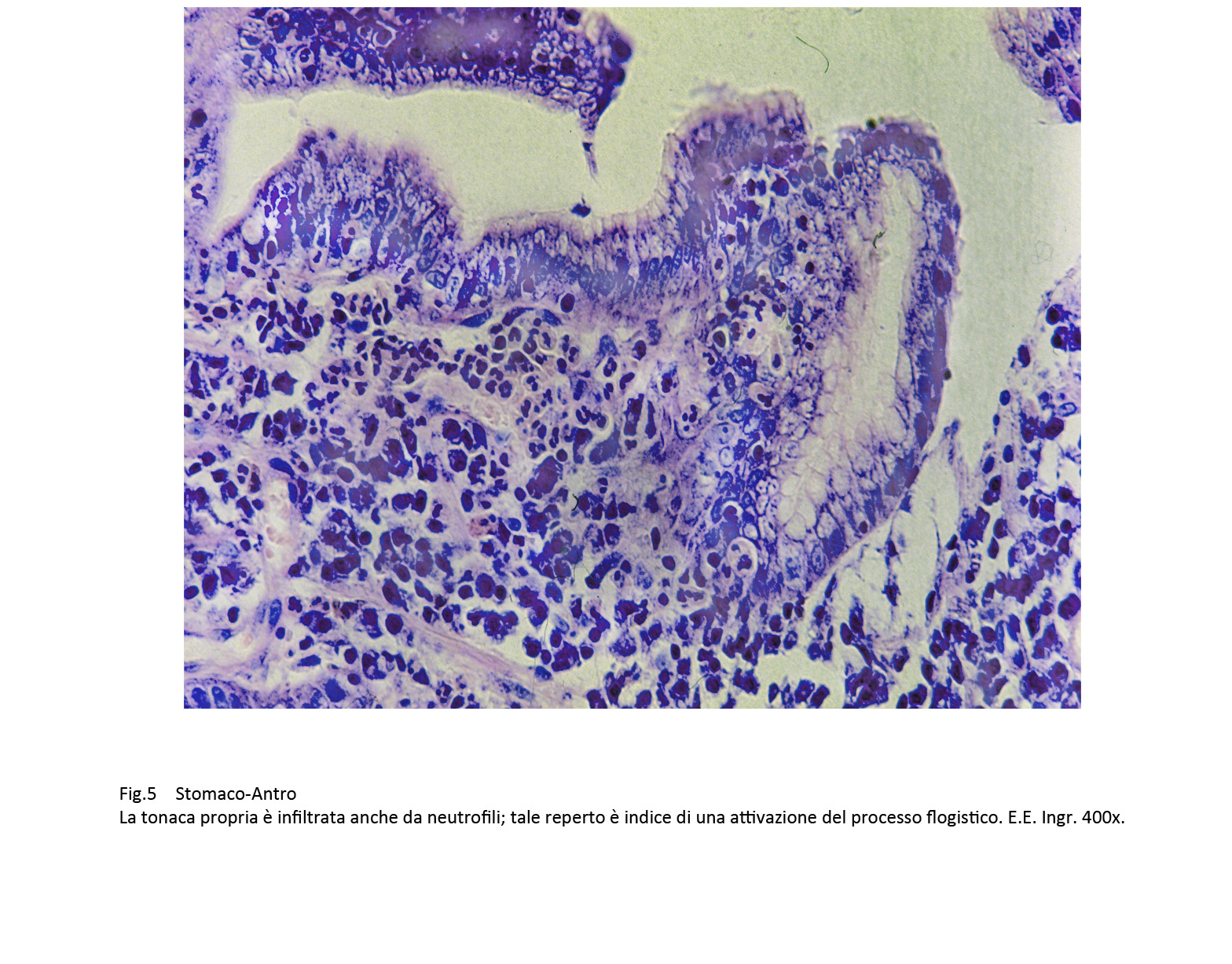
Questo processo di flogosi cronica può acquisire una morfologia a focolai; questi sono caratterizzati da aree parzialmente circoscritte ed occupate da aggregati di elementi mononucleati, frequentemente attraversate o sepimentate da sottili tralci di fibre collagene.
Fig.6 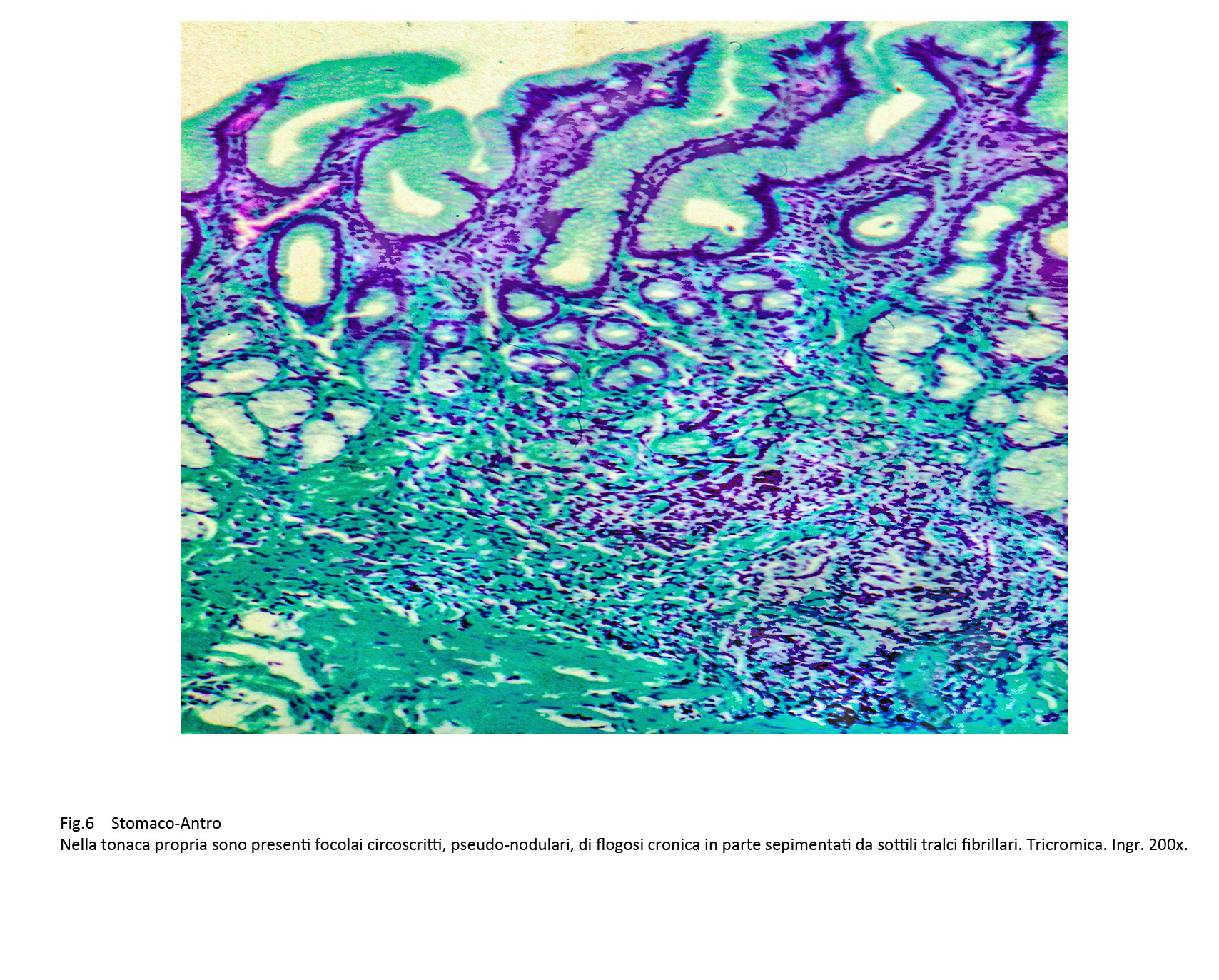 Fig.7 Fig.7 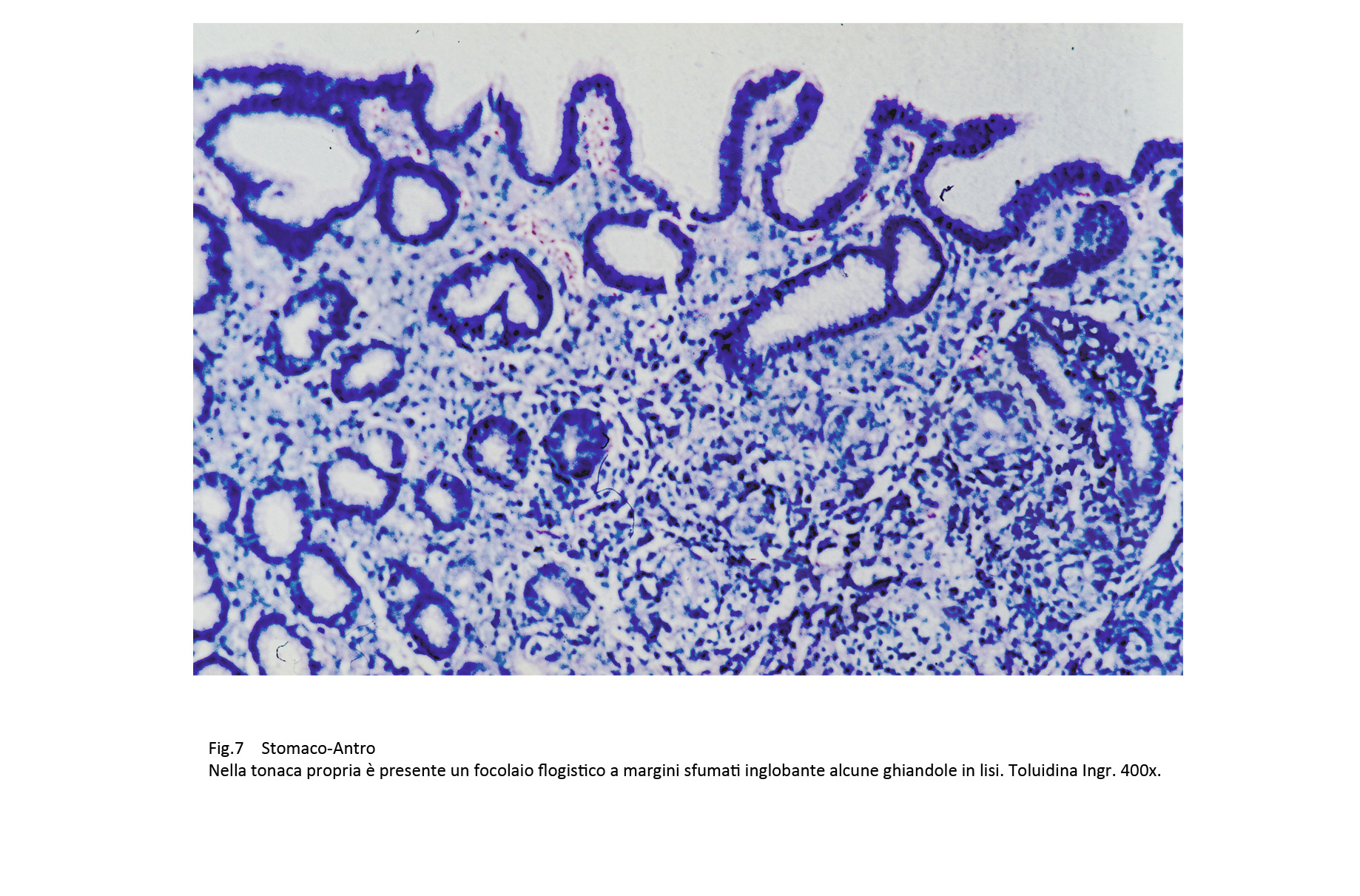
Le cellule della flogosi avvolgono le ghiandole, penetrano in esse e causano fenomeni degenerativi fino alla necrosi degli epiteli; nei quadri di maggiore gravità provocano frammentazione e distruzione dell’architettura ghiandolare.
Fig.13bis 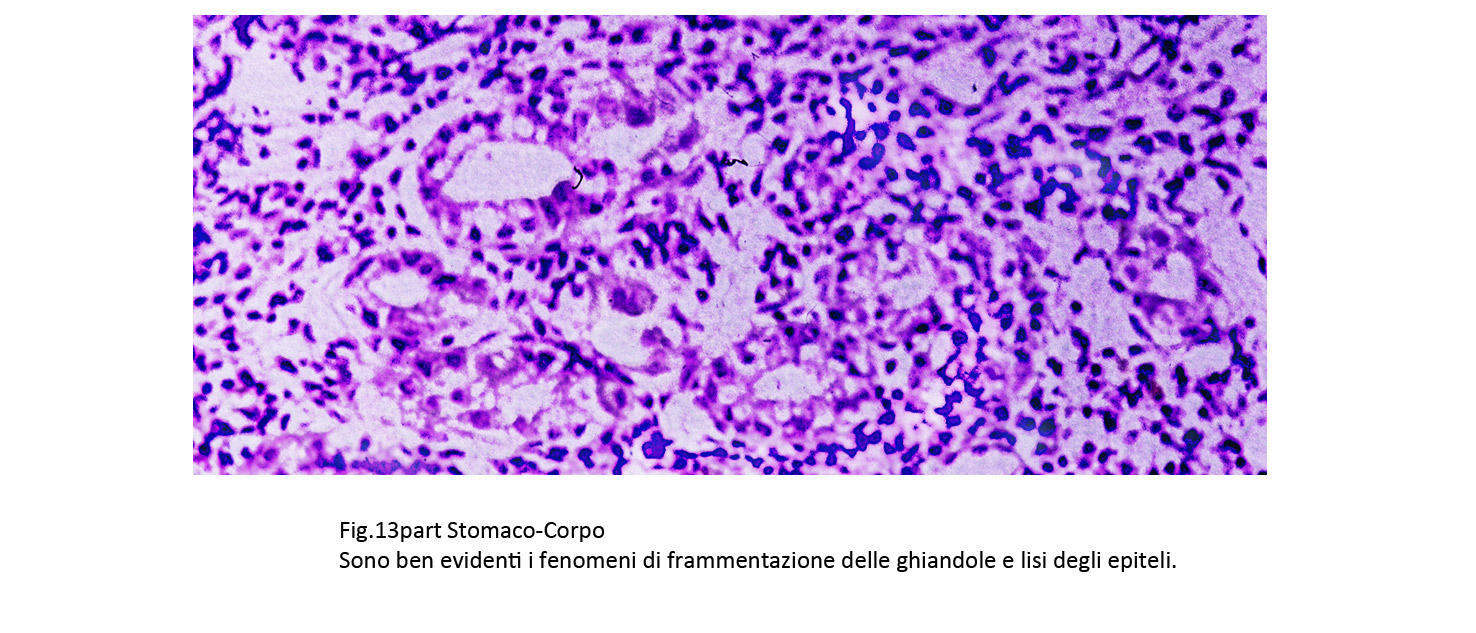
A questa azione patogena degli H.pylori si riscontrano reazioni differenziate degli epiteli caratterizzate da processi di iperplasia, di metaplasia, di attività proliferative nelle varianti displastiche, e neoplastiche.Queste risposte si manifestano in modo diverso con quadri morfologici nei quali le ghiandole presentano in modo commisto fenomeni di iperplasia,di displasia e degenerativi.
Fig.16 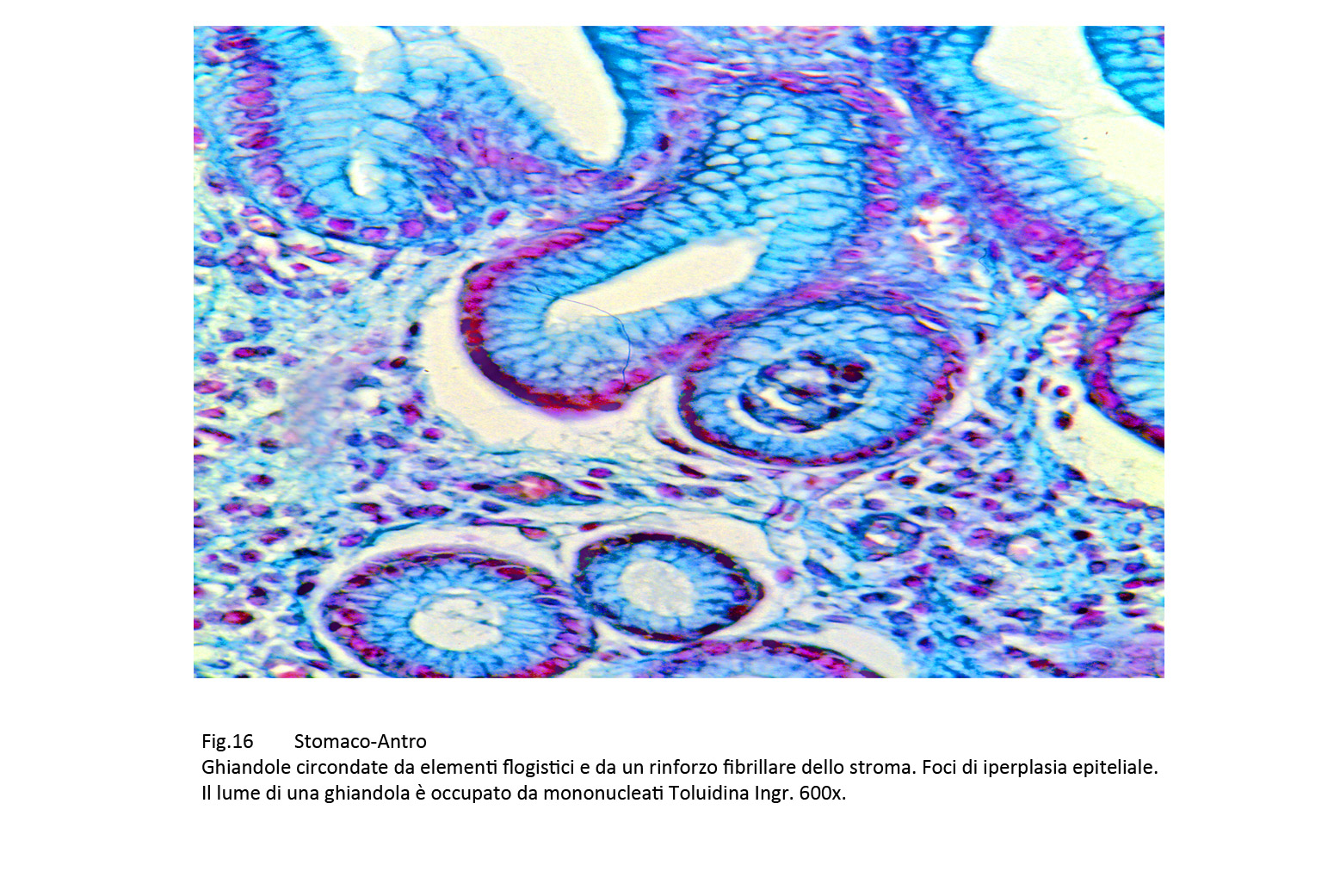 Fig.16part Fig.16part 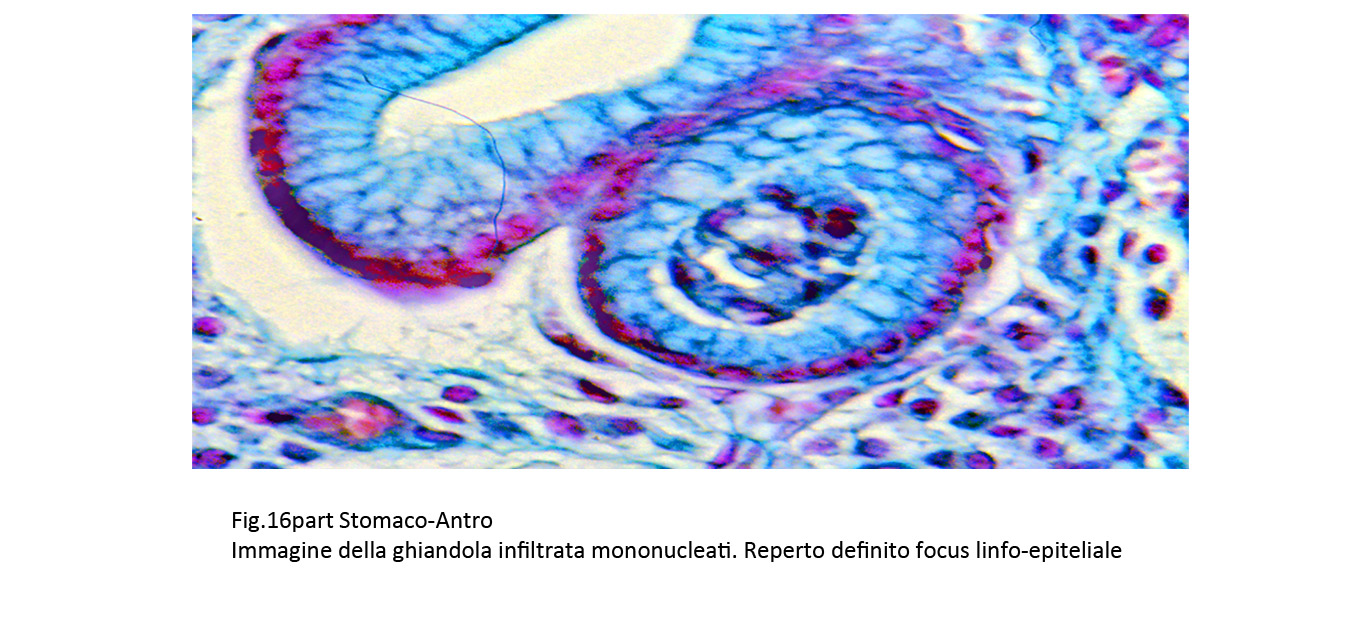
Fig.23 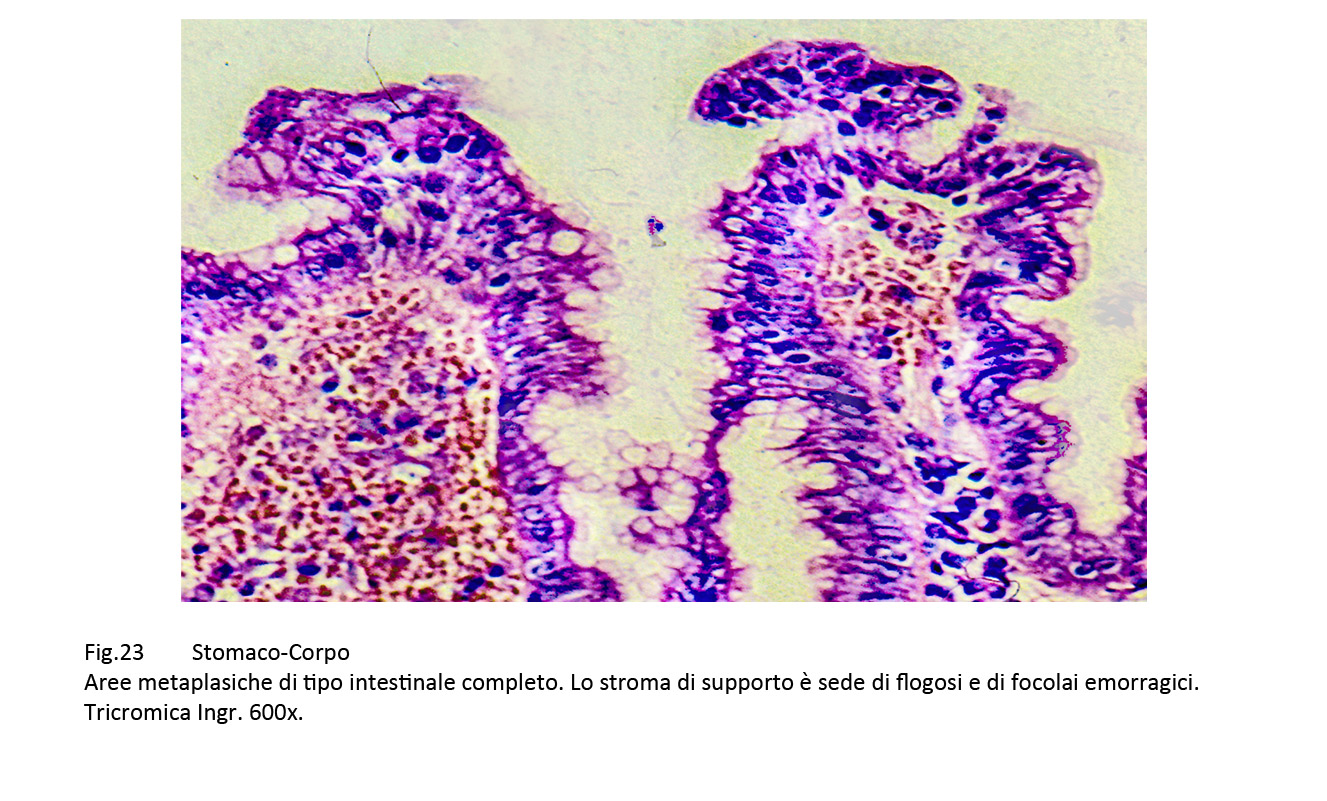 Fig.23bis Fig.23bis 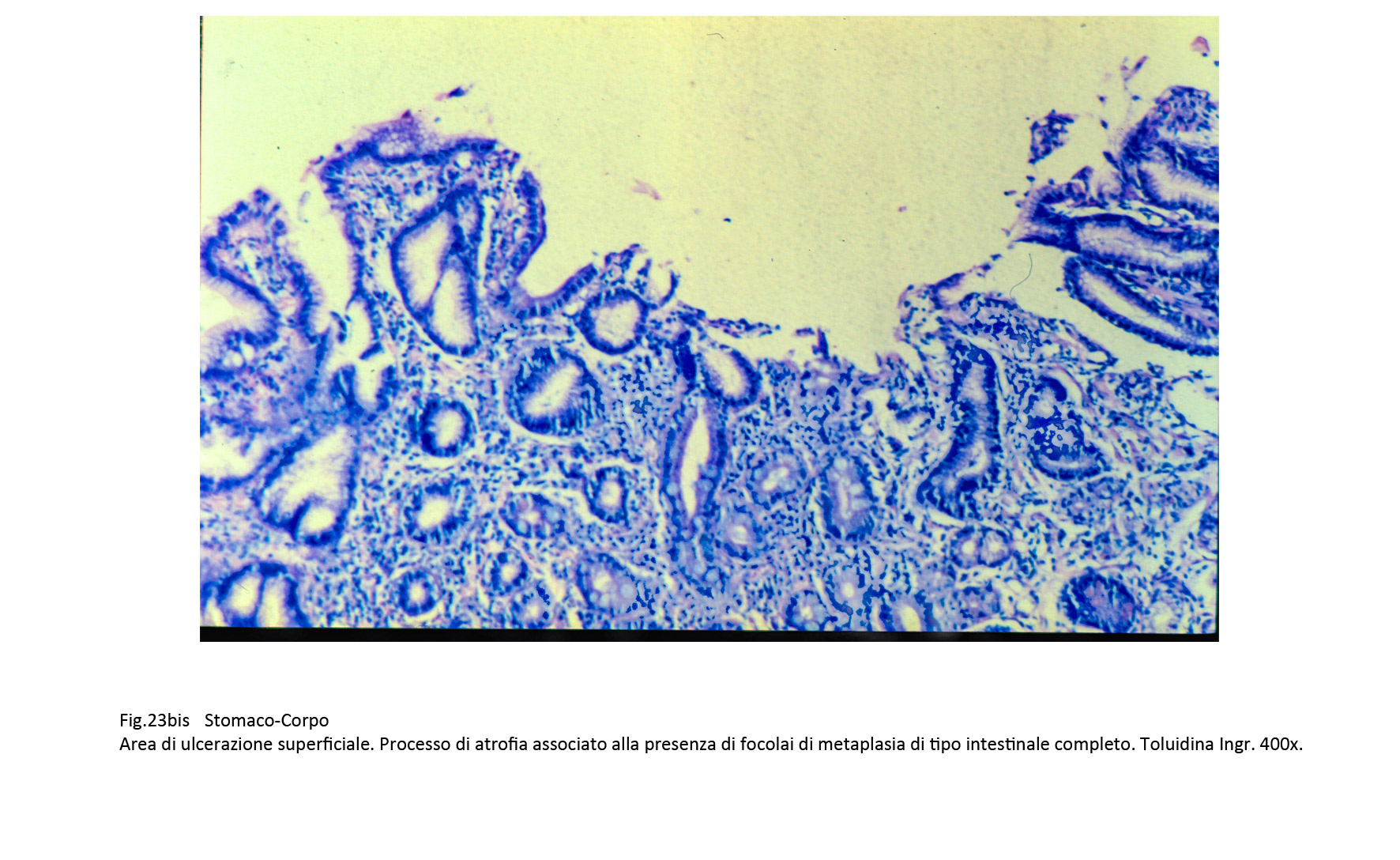
La forma incompleta si riconosce per la presenza di con caratteri simili a quelli della mucosa del colon.
Fig.24 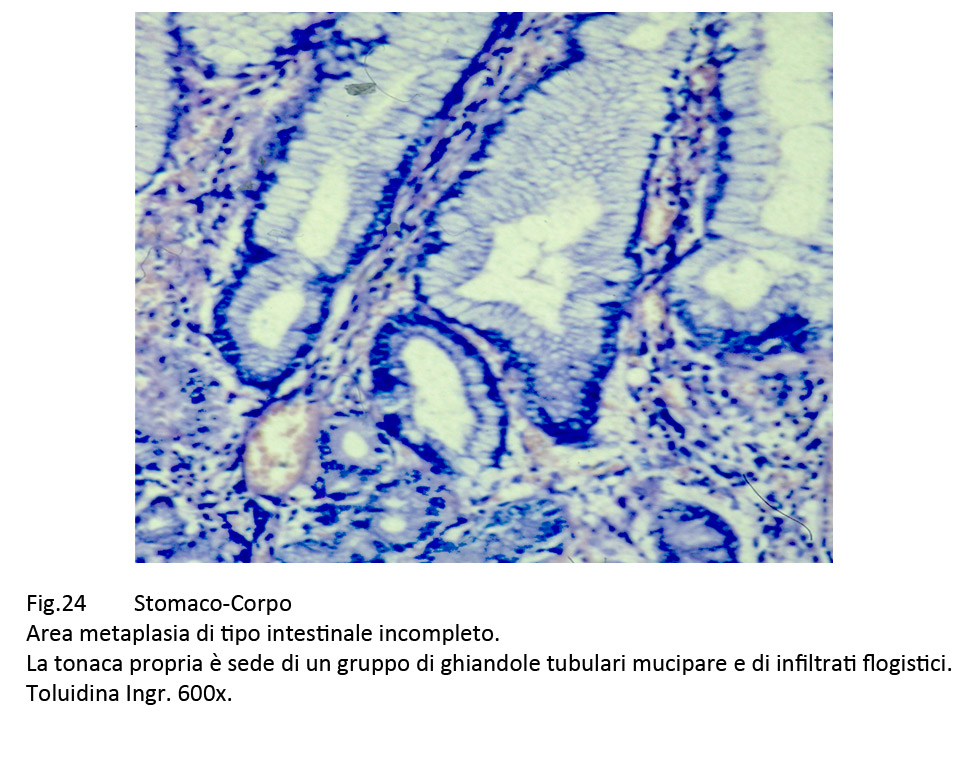
I processi proliferativi degli epiteli ghiandolari si innestano nell’interno di ghiandole dismorfe rivestite da epiteli con nuclei ipercromatinici. Nel contesto di tali focolai non è infrequente cogliere la presenza di epiteli di forma voluminosa-irregolare,con ncleoli, quale espressione di displasia grave, o di atipie evolventi verso l’adenocarcinoma in situ.
Fig.30 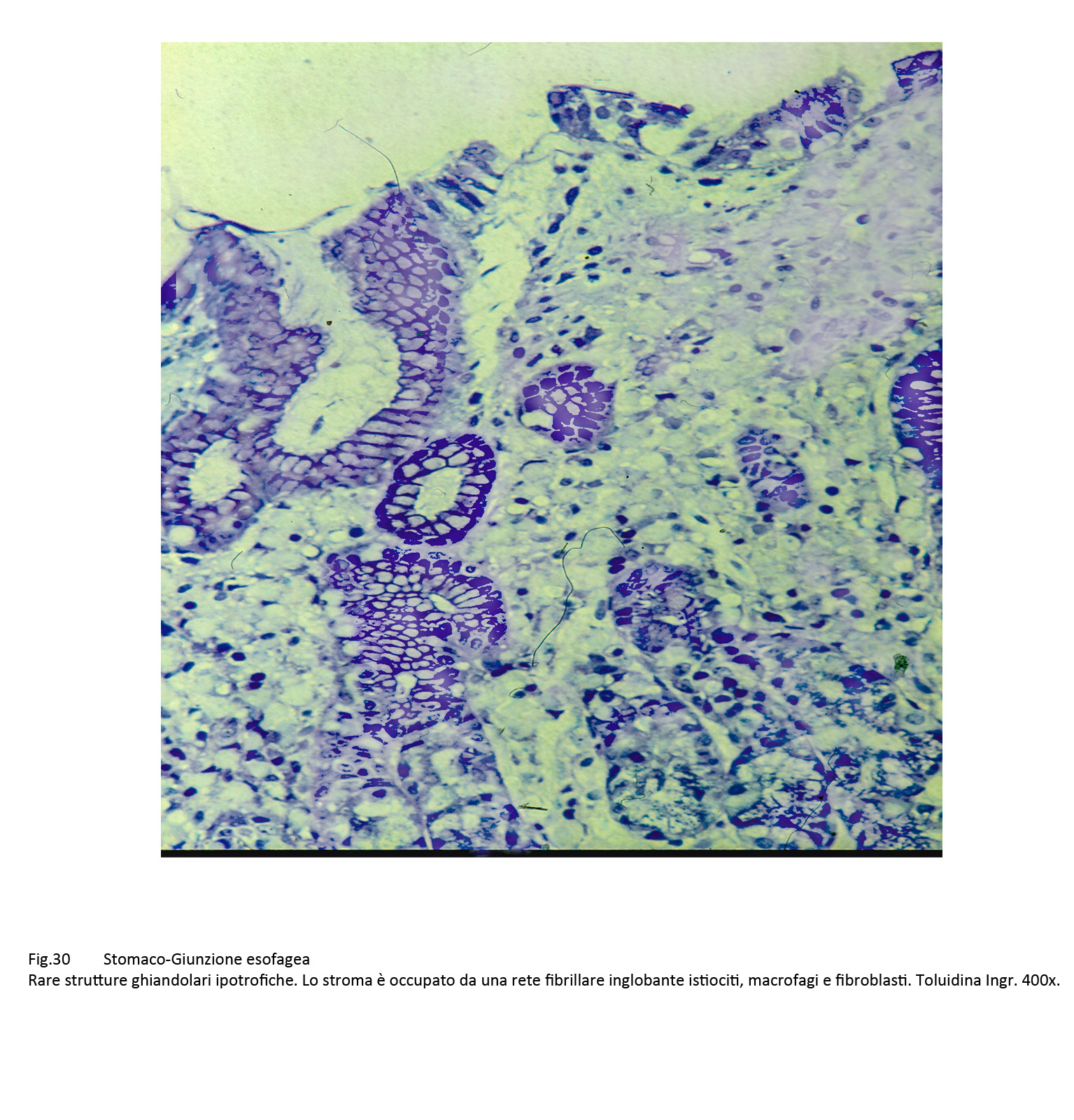 Fig.31 Fig.31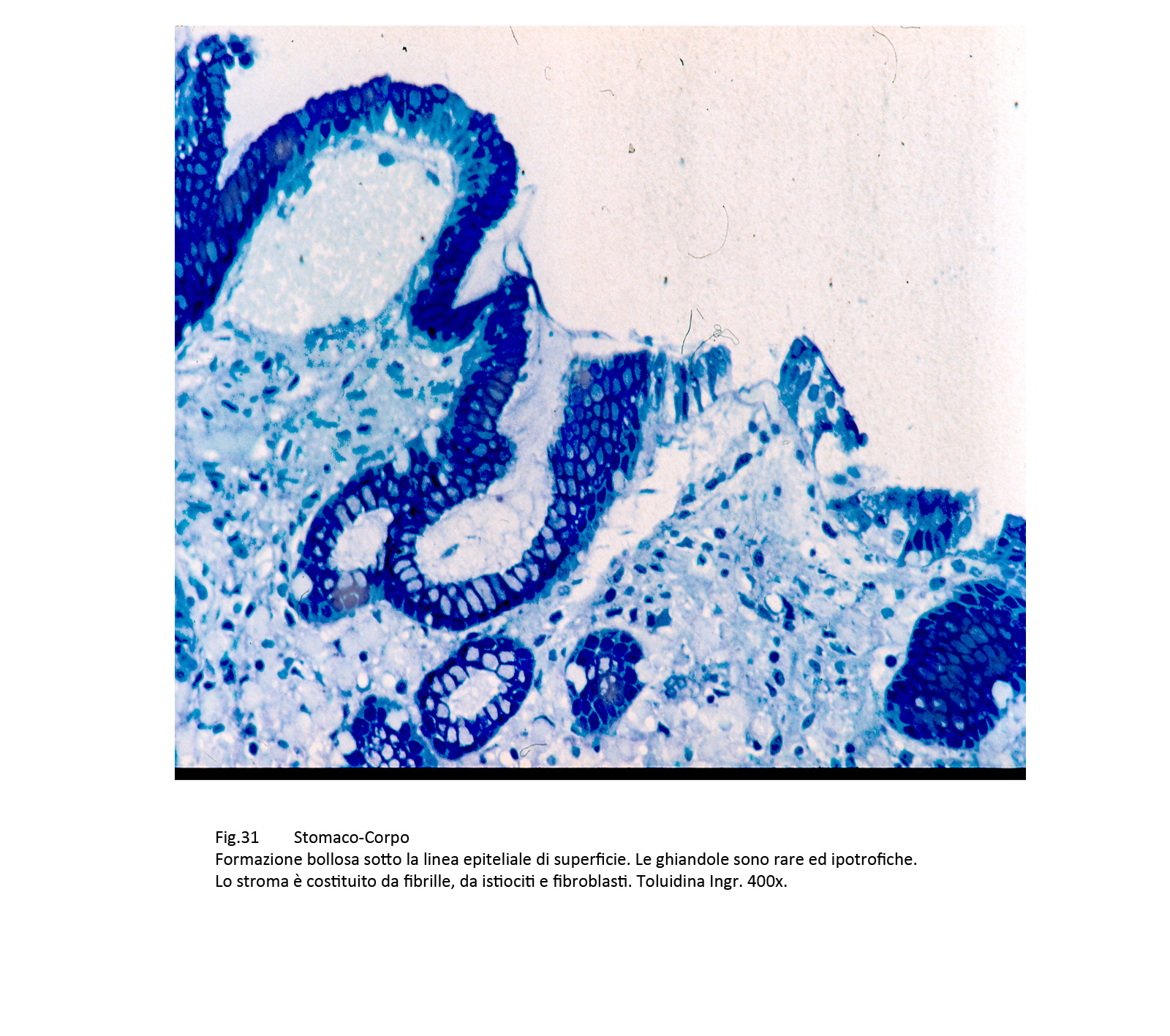 Fig.32 Fig.32 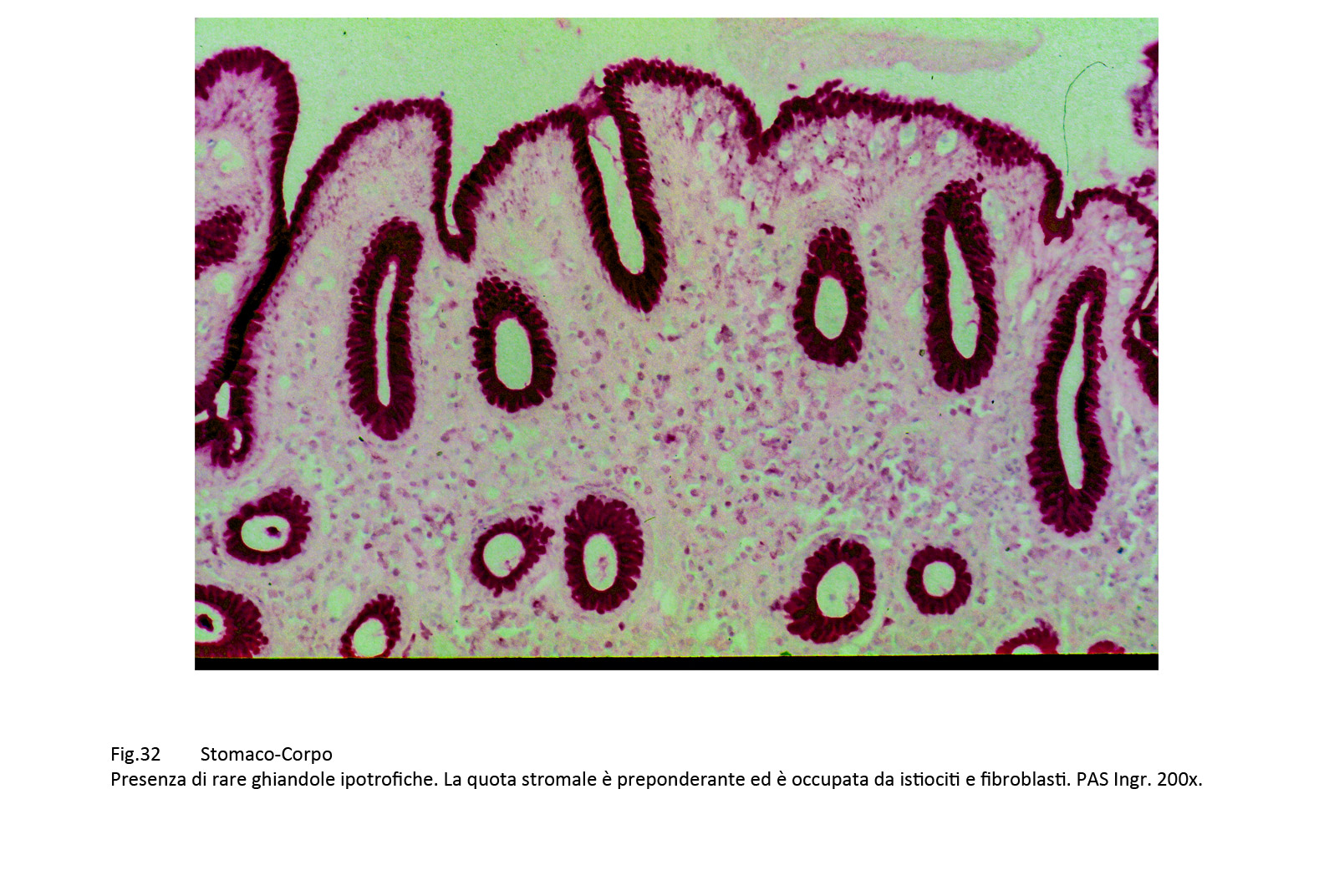
COMMENTO
La gastrite cronica da H.pylori è complessa, evolutiva, e la persistenza del processo flogistico con subentranti fasi di attivazione possono sviluppare quadri di metaplasia, di iperplasia proliferativa con devianza in senso displastico-neoplastico.
Essa non presenta caratteri morfologici di specificità, si sviluppa secondo i parametri delle gastriti da batteri Gram-negativi, pervenendo alla atrofia gastrica con un doppio profilo morfologico e prognostico.
Il primo profilo mostra i caratteri di una atrofia con focolai flogistici sostenuti da istiociti,macrofagi,fibroblasti associati a iperplasia dello stroma e guarigione con sclerosi delle lesioni.
Il secondo ha i caratteri di una atrofia con focolai di metaplasia con il concreto rischio di attività proliferative degli epiteli e sovvertimento dell’architettura della mucosa.
Si ritiene che queste diversità dei quadri anatomo-clinici e prognostici siano probabilmente associati alla molteplicità dei ceppi di questi batteri e alla loro capacità di secernere molecole con diverse potenzialità patogene.
Da quanto viene riportato dalla letteratura, su la base di risultati sperimentali in vivo e in vitro, le molecole secrete da questi batteri svolgono azioni lesive secondo due percorsi differenti ma convergenti nel danno finale.
Il primo percorso si snoda attraverso focolai flogistici con danni irreversibili degli epiteli di superficie e delle ghiandole. La presenza di colonie di H-pylori innesca l’attivazione e la infiltrazione di mononucleati e di neutrofili nella tonaca propria e successiva distruzione della componente ghiandolare fino ai quadri della atrofia gastrica con sclerosi della mucosa.
Il secondo percorso,delineato da ricerche sperimentali in vitro, è attuato da molecole secrete dagli H.pylori aventi azioni lesive su il DNA degli epiteli atte a indurre processi proliferativi di varia gravità e intensità.
La patologia da H.pylori rimane ancora sede di numerosi interrogativi sia su temi della biologia di questo agente,sia su le modalità di risposta della mucosa gastrica e ancora su le modalità di interazione tra batteri e epiteli.
Si ritiene che il grado di virulenza degli H.pylori sia diverso a seconda dei ceppi infettanti e la gravità e la evoluzione delle lesioni della mucosa gastrica siano conseguenti a una predisposione genetica del soggetto.
|
