ER STRESS, Alterazioni mitocondriali
Autofagia negli epatoci di pazienti affetti da HCVOsservazioni al microscopio elettronico
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica
-
Il reticolo endoplasmico (ER) svolge numerosi processi biologici atti a regolare la omeostasi cellulare in condizioni di fisiologia e di patologia.
Tra questi,il ER ha attività di sintesi delle proteine che,prima di essere versate nel citosol,sono sottoposte a un delicato e controllato” ripiegamento”(folding).
Queste attività di sintesi e di folding sono continue,inarrestabili, ed esiste un equilibrio dinamico-quantitativo tra la quota di proteine sintetizzate e quella sottoposta a folding.
Il processo di folding è molto importante,poiché solo le proteine correttamente ripiegate sono versate nel citosol e sono utilizzabili. In consequenza di insulti acuti o cronici dell’ER si determina uno squilibrio tra la quota di proteine sintetizzate e quella sottoposta a folding: ciò provoca un accumulo nelle cisterne dell’ER di proteine non ripiegate (unfolded) o mal-ripiegate (misfolded). Questo stato patologico viene denominato: ER-STRESS(Journal of Hepatology 2011;34:795-809).
L’ accumulo di proteine unfolding o misfolding danneggia profondamente le funzioni e la ultrastruttura del reticolo endoplasmico e innesca risposte citoprotettive che sono espletate dal sistema “unfolded protein response” (UPR), il quale è attivato dai sensori JRE-1, ATEG, PERK. per eliminare le proteine compromesse e ripristinare la normale attività dell’ER. (Plos One 2011; 6(9): e24660).
Tale meccanismo si svolge secondo due direttrici secondo le quali si ha la la riduzione della sintesi delle proteine e contestualmente si ha il versamento nel citosol delle proteine unfolding o misfolding. (J, Clin. Invest. 2002; 110 (10): 1389-1398) (Nature 2008; 454 (7203): 455-462).
Le proteine riversate nel citosol, non sono utilizzabili,e successivamente saranno degradate mediante il sistema ER-Associated-Protein-Degradation (ERAD) che opera secondo due percorsi a seconda la solubilità e lo stato di aggregazione di tali molecole(Dev Cell 2003;4:265-271).
Il primo di questi percorsi si effettua secondo il sistema ubiquitina-proteosomico e interessa le proteine molto solubili; il secondo che interessa le proteine scarsamente solubili, insolubili o aggregati di proteine, si avvale del sistema autofagosoma-lisosoma (Cell Biol 2012; doi: 10.1155/2012/673290).
.Pertanto, emerge una continuità dei processi biologico- catabolici con partenza da una situazione di Er-stress cronica irreversibile, si attiva il sistema UPR e si conclude con il sistema ERAD caratterizzato dalle substrutture autofagoso-lisosomiali (J. Clin. Investig. 2011; 121: 37-56) (Autophagy 2014; 10: 766-784) (Int. J. Mol. Sci. 2019; doi 10 3390/ijms 20020300).
L’autofagia è un processo catabolico orientato a garantire la omeostasi cellulare; esso è complesso e si concretizza a tappe con una substruttura iniziale denominata fagofore, con una fase maturativa che si concretizza con il reperto dell’autofagosoma,infine con una fase conclusiva rappresentata dall’autofagosoma-lisosomiale (Cell. Res. 2014; 24(1): 24-41) (Cell. Res., 2014: 24: 58-68) (J. Cell Sci 2015; 128: 193-205). Numerosi studi hanno accertato che l’ER-STRESS e l’UPR sono importanti per la formazione dei focolai di autofagia (J. Hepatol. 2011; 55; 1150-1153)
Una situazione di ER-STRESS acuto provoca la morte della cellula, uno stato di ER-STRESS cronico induce un adattamento e una stabilizzazione del sistema UPR che consentono la sopravvivenza della cellula (Plos One 2011; 6(9): e24660).
Situazioni fisiopatologiche dianzi descritte sono di carattere generale; pertanto, esse si manifestano anche a livello degli epatociti in diverse condizioni fisiopatologiche reversibili e irreversibili; infatti sono state osservate e descritte nelle steatosi epatiche, nelle epatopatie tossico-degenerative, nelle epatopatie da alcool, in quelle da farmaci e da sostanze esogene (J. Hepatology 2011; 54 (4): 795-809).
Il sistema ER-stress-UPR-Autofagia viene attivato anche da agenti patogeni quali: Virus, batteri, parassiti; tra questi si ritrova anche il virus dell’epatite C. In culture cellulari infettate da HCV è stato osservato un danno cellulare rappresentato da vacuoli, ER-stress, alterazioni mitocondriali e formazione di numerosi autofagosomi (Autophagy 2008; 4(6): 830-831).
Anche ricerche in vivo su animali da esperimenti hanno evidenziato la comparsa di autofagosomi in corso di epatite cronica da HCV , dati confermati anche su materiale bioptico di pazienti affetti da epatite cronica da HCV (Journal of Hepatology 2011; 55: 1150-1153).
Il meccanismo mediante il quale l’agente HCV provochi la formazione di focolai di autofagia è ancora non ben chiarito: ma si riconosce che l’HCV provochi uno stato di ER-Stress e di UPR con successiva comparsa di focolai di autofagia (World J. Gastroenterol. 2014; 20(19): 5773-5793).
Appare anche accertato che il processo di autofagia in corso di infezione da HCV sia incompleto poiché non si repertano le strutture lisosomiali atte a realizzare l’ultima fase, quella della degradazione mediante la fusione autofagosoma-lisosoma (Am. J. Pathol. 2011; 178(6): 2708-2715).
E’ stato riportato in letteratura che i focolai di autofagia non solo sono sedi di sequestro di virus da HCV ma rappresentano sedi di replicazione virale e attraverso questo meccanismo si ha la persistenza della malattia (World J. Gastroenterology 2015; 21(28): 8492-8507) (Int. J. Med. Sci. 2019(20)2 doi 3390/ijms20020300).
- I mitocondri sono organelli dinamici con modulazioni diverse sul piano funzionale e morfologico in situazioni di stress fisiologico, nelle attività metaboliche anomale, nelle infezioni, nelle azioni pro-apoptosiche (Physiol. Rev. 2009; 89: 799-845).
Fattori endo o extracellulari alterano le funzioni mitocondriali, incrementando la reactive oxygen species (ROS), la glicolisi aerobica, e riducendo la fosforilazione ossidativa (Gastroenterology 2018; 155(3): 629-647) (Front Chem 21; doi: 10.3389/fchem 2018.000 73).
Uno stato di disfunzione mitocondriale eccedente i limiti d una omeostasi reversibile provoca un grave disordine metabolico e morte cellulare (Antioxid Redox Signal 2011; 14(10): 1939-1951).
In letteratura sono riportati dati circa l’azione dell’HCV su i mitocondri degli epatociti,provocandovi disfunzioni e alterazioni ultrastrutturali,sebbene non si conoscano i meccanismi di tali azioni patogene (World J.Gastroenterol: 2014;20(10):2624-2633).
I mitocondri disfunzionali o danneggiati nella loro morfologia subiscono un processo di fissione asimettrica e sono inglobati in un focolaio di autofagia selettiva per poi essere demoliti mediante il meccanismo della funzione autofagosoma-lisosoma (Science 2012; 337: 1062-1065).
E’ stato riportato che l’infezione da HCV provochi anche una autofagia selettiva, finalizzata alla degradazione e demolizione di mitocondri, mediante focolai di mitofagia (Gastroenterol. 2012; 142: 644-653) (PLOS Pathog. 2013; 9: e1003285
Si ritiene che la proteina core e altre proteine dell’HCV interagiscano con la matrice mitocondriale e si leghino alle membrane di questi organelli(Adv.Exp.Med.Biol.2017;997:49-67)(Chemosphere 2019;223:577-587).
Queste proteine virali si sposterebbero per diffusione laterale dall’ER ai mitocondri nelle aree di contatto tra queste due sub strutture,aree di probabile adesione tra membrane contigue (MAMs= mitochondrial- associated- membranes)(Biochim.Biophys. Acta 2014;1841(4):595-609).
La penetrazioni di queste proteine virali nei mitocondri altera la permeabilità della membrana esterna di tali organelli,induce un rigonfiamento osmotico,è causa di eccessivo accumulo di Ca2+,provoca il rilascio del citocromo C e di molecole pro-apoptosiche, attiva un incremento del ROS e si accompagna auna frammentazione delle membrane interne (Biochim. Biophys. Acta 1998;1366:33-50) (Curr.Pathobiol.Rep. 2013;1(3):179-187).
Il riferimento di questi dati,ampiamente riportati in letteratura,dati in prevalenza di virologia e di biologia molecolare elaborati secondo metodologie sperimentali,suggeriscono di verificare su campioni bioptici con l’ausilio del microscopio elettronico,se sul piano strettamente morfologico si repertino alterazioni riferibili a quanto acquisito a livello sperimentale e in particolare a reperti compatibili con l’ER-STRESS, con le alterazioni mitocondriali e con i susseguenti processi di autofagia.
REPERTI
I reperti qui di seguito descritti si riferiscono a dati acquisiti da biopsie di pazienti affetti da epatite cronica da virus C (HCV).
Al microscopio elettronico si evidenziano alterazioni citopatiche degli epatociti con danni più gravi a carico del reticolo endoplasmico e dei mitocondri con frequente presenza di focolai di autofagia.
Queste alterazioni non sono presenti in tutti gli epatociti, né coesistono nella medesima cellula ma variano a seconda della gravità e della fase dell’epatite cronica.
Dall’esame dei campioni presi in esame, si repertano epatociti caratterizzati con dominanza di reticolo endoplasmico ed altri con un elevato numero di mitocondri
A) Gli epatociti forniti di alte quote di reticolo endoplasmico mostrano un citoplasma diffusamente occupato da questa sub-struttura che appare profondamente modificata. La sua disposizione spaziale è disordinata, le cisterne sono dilatate, le membrane sono frammentate e disperse nel citosol. Le cisterne così dilatate sono occupate in varia misura da materiale amorfo o finemente granuloso.
In questi campi citoplasmatici così profondamente modificati si repertano focolai di fagofore e di autofagosomi. I focolai di fagofore si riconoscono per essere forniti di una membrana delimitante che in modo parziale o incompleto racchiude il materiale che dovrà essere demolito.
Fig.1 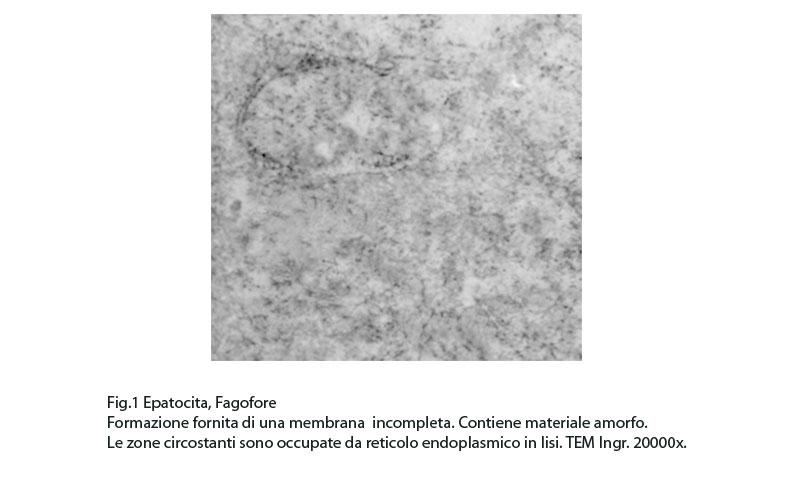 Fig.2
Fig.2 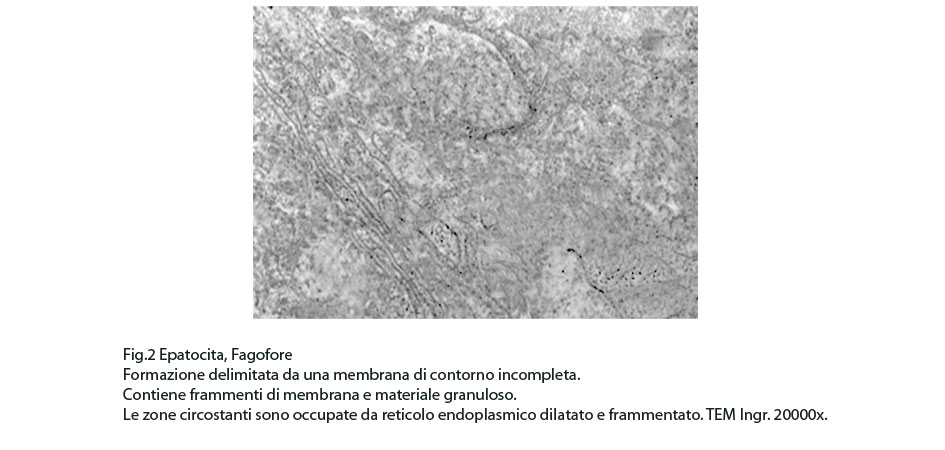
Fig.3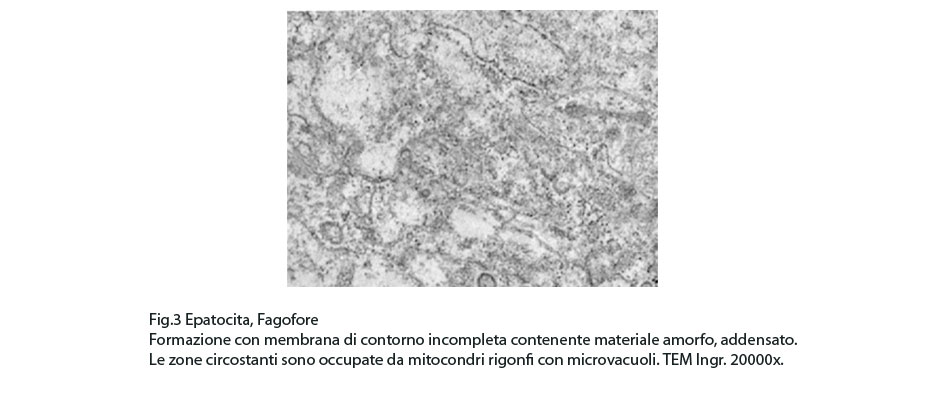 Fig.4
Fig.4 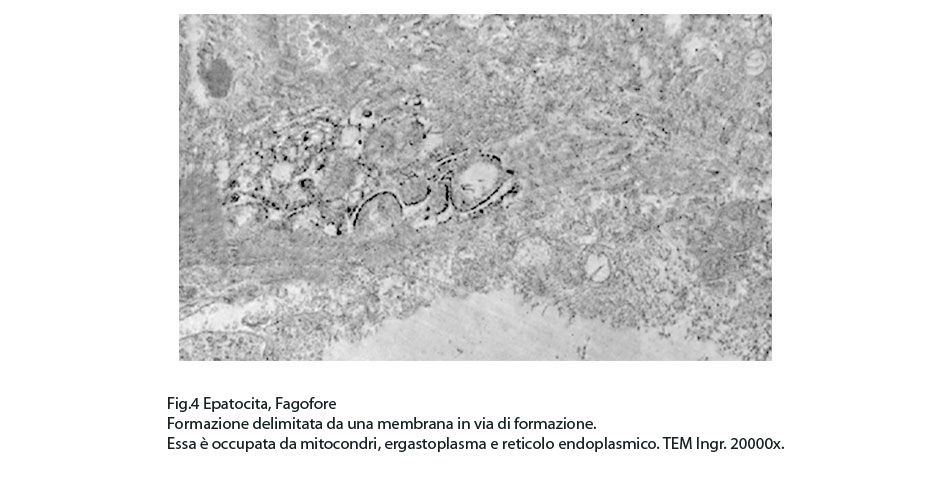
Fig.5 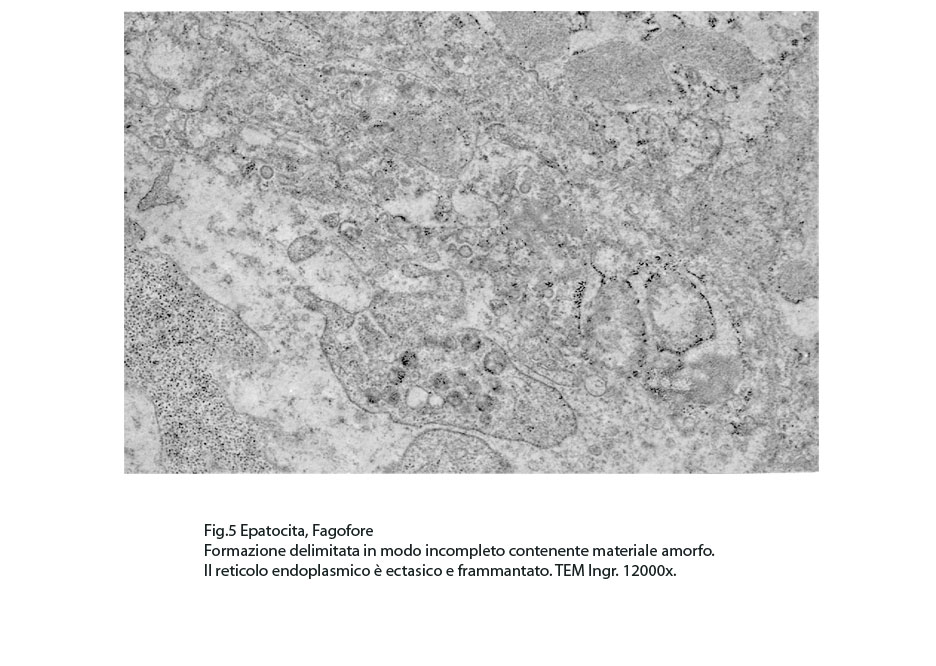 Fig.6
Fig.6 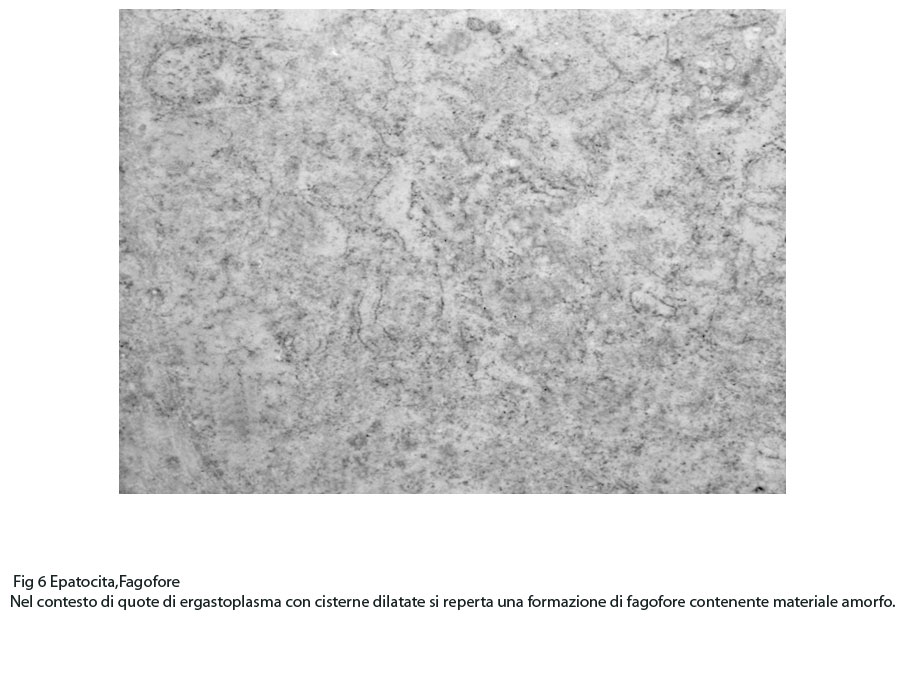
Fig.7 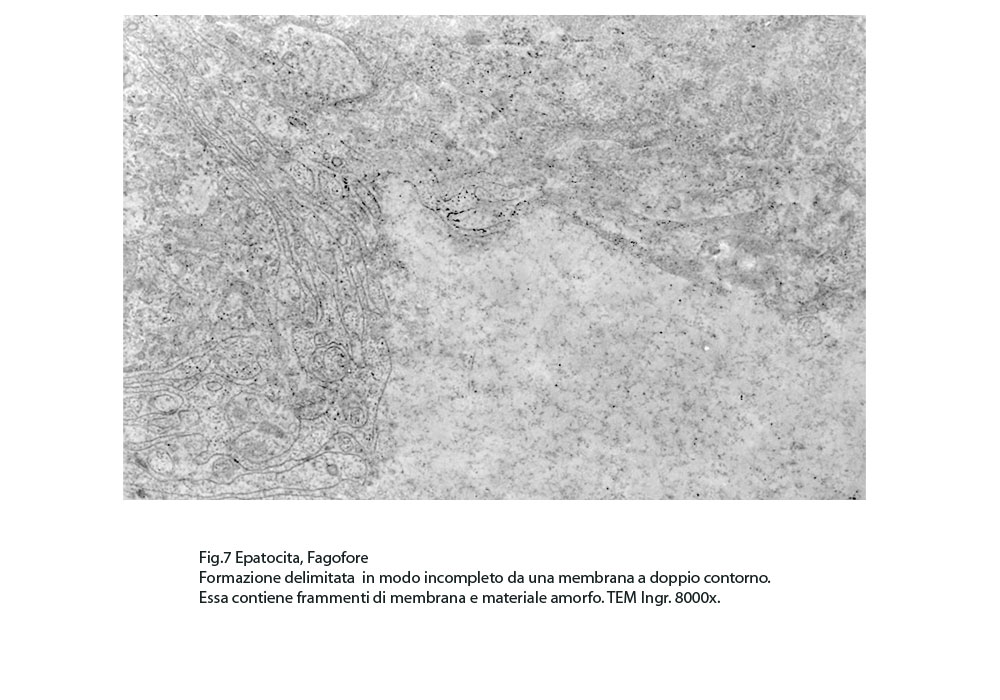 Fig.8
Fig.8 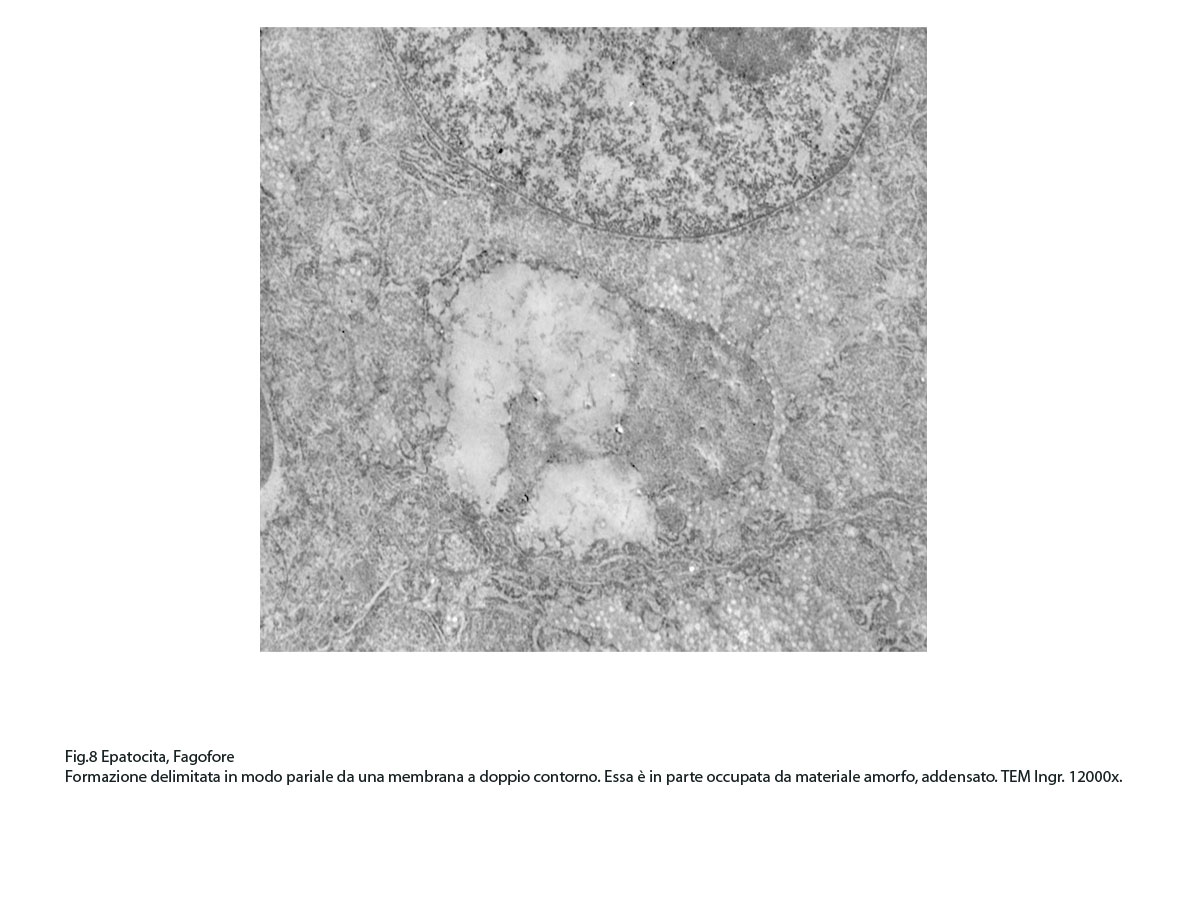
I focolai di autofagosomi, sono caratterizzati da una netta membrana a doppio strato che delimita ed avvolge il cargo che dovrà essere demolito.In questi reperti il cargo dei fagofori e degli autofagosomi è dato da frammenti di membrane del reticolo endoplasmico strutturato e da materiale amorfo o granuloso.
Fig.9 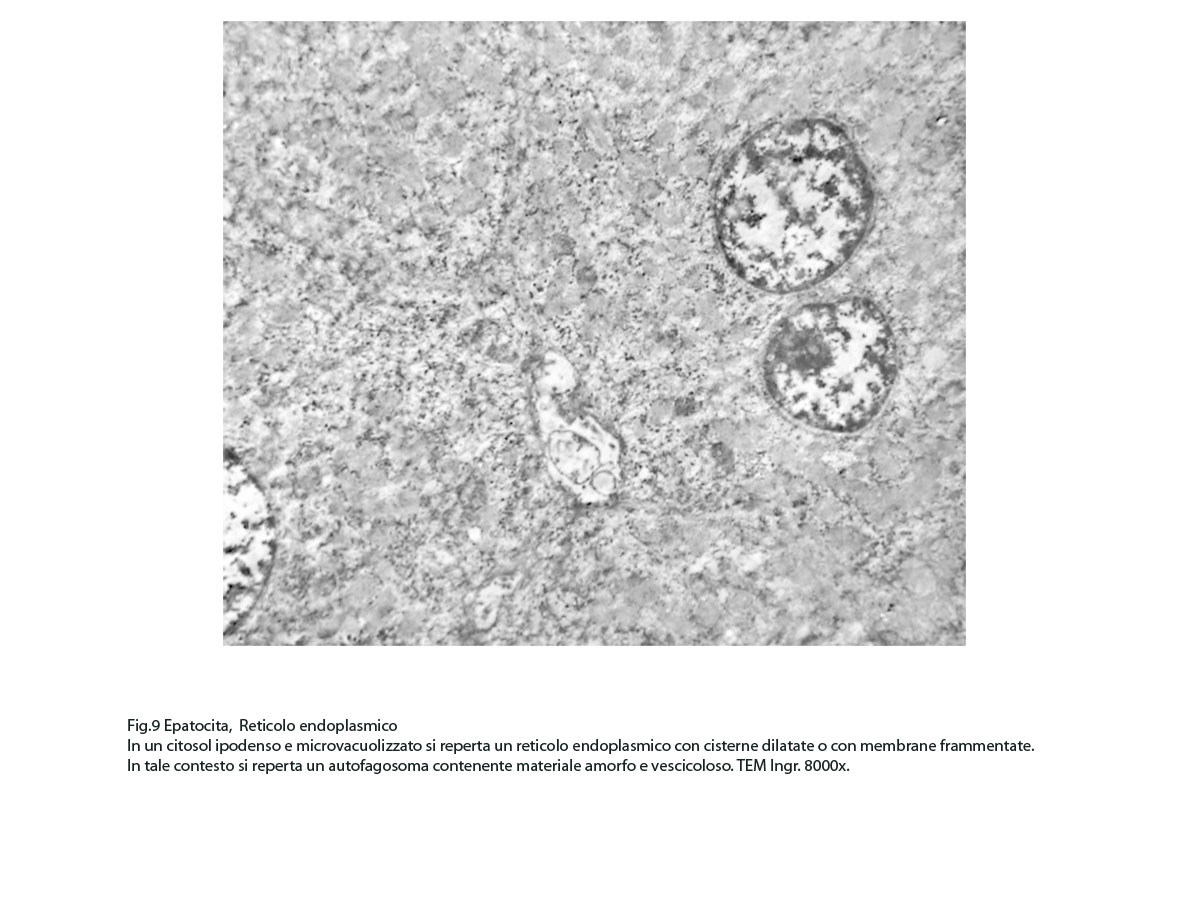 Fig.9part
Fig.9part 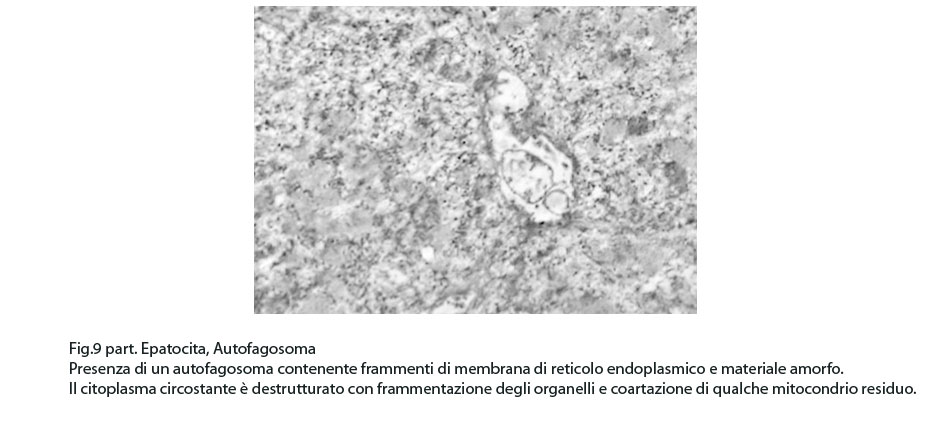
Fig.10 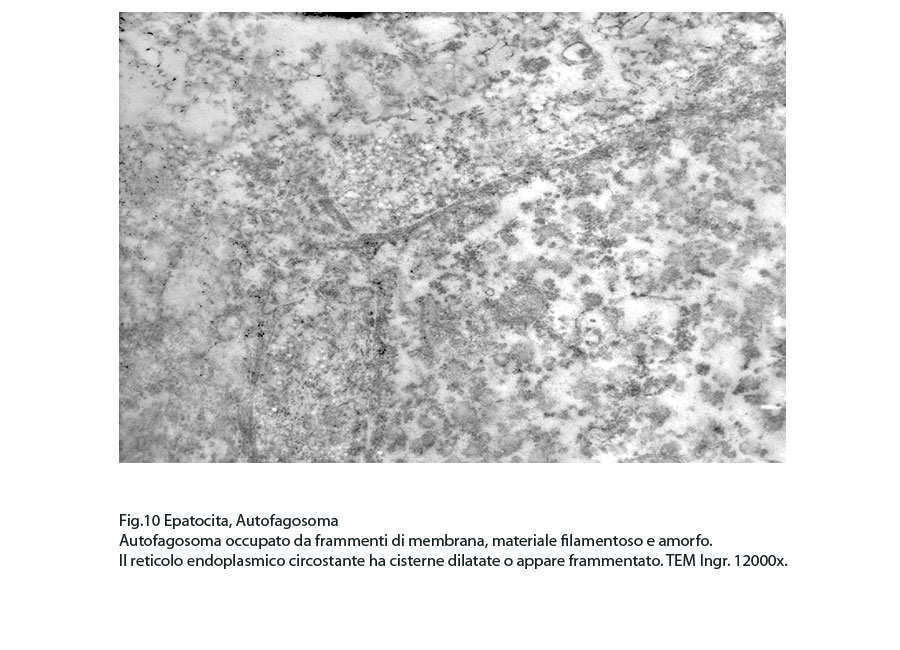 Fig.10part
Fig.10part 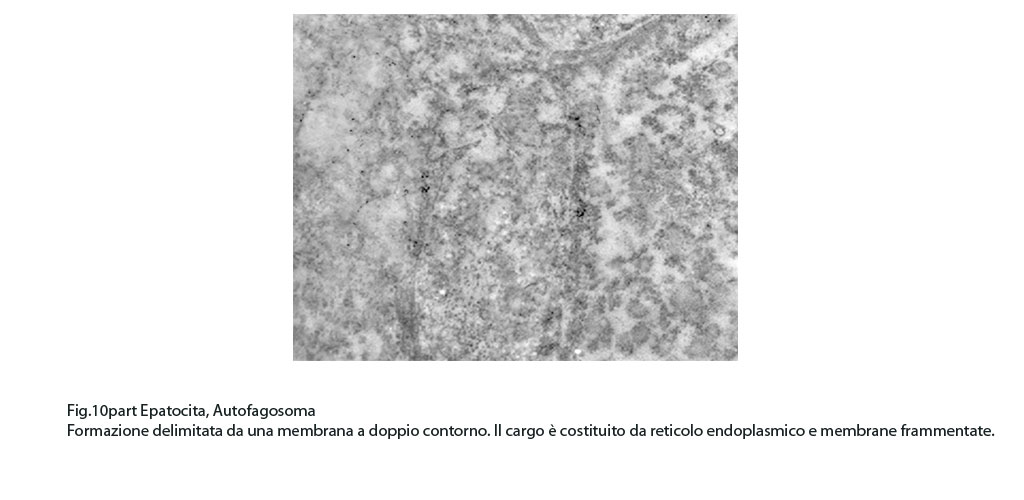
Fig.11 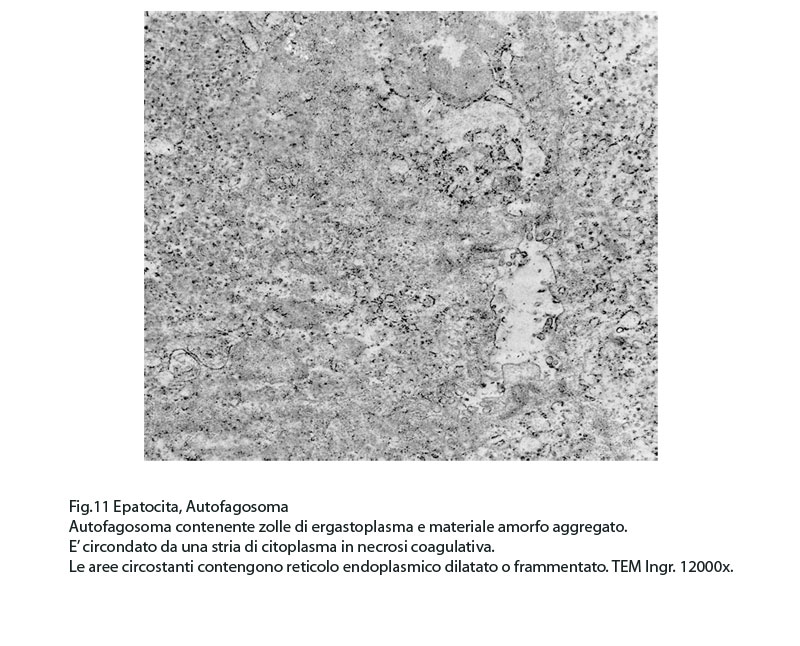 Fig.11part
Fig.11part 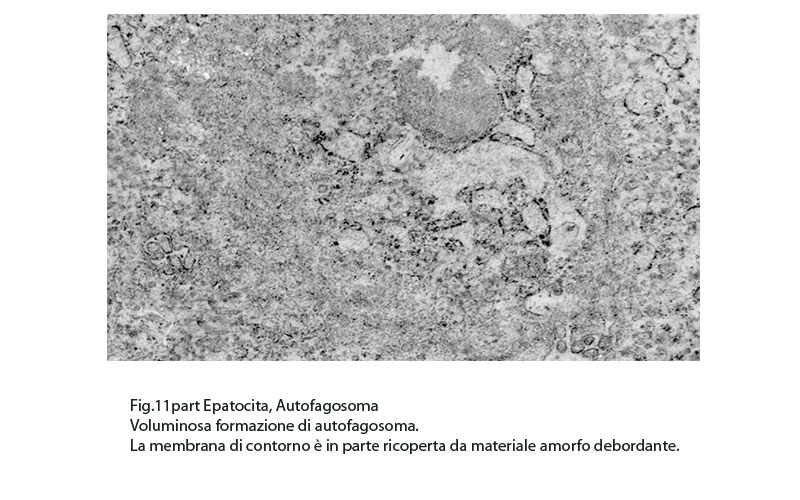
Fig.12 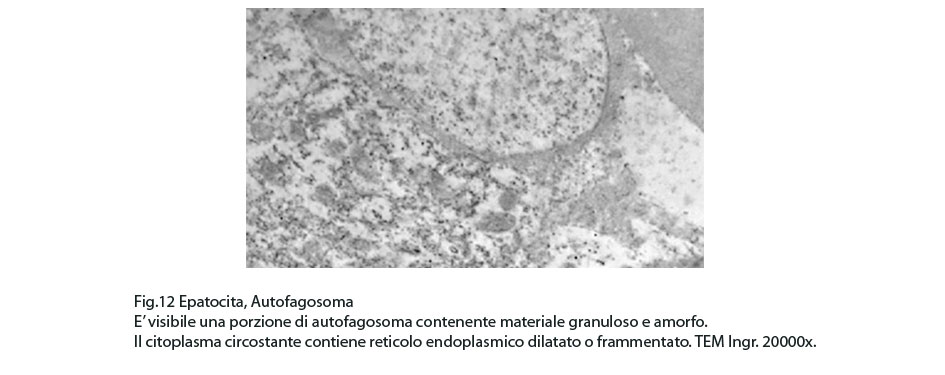 Fig.13
Fig.13 
Fig.13part  Fig.14
Fig.14 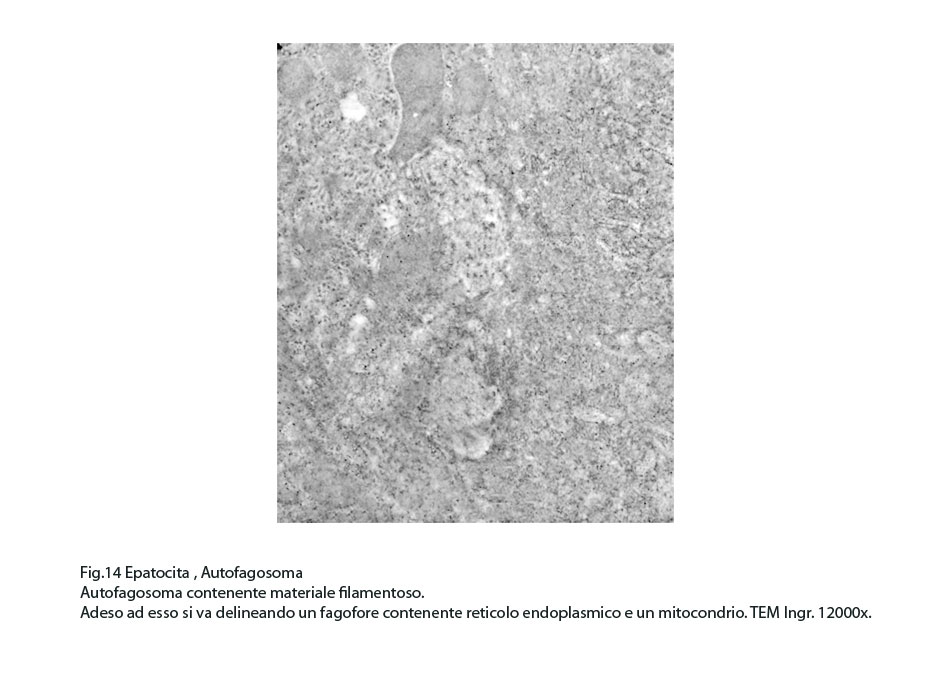
Fig.15 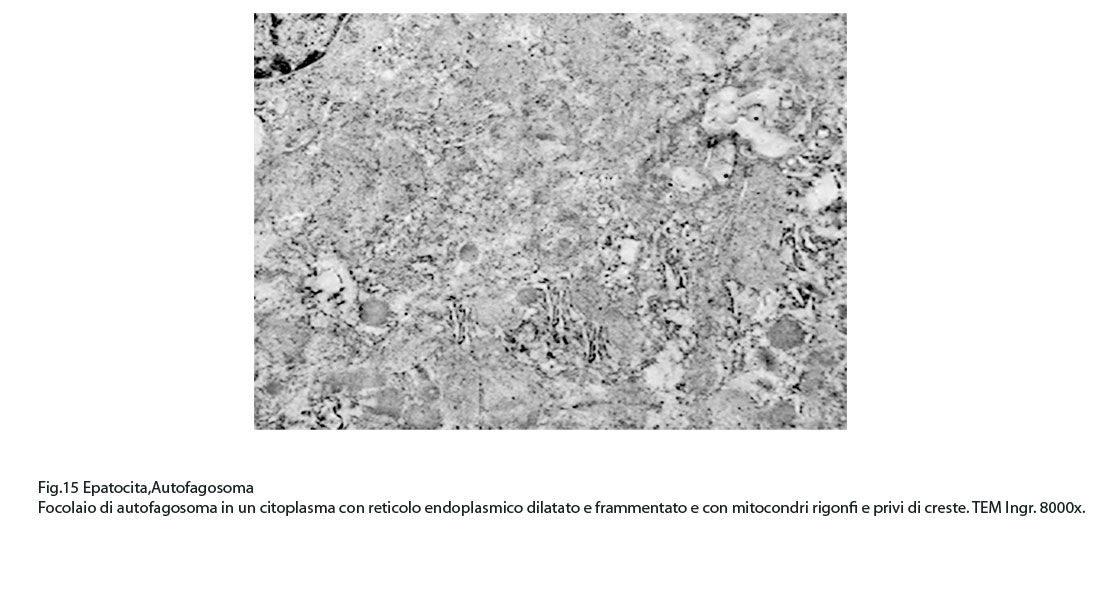 Fig.15part
Fig.15part 
Fig.16  Fig.17
Fig.17 
Fig.18 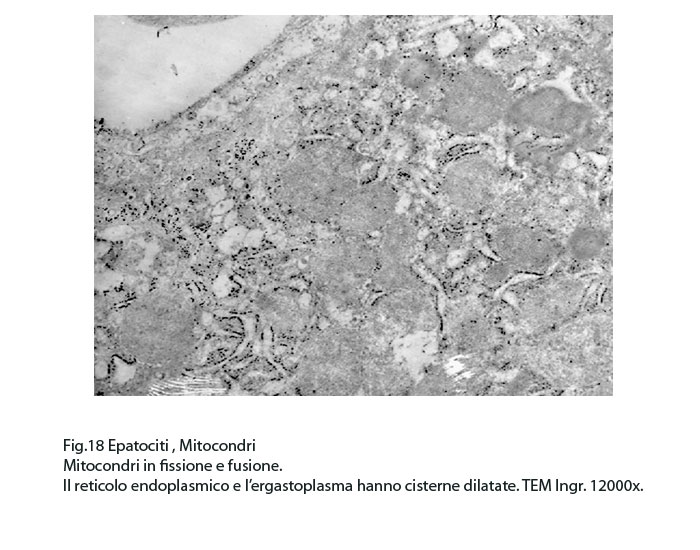 Fig.18part
Fig.18part 
In nessun campo citoplasmatico sono stati evidenziati lisosomi, pertanto il processo autofagico in esame appare non essere esposto alla fase della degradazione lisosomiale.
Questi epatociti sono deprivati in buona parte dagli altri organelli costituenti il citoplasma in condizioni di normalità. Infatti, si repertano rari mitocondri coartati iperdensi e privi di creste, piccoli segmenti di ergastoplasma poveri di ribosomi, un apparato del Golgi ipotrofico e destrutturato.
B) Gli epatociti forniti di un cospicuo numero di mitocondri evidenziano il proprio citosol ricolmo di questi organelli lasciando agli altri componenti (in particolare reticolo endoplasmico ed ergastoplasma) solo esigui spazi rappresentati dagli stretti solchi delimitati da due mitocondri contigui.
La maggior parte di questi mitocondri presentano alterazioni riguardanti la loro conformazione e in modo precipuo la loro microarchitettura interna,alterazioni che possono qui di seguito essere elencate: mitocondri dismorfi, irregolari, microvacuolizzati, mitocondri coartati e compatti, mitocondri rigonfi e associati a cristolisi, mitocondri giganti ricchi di creste tubulari.
Fig.19 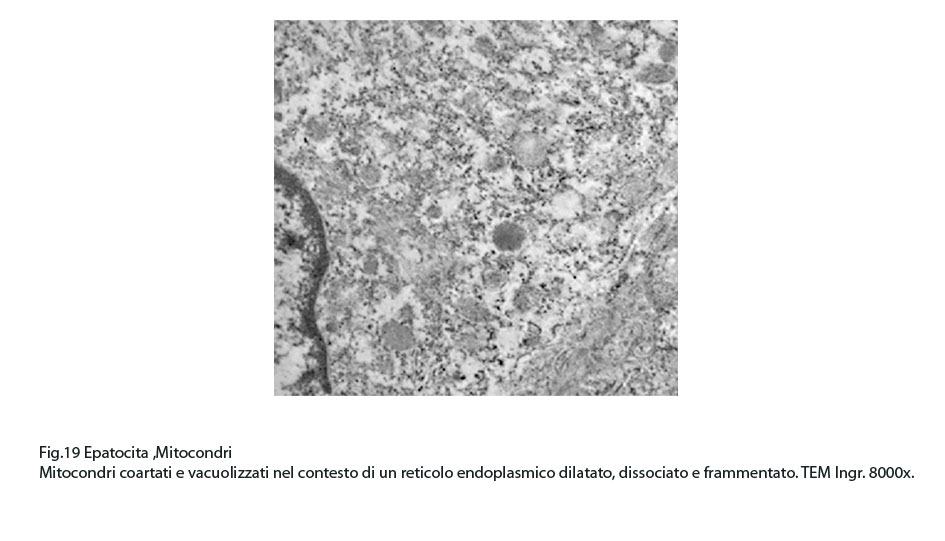 Fig.20
Fig.20 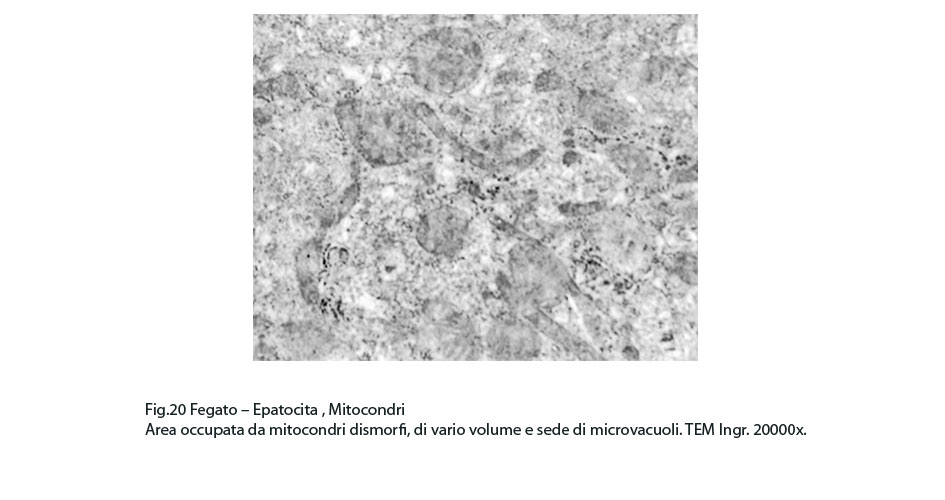
Fig.21 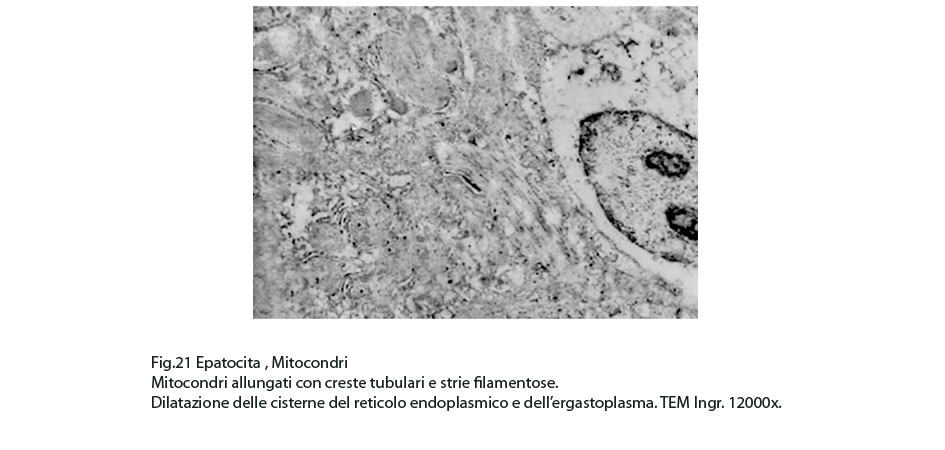 Fig.22
Fig.22 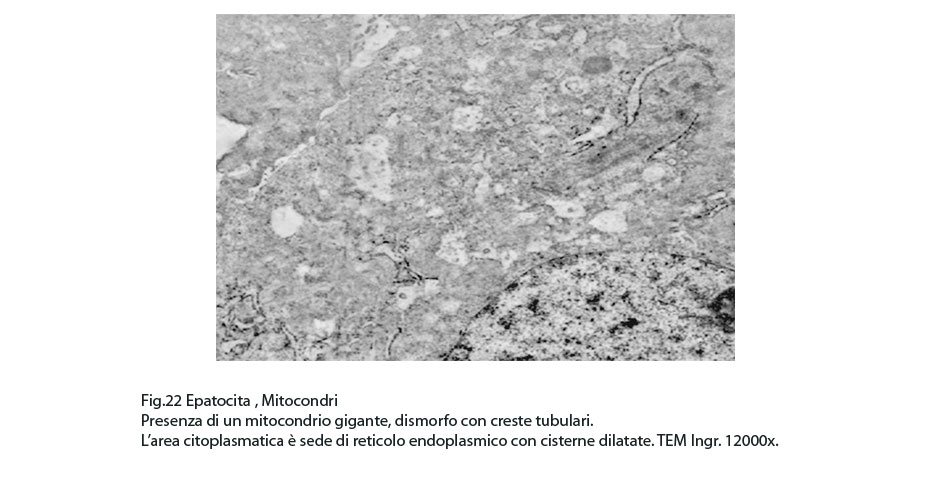
Fig.23 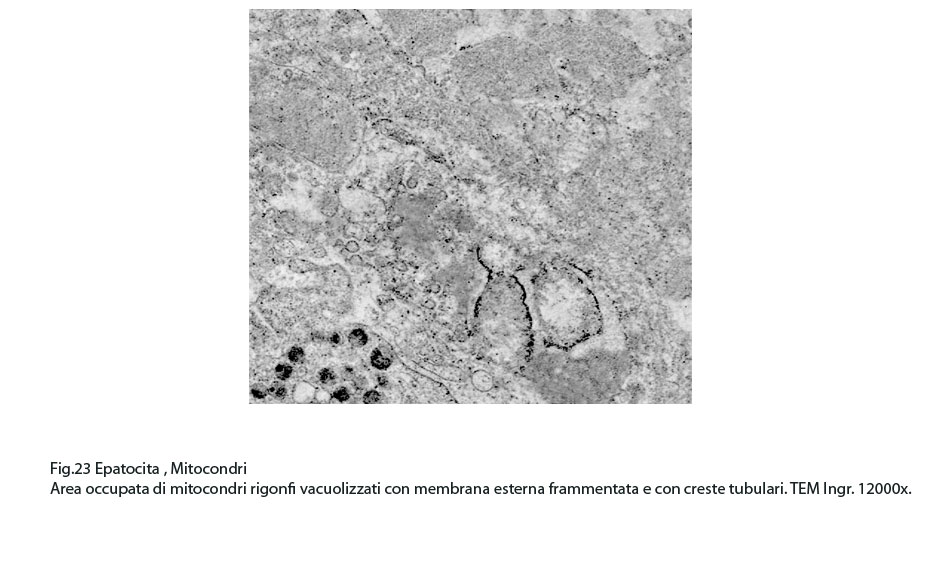 Fig.24
Fig.24 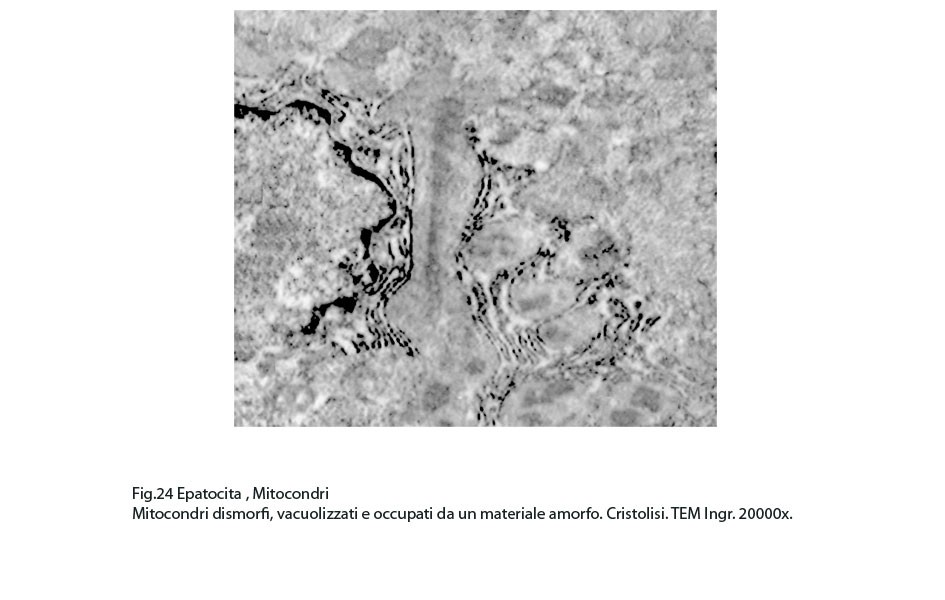
Fig.25 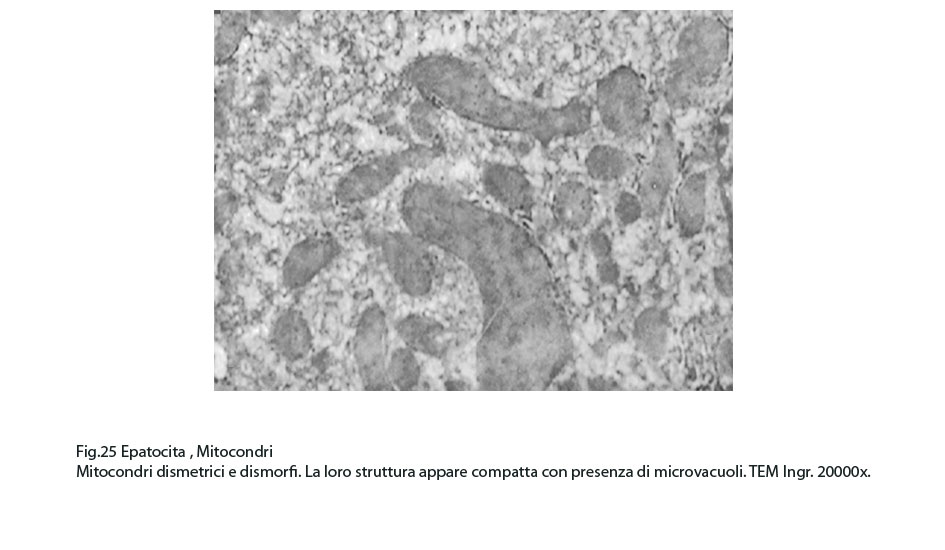 Fig.26
Fig.26 
Nel contesto di queste aree si repertano isolati focolai di fagofore e di autofagosomi contenenti mitocondri variamente danneggiati o destrutturati non sottoposti a demolizione enzimatica per assenza di strutture lisosomiali.
Fig.27 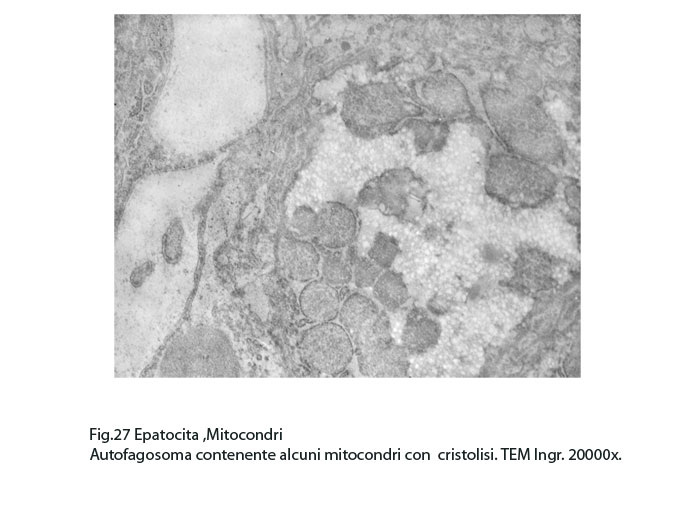 Fig.28
Fig.28 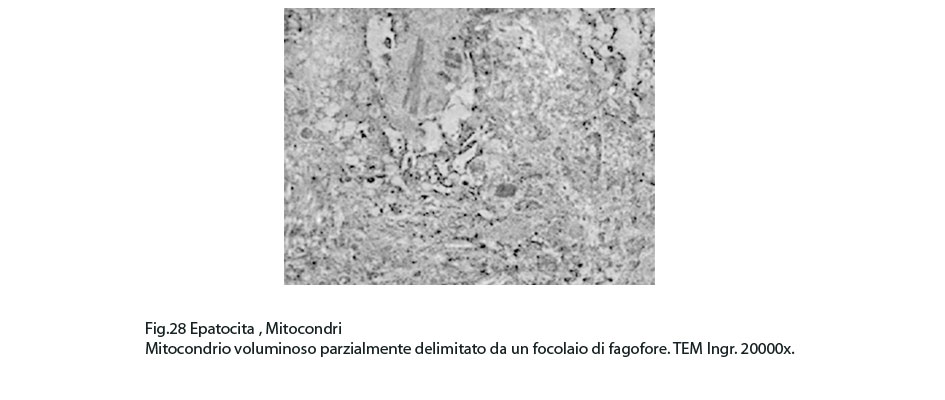
Fig.29 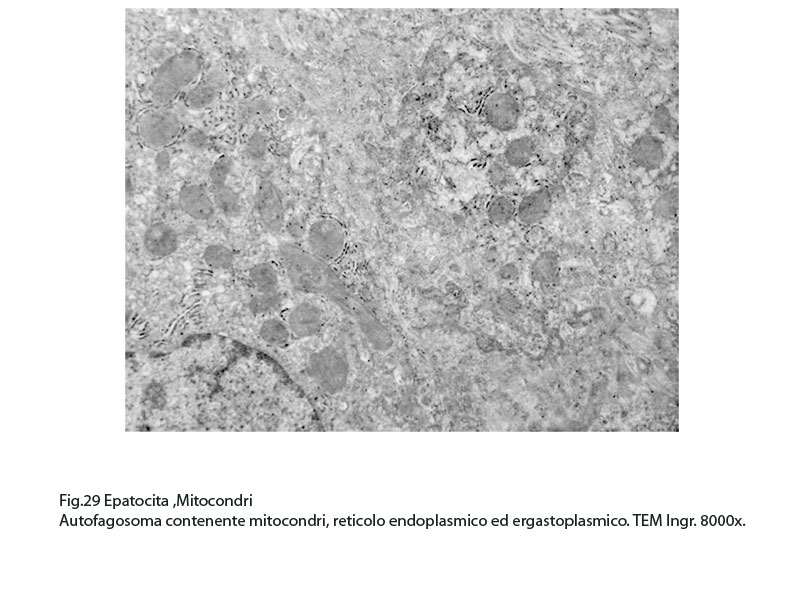 Fig.30
Fig.30 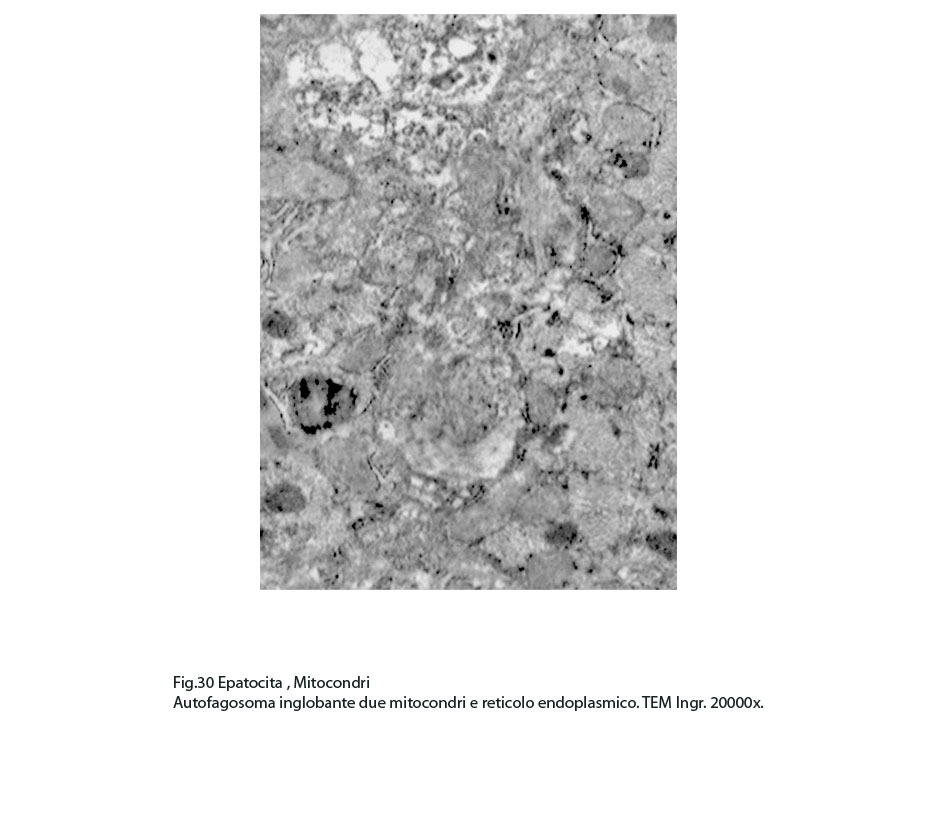
COMMENTO
Le conoscenze riportate in letteratura circa i danni indotti su gli epatociti da parte del virus dell’epatite C sono state acquisite soprattutto mediante l’utilizzo di culture in vitro e mediante animali da esperimento.
Le ricerche su questi campioni biologici si sono volte secondo direttrici virologiche, biochimiche, metaboliche, genetiche e non ultimo morfologiche.
Tali studi sono state considerati necessari per scoprire le modalità attraverso le quali il virus penetra nell’epatocita, come sviluppa la sua azione citopatica, in quali substrutture dello epatocita si replica e attraverso quali vie diffonde in sede endocellulare e poi in quella extracellulare per determinare uno stato di cronicità dell’infezione.
Le osservazioni condotte su materiale bioptico appartenente a pazienti affetti da epatite cronica da virus C si avvalgono, nel valutare la morfopatologia degli epatociti, delle acquisizioni ottenute dalle ricerche sperimentali dianzi ricordate.
. A differenza delle ricerche sperimentali, durante le quali sono fissati preliminarmente i parametri della crono-evoluzione della infezione virale su un substrato biologico sicuramente indenne da altre patologie, le ricerche condotte su campioni bioptici prelevati sono uno scandaglio sicuramente importante per la diagnostica, limitativo per elaborare interpretazioni patogenetiche, ma offrono la possibilità di osservare secondo meccanismi naturali lo stato patologico degli epatociti, aggravato quasi sempre dal sovrapporsi di lesioni indotte da altri fattori causali e concausali.
I reperti dianzi descritti consentono di sostenere uno stato di ER-STRESS ,di alterazioni mitocondriali e di una evidente attività autofagica in soggetti affetti da HCV cronica,simili a quelle ottenute dalle ricerche sperimentali.
Le indagini morfologiche su campioni bioptici si rivelano in necessarie per la definizione del quadro clinico e per le scelte terapeutiche anti virali e sono importanti per valutare la difesa delle due sub-strutture bersaglio dei virus,fornendo elementi di valutazione per bloccare, a livello delle cisterne del reticolo- endoplasmico e dell’ergastoplasma, i focolai di replicazione virale.
