DEGENERAZIONE EOSINOFILA, IDROPICA, STEATOSICA IN FEGATO AFFETTO DA EPATITE CRONICA DA VIRUS C
(Osservazioni morfopatologiche)
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica
-
L’epatite cronica da virus C (Hepatitis C Virus,HCV) presenta a livello istopatologico caratteri simili alle altre epatiti virali. Le alterazioni di base sono date da processi di necrosi degli epatociti, da concomitanti processi infiammatori cronici, con capacità evolutive verso la cirrosi e il carcinoma epatocitario.
L’HCV, con modalità simili alle altre epatiti virali viene distinta a livello morfologico nelle due forme di epatite interfaccia (caratterizzata da focolai di necroflogosi a livello dell’interfaccia mesenchima/parenchima) ed epatite cronica lobulare per la esistenza di focolai di necroflogosi interessanti il lobulo.
Tuttavia,l’HCV evidenzia alcuni aspetti morfologici caratterizzanti; questi sono rappresentati da una maggiore densità degli aggregati linfoidi fino allo sviluppo di follicoli linfatici con centri germinativi, da gravi alterazioni dei dutti biliari e dalla esistenza di processi di steatosi (Mac Sween’s, Pathology of the Liver, Elsevier, 2018).
In associazione alla steatosi, frequentemente si riscontrano a livello degli epatociti altre due forme regressive, quali la degenerazione acidofila e la degenerazione balloniforme. Queste spesso rappresentano manifestazioni regressive che preludono o si associano alla steatosi conclamata; tenuto conto di questa progressione istogenetica è necessaria qui di seguito tratteggiare prima la presentazione delle degenerazioni acidofila e balloniforme.
-
Degenerazione acidofila
Il citoplasma degli epatociti è frequentemente sede di un processo regressivo denominato “degenerazione acidofila”.
Le cellule interessate si riconoscono al microscopio luce per la loro maggiore volumetria,per l’aspetto compatto e finemente granuloso e soprattutto per l’affinità del citoplasma per i coloranti acidofili utilizzati nelle tecniche di istopatologia.
Queste modificazioni sono dovute alla presenza di un elevato numero di mitocondri con conseguente notevole riduzione delle altre sub-strutture, in particolare dell’ergastoplasma e del reticolo endoplasmico.
Il maggior numero di questi mitocondri sono aumentati di volume, sono dismorfi, sono colmi di materiale amorfo o sono sedi di microvacuoli oppure di creste frammentate.
Queste alterazioni mitocondriali sono state rilevate in numerose situazioni di stress e di patologia;esse sono correlate a un maggiore dinamismo di questi organelli,dinamismo che si appalesa attraverso modificazioni funzionali e morfologiche , soprattutto a livello delle creste che perdono la loro normale configurazione (Chemosphere 2019; 223: 577-587) (Adv. Exp. Med. Biol. 2019; 1158: 183-196).
In associazione alle alterazioni dei mitocondri si repertano alterazioni dell’ergastoplasma e del reticolo endoplasmico, con danni più gravi a livello delle zone di contatto ER-Mitocondri (MAM= Mitochondrial associated Membranes) (Biochem Biophys Acta Mol Cell Res 2017; 1864 (6): 865-876).
Tali danni sregolano i passaggi di lipidi, di glicogeno, alterano i controlli su la biosintesi dei lipidi, su la regolazione del Ca2+ e su tutti gli scambi bidirezionali tra mitocondri e reticolo endoplasmico (Nat. Rev. Mol. Cell. Biol. 2012; 13 (10); 607-625) (Cells 2019; 8(1) doi: 103390/cells8010016).
Queste disfunzioni, transitorie o permanenti, si riscontrano in numerose epatopatie croniche quali le steatosi, le steatoepatiti, le epatopatie alcoliche,le epatopatie da farmaci,e non ultime, le epatiti virali (Gastroenterology 2018; 155 (3): 629-647).
Alterazioni mitocondriali sono state riscontrate anche in pazienti affetti da HCV con disfunzioni morfo-funzionali a cui è associato uno stato di stress ossidativo(Am.J.Gastroenterol.1999:94:2198-2205) (Curr Pathobiol Rep. 2013; 1(3): 179-187).
Dati clinici e sperimentali hanno evidenziato la penetrazione di proteine dell’HCV nei mitocondri;queste si ritrovano negli spazi intermembrane,nella matrice mticondriale, si legano alla membrana esterna;tra queste proteine una maggiore azione patogena è svolta dalla proteina core dell’HCV.
La penetrazione di tali proteine avviene in prevalenza nelle zone di contatto ER/mitocondri (MAM),per diffusione dalle cisterne del reticolo endoplasmico,veri serbatoi virali(J.Gastroenterol Hepatol 2006;21Suppl3:34-37)(J.Viral Hepat.2010;17:784-793)(Curr.Pathobiol.Rep.2013;1:179-187).
La conseguenza di ciò comporta disfunzioni mitocondriali,quali un incremento del ROS,un accumulo di Ca2+, una abnorme permeabilità della membrana esterna dei mitocondri con rigonfiamento osmotico, rottura della membrana esterna,rilascio del citocromo c e di altre molecole pro-apoptosi (World J. Gastroenterol 2014; 20(10): 2624 – 2633).
-
Degenerazione balloniforme
Gli epatociti balloniformi hanno acquisito un aspetto globoso, sono aumentati di volume,mostrano un citoplasma iperchiaro, quasi trasparente centrato da un nucleo ben evidente. Nell’insieme, tali epatociti si riconoscono per la membrana plasmatica ben disegnata,per la massa nucleare posta in posizione centrale,il tutto ben apprezzabile per il contrasto con lo stato di trasparenza del citoplasma.
Nelle fasi iniziali tale alterazione, al microscopio elettronico, è caratterizzata da una riduzione della densità della matrice citoplasmatica, dalla dilatazione del reticolo endoplasmico spesso associata a un rigonfiamento dei mitocondri.
Nelle fasi di stato,essa mostra una ulteriore rarefazione della matrice citoplasmatica, una destrutturazione degli organelli citoplasmatici, una alterazione dei filamenti intermedi fino alla frammentazione del citoscheletro,e un’accumulo di gocce lipidiche nella matrice citoplasmatica; i dati di immunoistochimica hanno confermato i danni dei filamenti intermedi documentando la perdita della cheratina 8/18(J Hepatol 2008;48(5):821-828) (Expert Rev Gastroenterol Hepatol 2011;5(2):223-231) (J.Gastroenterol 2018;53(12):1285-1291) ( Tissue Eng. Part A 2020;26(1-2):93-101).
La etio-patogenesi della degenerazione balloniforme è multifattoriale;essa richiama alterazioni della molarità osmotica,stress ossidativi,deplezione di ATP,aumento intracitoplasmatico di Ca2+,frammentazione dei filamenti intermedi(J. Biol. Chem. 2004;279:294-301). Viene richiamata anche la partecipazione di una componente idropica per alterazioni della semipermeabilità della membrana plasmatica,componente non correlata all’accumulo di gocce lipidiche (J.Hepatol 2010;53(4):719-723).
La degenerazione balloniforme è stata riscontrata in diverse epatopatie quali,per esempio,nelle ischemie-riperfusioni,nei trapianti di fegato,nelle epatopatie da tossici,nelle epatiti virali croniche e soprattutto nelle steatoti e steatoepatiti alcoliche e non alcoliche(J.Hepatol 2005;42:378-385)(Semin.Liver Dis.2007;27:173-193).Questa sua relativa aspecificità consente di ritenere,in situazioni di patologie croniche,la risultante di concause che associandosi ne hanno determinato la estensione, la gravità e la progressione della degenerazione.
-
STEATOSI
Nel citoplasma degli epatociti è frequente la presenza di gocce lipidiche costituite da trigliceridi, fosfolipidi e colesterolo. La gravità di questo processo è varia: nelle forme lieve-moderate (steatosi microvescicolare) il profilo della cellula non viene modificato e la posizione del nucleo rimane centrale. Nelle forme gravi (steatosi macrovescicolare), gli epatociti sono voluminosi, acquistano un aspetto globoso, il citoplasma è interamente occupato da lipidi e il nucleo è spostato ai margini del corpo cellulare, a ridosso della membrana plasmatica (Mac-Sween – Pathology of the liver-Elsevier, 2018).
La steatosi degli epatociti è un processo degenerativo indotto da numerose cause e tra queste dalle epatiti virali e dalle epatiti autoimmuni, ed è considerata un reperto caratterizzante l’ epatite cronica da virus C (HCV).
Secondo quanto è riportato in letteratura, due proteine dell’HCV, proteina core e proteina NS5A interferiscono nel metabolismo lipidico degli epatociti, inibendo la attività della proteina MTP (microsomal trigliceridi transfer protein) e provocando un accumulo di trigliceridi negli epatociti (Gastroenterology Report 2016; 4: 24-29).
E’ stato accertato che l’HCV genotipo 3 ha una azione steatosica diretta a livello degli epatociti; invece, l’HCV genotipo 1 induce la steatosi solo se pre-esistono alterazioni dismetaboliche, situazioni di diabete mellito, di insulina resistenza,di etilismo cronico,o di danni degli epatociti provocati da altri fattori (Arch. Lab. Med. 2011; 135: 1320-1328)( World J.Gastroenterology 2014;20:7089-7103)(Hepatol.Res.2014;44:123-132).
Lo stato di steatosi favorisce la penetrazione dei virus negli epatociti, la replicazione virale, lo stress ossidativo, il rilascio di citochine che inducono la necro-flogosi e la fibrosi. (Gastroenterology 2004; 126(2): 586-597).
Il riscontro di steatosi in pazienti affetti da HCV in associazione ad altre patologie epatiche provoca un potenziamento sinergico,una sovrapposizione di processi lesivi che inducono rapidamente il quadro patologico verso la cirrosi e il carcinoma epatocellulare (Schiff’s Diseases of the Liver, Wiley Blackwell, 2018).
-
REPERTI
La descrizione dei reperti di istopatologia e di microscopia elettronica qui di seguito riportati è stata ricavata da casi epatite cronica lobulare da HCV. L’attenzione è stata rivolta in modo selettivo ai processi regressivi degli epatociti,enucleandoli dai focolai di flogosi,di necrosi e di fibrosi coesistenti.
-
Degenerazione acidofila
Le lamine epatocitarie mono-bi-pluristratificate sono costituite da epatociti interessati da processi regressivi diversi per morfologia e gravità. Tra questi, si riscontrano con molta frequenza epatociti sede di degenerazione “acidofila”.
Al microscopio luce queste cellule si riconoscono agevolmente per la loro maggiore volumetria, ma soprattutto per i caratteri del citoplasma; infatti questo appare intensamente colorato con i coloranti acidi ed ha un aspetto compatto e finemente granuloso.
-
Fig.1 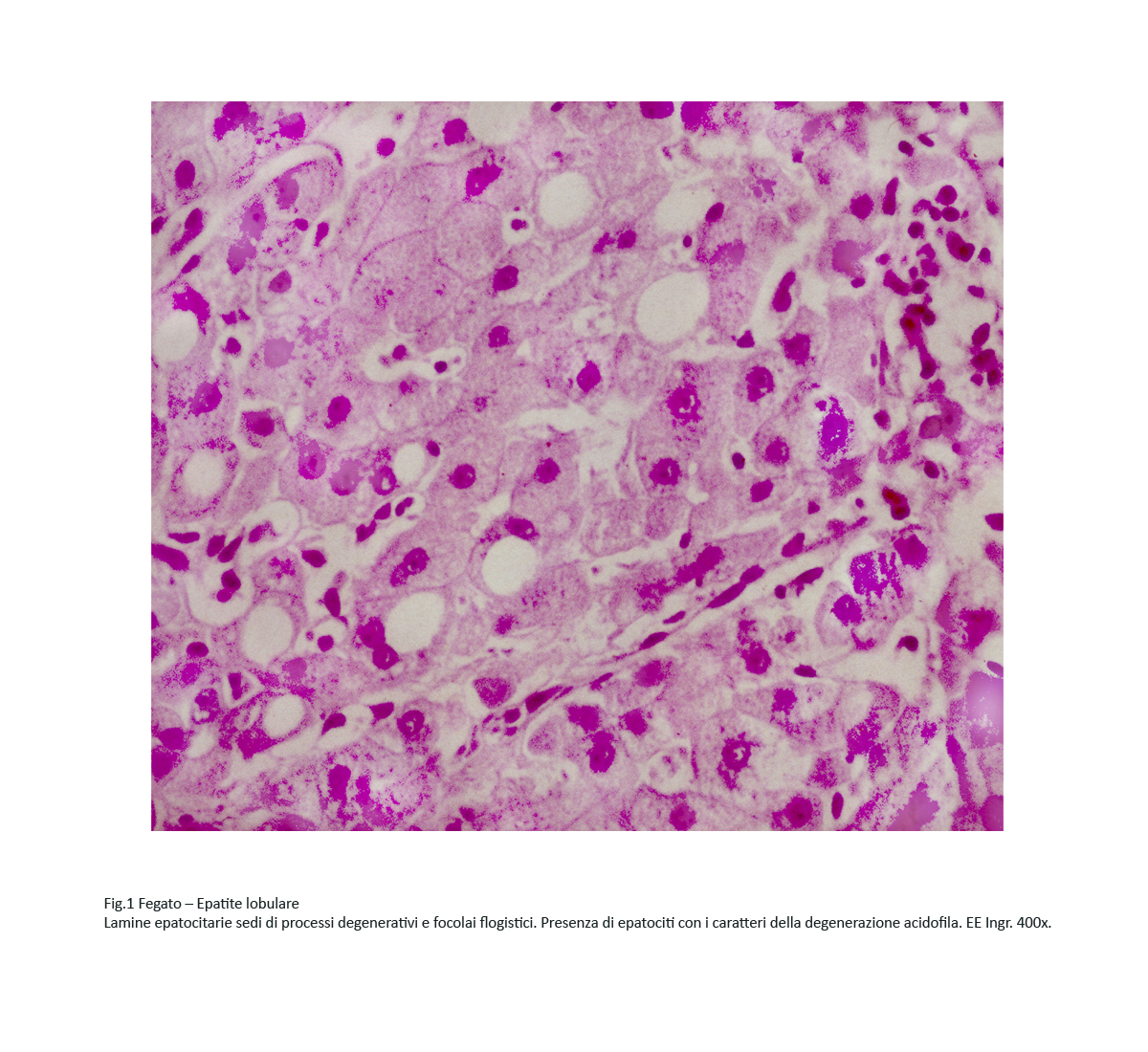
Al microscopio elettronico, il citoplasma di questo epatocita si rivela essere occupato da quote cospicue di mitocondri.
Nel dettaglio la morfologia di tale citoplasma è data da un elevato numero di mitocondri e da strutture dell’ergastoplasma e del reticolo endoplasmico che si distribuiscono e si ramificano negli esigui spazi residuati tra mitocondri contigui.
-
Fig.2 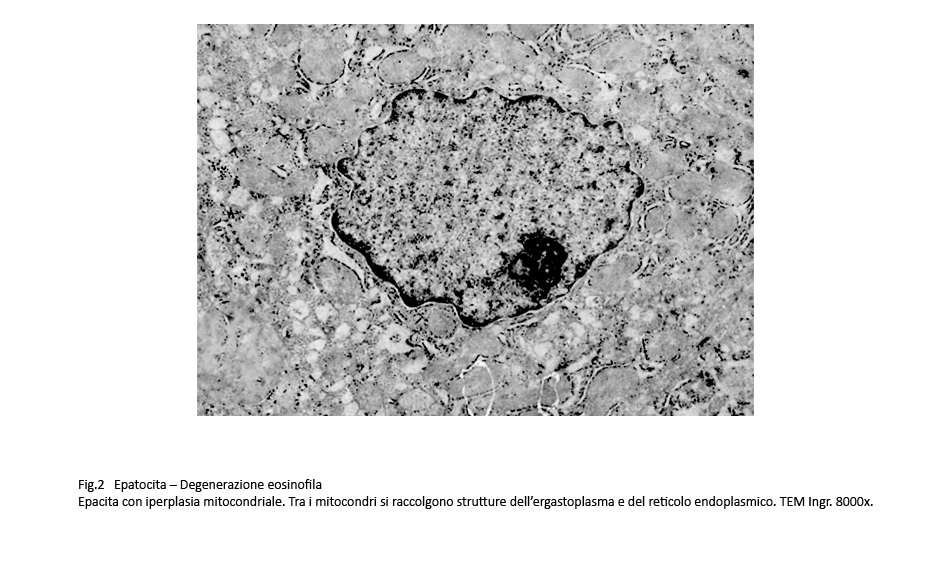 Fig.3 Fig.3 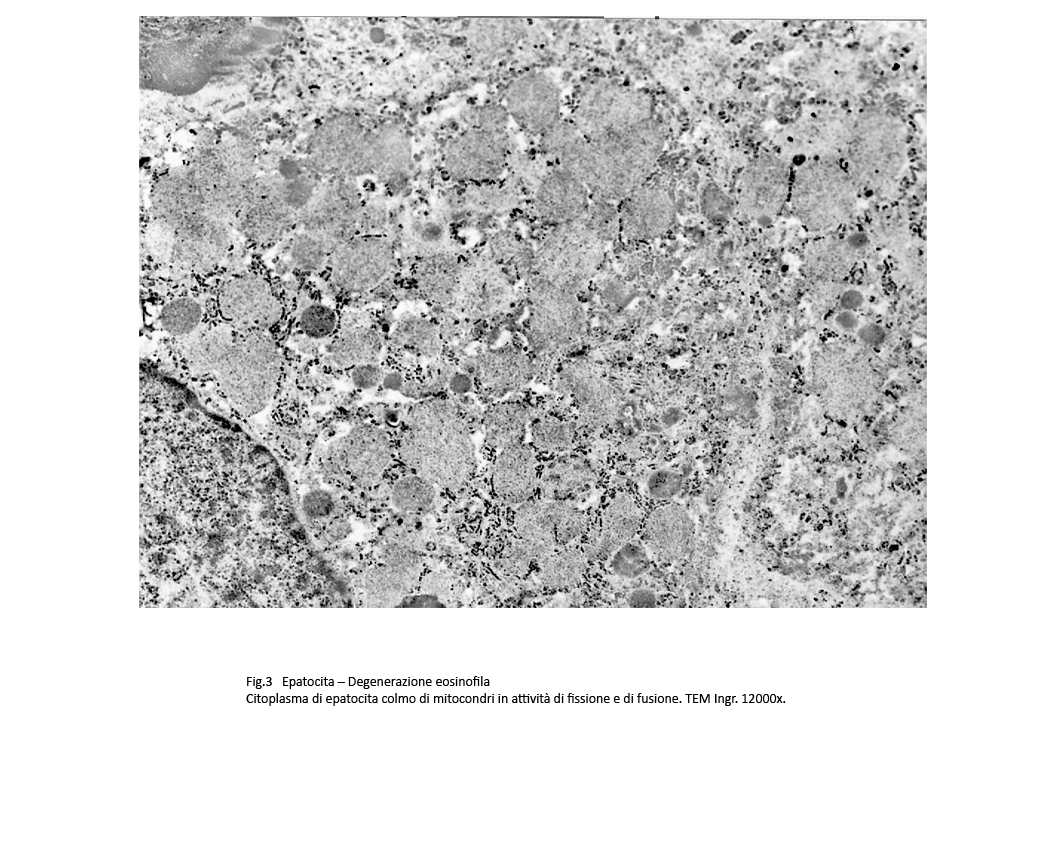
-
Osservazioni analitiche di tali organelli mettono in evidenza la esistenza di stati di adesione mitocondri-ergastoplasma e mitocondri reticolo endoplasmico con zone di contatto tra le due sub-strutture senza alcun segno morfologico di fusione. Di questo insieme l’ergastoplasma mostra una struttura nei limiti della norma con microaree di dilatazione delle cisterne, mentre i mitocondri mostrano focali attività di fusione e di fissione e in elevato numero appaiono rigonfi,micro vacuolizzati e con creste frammentate o il lisi.
-
Fig.4  Fig.5 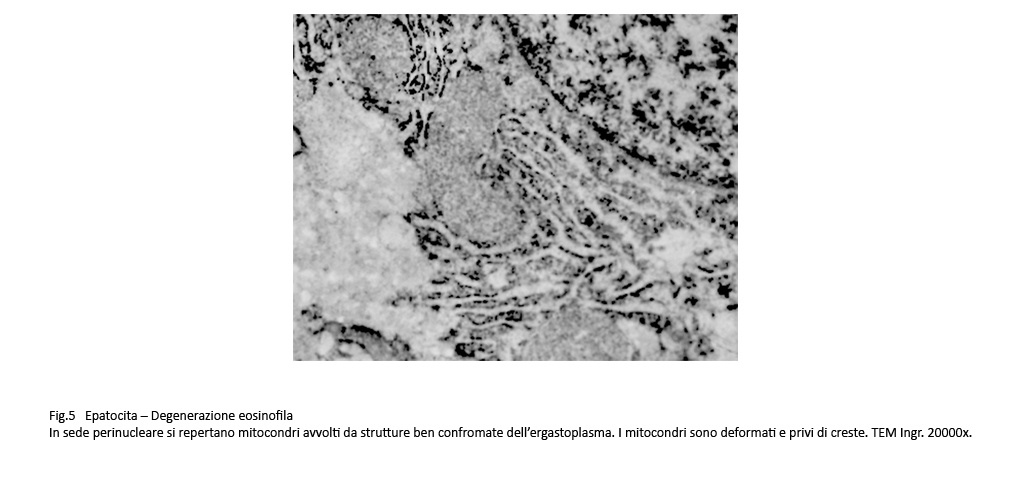
-
Fig.6 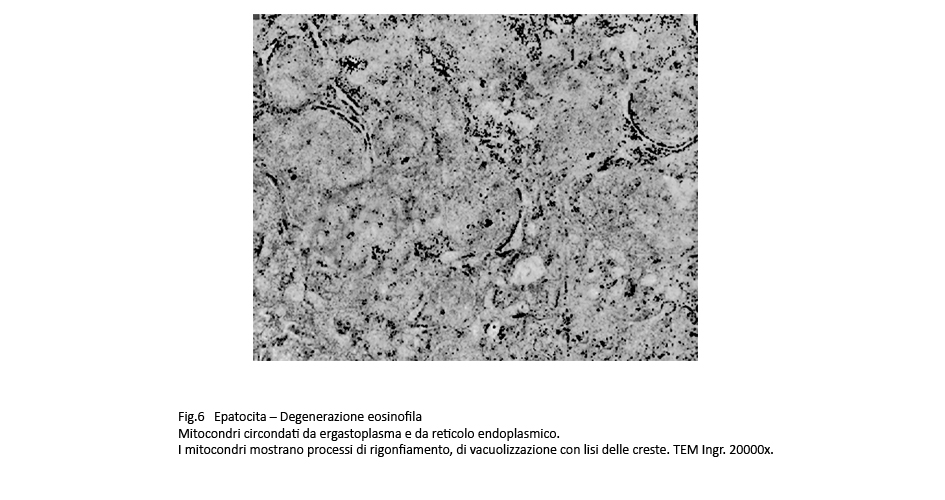 Fig.7 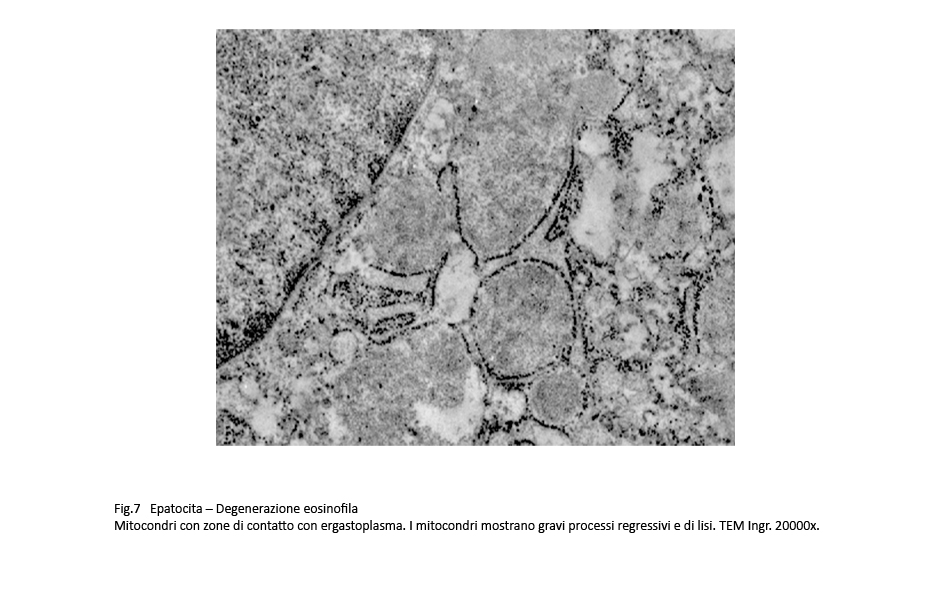
-
Degenerazione balloniforme
Nel contesto delle lamine epatocitarie uni-bi-pluristratificate si repertano epatociti globosi, aumentati di volume con matrice citoplasmatica ipodensa o addirittura diafana, trasparente. In essi, residuano in quantità diverse aggregati filamentosi commisti a materiale amorfo-granuloso oppure micro-insule frammentate di citoplasma. Il nucleo occupa una posizione centrale nel corpo cellulare e frequentemente si presenta parzialmente rarefatto.
-
-
Fig.11 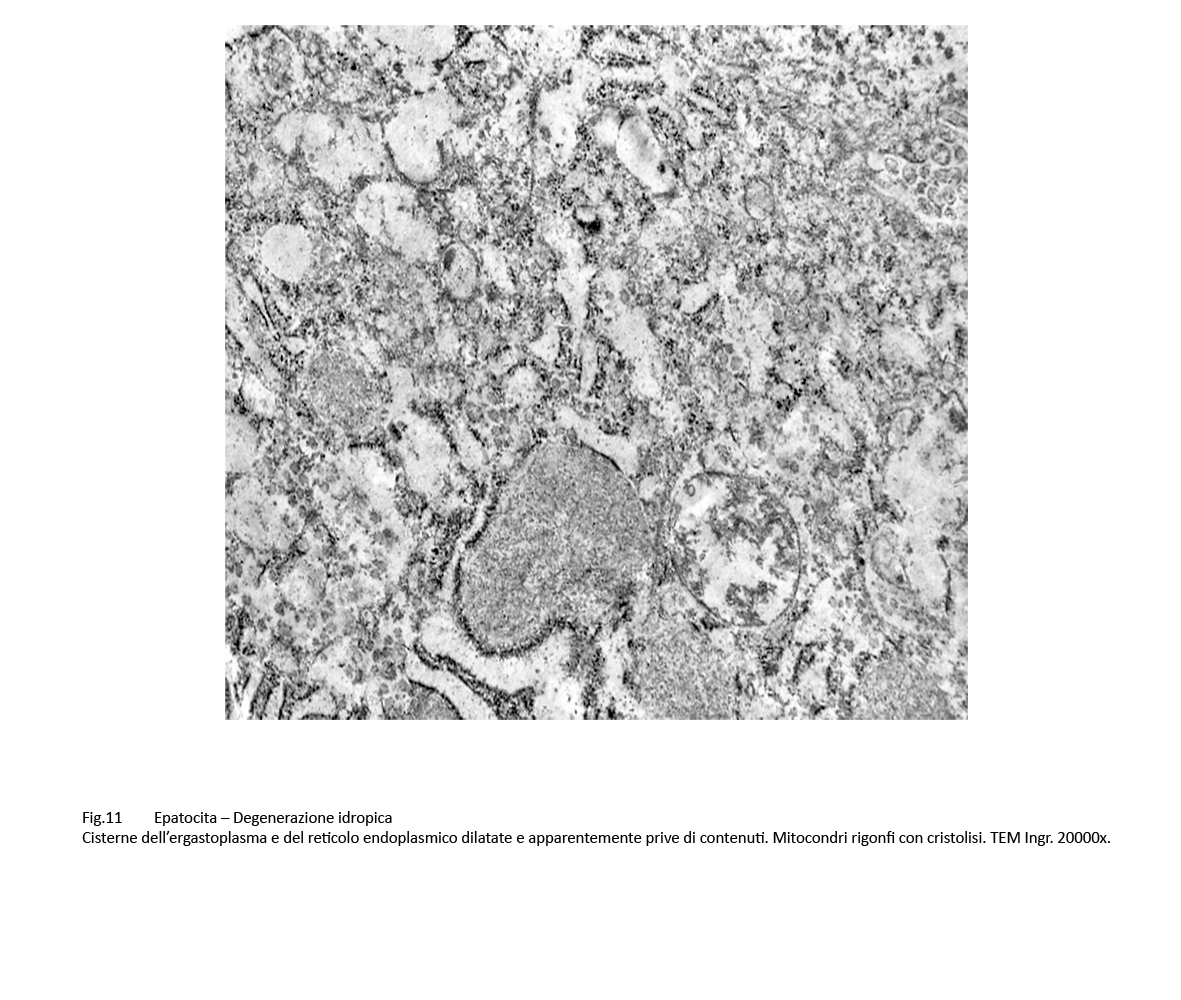 Fig.12 Fig.12 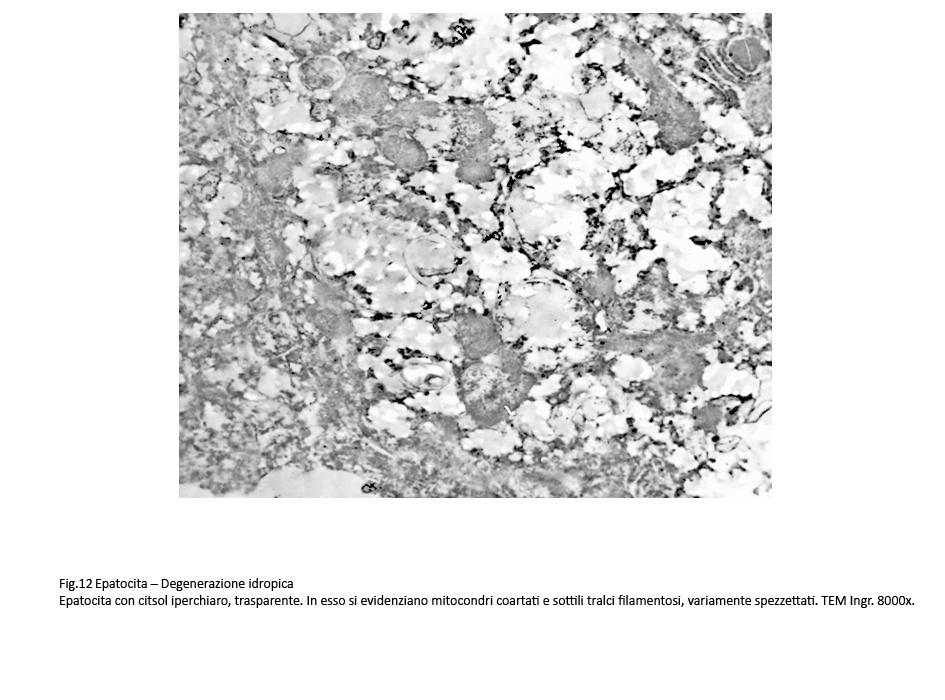
Nelle forme gravi si rivela un citosol trasparente contenente alcuni mitocondri coartati e pochi frammenti di ergastoplasma quale risultato di una estesa e profonda destrutturazione del citoplasma.
-
Fig.13 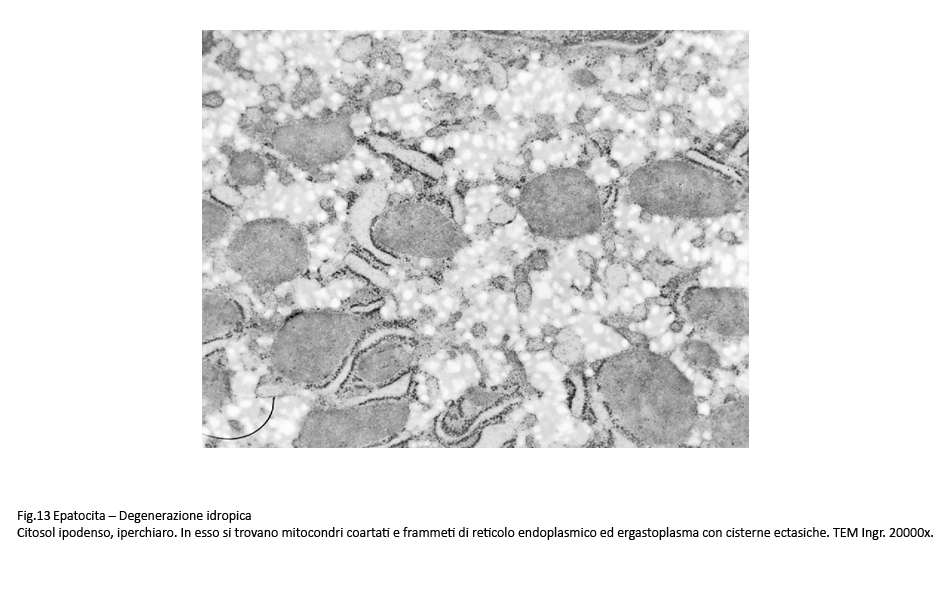 Fig.14 Fig.14 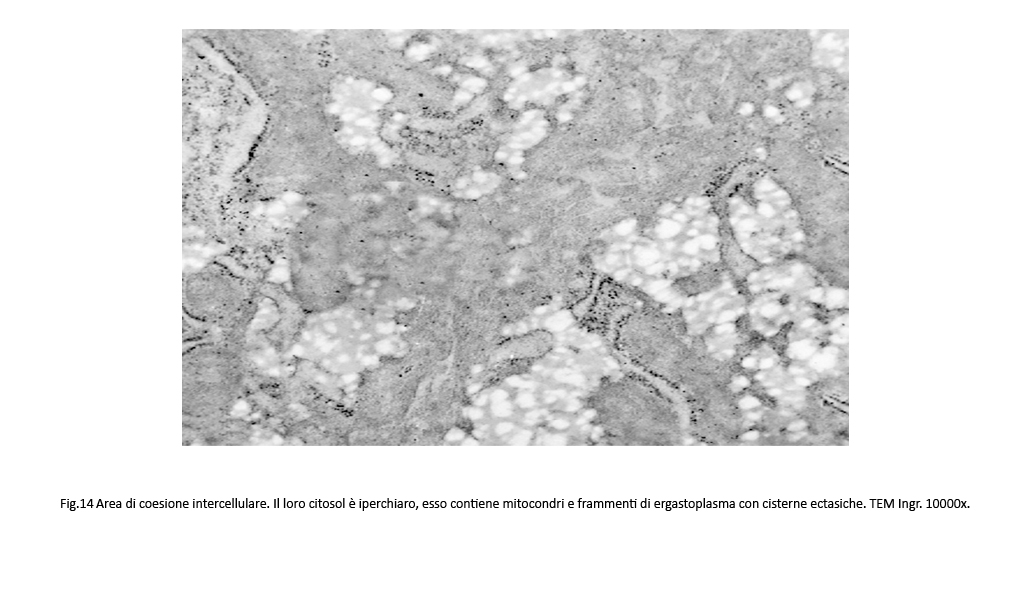
Sono, altresì, presenti epatociti nei quali il processo di rigonfiamento idropico con dilatazione delle cisterne dell’ergastoplasma è associato a microdepositi di materiale amorfo, verosimilmente di natura lipidica.
-
Fig.15 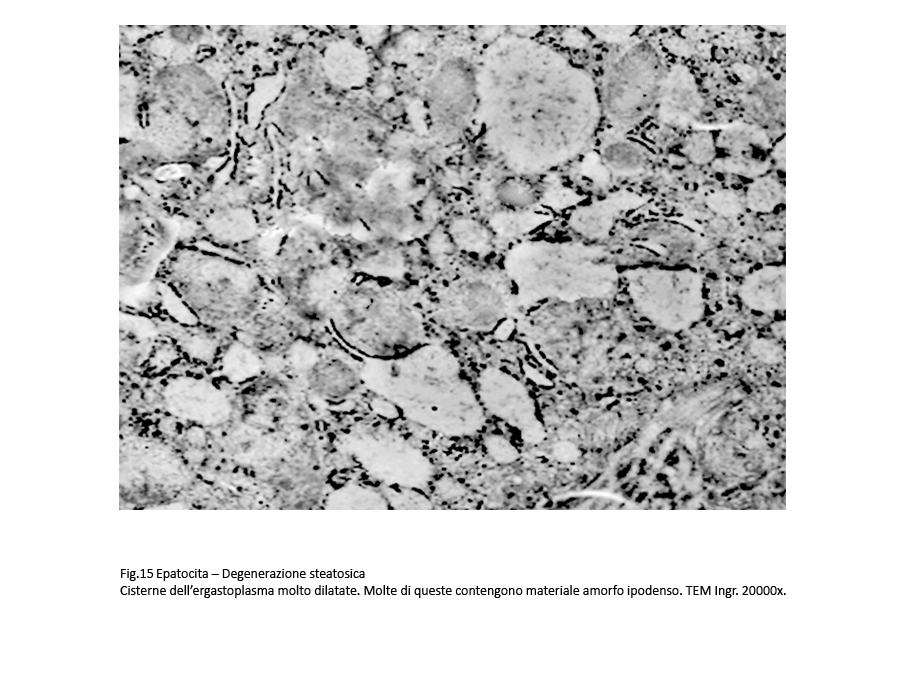
-
Steatosi
Il processo steatosico varia per distribuzione, intensità e volumetria delle vescicole o delle cisti grassose.
Nelle steatosi focali di grado lieve-moderato si riscontrano microare di steatosi distribuite in modo casuale a livello delle lamine epatocitarie;questi foci di steatosi spesso,sono associati ad altre forme degenerative o a necrosi.
-
Fig.16 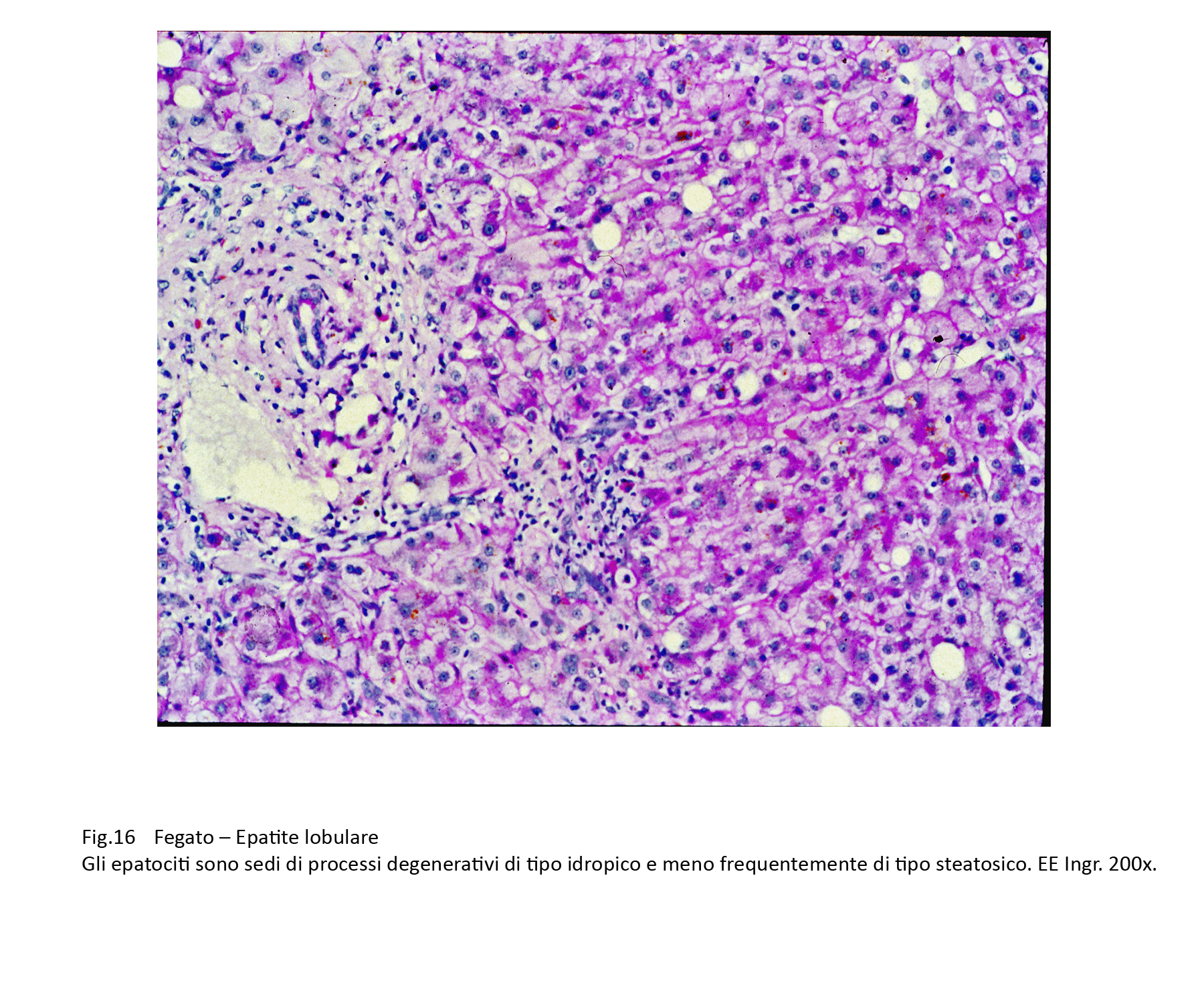
Nelle steatosi diffuse e gravi, la maggior parte degli epatociti hanno acquisito una voluminosa, forma globosa per la presenza nel citoplasma di aggregati di vescicole o di un'unica cisti,tutte ricolme di materiale lipidico. Il progressivo accrescimento di questi depositi provoca,a far tempo,la rottura della membrana plasmatica con versamento del materiale lipidico negli interstizi; questo,come materiale estraneo,provoca una reazione flogistica mononucleare-macrofagica.
-
Fig.17 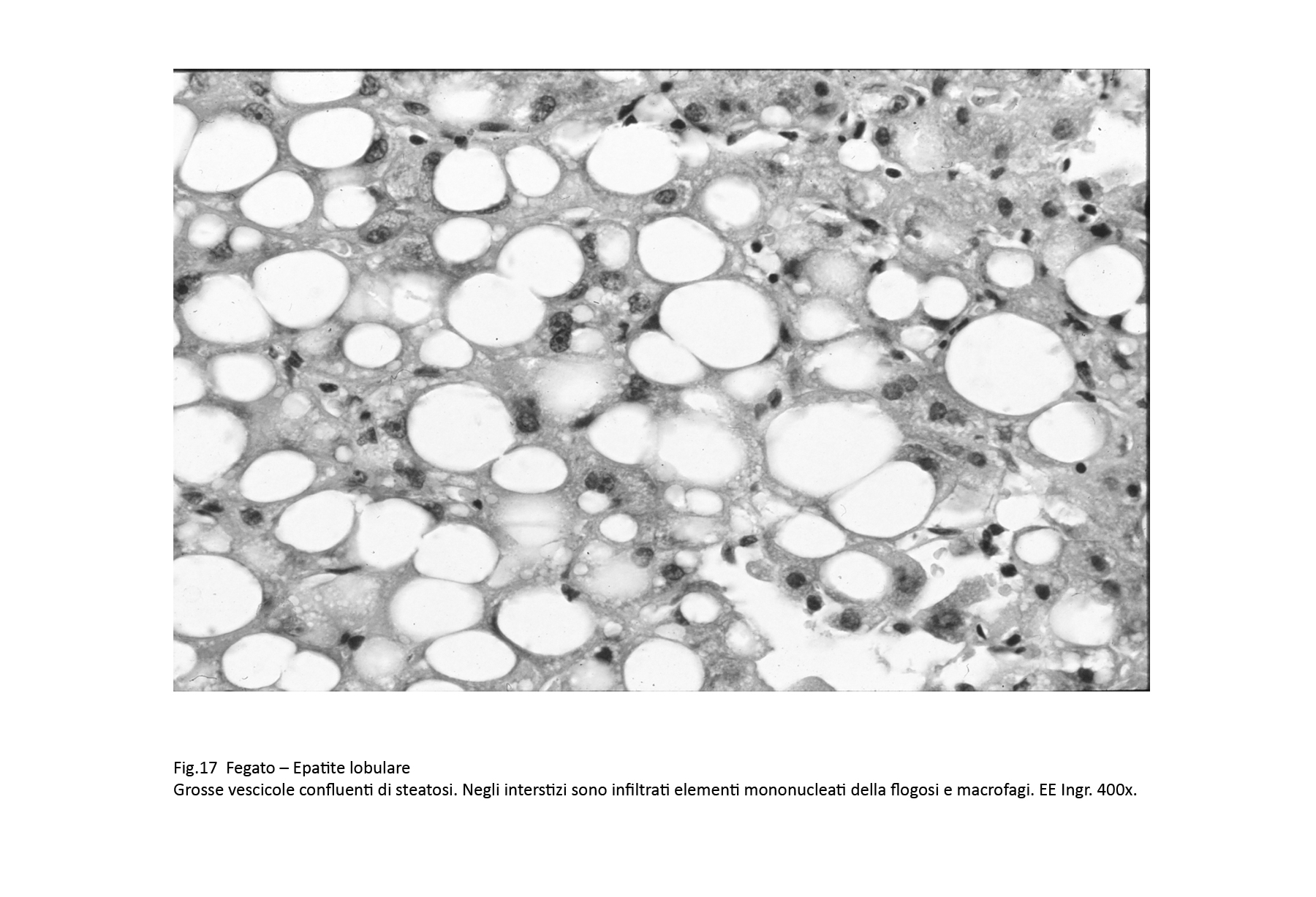
Al microscopio elettronico,le steatosi di grado lieve-moderato il quadro morfologico è rappresentato da gocce lipidiche accumulate nel citosol,da dilatazione delle cisterne dell’ergastoplasma e del reticolo endoplasmico e da alterazioni mitocondriali riguardanti il loro volume,la frammentazione delle creste fino alla cristolisi,dalla micro vacuolizzazione della matrice mitocondriale. Le steatosi gravi,caratterizzate da ammassi di lipidi l’intero citosol,evidenziano una globale destrutturazione dell’epatocita con frammentazione degli organelli fino alla loro cancellazione.
-
Fig.18  Fig.19 Fig.19 
-
Fig.20 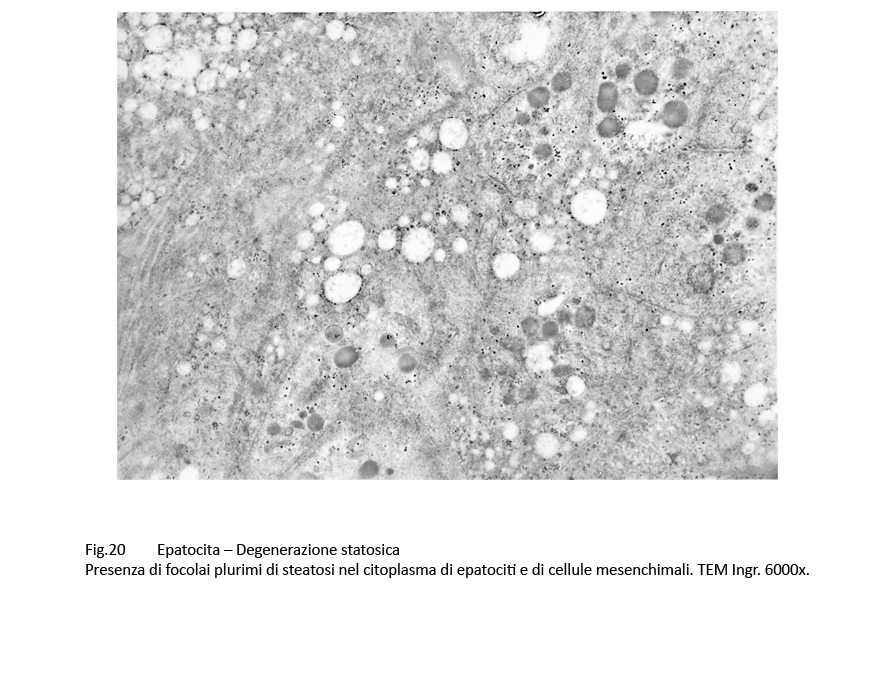 Fig.21 Fig.21 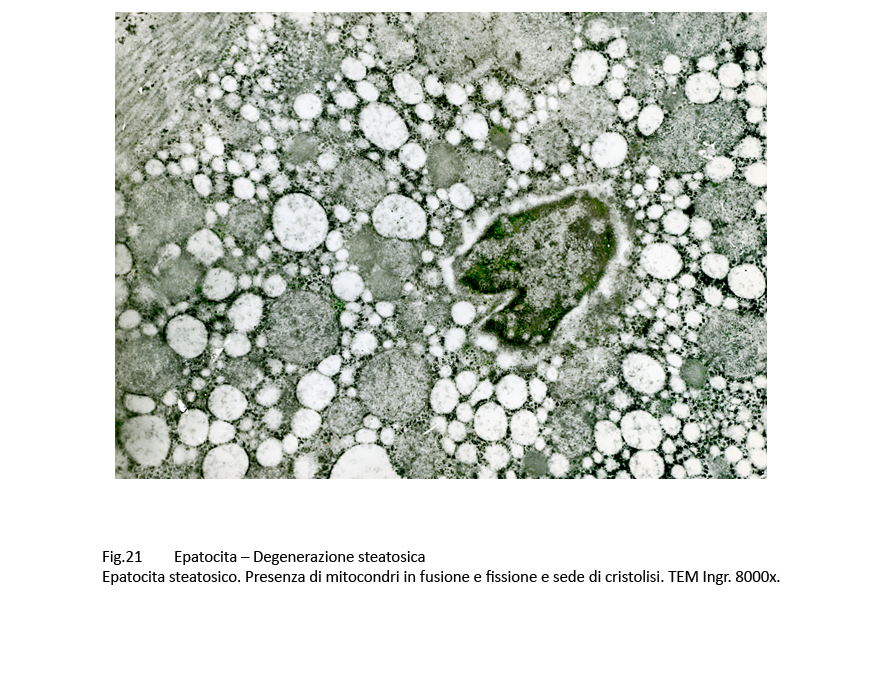
-
Fig.22  Fig.23 Fig.23 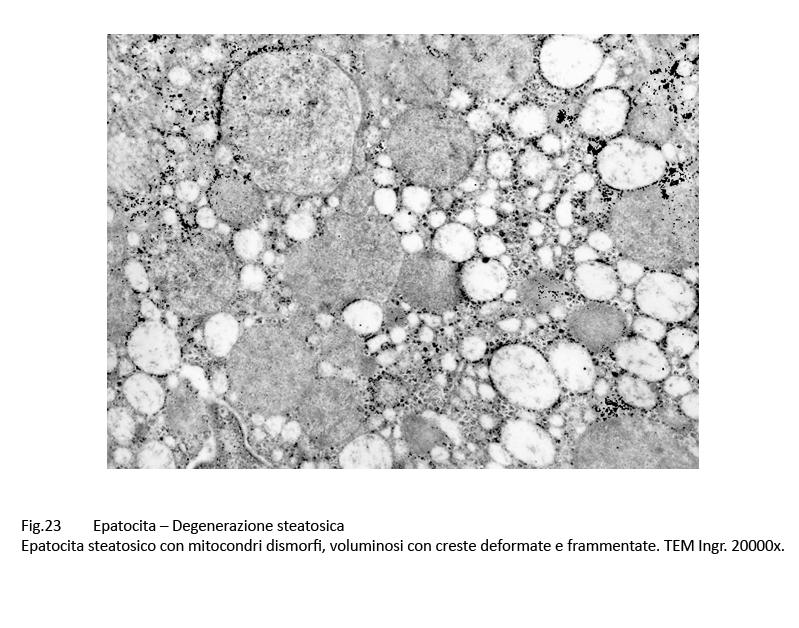
Commento
Accanto alle lesioni necro-flogistiche, ai focolai di portite e periportite, alle alterazioni del polo sinusoidale, ai processi ingravescenti di fibrosi con evoluzione verso la cirrosi, è opportuno tener presente anche i processi regressividegli epatociti rappresentati dalla degenerazione acidofila, da quella balloniforme e da quella steatosica.
Questi processi degenerativi, potenzialmente reversibili, sono considerati di significato minore nel quadro complesso della epatopatia cronica da HCV; al contrario, essi rappresentano, a livello biomolecolare, fattori concausali determinanti nella progressione della malattia.
La degenerazione eosinofila è dovuta a una iperplasia dei mitocondri, iperplasia legata a uno stato deficitario del sistema “chain complexes respiratory” con riduzione della sintesi dell’ATP, aumento della lipogenesi, accumulo dei trigliceridi e aumento del ROS (Gastroenterology 2018; 155(3): 629-647).Si rileva una disregolazione mitocondriale che si appalesa a livello morfologico e funzionale chev si traduce in alterato metabolismo dell’intera cellula (Adv.Exp.Med.Biol.2019;1158:183-196).
Questo danno mitocondriale è legato alla presenza della proteina core ed altre proteine del virus C nell’interno dei mitocondri,proteine che provengono dalle cisterne dell’ergastoplasma e del reticolo endoplasmico, sedi di replicazione virale, e che pervadono i mitocondri a livello delle zone di contatto mitocondri/ER (Hepatol.Res.2014;44(2):123-132).Un alterato contatto ER/Mit può determinare alterazioni del metabolismo dei lipidi,dei fosfolipidi, della regolazione del Ca2+ (Biochim.Biophys.Acta 2019;1866(4):650-662).
La degenerazione balloniforme in parte è indotta dalla alterazione della pompa Na/K che provoca una deplezione dell’HTP, un aumento degli ioni nel citoplasma porta alla dilatazione delle cisterne dell’ergastoplasma, alla vacuolizzazione dei mitocondri e alla frammetazione del citoscheletro ed alterazioni della litogenesi e del metabolismo lipidicoi.
La steatosi è determinante nella progressione della epatite cronica da HCV ed è concausa dei processi fibrotici e di necro-flogosi in modo simile a quanto accade nella NAFLD (Gastroenterolog2004;126(2):586-597)(Arch.Pathol.Lab.Med.2011;135:1320-1328).La biogenesi del processo steatosico è diversa a seconda del genoma dell’HCV:
Nei casi di epatite cronica da HCV genoma 3,il virus interferisce direttamente sul metabolismo lipidico degli epatociti con uno stato di stress ossidativo, il rilascio di citochine atte a indurre necroflogosi, apoptosi e fibrosi.
In quelle da HCV genoma non-3,il processo steatosico viene indotto in modo mediato,allorquando pre-esistono situazioni dismetaboliche di varia eziologia (Gastroenterology 2004; 126(2): 586-597)(Journal of Hepatology2004;40:533-535).
E’ stato anche accertato che la steatosi in corso di epatite cronica da HCV favorisce la persistenza e la replicazione del virus,induce una più rapida progressione della fibrosi ed aumenta il rischio dell’ epatocarcinoma(Int.J.Mol.Sci.2016;doi:10.3390/ijms17060803).
|
