CRANIOFARINGIOMA
Luigi Cuccurullo
|
Il craniofaringioma è un tumore epiteliale benigno, parzialmente cistico, della regione sellare derivante presumibilmente dagli epiteli della tasca di Rathke (W.H.O.).
Esso può avere sede a livello della sella turcica (intrasellare), al di sopra di essa (soprasellare) o in una posizione intermedia (intra-soprasellare). Sono descritti, in letteratura, casi di craniofaringioma nell’interno del 3° ventricolo, alla base dei lobi frontali e temporali del cervello, nell’ambito della fossa posteriore del cranio, a carico del rino-faringe, dell’etmoide, del seno sfenoidale, del seno mascellare e delle cavità nasali.
Abitualmente questa neoplasia è ben circoscritta e si accresce con modalità espansiva e può provocare in questo suo sviluppo compressione delle strutture anatomiche circostanti; sono possibili anche saldature con tali strutture sia per manifestazioni flogistico-aderenziali sia per processi di infiltrazione di cellule del craniofaringioma.
Il craniofaringioma può manifestarsi in tutte le età, esso evidenzia una maggiore frequenza nell’età pediatrica; nell’età adulta i dati statistici indicano una maggiore incidenza nella quinta – sesta decade di vita; sono stati riportati in letteratura casi di questo tumore presente già alla nascita e di conseguenza è stato formulato il giudizio di craniofaringioma congenito.
Il W.H.O., pur riconoscendo la variabilità architettonica e strutturale di questo tumore, ha riconosciuto, nella sintesi, i seguenti due istotipi:
- 1. Craniofaringioma adamantinomatoso
- 2. Craniofaringioma papillare
- Craniofaringioma adamantinomatoso
Il quadro macroscopico di questo istotipo è polimorfo, in quanto è condizionato dalla prevalenza o meno della componente cistica, dalla entità quantitativa della componente solida, e dalla gravità dei fenomeni regressivi o dei processi flogistici cronici. Per razionalizzare questo polimorfismo di base, si riconosce schematicamente la esistenza di un sub-istotipo con prevalente carattere cistico, un sub-istotipo con prevalente componente solida, e un sub-istotipo con una struttura intermedia rispetto ai primi due.
All’esame macroscopico, il sub-istotipo cistico ha contorni ben definiti, è fornito di una capsula sottile, a superfici lisce o lobulate; questa neoformazione semitrasparente è di colore grigio-verdastro, ha una consistenza molliccia e contiene un liquido denso, untuoso, vischioso, simile all’olio delle macchine.
Questo sub-istotipo cistico può contenere una macrocisti uniloculare oppure numerose piccole cisti inframmezzate da strisce di tessuti solidi.
Al contrario, il sub-istotipo a componente prevalentemente solida appare come formazione compatta, di colore grigio-biancastro, è di consistenza paranchimatosa; al taglio le superfici di sezione mostrano aree compatte commiste ad aree di aspetto spongiosico per la presenza di microcavità dalle quali fuoriesce liquido denso, oleoso, verdastro. Il sub-istotipo intermedio presenta i caratteri anatomici misti per la presenza di macro-microcisti inframmezzate in modo disordinato da vaste aree aventi aspetti solido – compatti.
Questi caratteri macroscopici sono frequentemente sconvolti, sommersi in modo parziale o totale da processi secondari che casualmente sopraggiungono e si sovrappongono; si possono osservare aree di colore rosso per stravasi emorragici o aree gialle per la esistenza di focolai di colesterolo, oppure zone grigie per fenomeni di ialinosi, e ancora zone bianche e di consistenza dura per processi di calcificazione e/o di metaplasia osteoide. Questo polimorfismo anatomico si manifesta con maggiore evidenza agli esami mediante il microscopio luce per la esistenza di microdiversità strutturali presenti nell’ambito dello stesso caso.
All’'esame istopatologico, le cisti hanno pareti rivestite da epiteli cubico-piatte pluristratificate e ben differenziate; questi elementi poggiano su una filiera di cellule basali di forma cubica, la quale a sua volta è supportata da una sottile membrana basale; lo stroma circostante è formato da una trama fibrillare lassa, inglobante istiociti, fibroblasti, macrofagi ed è permeata da numerosi capillari ematici.
Le superfici endocistiche sono lisce, tuttavia è possibile riscontrare focali ispessimenti degli strati epiteliali o abbozzi di pseudopapille.
Fig.1 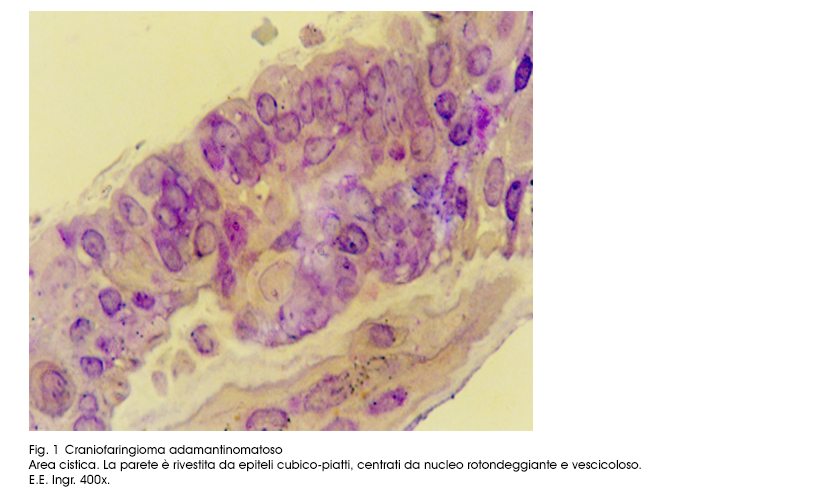 Fig.2
Fig.2 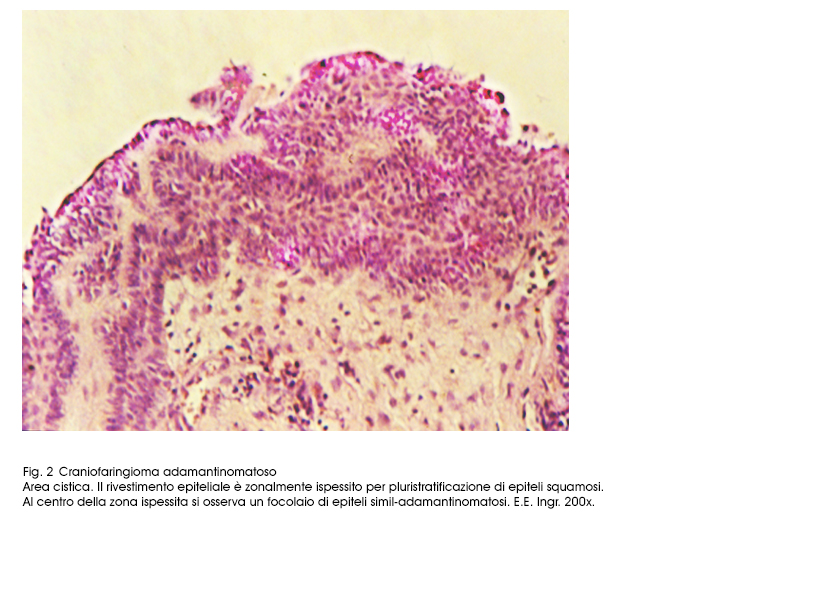
Fig.3 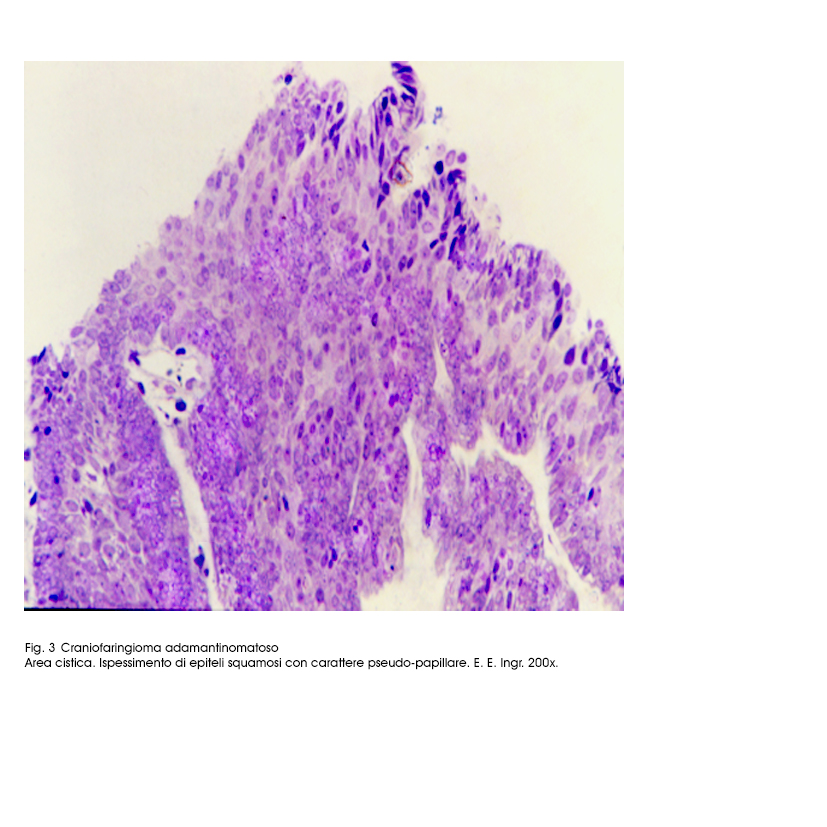
Il sub-istotipo a struttura prevalentemente solida appare al microscopio luce essere costituito da travate, filiere, cordoni, trabecole, variamente orientate,o intrecciate di epiteli squamosi. I bordi di ciascuna di queste strutture sono tracciati da una filiera di epiteli cubici poggiante su una membrana basale. Invece le cellule che riempiono queste strutture sono squamose, ben differenziate e saldamente coese; ciascuno di questi elementi ha citoplasma eosinofilo, ha nucleo in posizione centrale, di forma sferoidale ed è
normo-cromatinico.
Fig.4 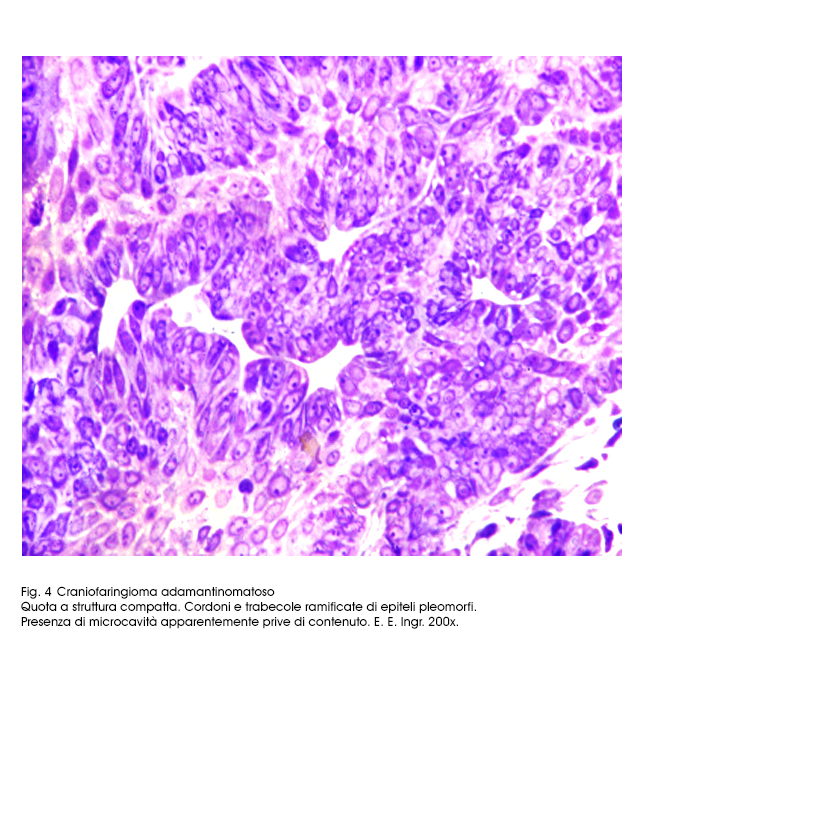 Fig.5
Fig.5 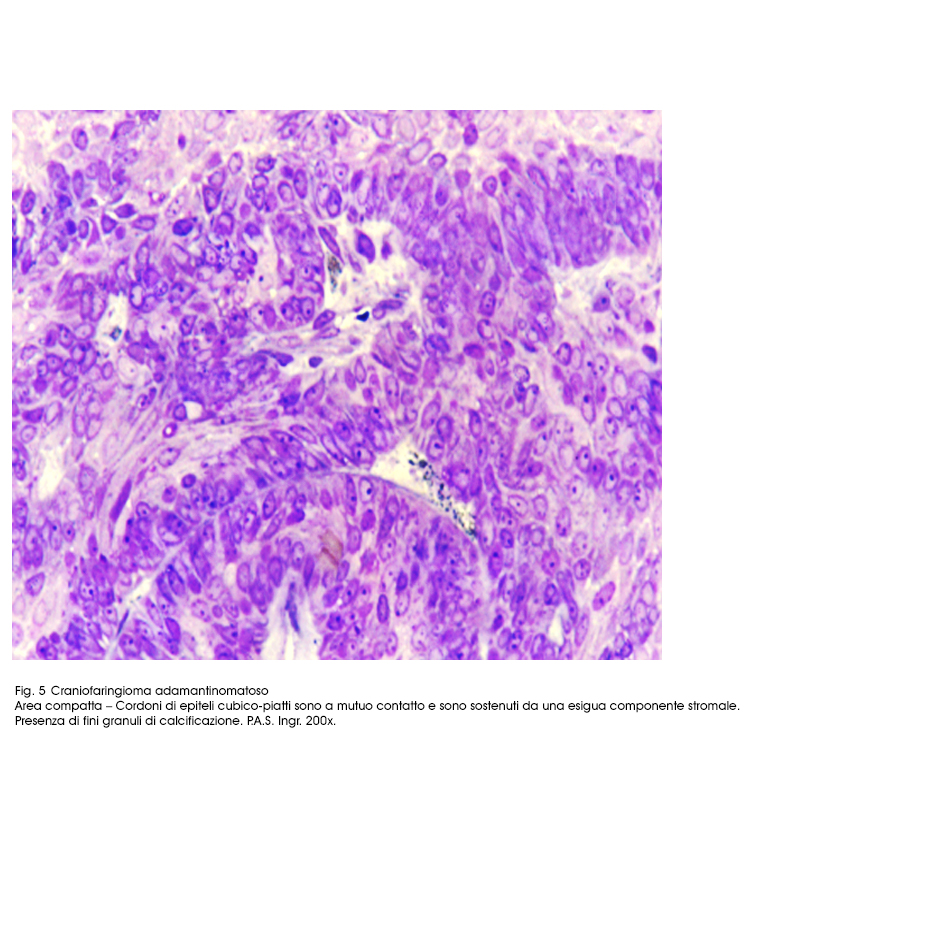
Frequentemente in molti campi microscopici si repertano processi di de-coesione epiteliale, i quali nel tempo possono concludersi nelle seguenti due modificazioni cito-architettoniche.
- A. La prima modificazione si concretizza, per lisi delle strutture giunzionali e per
rimodellamento del profilo morfologico degli epiteli ,nella comparsa di epiteli
con un aspetto stellato per la presenza di prolungamenti citoplasmatici tra
loro adesi per le estremità; nell’insieme si hanno immagini simili a quelli
degli ameloblasti presenti negli adamantinomi.
Fig.6 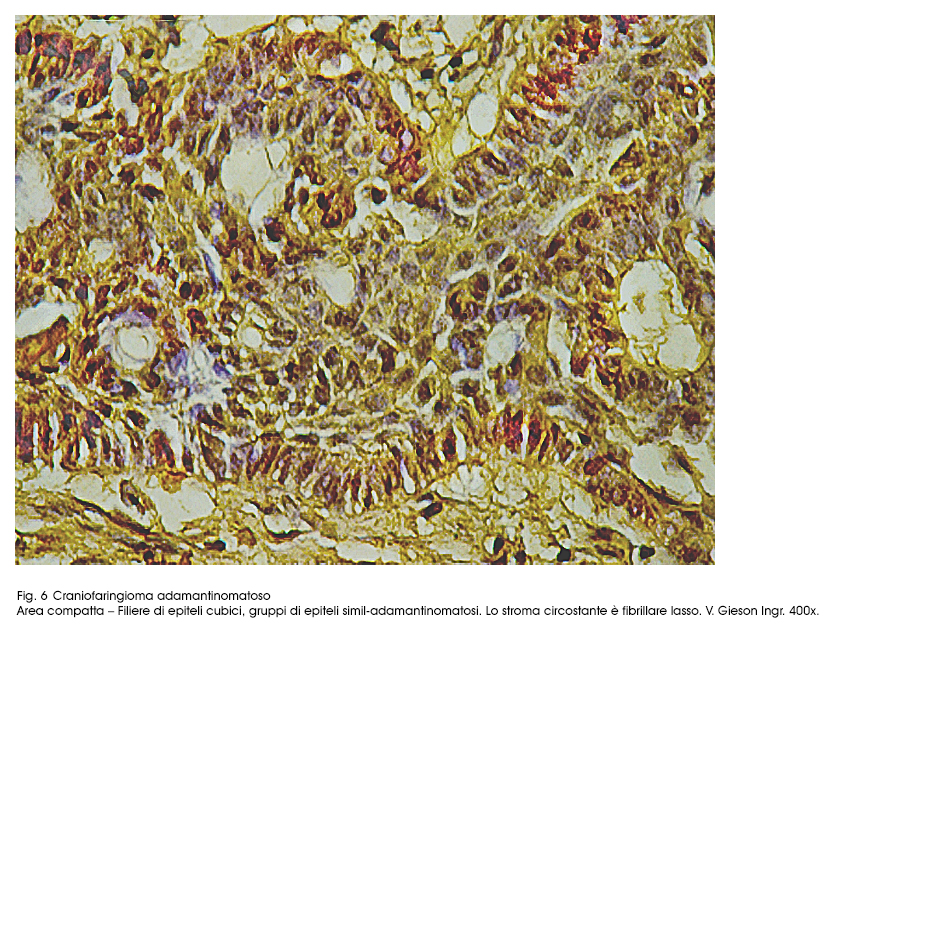
B. La seconda modificazione è data dalla neo-strutturazione di microcavità prive di
pareti proprie, e delimitate dagli epiteli delle aree circostanti.
Fig.7 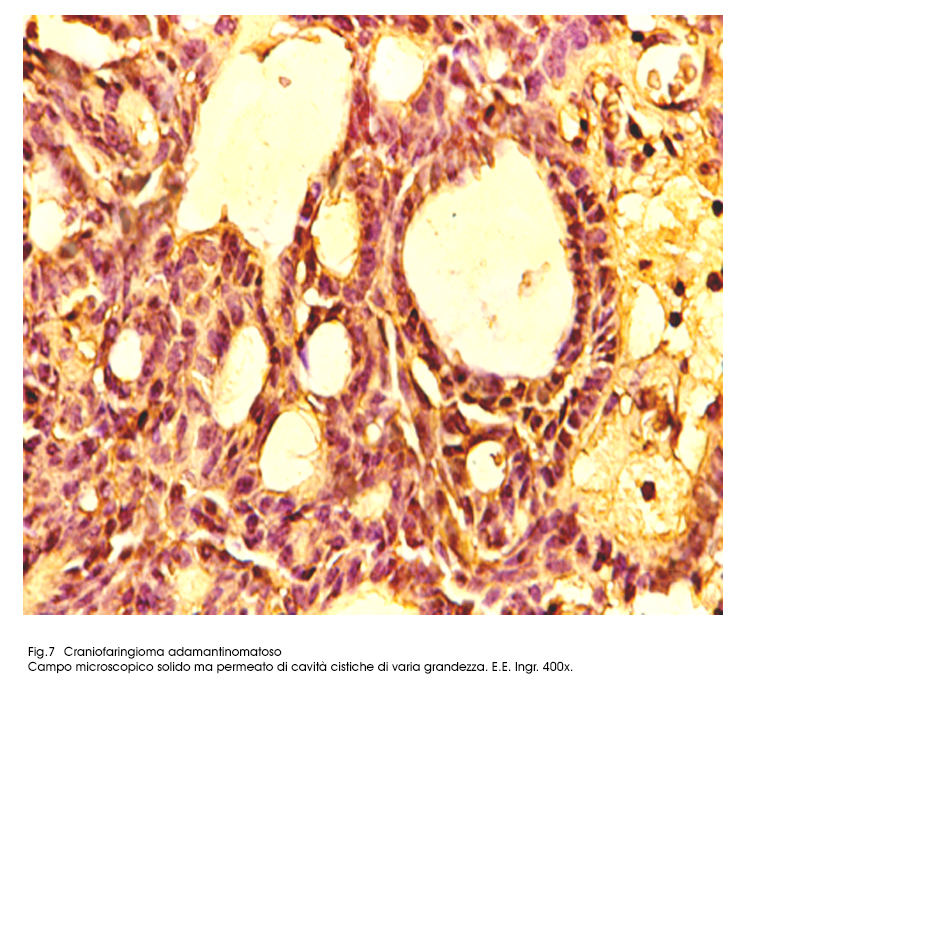 Fig.8
Fig.8 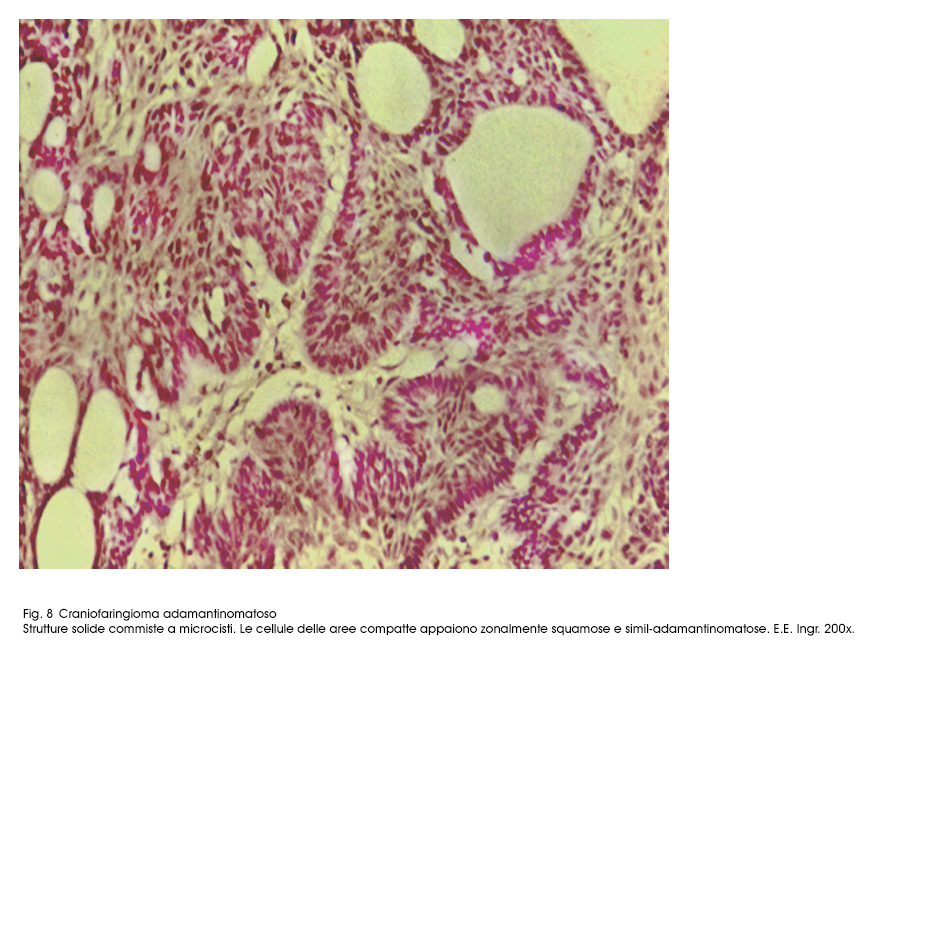
Fig.9 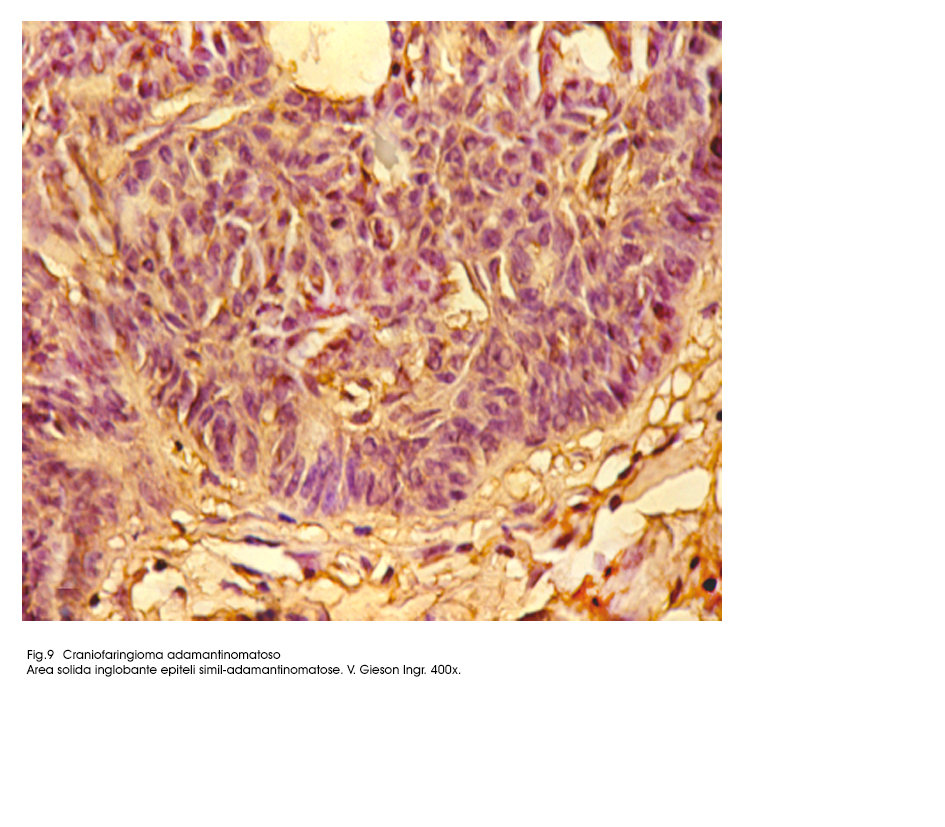
Queste microcavità in seguito a processi regressivi di de-connessione e a processi di lisi cellulari ,progressivi, ingravescenti, possono sfociare in microcisti prive di pareti proprie. Esse sono in numero variabile e nei casi in cui sono numerose e ravvicinate possono confluire disegnando cavità più ampie.
Fig.10 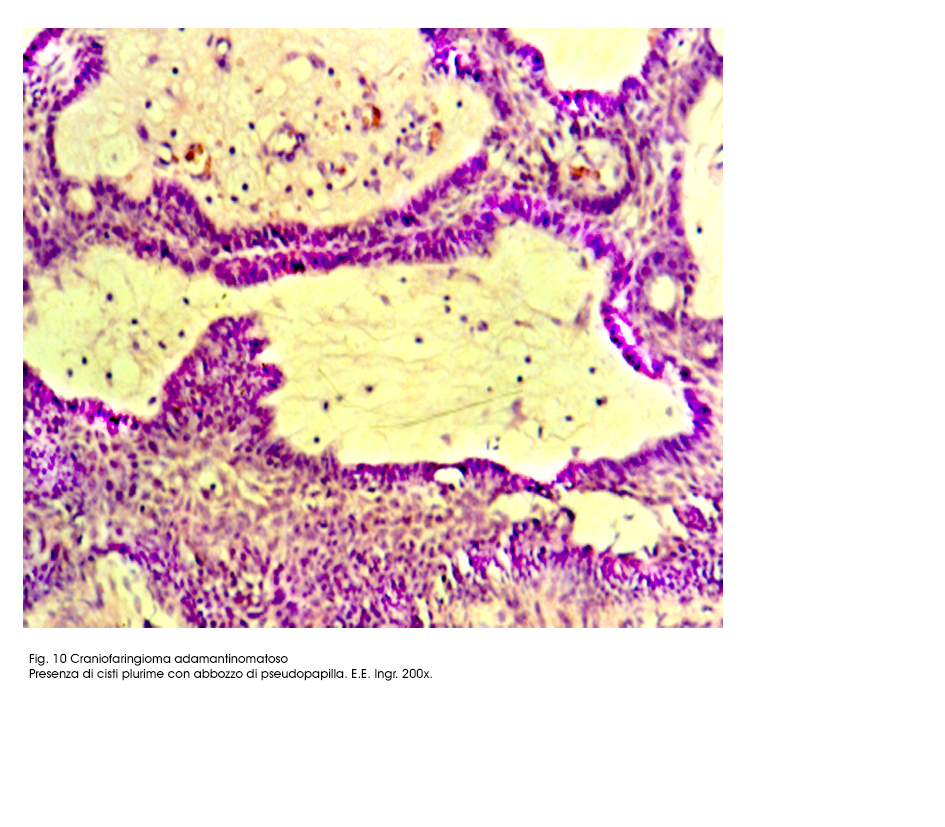
Nel contesto delle aree solide, oltre alle cellule adamantinomatose e alle microcavità si possono repertare formazioni sferoidali costituite da epiteli squamosi, disposti spazialmente a strati concentrici, simili ad abbozzi di perle cornee.
Fig.11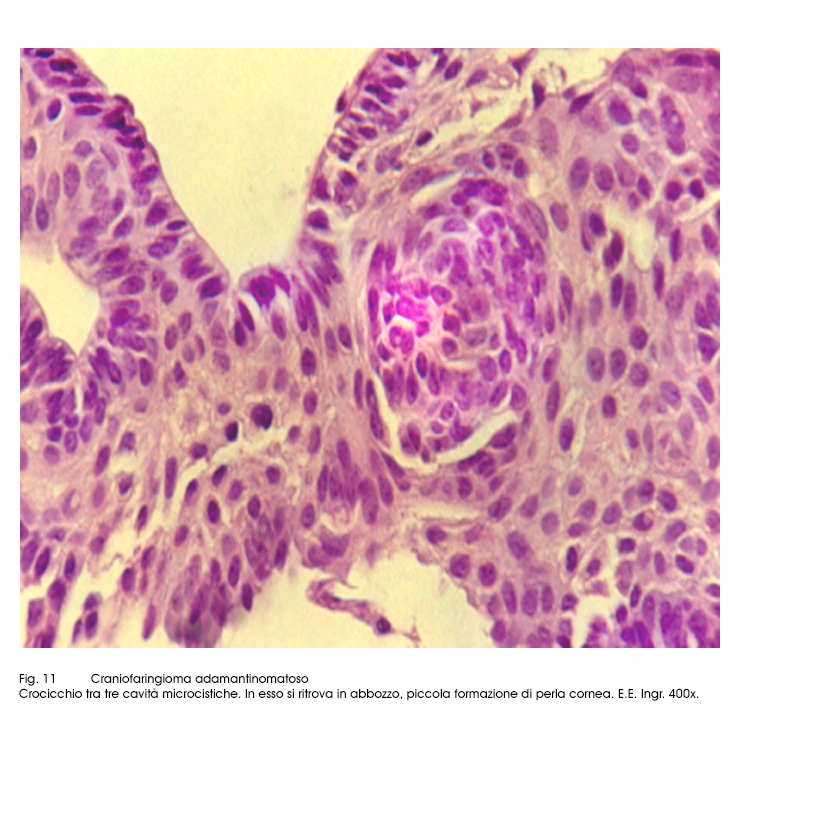
Anche il craniofaringioma solido è fornito di uno stroma fibrillare lasso, ricco di cellule mesenchimali autoctone e di capillari; questo stroma avvolge o si interpone tra le strutture che compongono la quota epiteliale.
Il craniofaringioma adamantinomatoso è frequentemente sede di processi secondari destruenti che possono essere limitati a zone circoscritte o possono interessare l’intera neoplasia. Inoltre si sottolinea la possibilità di depositi di idrossi-apatite sia negli spazi intercellulari sia in sede intra-citoplasmatica, lungo l’asse maggiore delle tonofibrille e per processi di metaplasia si possono formare anche lamelle osteoidi costeggiate da osteociti e/o da osteoblasti. Così pure lo stroma fibrillare da lasso può acquisire caratteri di compattezza per neoformazione di fibre collagene, essere omogeneo, iperplasico ed acquisire un carattere dominante nella morfologia della neoplasia; ancora, la quota stromale può subire fenomeni estesi e gravi di ialinosi o essere sede di focolai plurimi di colesterolo.
Questa neoplasia può essere esposta a processi flogistici, i quali possono essere circoscritti o diffusi, possono essere sostenuti solo da infiltrazioni linfo-monocitarie o essere caratterizzate da fenomeni granulomatosici aspecifici, ma destruenti.
Fig.12 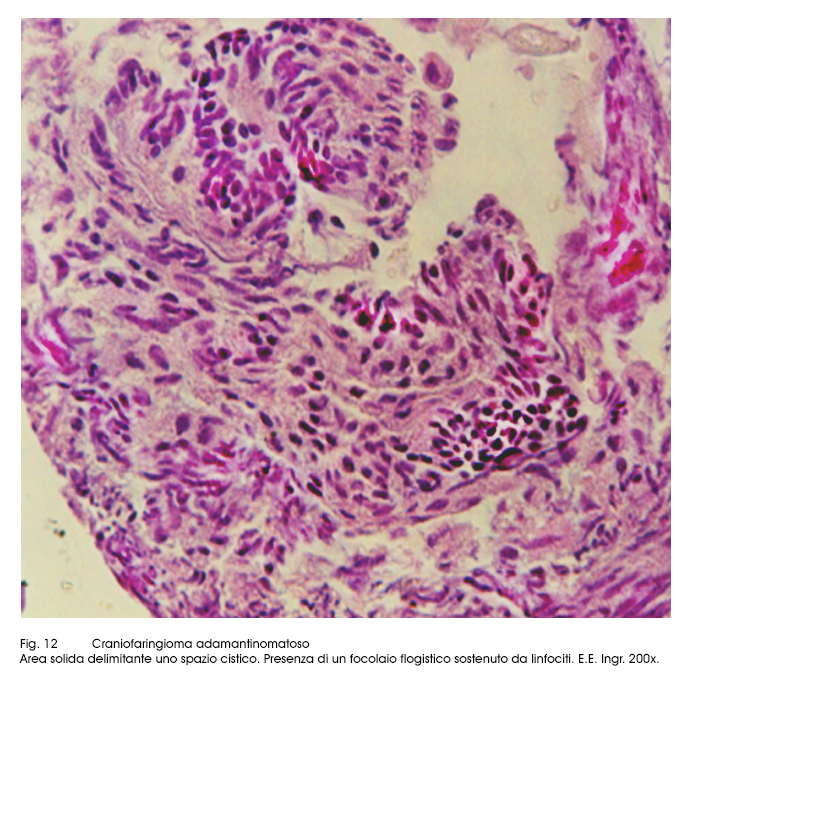 Fig.13
Fig.13 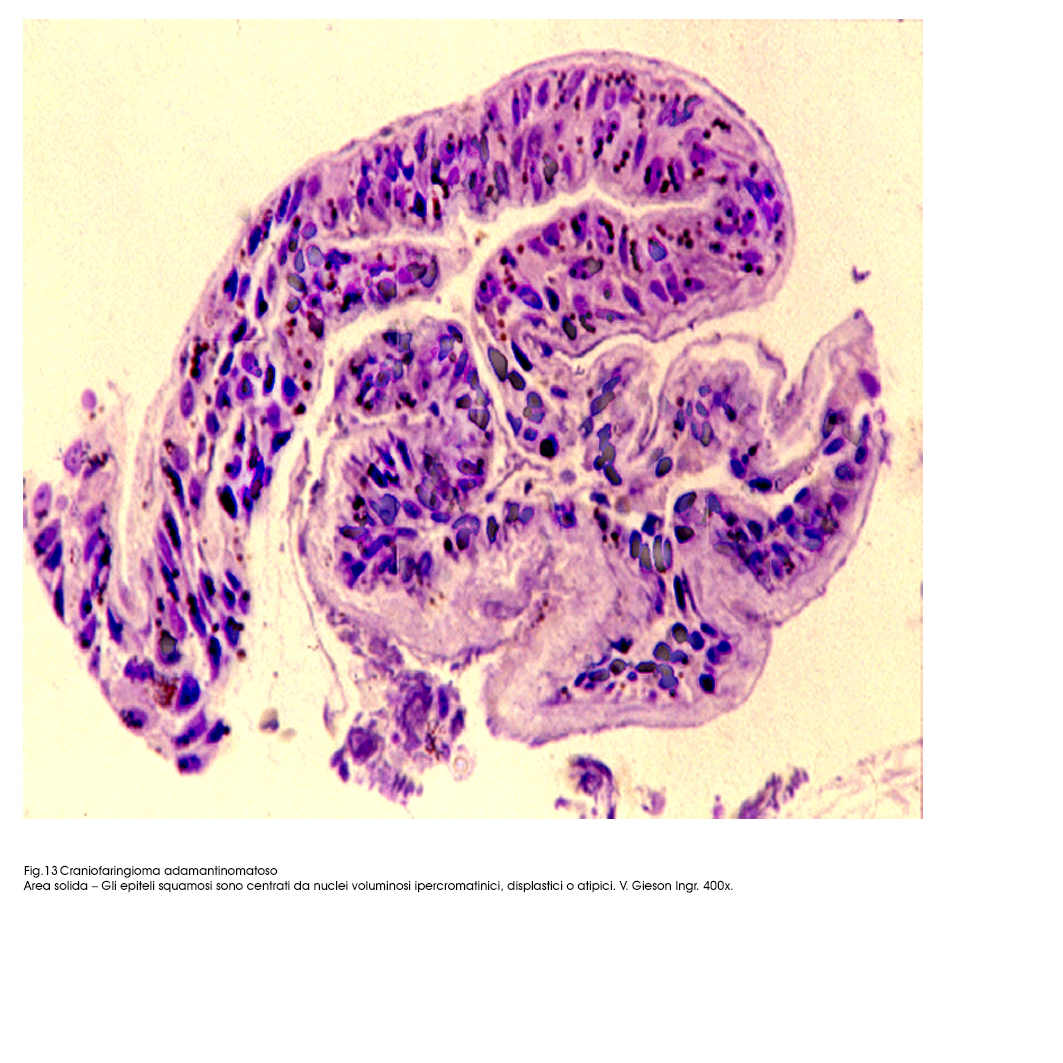
Craniofaringioma papillare
Il craniofaringioma papillare si mostra come una neoformazione capsulata, ben circoscritta, di colore grigio-rossastro, di consistenza morbido-parenchimatosa. Al taglio, le superfici di sezione lasciano fuoriuscire un liquido fluido, trasparente, sieroso e mostrano una struttura compatta punteggiata da piccole cavità; se queste sono molto numerose, il quadro morfologico acquisisce un aspetto cribroso.
Al microscopio luce si evidenziano due aspetti strutturali strettamente commisti ed evolventi l’uno nell’altro. Il primo è dato da strutture trabecolari, cordonali, insulari di epiteli squamosi ben differenziati e fortemente coesi. Il secondo aspetto è formato da cavità cistiche di varia grandezza, le quali contengono nel loro spazio formazioni papillari di diversa altezza; ciascuna di esse (quasi sempre mono-assile) è costituita da un’asse sottile vasculo-connetivale e da un rivestimento di epiteli cubico-squamosi, pluristratificati.
Fig.14 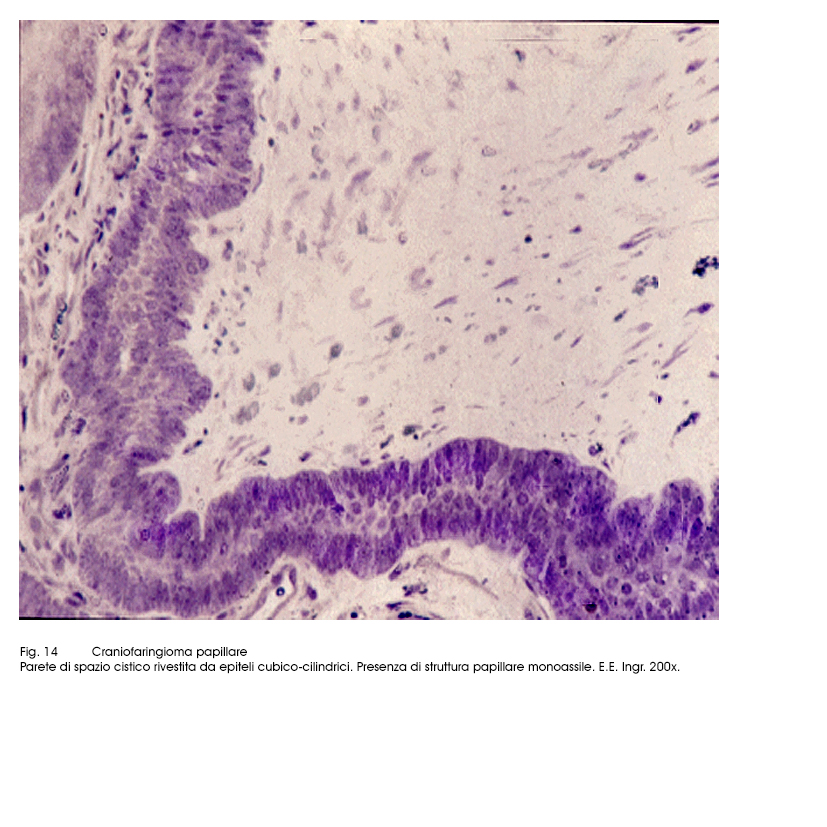 Fig.15
Fig.15 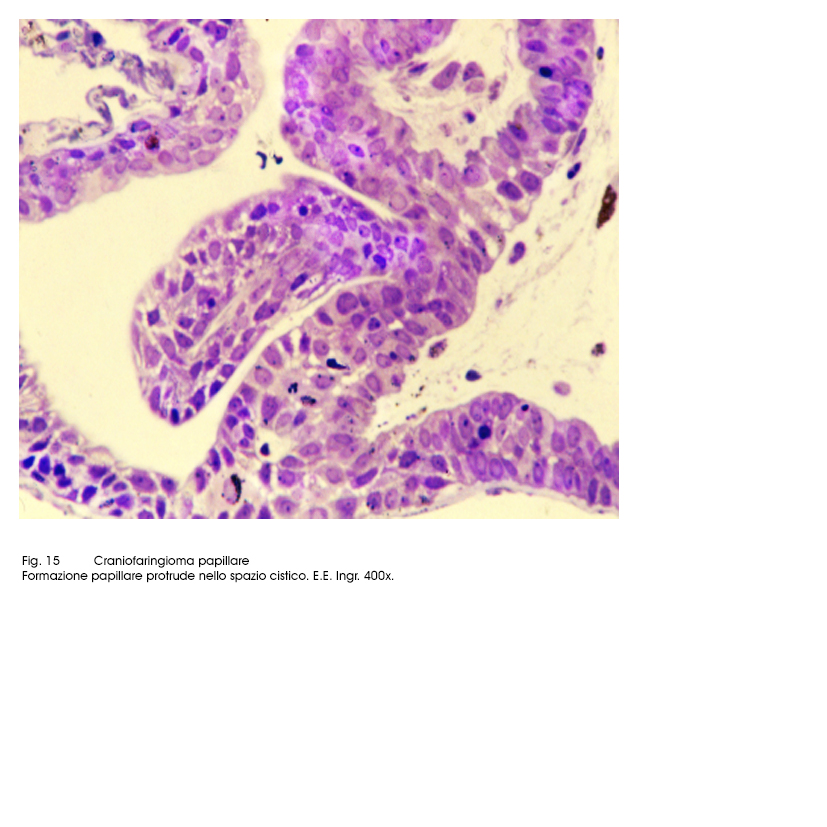
Fig.16 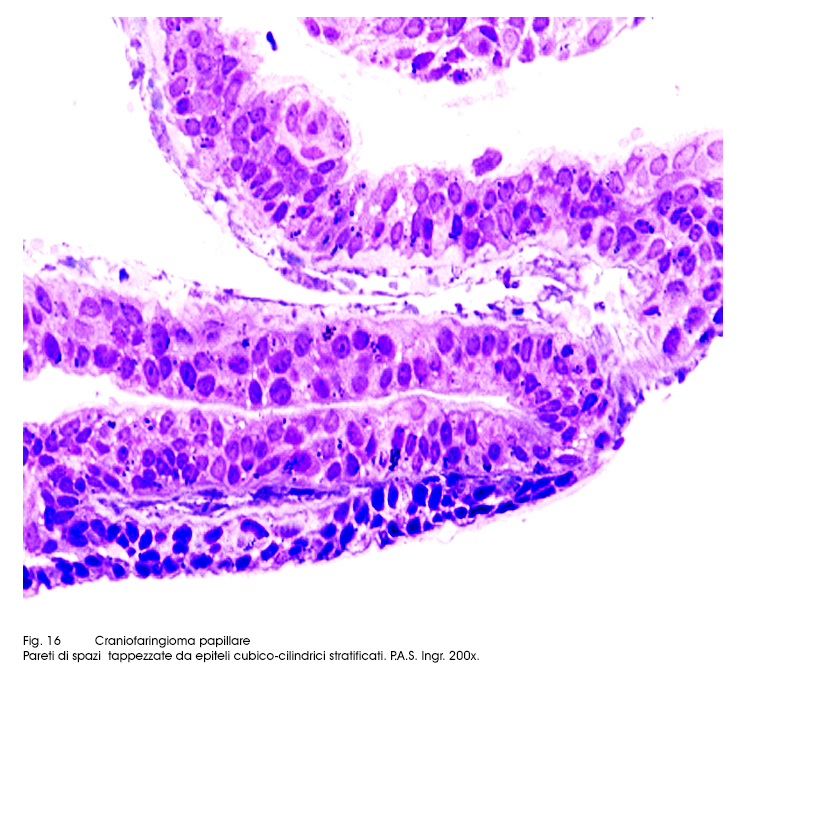 Fig.17
Fig.17 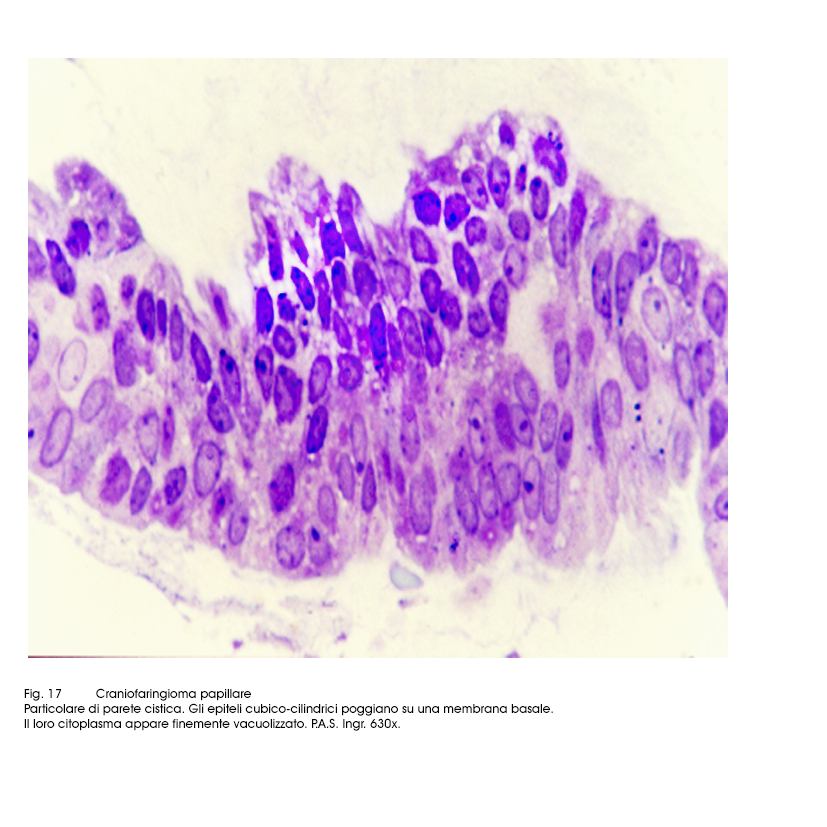
Fig.18 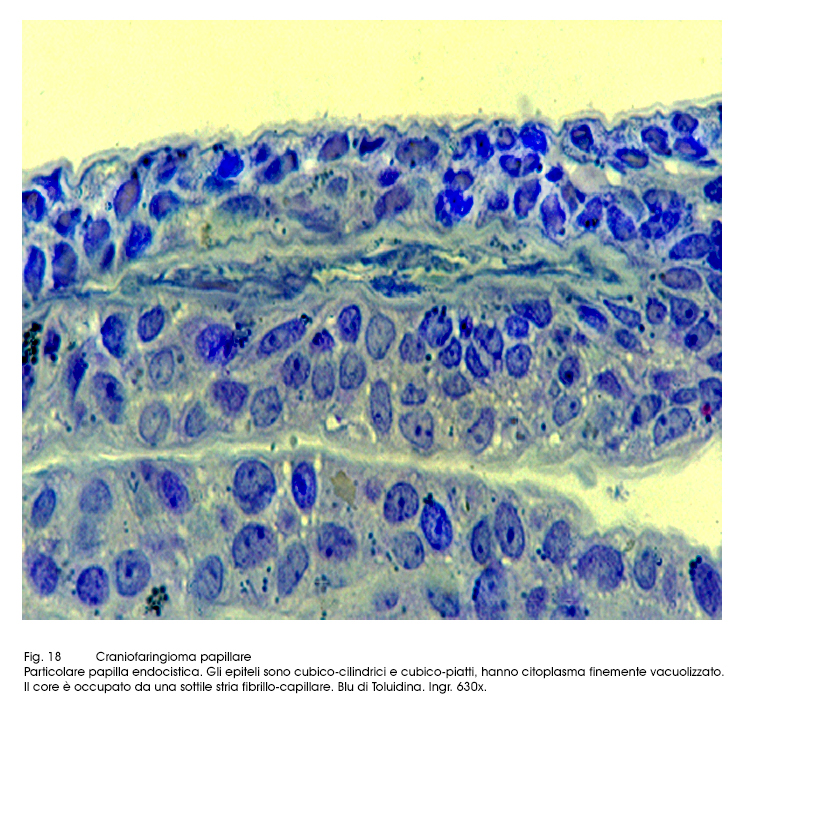
Questo istotipo non è sede di processi secondari e in modo elettivo non subisce fenomeni di calcificazione e/o di depositi di colesterina.
Immunoistochimica
Le ricerche di immunoistochimica nei casi di craniofaringioma si svolgono seguendo due direttrici: la prima si pone il problema della identità istogenetica della popolazione neoplastica; la seconda si interroga su gli indici biologici di proliferazione.
Il problema della identità delle cellule neoplastiche può essere risolto mediante l’accertamento della immunoespressività per le citocheratine a basso e a medio peso molecolare. L’acquisizione di questi risultati permette, tra l’altro, di differenziare sul piano diagnostico i craniofaringiomi di elevata componente cistica dalle cisti della tasca di Rathke.
Il secondo problema (l’accertamento delle attività proliferative) può trovare risposta mediante il grado di immunoespressività per la MIB-1 e il PCNA. La determinazione di questi valori biologici è importante quale fattore prognostico: esso permette di valutare il
rischio di recidive, di processi di aggressività locale, o di chiara trasformazione in senso maligno.
Microscopia elettronica
Le indagini ultrastrutturali sono state orientate verso la conoscenza della popolazione
epiteliale e verso lo studio dei vasi inerenti i craniofaringiomi. Le osservazioni ultrastrutturali degli epiteli si incentrano su le quote degli organuli intracitoplasmatici, su lo sviluppo delle tonofibrille, e su le quote delle strutture giunzionali.La valutazione ragionata di questi caratteri permette di tracciare un esatto profilo morfologico su i livelli di differenziazione raggiunti. Mediante la microscopia elettronica si evidenziano anche inziali processi regressivi non ancora apprezzabili mediante la microscopia luce.
Indipendentemente dagli istotipi e sub-istotipi, come caratteri generali è sto rilevato che gli epiteli degli strati basali sono ricchi di organuli citoplasmatici; mentre quelli degli strati intermedi e superficiali subiscono una progressiva riduzione di questi organuli e contestualmente si rileva un aumento delle tonofibrille.
L’'esame ultrastrutturale ha sottolineato alcuni caratteri citologici già colti mediante la microscopia luce. E’ stata anche confermata la differenza esistente tra i caratteri degli epiteli del craniofaringioma adamantomatoso e quello papillare.
Gli epiteli dell’istotipo adamantomatoso sono epiteli squamosi ben differenziati aventi il citoplasma povero di organuli ma particolarmente ricco di tonofibrille. La coesione intercellulare è molto forte per la esistenza di un apparato giunzionale ben sviluppato.
Fig.19 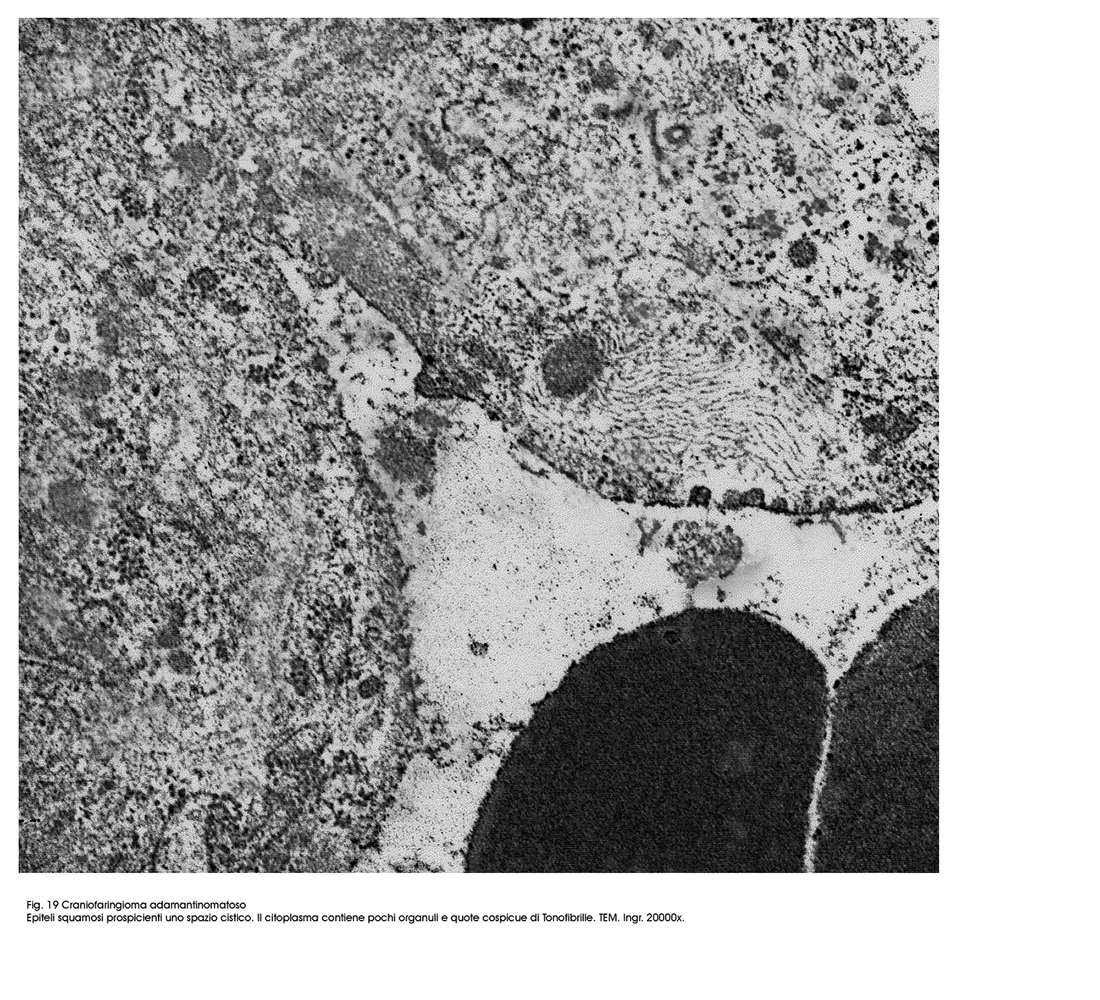 Fig.20
Fig.20 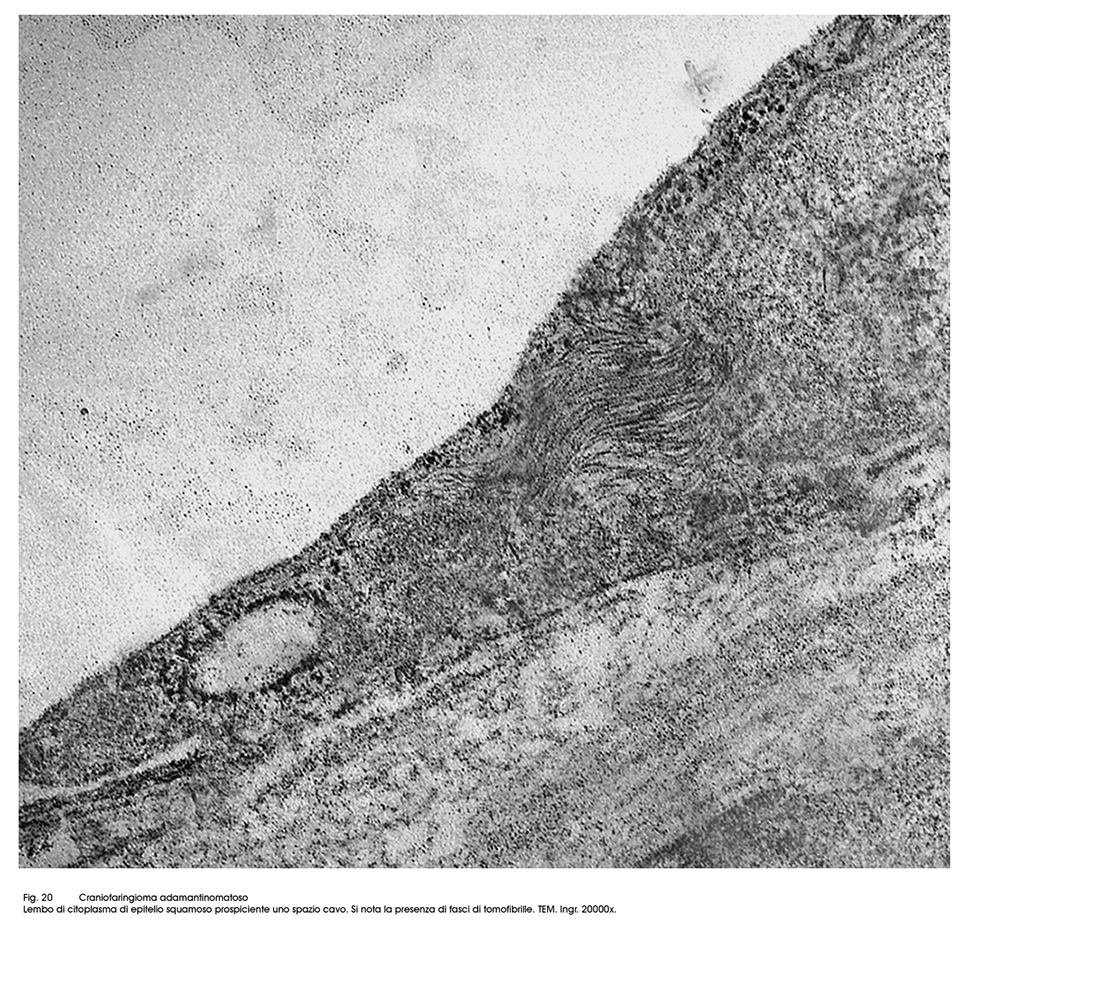
Fig.21 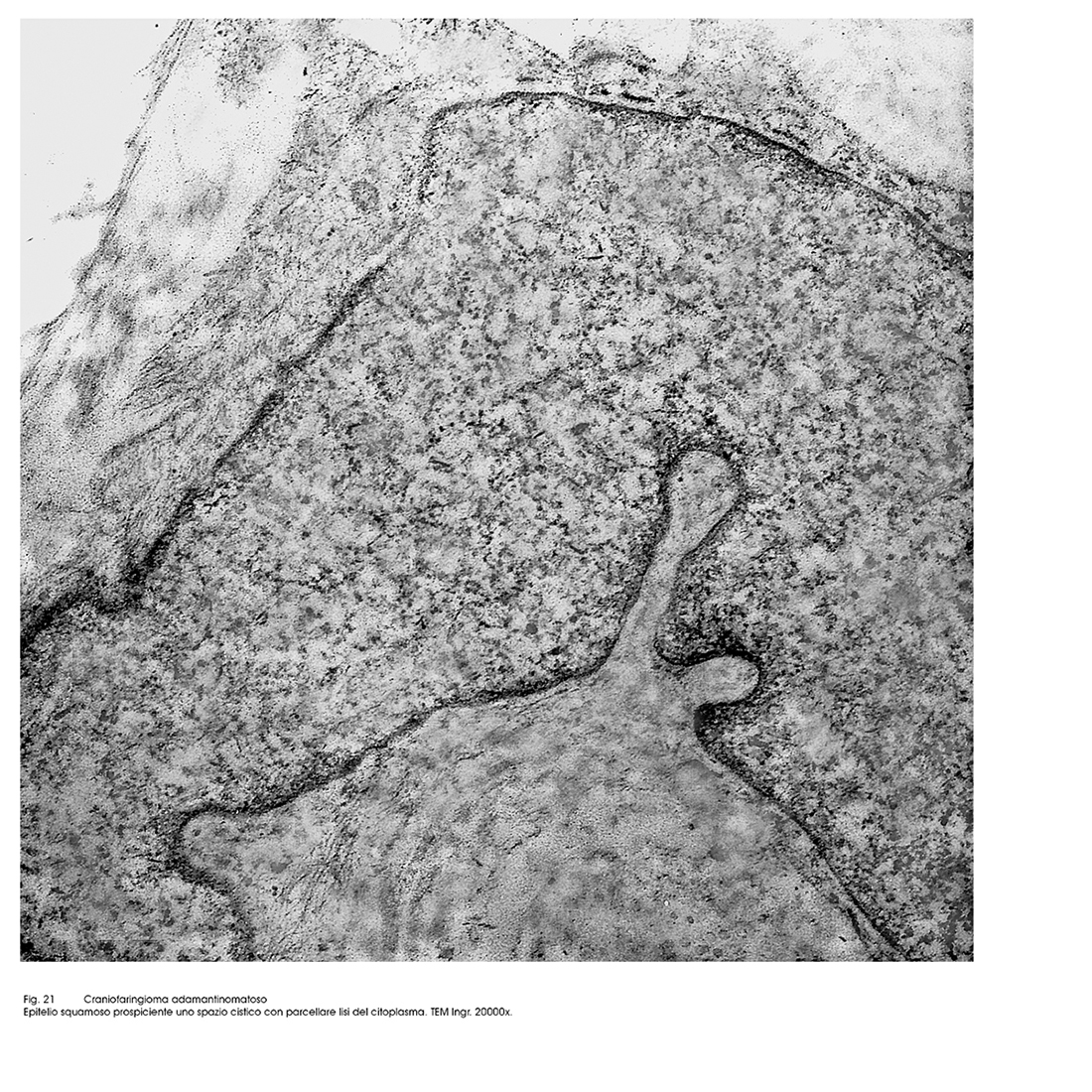 Fig.22
Fig.22 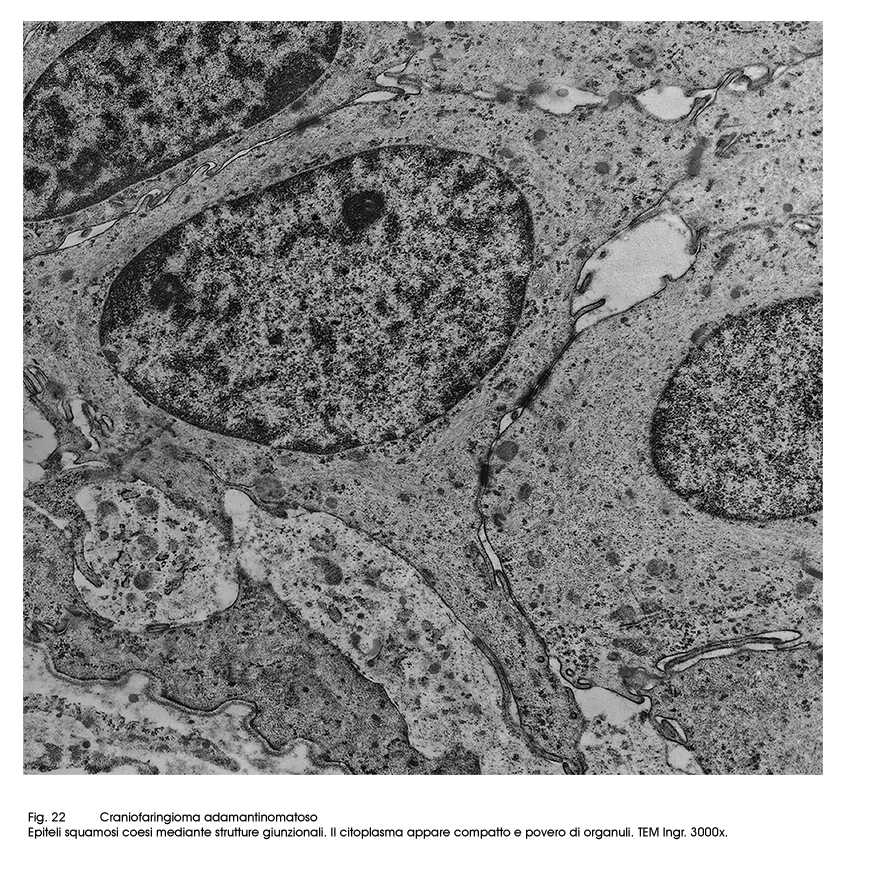
Fig.23 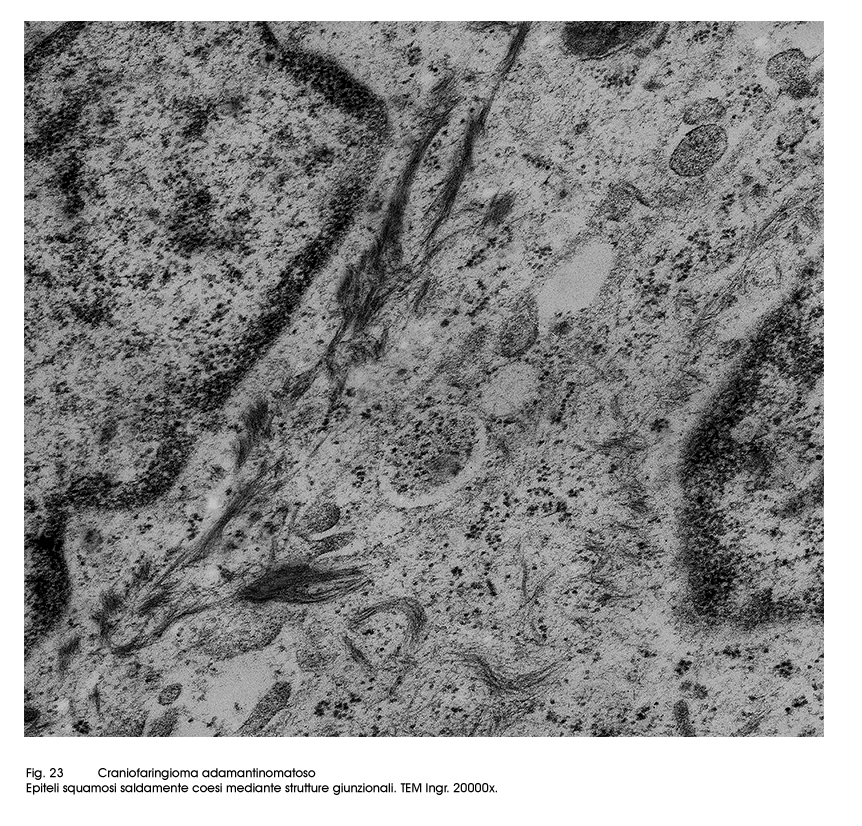
Questo quadro ultrastrutturale di base, molto frequentemente può subire variazioni o modificazioni citostrutturali e citoarchitettoniche. Infatti si rileva la esistenza di microframmentazioni della membrana cellulare, o punti di de-coesione intercellulare con conseguente formazione di spazi inter-epiteliali; in conseguenza di processi di vacuolizzazione in sede intracitoplasmatica si ha una notevole riduzione del patrimonio mitocondriale ed ergastoplasmatico fino alla formazione di aree di micronecrosi. Il processo di decoesione intercellulare favorisce una rimodulazione del profilo cellulare con conseguente ridisegnazione del corpo cellulare e presenza di sottili prolungamenti citopolasmatici (aspetto simil-adamantinomatoso).
Fig.24 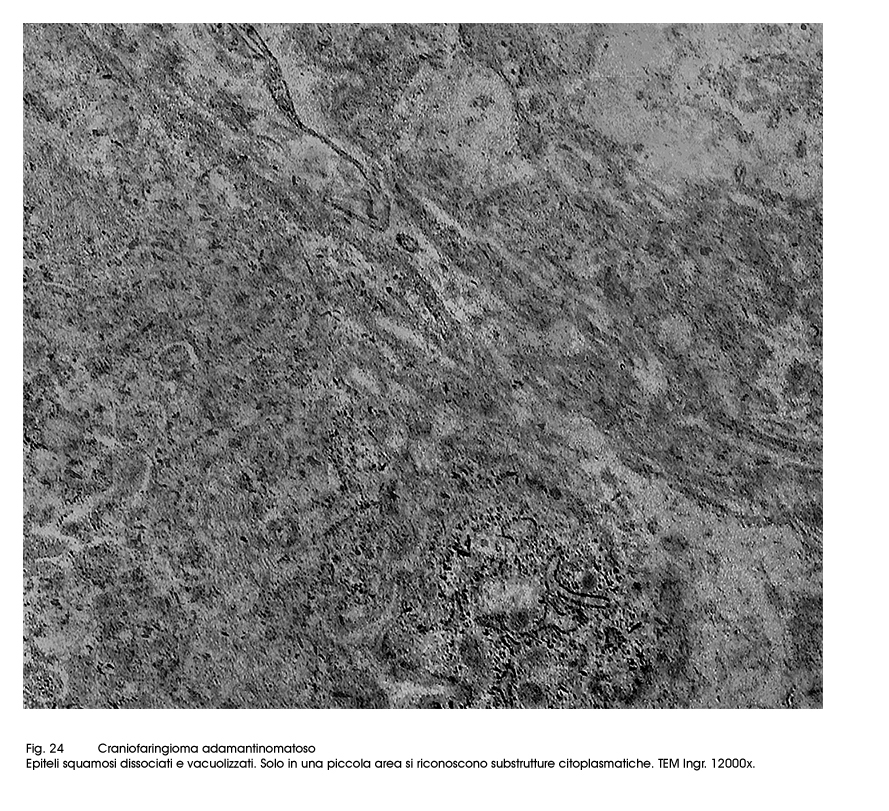 Fig.25
Fig.25 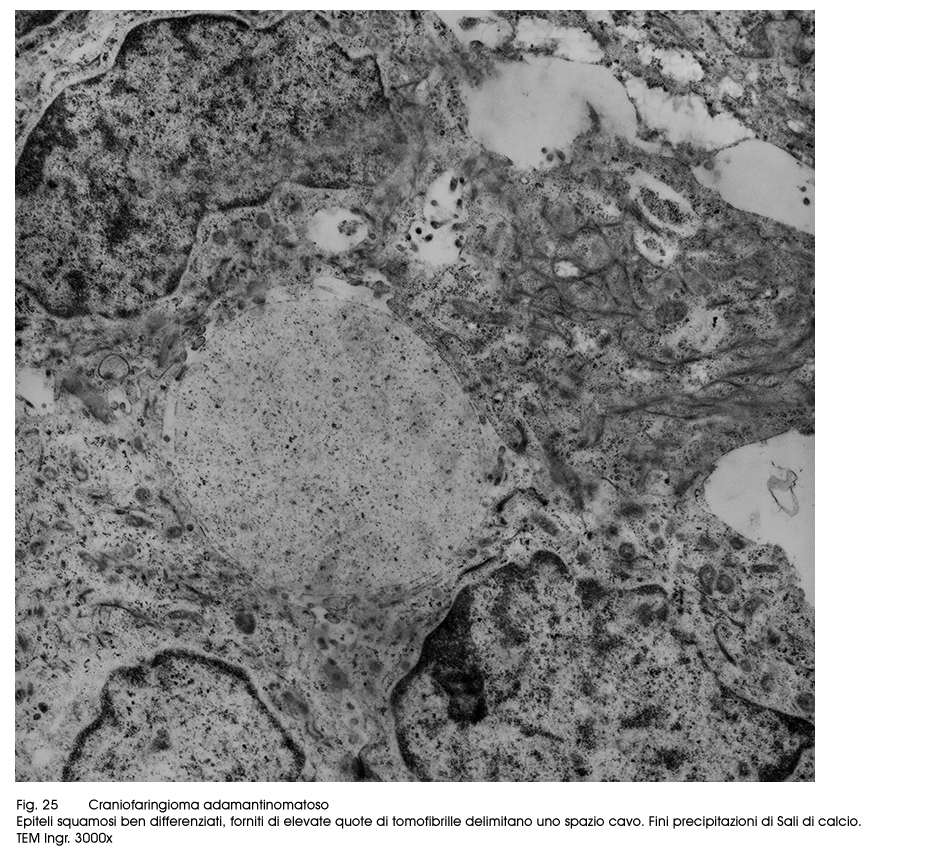
Fig.26 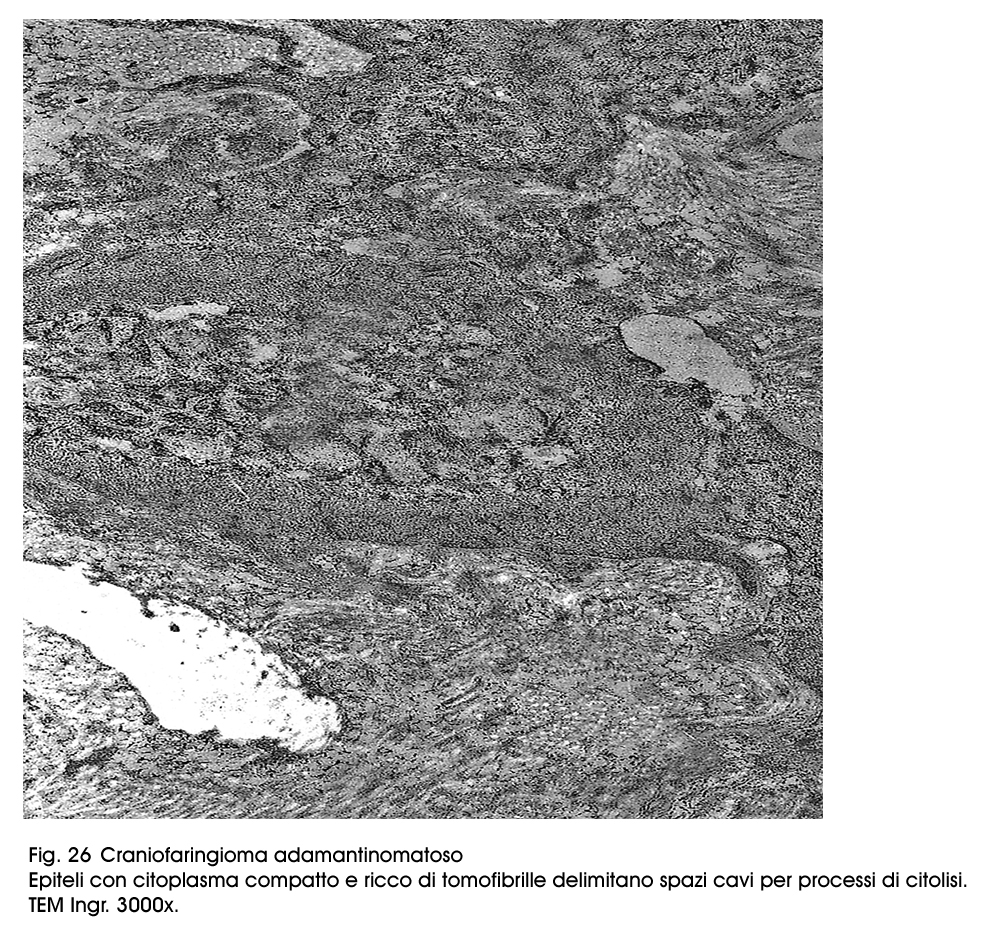 Fig.27
Fig.27 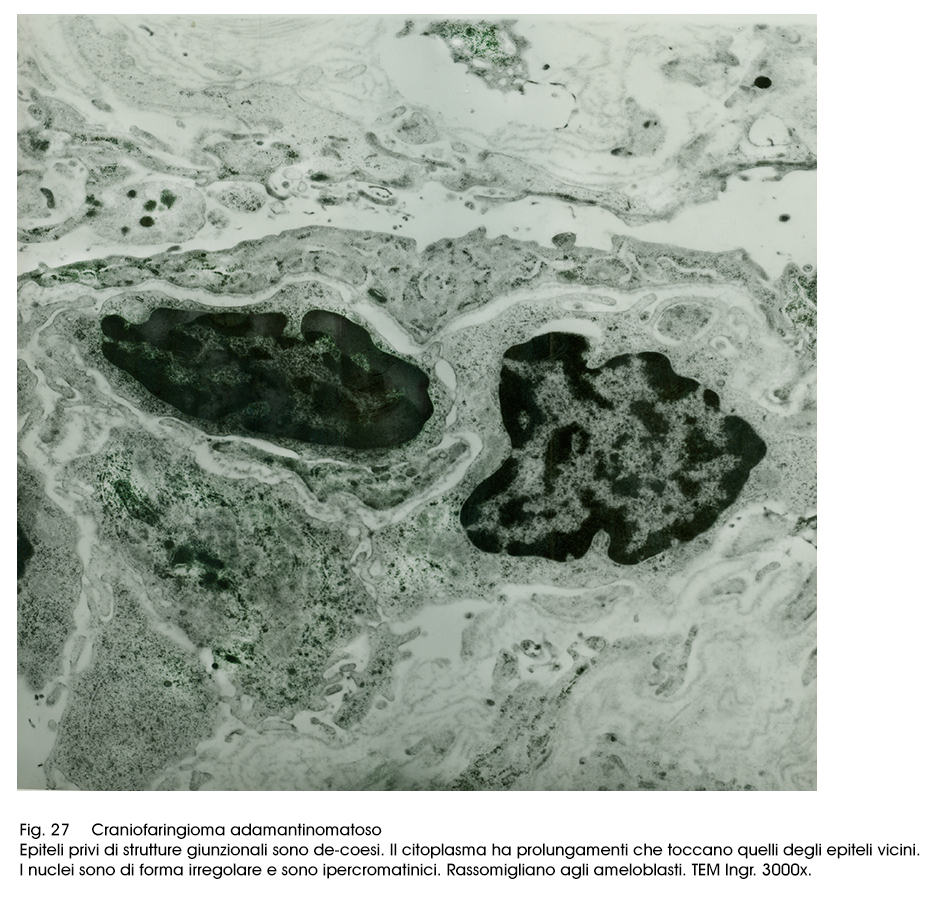
Fig.28 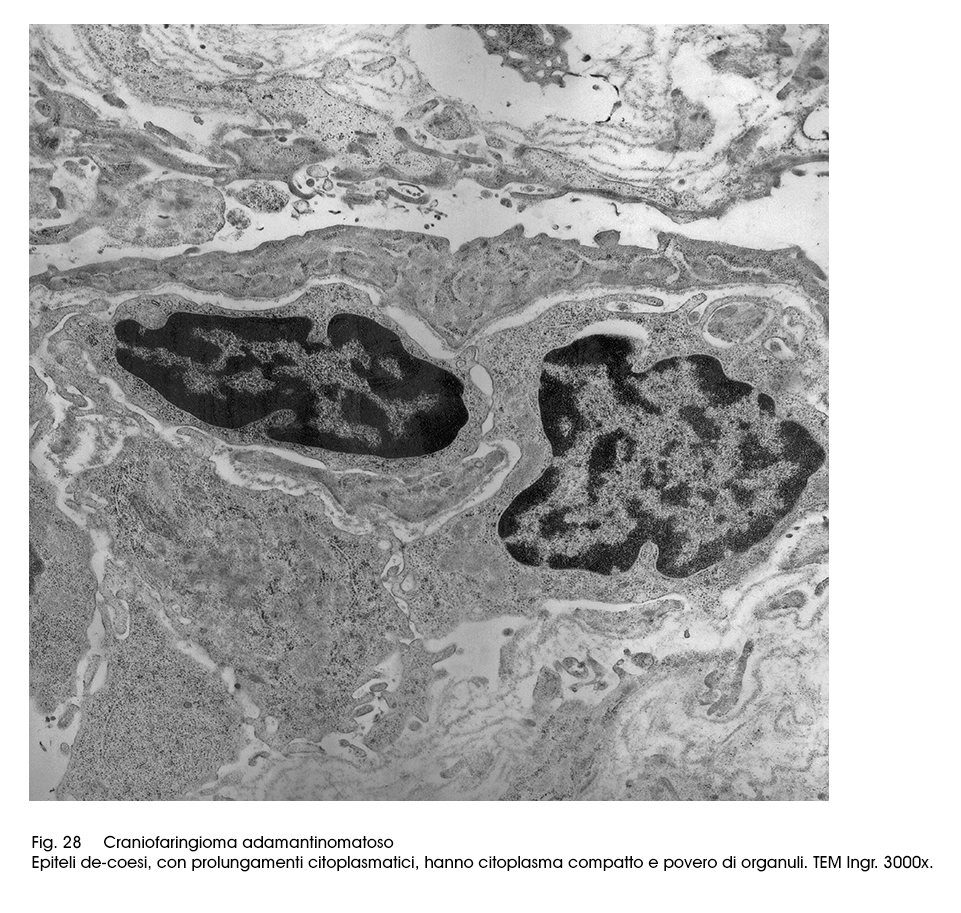
L'’ultrastruttura degli epiteli dell’istotipo papillare è molto diversa da quelle dianzi descritta. Gli epiteli sono di forma cilindrica, sono tra loro coesi mediante strutture giunzionali e mostrano quote ben sviluppate di organuli intracitoplasmatici. Sono ben evidenti sia strutture mitocondriali, anche se coartate, sia una cospicua componente ergastoplasmatica
anche se frammentata.
Fig.29 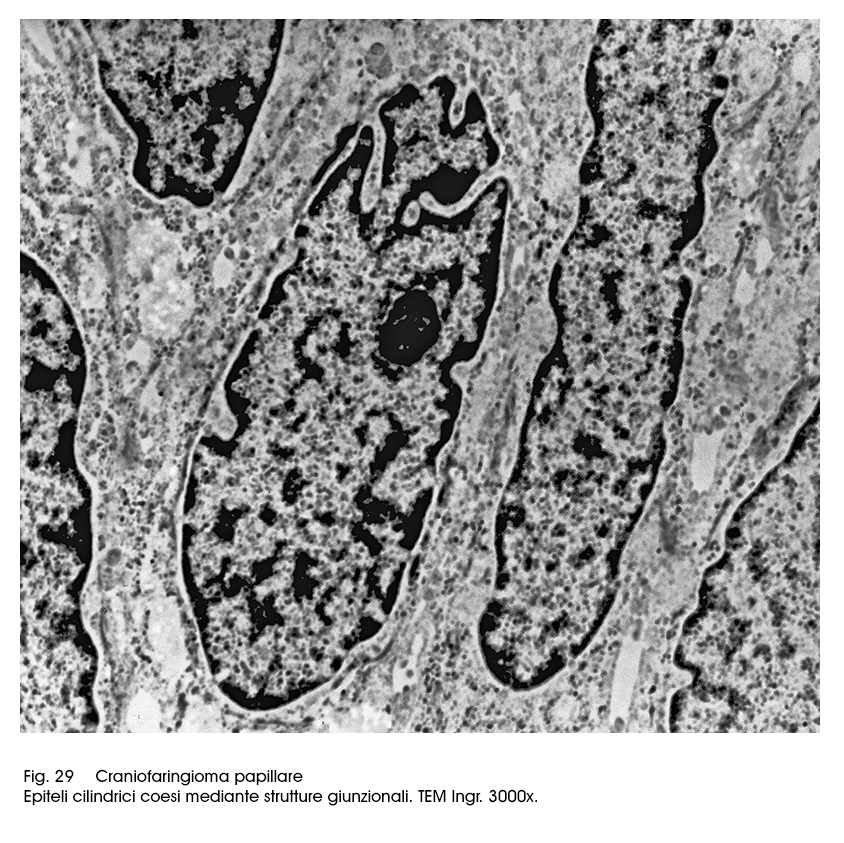 Fig.30
Fig.30 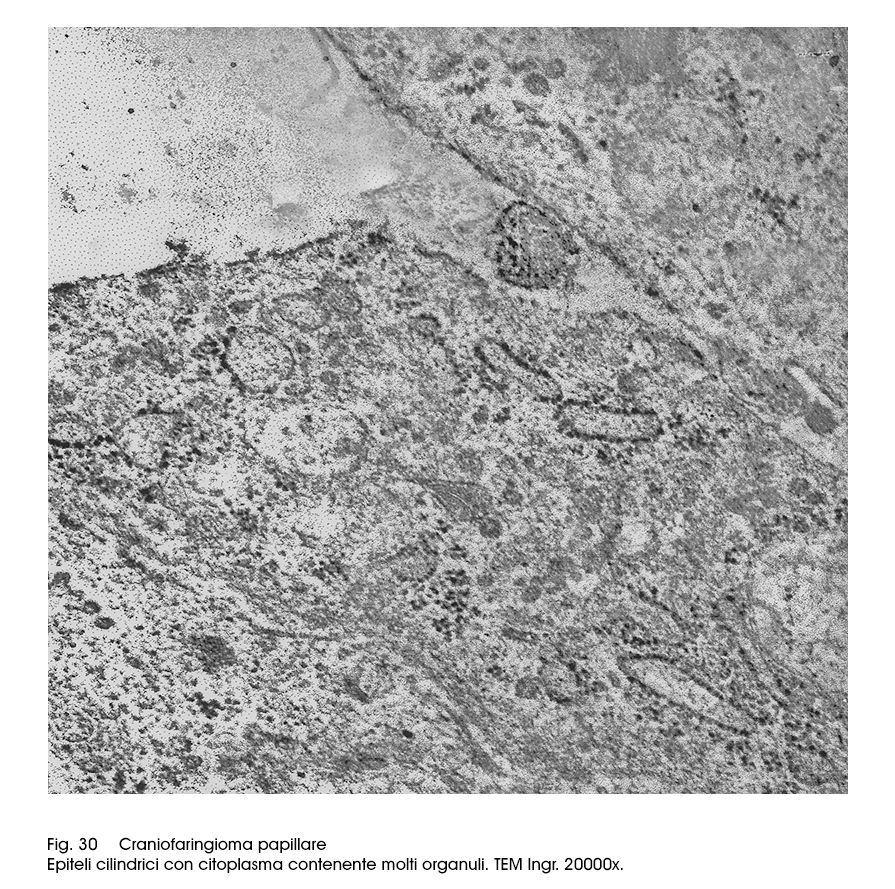
Fig.31 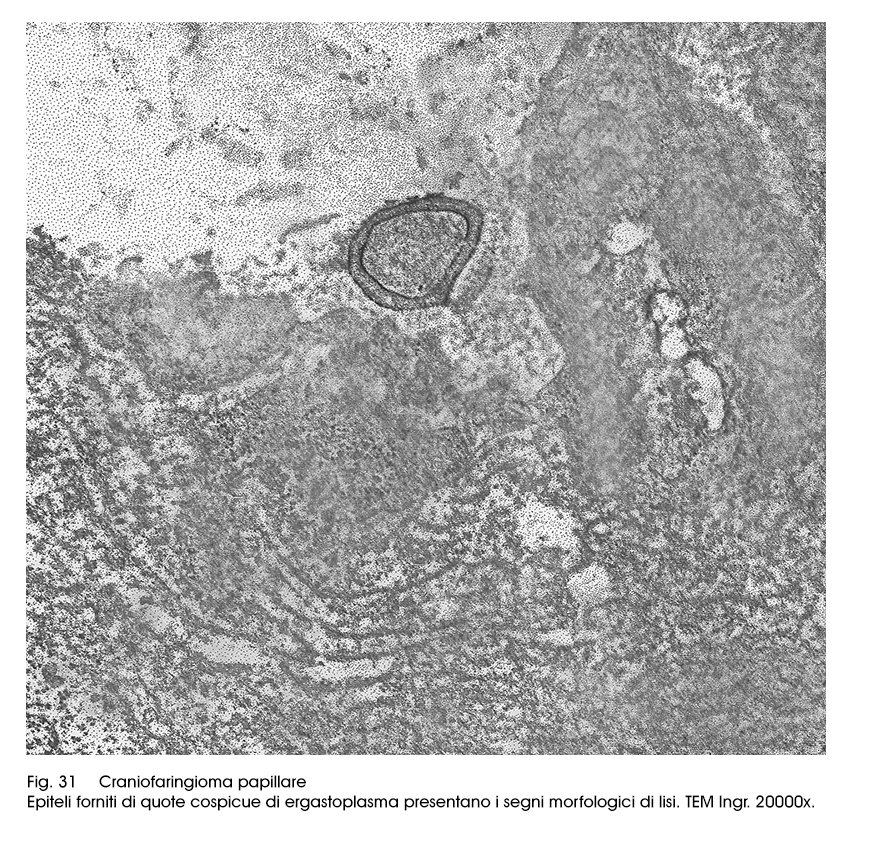 Fig.32
Fig.32 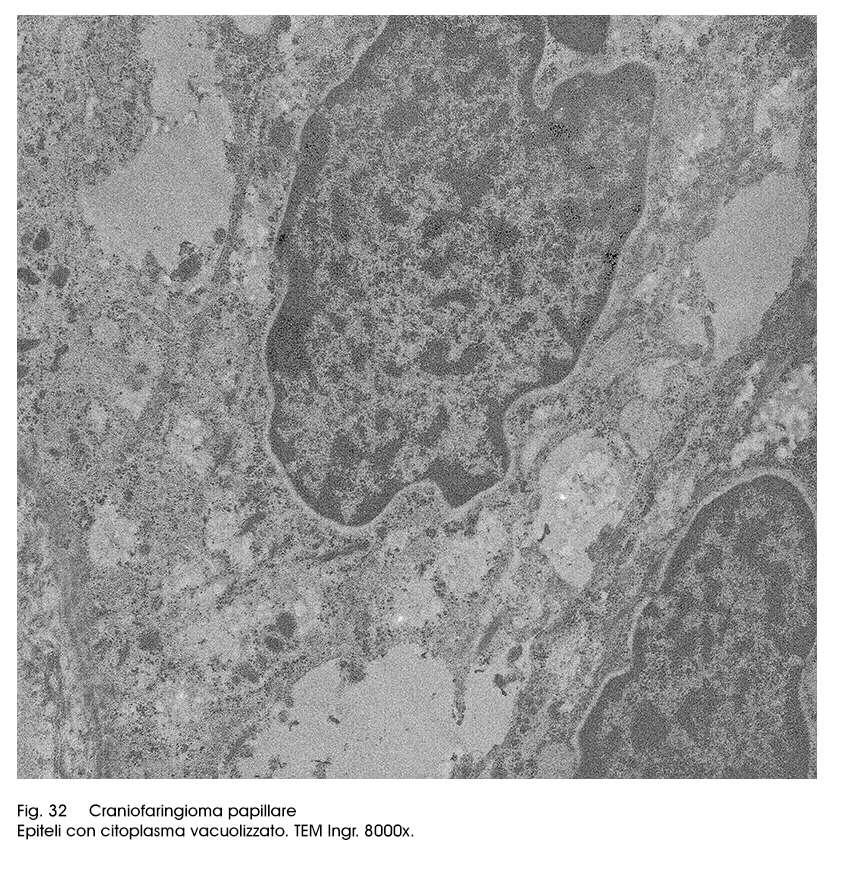
I craniofaringiomi, in tutte le loro varietà anatomiche sono forniti di una cospicua quota vascolare; questa è rappresentata soprattutto da capillari che permeano le strutture solide e/o costeggiano o si interpongono a livello delle formazioni cistiche. Questi capillari sono ben strutturati, sono tappezzati da endoteli rigonfi, diafani o punteggiati da micro-vacuoli; in molti campi microscopici si rivelano a livello dei punti di giunzione tra endoteli contigui fenestrature più o meno ampie.
Fig.33 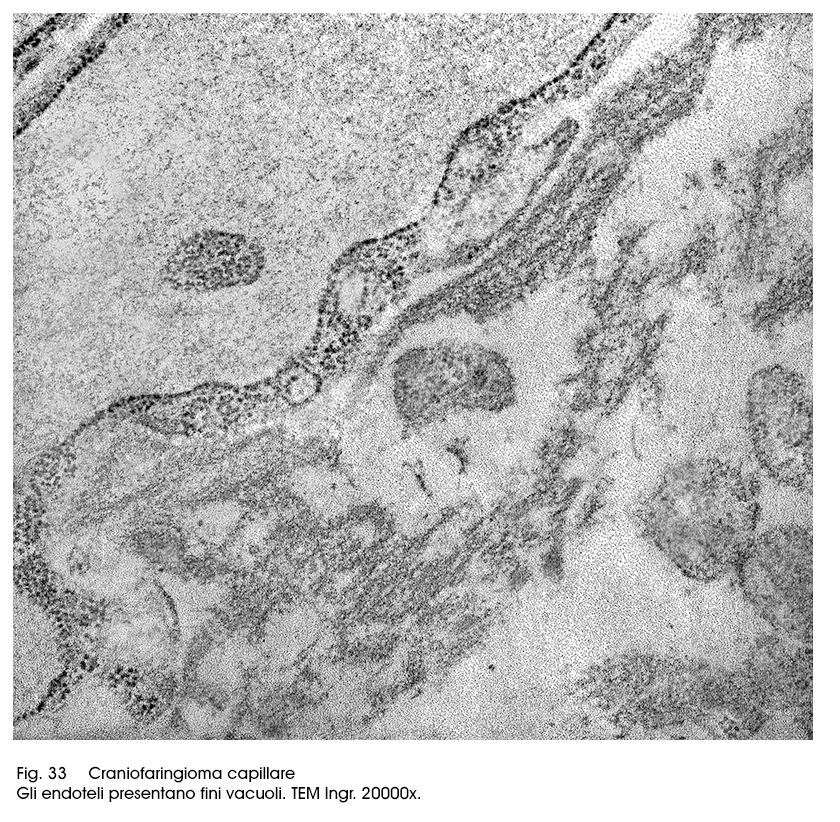 Fig.34
Fig.34 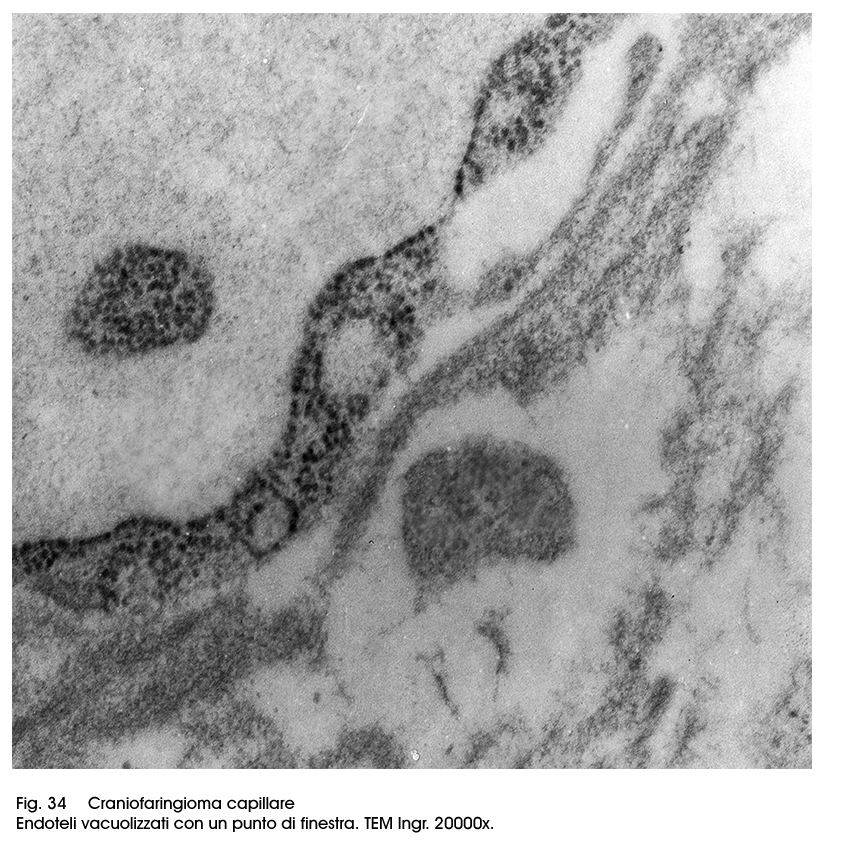
Ciò favorisce la trasudazione di liquido serioso in sede pericapillare con diffusione interstiziale centrifuga che coinvolge le aree neoplastiche nel tempo inducendo i processi di deconnessione inter-epiteliale e la formazione di escavazioni più o meno ampie.
Modalità di crescita dei craniofaringiomi
Il craniofaringioma può sviluppare una aggressività locale, può recidivare e ancora può manifestarsi come forma neoplastica maligna. Il craniofaringioma papillare è più invasivo rispetto a quello adamantinomatoso; al di là di questo dato statistico tutti i sub-tipi di craniofaringioma possono invadere il seno etmoidale, quello mascellare, quello frontale o possono impiantarsi quale sede secondaria a livello del rinofaringe e delle cavità nasali; sono possibili anche focolai metastatici con localizzazioni a livello degli emisferi cerebrali, dei nuclei della base, del midollo spinale.
Si ritiene che questi eventi di invasività locale o di metastatizzazione siano favoriti dai processi di neoangiogenesi ,dalla esistenza di fenestrature a livello degli endoteli dei capillari e/o dalle correnti del liquido cerebro-spinale.
Rimane tutt’ora aperto l’interrogativo riguardante la possibilità di recidiva; recidive riscontranti in casi nei quali la asportazione della neoformazione è stata totale. E’ stato confermato il dato secondo il quale hanno probabilità di recidiva i casi in cui la densità cellulare è più elevata, le mitosi sono più numerose, si appalesa un rapporto nucleo/citoplasma frequentemente invertito, si rileva un dismorfismo nucleare con nucleoli preminenti e con una coesione intercellulare ridotta.
Fig.35 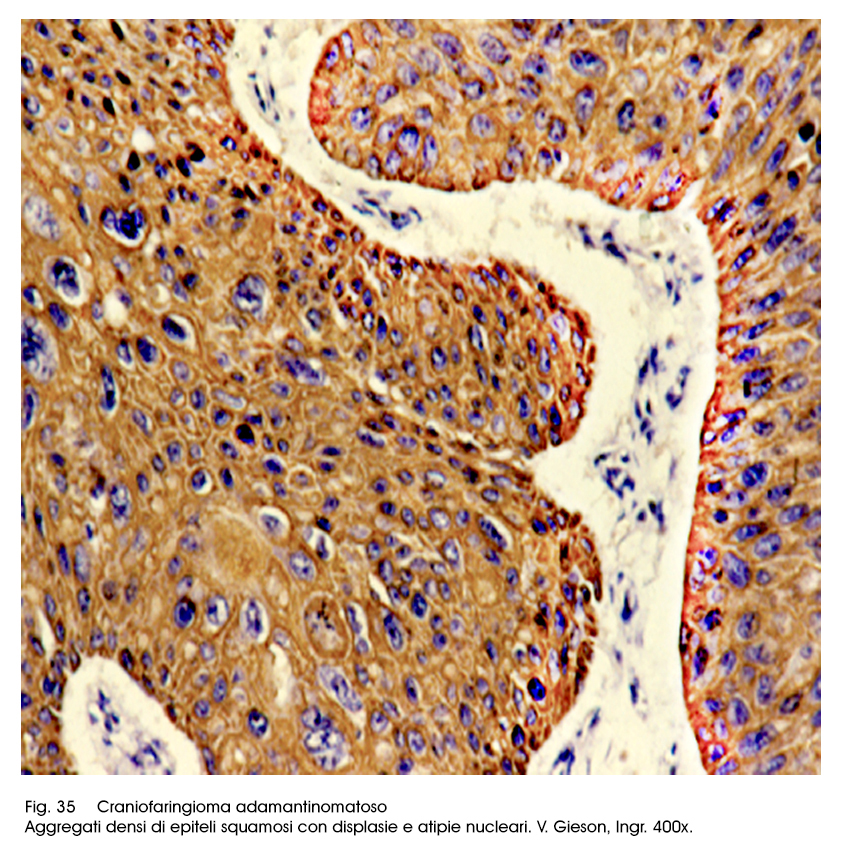
In letteratura sono riportati casi rari di craniofaringioma maligno; questi possono insorgere come neoplasia primitiva oppure derivare da un preesistente cranio-faringioma benigno, acquisendo in questo processo di trasformazione i caratteri del carcinoma squamoso con gradi di differenziazione variabili da caso a caso.
Cisti della tasca di Rathke e craniofaringioma.
Le cisti della tasca di Rathke sono ben circoscritte, sono capsulate e al taglio lasciano defluire un liquido mucinoso. Al microscopio le pareti delle cisti sono rivestite da epiteli cubico-cilindrici, di forma colonnare, forniti di strutture ciliate e da epiteli globoidi secernenti mucine. Questi caratteri citologici consentono una agevole diagnosi differenziale rispetto ai craniofaringiomi con caratteri cistici aventi questi ultimi un rivestimento epiteliale di tipo cubico-squamoso. In letteratura sono riportati casi nei quali coesistono i caratteri delle cisti di Rathke con quelli tipici del craniofaringioma; pertanto si teorizza l’ipotesi di forme intermedie e/o transizionali aventi una morfopatologia mista delle due neoformazioni su la base di una comune istogenesi.
Fig.36 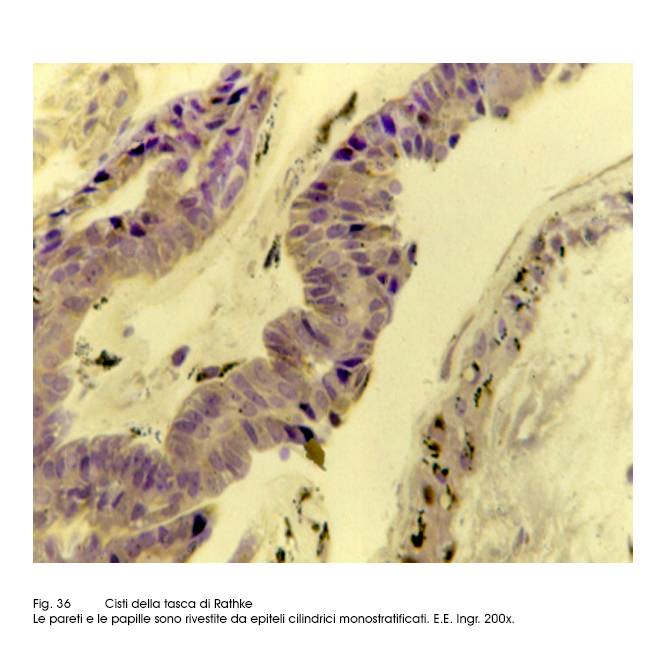 Fig.37
Fig.37 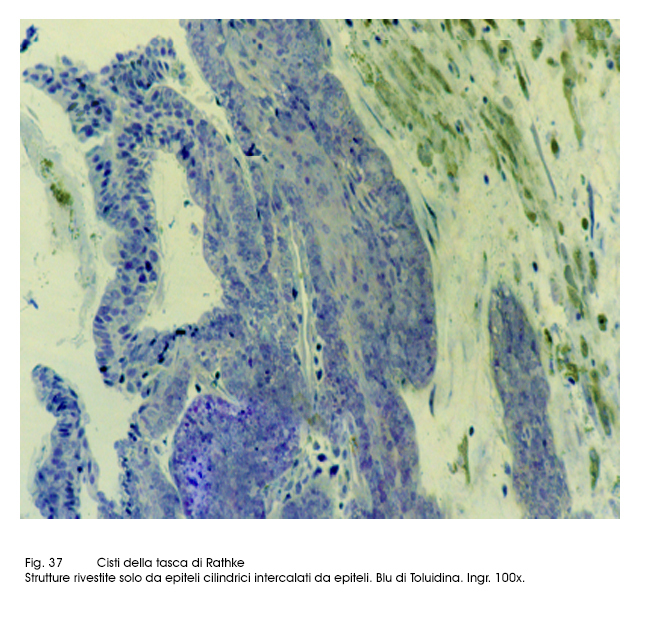
Sono descritti in letteratura casi di craniofaringiomi commisti a strutture riferibili ad adenoma ipofisario. Si elaborano ,di fronte a questi reperti, due ipotesi istogenetiche: la prima prende in considerazione essere un tumore da collisione e in quanto tale provenienti da due distinte filiere cellulari; la seconda ipotesi prospetta la teoria della esistenza di due cloni cellulari con differenti caratteri strutturali avente come fase iniziale lo stesso citotipo. Questa ipotesi è considerata quella più probabile poiché sono state repertate strutture e popolazioni cellulari con caratteri intermedi tra le due neoplasie. In letteratura sono stati descritti craniofaringiomi contenenti strutture riconoscibili come adenoma silente sub-tipo 3 e adenoma silente sub-tipo 2ACTH.

