AUTOFAGIA, DISFUNZIONI MITOCONDRIALI, APOPTOSI, NECROSI NELL'ADENOMA DELL'IPOFISI
Osservazioni ultrastrutturali
Prof. Luigi Cuccurullo
|
INTRODUZIONE
L’omeostasi delle singole cellule e l’omeostasi numerica dei tessuti e degli organi rappresentano condizioni di equilibrio fondamentali per la sopravvivenza dell’organismo.
Questo equilibrio è regolato da processi biologici complessi, tra questi vi sono l’autofagia e l’apoptosi; la loro complessità riguarda le loro fasi evolutive e i fattori intrinseci ed estrinseci che vi partecipano sia in condizioni di fisiologia sia in quelle di varia patologia.
Tra fattori intrinseci hanno notevole importanza le numerose disfunzioni mitocondriali e le molteplici condizioni di stress del reticolo endoplasmatico, capaci di attivare singolarmente o insieme processi di degradazione (autofagia) o morte cellulare (apoptosi).
Un modello per osservare e descrivere alcuni aspetti di degradazione endocellulare è rappresentato da reperti di adenomi ipofisari. La preferenza verso tali reperti cellulari è giustificata dall’essere questi elementi ben differenziati, con basso indice proliferativo, in attività secretiva e con un ottimo livello metabolico, e un citosol altamente fornito di organuli.
Sono stati presi in considerazione casi di adenoma ipofisario secernenti ormoni diversi per escludere ogni correlazione tra la biochimica della sostanza secreta, la fisiopatologia degli organuli predisposti alla loro sintesi e le manifestazioni di degradazione endocellulare.
Le osservazioni esperite sono indicative della esistenza di un processo di degradazione endocellulare che è avulso dal tipo di ormone sintetizzato, ma è grosso modo correlato al grado di attività metabolica e alle quote di organuli rappresentate.
Infatti, si rileva in modo costante nelle cellule ben differenziate e in
ottimale attività secernente un maggior numero di mitocondri e di retico endoplasmatico e nel contesto di questi reperti un maggior numero di mitocondri disfunzionali e di reticolo endoplasmico in stress associati alla esistenza di focolai autofagici.
AUTOFAGIA
L’omeostasi endocellulare è fondamentale per lo stato di salute delle cellule; questa condizione è conservata mediante processi di degradazione e ristrutturazione endocellulare,processi complessi che si svolgono a tappe e sono regolati da geni.
L’omeostasi endocellulare si concretizza attraverso fini sistemi di degradazione riguardanti proteine, complessi lipidici, materiali di esosecrezione o di endosecrezione, parti di citosol, organuli endocitoplasmatici,, batteri, virus,materiali estranei penetrati nella cellula,etc.
Questi sistemi di degradazione sono diversificati in quanto sono programmati a seconda del materiale da degradare e su la base di alcuni dati riportati in letteratura si riconoscono i seguenti tre meccanismi di degradazione:
- - Sistema ubiquitina-proteosoma
- - Sistema endolisosomiale
- - Sistema fagolisosomiale
Il sistema ubiquitina-proteosoma è finalizzato alla degradazione di singole catene poliptidiche mentre i sistemi endolisosomiali e fagolisosomiali sono organizzati per degradare complessi multiproteici, organuli citoplasmatici, frammenti di citoplasma (Autophagy, 2012; 8: 794-811).
Dei tre sistemi sopra riportati,qui di seguito si rivolgerà l’attenzione solo ai processi fagolisosomiali,cioè a quei complessi processi catabolici endocellulari, indicati anche con la denominazione di processi autofagici (Autophagy, 2015; 11: 60-74) .
Tali processi si manifestano nel citoplasma di elementi cellulari di organismi eucarioti,quali lesioni a focolai aventi livelli diversi di complessità e fasi di evoluzione ben scandite da proprii caratteri morfologici e biochimici, focolai repertabili in condizioni sia di fisiologia sia di patologia cellulare.
In condizioni di fisiologia, questo processo è chiamato a regolare l’omeostasi cellulare mediante la rimozione di quote eccessive e/o superflue di citosol,di complessi proteici,di membrane o di organuli citoplasmatici e nel contempo è organizzato per controllare l’entità dei flussi metabolico-nutrizionali, ormonali, ossidativi,al fine di evitare danni al complesso edificio cellulare (EMBO J, 2015; 34: 856-880).
In condizioni di patologia cellulare, esso si attiva per rimuovere prodotti biologici lesivi quali, per esempio, fattori genotossici, proteotossici, agenti infettivi, particelle estranee o ectopiche, microaree citoplasmatiche disfunzionali,microstrutture anomale o alterate presenti in processi neurodegenerativi,squilibri subcellulari nell’ambito di fenomeni riparativi ,o percorsi deviati nelle fasi di differenziazione cellulare o tissutale. (J. Cell Mol. Med. 2013; 17: 12-29).
Tutte queste microalterazione,disfunzioni,disordini molecolari,depositi di complessi proteici innescano il complesso meccanismo dell’autofagia;questo meccanismo, dopo un percorso scandito in varie fasi, si conclude con la loro degradazione lisosomiale. .Le molecole così disaggregate mediante la demolizione enzimatico-lisosomiale (molecole rappresentate da aminoacidi, zuccheri, acidi grassi, nucleosidi, etc.),successivamente saranno riutilizzate per le fasi di risistemazione e recupero delle cellule . (FEBS J. 2016; 283: 2403-23).
I focolai dell’ autofagia sono indicati con il termine di autofagosomi,sono identificabili agevolmente per la presenza di una membrana di delimitazione a doppio strato che è di incerta origine e si ritiene possa derivare
dal reticolo endoplasmico,o dall’apparato del Golgi, o ancora dalla membrana plasmatica. (Nat. Commun. 2015; 11: 7007-15) (J. Mol. Biol. 2016; 428: 1700-13).
L’autofagia si manifesta in modo diverso sia a livello qualitativo sia a quello quantitativo,aventi ciascuno di essi una notevole importanza per la patogenesi del processo autofagico e per la gravità dello stesso.
Secondo le modalità qualitative, sono stati identificati focolai autofagici non selettivi nei quali sono coinvolti tutti i componenti di una area citoplasmatica e focolai autofagici selettivi nei quali vi è il coinvolgimento di un solo tipo di organulo del citoplasma. Esempi di autofagia selettiva è quella dei mitocondri (mjtofagia),del nucleo(nucleofagia),del reticolo(reticolofagia),di gocce di lipidi(lipofagia),etc. . (Autophagy, 2012; 8: 794-811) (Cell Res. 2012; 22: 43-61).
L’autofagia selettiva contribuisce a regolare la omeostasi cellulare ed è controllata da recettori autofagici specifici per le molecole e le sub-strutture selezionate (J.Mol. Biol. 2016; 428 (Parte A): 17/11-24).
Le modalità quantitative riguardano il numero dei focolai autofagici per singola cellula, e soprattutto la estensione e la complessità del singolo focolaio,quale espressione della tipologia e della gravità delle alterazioni endocellulari che hanno sviluppato l’evento autofagico.
Queste modalità sono descitte e diagnosticate secondo le seguenti tre tipologie:
- Microautofagia
- Macroautofagia (autofagia propriamente detta)
- Autofagia chaperone mediata (CMA)
MICROAUTOFAGIA
La microautofagia procede alla degradazione di molecole presenti nel citosol mediante enzimi lisosomali. Questo processo si realizza con di invaginazione della membrana lisosomiale finalizzata a inglobare il materiale da degradare; il risultato è dato dalla formazione di corpi multivescicolari contenenti materiale amorfo o filamentoso in via di demolizione. (Dev Cell, 2011; 20: 131-39).
MACROAUTOFAGIA (Autofagia propriamente detta)
Il processo di macroautofagia (autofagia) appare al livello ultrastrutturale quale focolaio vesciclolare delimitata da una membrana a doppio strato e contenente organuli vari e/o frammenti di materiale vario intra ed extra cellulare. Osservazioni condotte in fasi diverse di questo processo evidenziano prima la formazione delle membrane di contorno, segue la formazione di vacuoli con l’accumulo del materiale biologico da degradare quindi si innesta la fusione lisosomale e la attivazione della demolizione enzimatica. (Oncotarget 2016; 7: 5788-5799) (J. Mol. Biol. 2016; 428: 1700-13).
Mediante la membrana di contorno a doppio strato si ha la separazione del materiale biologico danneggiato e da degradare dall’ambiente citoplasmatico circostante in condizioni eubiotiche.
Questi vacuoli prendono il nome di autofagosomi,e quando sono molto ampi o contengono aggregati complessi di materiali di varia natura e provenienza sono denominati “aggregofagosomi”; dopo la fusione con un lisosoma ,questo focolaio autofagosomico acquisisce una morfologia diversa e viene denominato autolisosoma (EMBO, 2015; 34: 856-880).
Si repertano anche ampi focolai autofagici contenenti un cargo di organuli e materiali commisti i quali mostrano i segni di un grave stato di demolizione molecolare;questi focolai rappresentano una fase avanzata del percorso autofagico e vengono denominati fagolisosomi. Nel citosol di cellule, sedi di pregressi focolai di autofagia, si repertano aggregati compatti di materiale biologico; questi sono denominati “corpi residui” in quanto sono espressione di prodotti residuali dopo l’estinzione di un focolaio autofagico.
AUTOFAGIA CHAPERONE MEDIATA
L’autofagia chaperone mediata (CHA) è un processo di autofagia selettiva riguardanti proteine bersaglio che vengono legate da chaperonine citosoliche,trasportate prima su la membrana lisosomiale,poi nell’interno di tale organulo per essere degradate con recupero delle molecole elementari.
Reperti:
I casi di adenoma dell’ipofisi esaminati evidenziano focolai di microautofagia e di autofagia; questi si ritrovano in cellule in attività secretiva ma sono indipendenti dal tipo di attività ormonale. Sono stati osservati in zone diverse del citoplasma con una maggiore incidenza a livello delle fasce periferiche. Quasi sempre questi focolai si associano ad alterazioni dei mitocondri e del reticolo endoplasmico presenti nelle zone circostanti.
La membrana di contorno a doppio strato non sempre è visibile per intero in considerazione dell’angolo di taglio delle sezioni ultrasottili e dei limiti di una immagine bidimensionale al microscopio elettronico. Il focolaio autofagico che si è formato nel citoplasma di una cellula, in tempi successivi potrà essere destrutturato e identificabile con difficoltà per subentranti processi di vacuolizzazione del citosol o per fenomeni di necrobiosi.
Le descrizioni qui di seguito riportate saranno raccolte in paragrafi separati, uno per la micro-autofagia, l’altro per la autofagia propriamente detta..
MICROAUTOFAGIA
I focolai di microautofagia si ritrovano frequentemente commisti a mitocondri disfunzionali e a reticolo- endoplasmatico in stato di stress.
Essi sono di piccole dimensioni, appaiono come vescicole, delimitate da una membrana a doppio strato, immerse nel citosol e
ricolme di materiale amorfo oppure di materiale amorfo commisto a frammenti filamentosi.
Fig.1 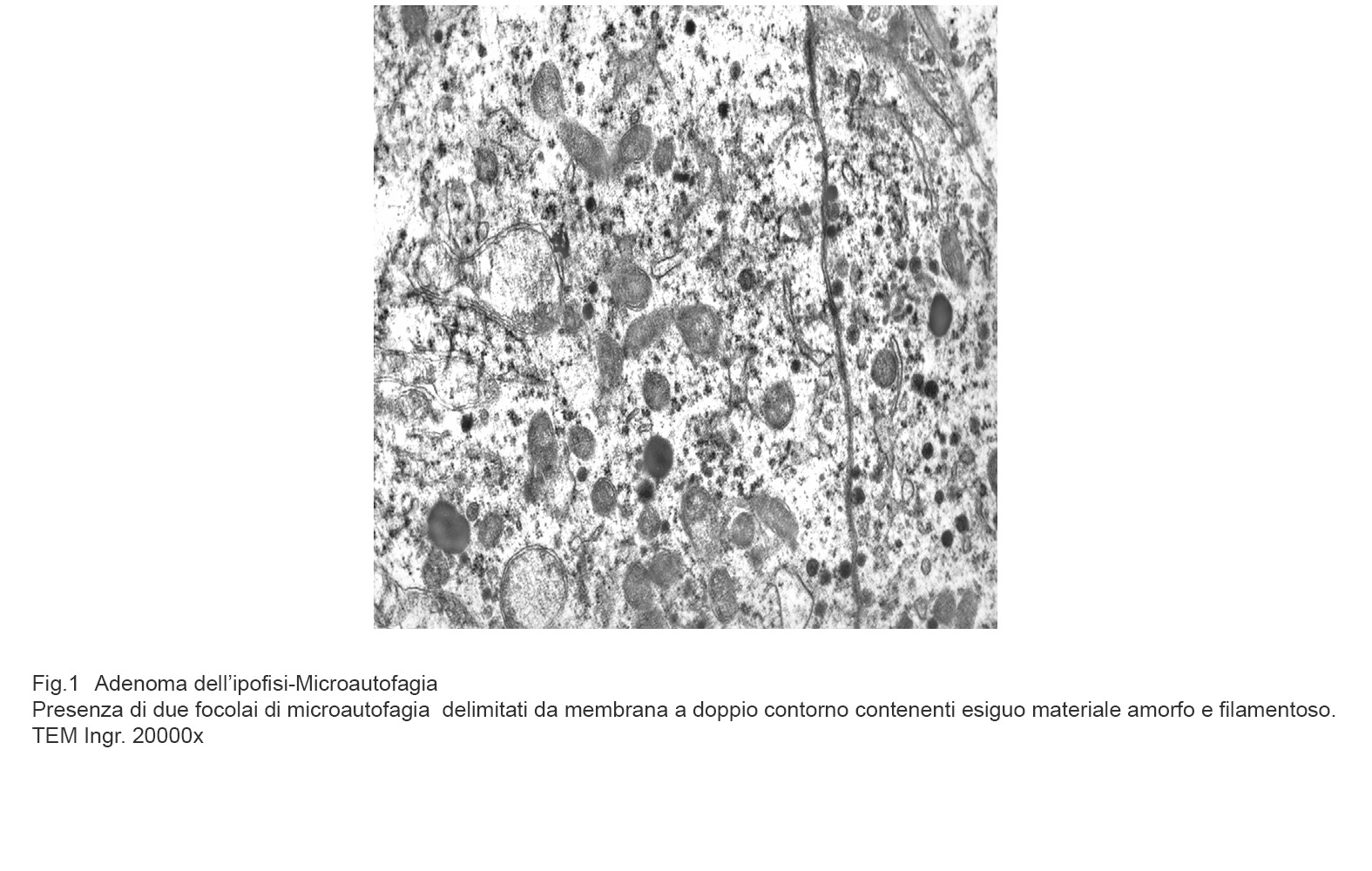 Fig.1a
Fig.1a 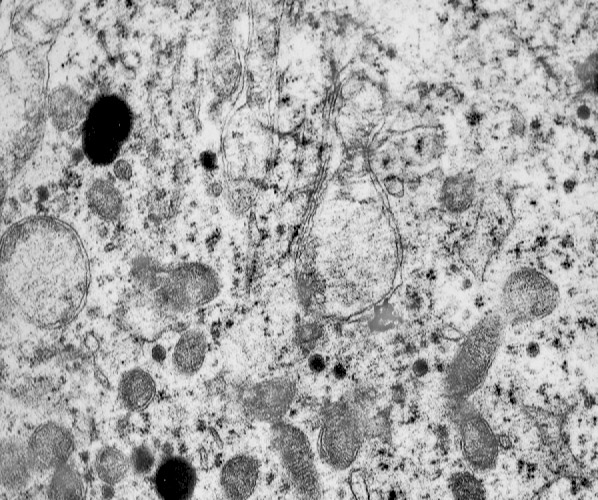
Fig.2 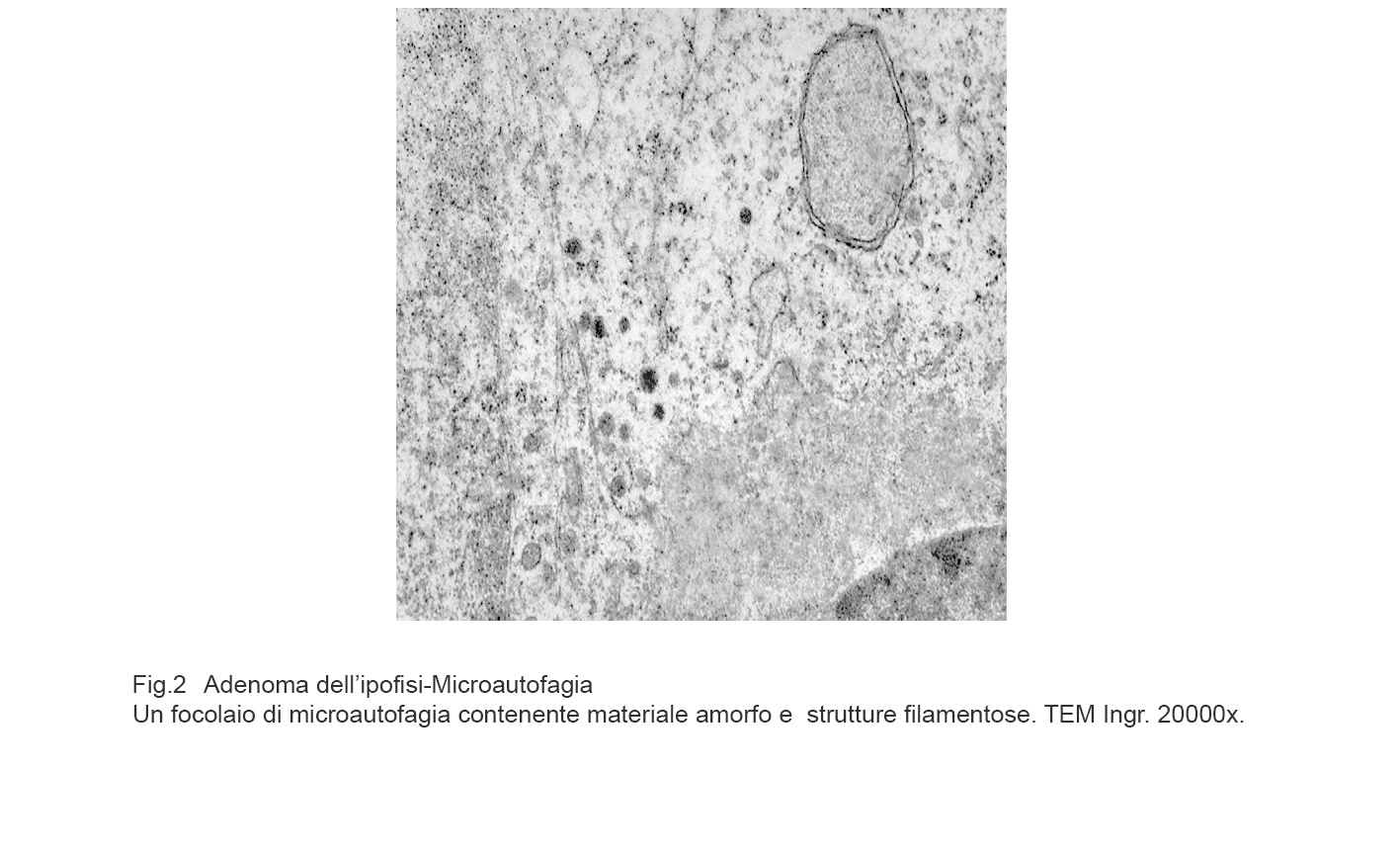
Fig.3 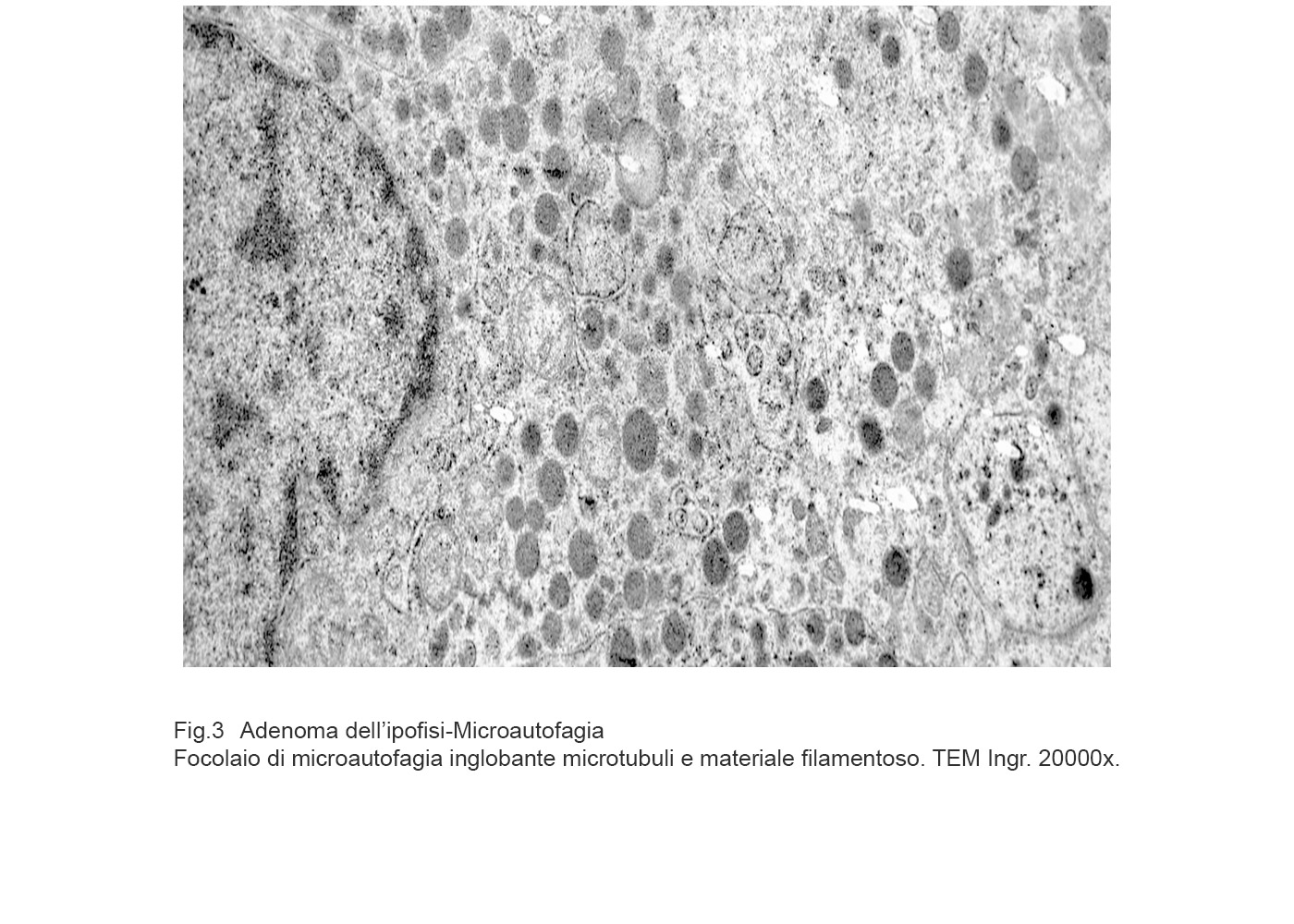 Fig.3a
Fig.3a 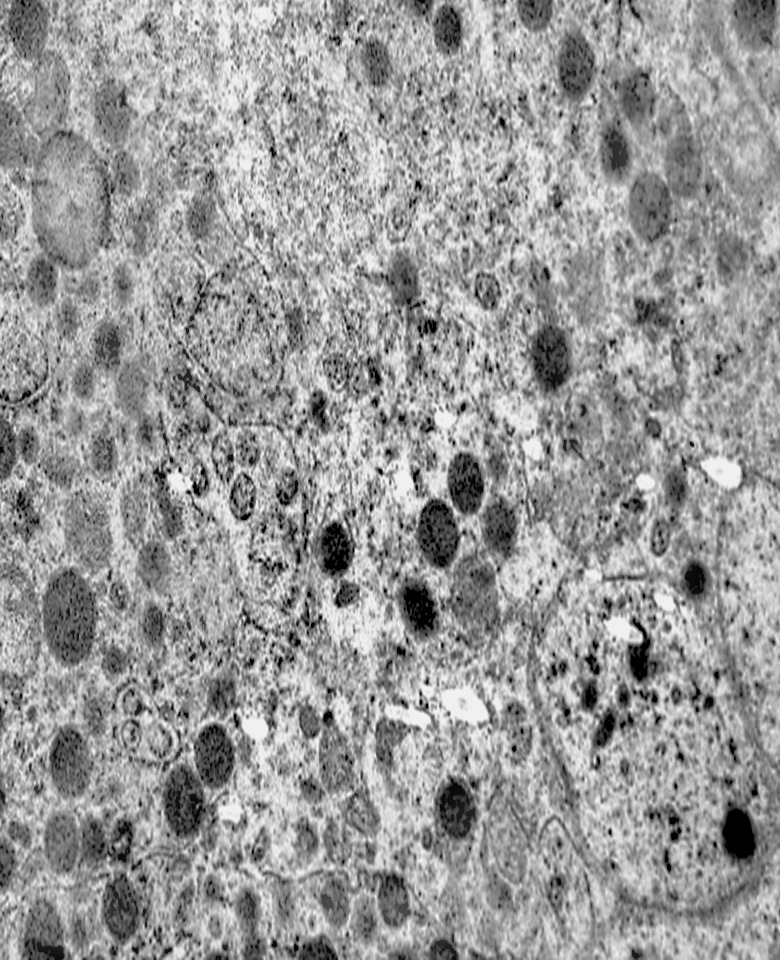
Fig.4 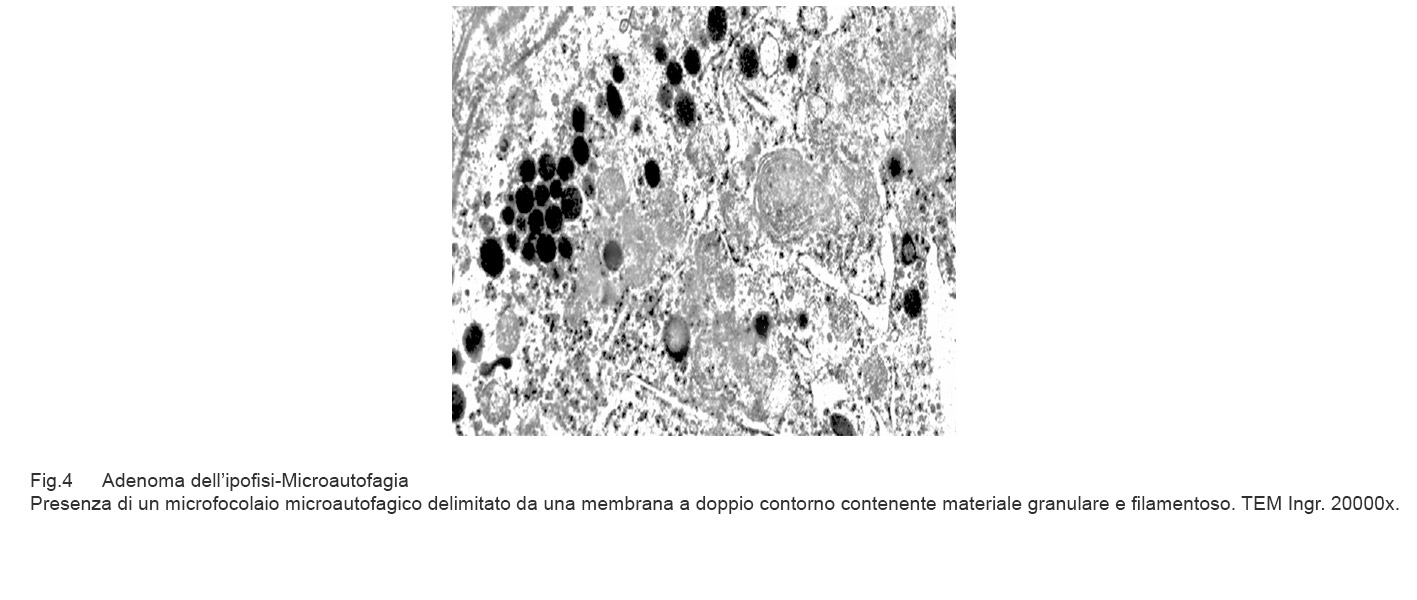 Fig.4a
Fig.4a 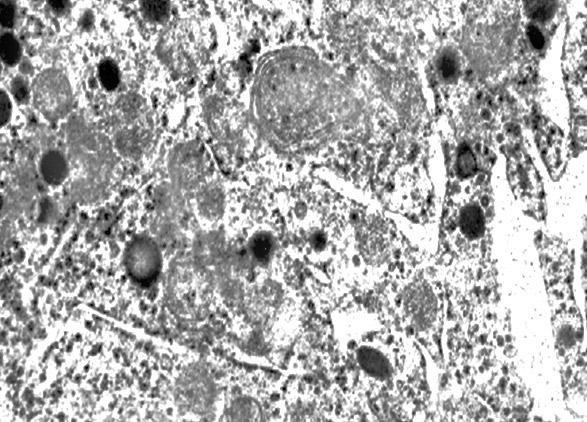
Fig.5 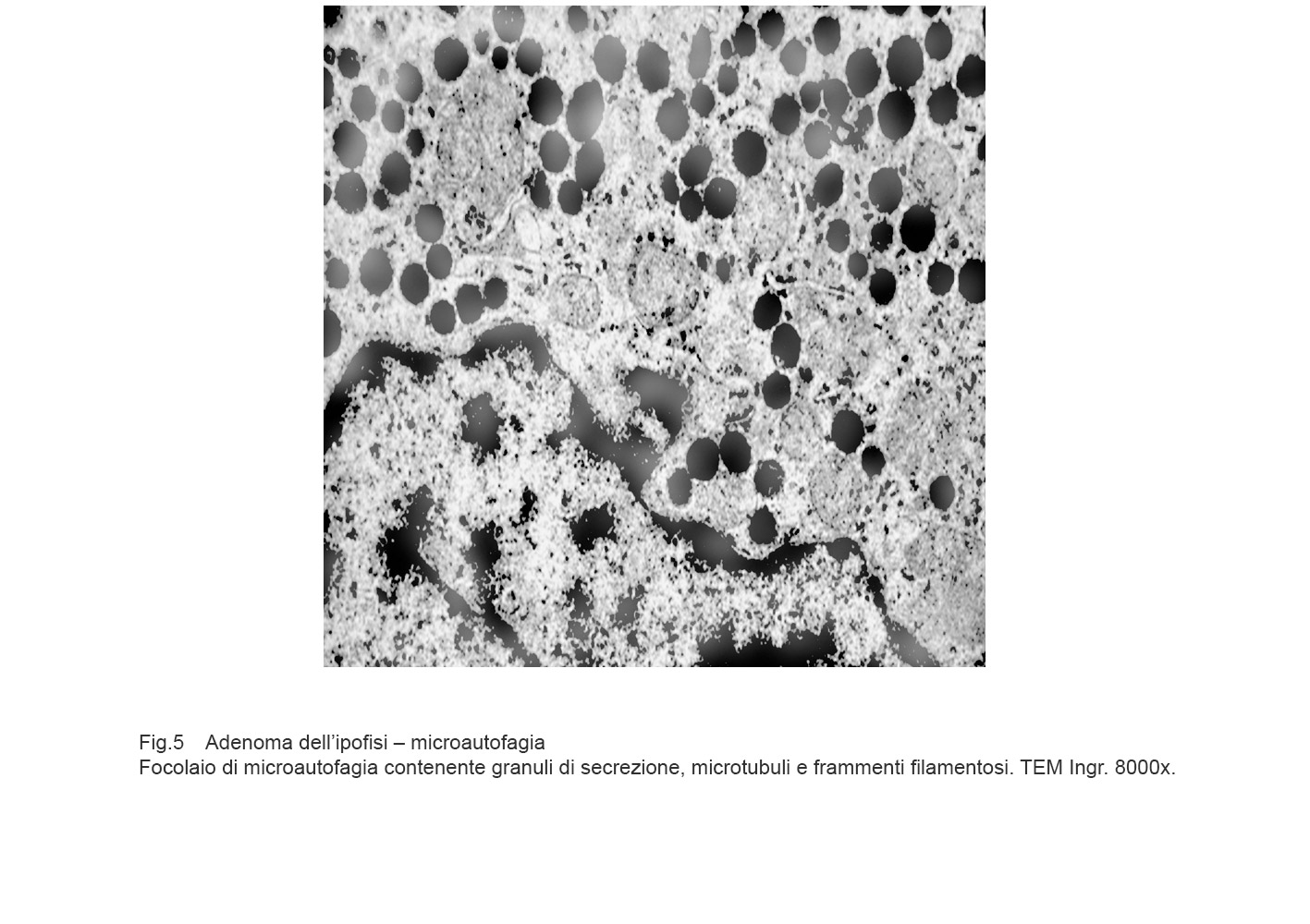 Fig.5a
Fig.5a 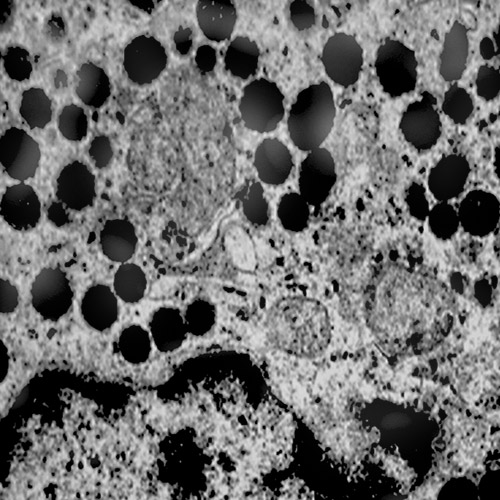
AUTOFAGIA
I focolai di autofagia sono di grandezza diversa e sono caratterizzati da una membrana a doppio strato e da contenuti rappresentati da frammenti di reticolo endoplasmico, da mitocondri in varie fasi di degradazione, da gocce lipidiche, da granuli di secrezione, da ribosomi, da microtubuli e da materiale amorfo.
Gli aspetti ultrastrutturali qui riscontrati sono conseguenti non solo alla tipologia delle substrutture inglobate ma anche alla fase di degradazione nella quale cade l’osservazione microscopica. E’ possibile documentare la esistenza di un focolaio di autofagia inglobante mitocondri, reticolo endoplasmico, microtubuli e citosol ancora in discreto stato di conservazione.
Fig.6 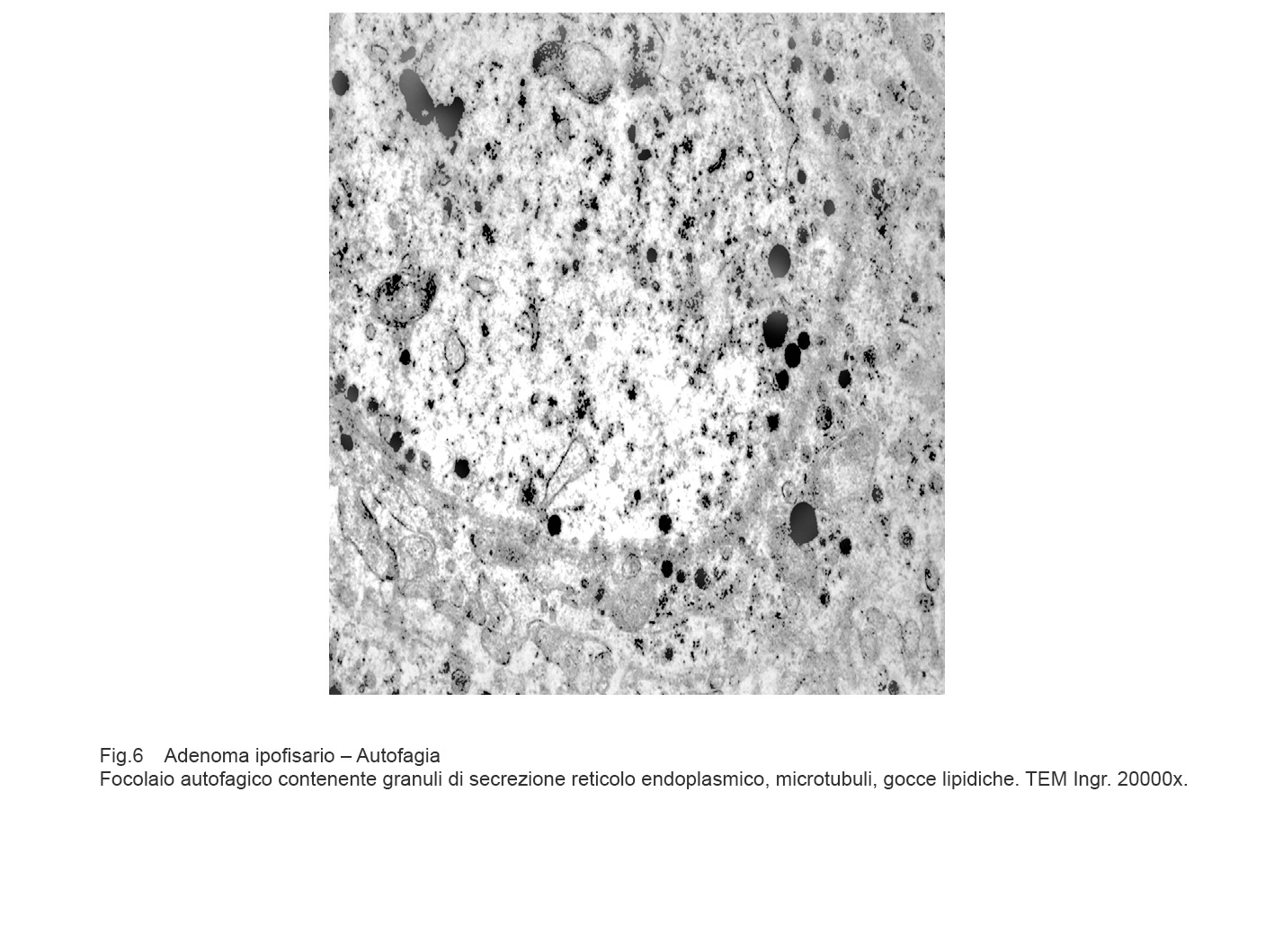
Se il focolaio autofagico si forma lungo la fascia periferica del citoplasma, a ridosso della membrana plasmatica e spesso a ridosso della parete di un capillare, si concretizza il rischio di una rottura del focolaio e svuotamento del contenuto negli spazi intercellulari o in modo mediato nel lume del vaso.
Fig.7 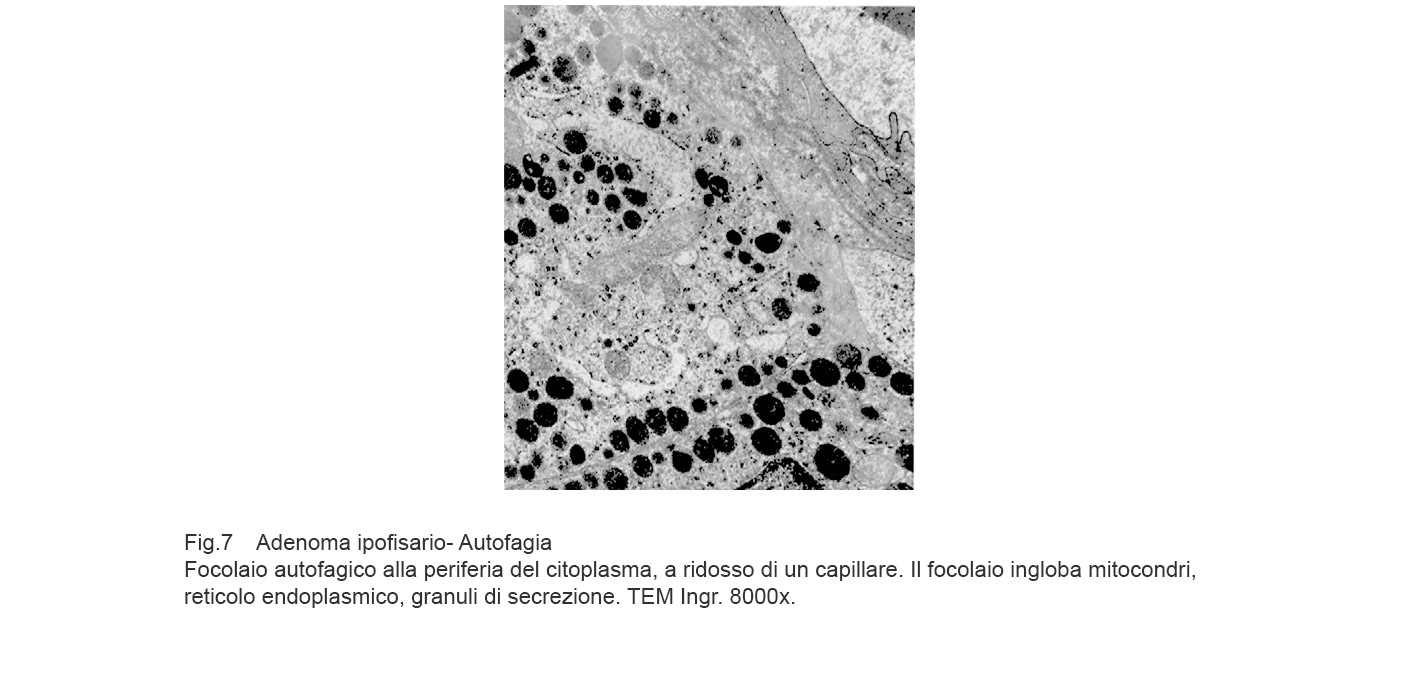
MITOCONDRI E RETICOENDOPLASMATICO IN STATO DI STRESS
I mitocondri sono organuli citoplasmatici dinamici aventi molteplici funzioni inerenti l’omeostasi cellulari e sono strettamente correlati con le altre substrutture presenti nel citoplasma.
Il loro dinamismo comporta una variazione di forma, di volumetria e di assetto interno del comparto delle creste. In particolare, questo dinamismo si manifesta nei processi di fissione e di fusione, i quali in condizioni fisiologiche sono in equilibrio,ma in quelle di patologia mostrano dis-equilibri che possono innescare apoptosi e/o mitofagia.
Queste delicate condizioni di equilibrio con il continuo rischio di disequlibri transitori o stabili sono regolate dalla proteina DRP1 (dynamin related protein, 1) e dalle proteine Mfn 1/2 (Mol. Cell. 2015; 57: 69-82).
L’assetto ultrastrutturale della quota mitocondriale è un indice importante per valutare lo stato di normo-funzionalità dell’intero corpo cellulare. Infatti, la grandezza dei mitocondri, la loro quota in fissione o fusione sono condizionati da fattori intrinseci ai mitocondri o da fattori ambientali a livello endo-citoplasmatico.
Uno stato fisiologico di omeostasi cellulare è caratterizzato da un numero cospicuo di mitocondri, da una loro volumetria ben sviluppata e da un ricco patrimonio, in ciascuno di essi, di creste ben disegnate.
Al contrario, negli stati di disfunzione mitocondriale, nei disturbi metabolici del corpo cellulare, nei processi cito-degenerativi o nelle fasi iniziali di necrobiosi, i mitocondri sono poco numerosi, piccoli, rotondeggianti, forniti di un ridotto patrimonio di creste, o addirittura frammentati.
Molto spesso questi processi disfunzionali o degenerativi sono avviati dalle alterazioni di permeabilità della membrana esterna ad opera di proteine della famiglia Bcl-2 (Curr. Hypertens Rep 2010; 12: 418-26).
Recentemente è stato documentato che le suddette proteine Bcl-2 alterano anche la permeabilità delle membrane interne dei mitocondri, modificano il pH, provocano la perdita del potenziale di membrana, inducono le riduzioni delle quote di ioni Ca+2, sono causa del grave rilascio di citocromo C e attivano la liberazione di fattori pro-apoptotici. (J. Cell Mol. Med. 2015; 19: 2084-97).
Nel citosol si ritrova anche la rete reticolo- endoplasmatica formata da cisterne interconnesse che tra l’altro comunica e interagisce con l’apparato mitocondriale condizionando la dinamica di tale apparato.(World J. Gastroenterl. 2014;20:8260-67) (Mol.Cell 2015;57:69-82).
Una compromissione dell’omeostasi è caratterizzata anche da alterazioni del sistema reticolo- endoplasmatico in conseguenza di accumuli di proteine,di disfunzioni delle membrane,di disturbi tossici,etc, attivando in vario grado il variegato quadro morfo-funzionale di retico endoplasmatico in stato di stress.
Queste alterazioni mitocondriali correlate a stati di stress reticoloendoplasmatici possono sfociare in processi di autofagia selettiva mitocondriale (mitofagia) oppure in forme più gravi di autofagia non selettiva. (Nat. Cell. Biol. 2011; 13: 589-98) (Biochem. Soc. Trans. 2016; 44: 541-45).
Reperti
Le alterazioni mitocondriali sono di vario grado e spesso si associano a modificazioni del reticolo endoplasmico. Le attività secretive-ormonali delle cellule sono conservate se il danno mitocondriale è circoscritto a piccole aree del citoplasma; le stesse sono ridotte o assenti se i processi regressivi mitocondriali interessano vaste aree del citoplasma.
Questi dati sono associati,anzi commisti,a reticolo endoplasmatico iperdisteso,rigonfio,tortuoso,dilatato, con lume occupato da materiale amorfo,verosimilmente di natura proteica
I dati rilevati possono essere sintetizzati nei seguenti punti descrittivi:
Aree citoplasmatiche occupate da mitocondri pleomorfi ben strutturati e forniti di un elevato numero di creste ben disegnate. In queste aree si ritrovano mitocondri in fusione e in fissione.
Fig.1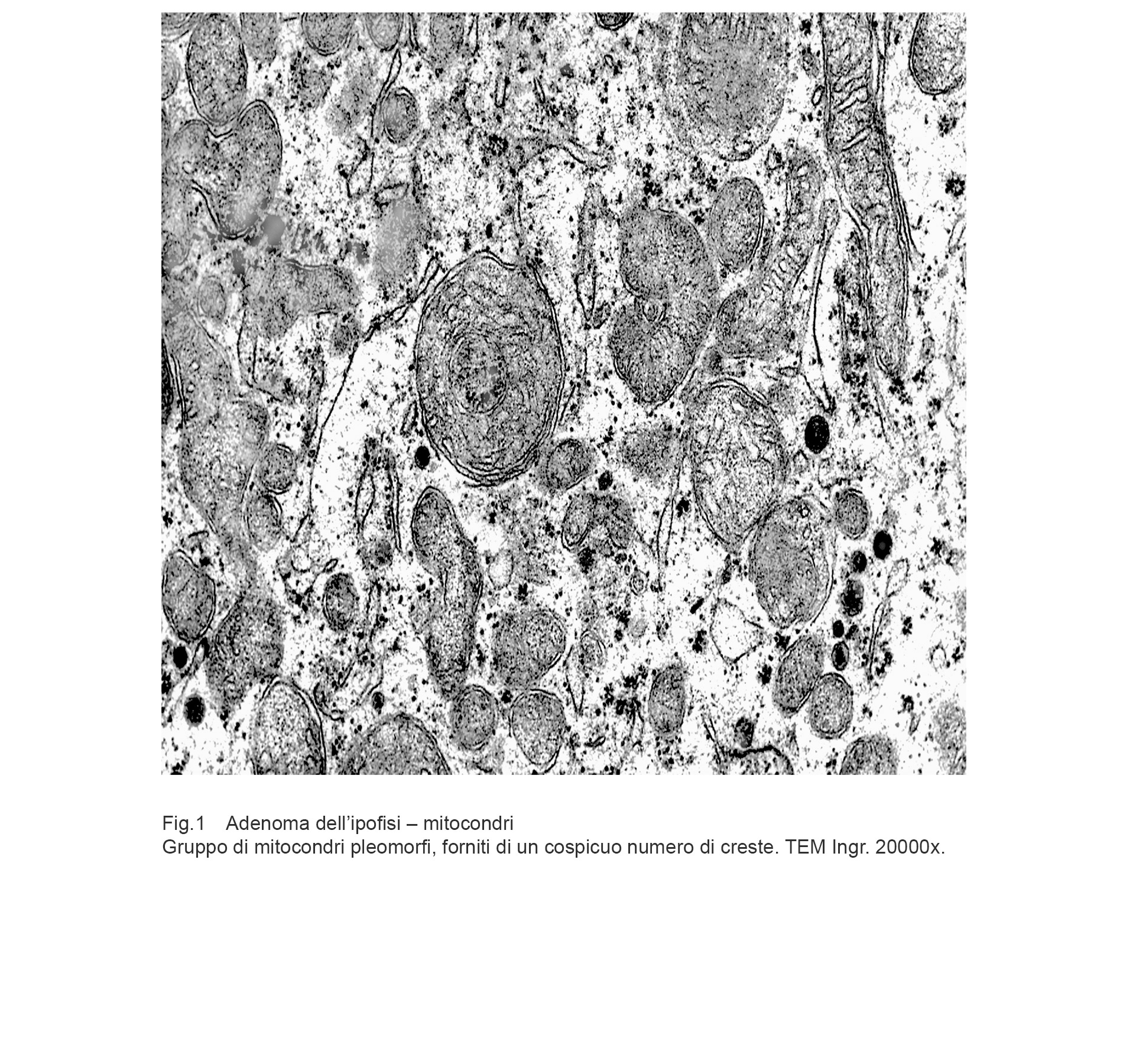 Fig.2
Fig.2 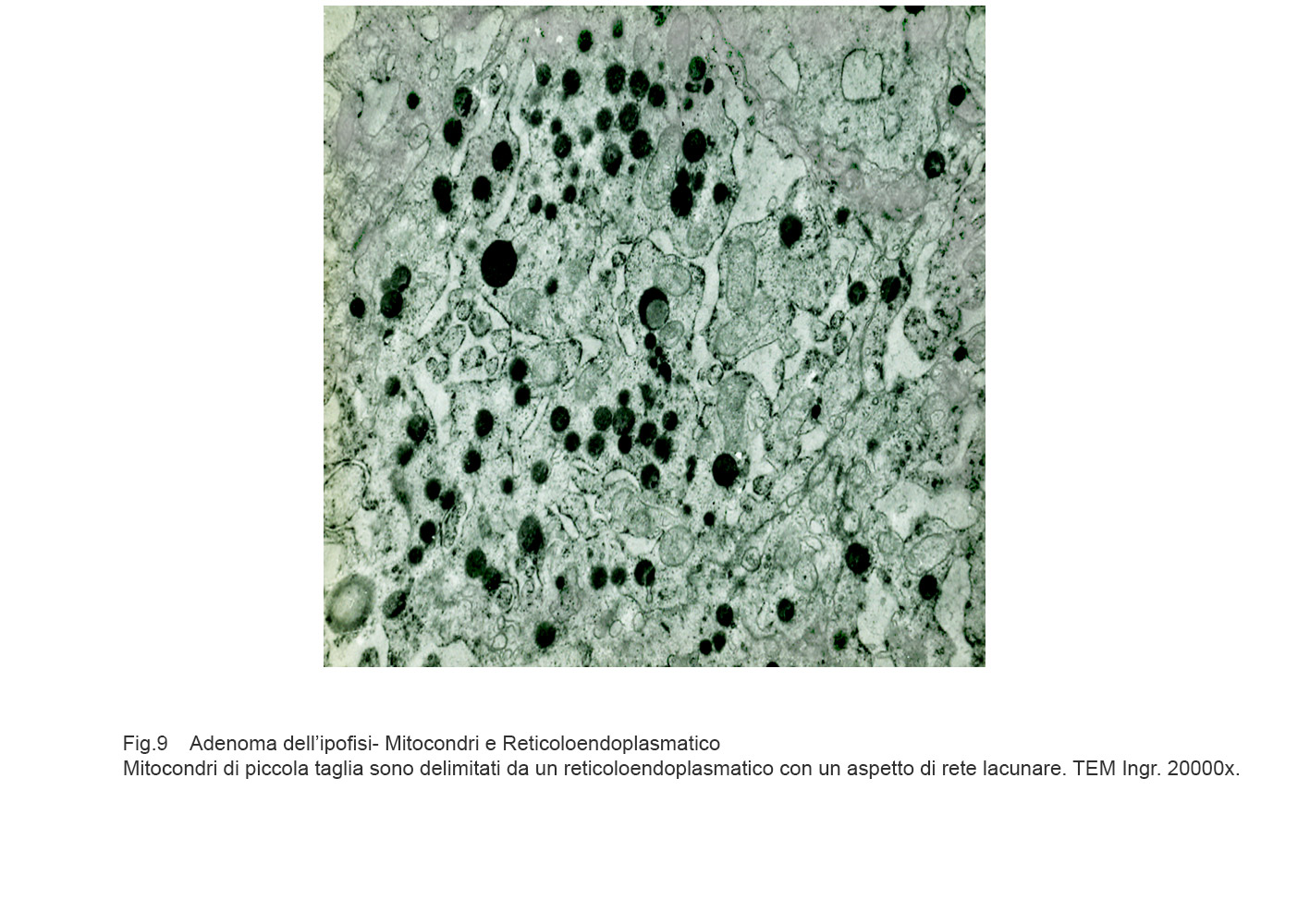
Cellule in attività secretiva le quali sono fornite di quote cospicue di mitocondri forniti di creste tubulari oppure di mitocondri rigonfi con creste in numero ridotto, spezzettate, disposte spazialmente in modo disordinato.
Fig.3 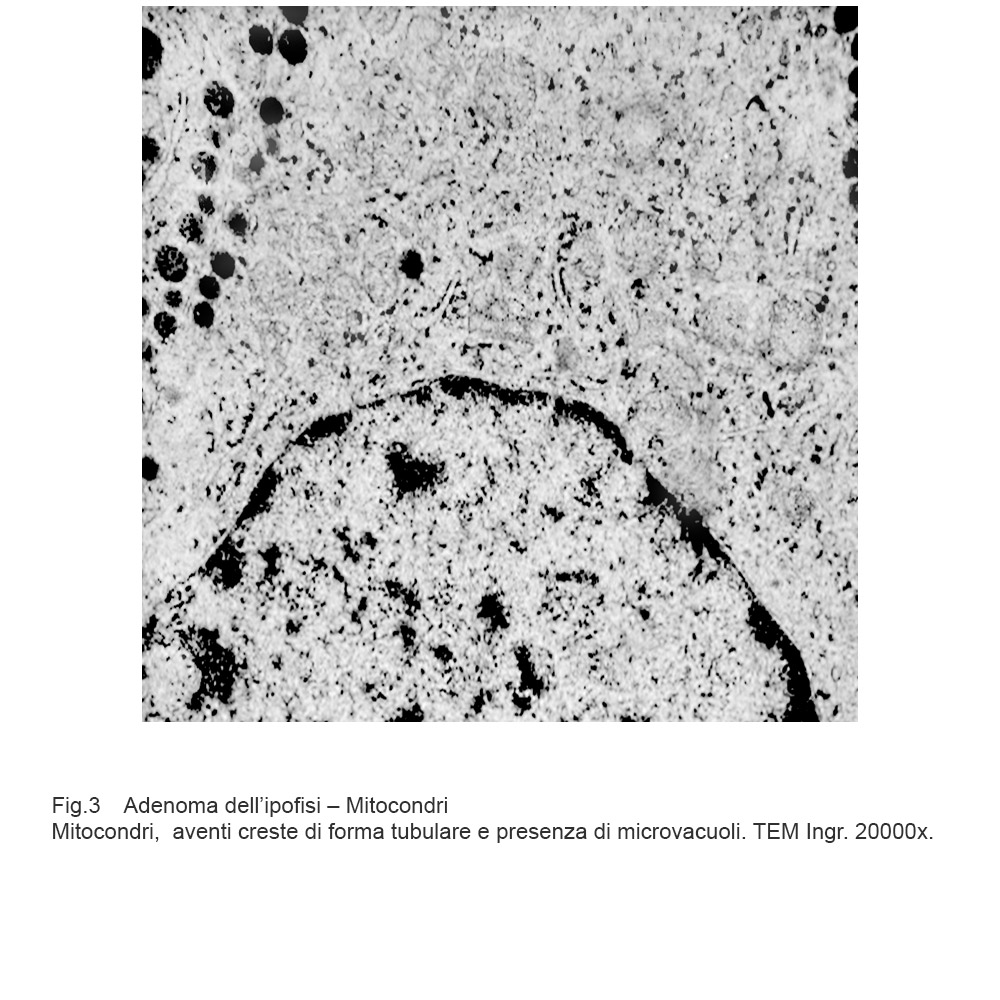 Fig.4
Fig.4 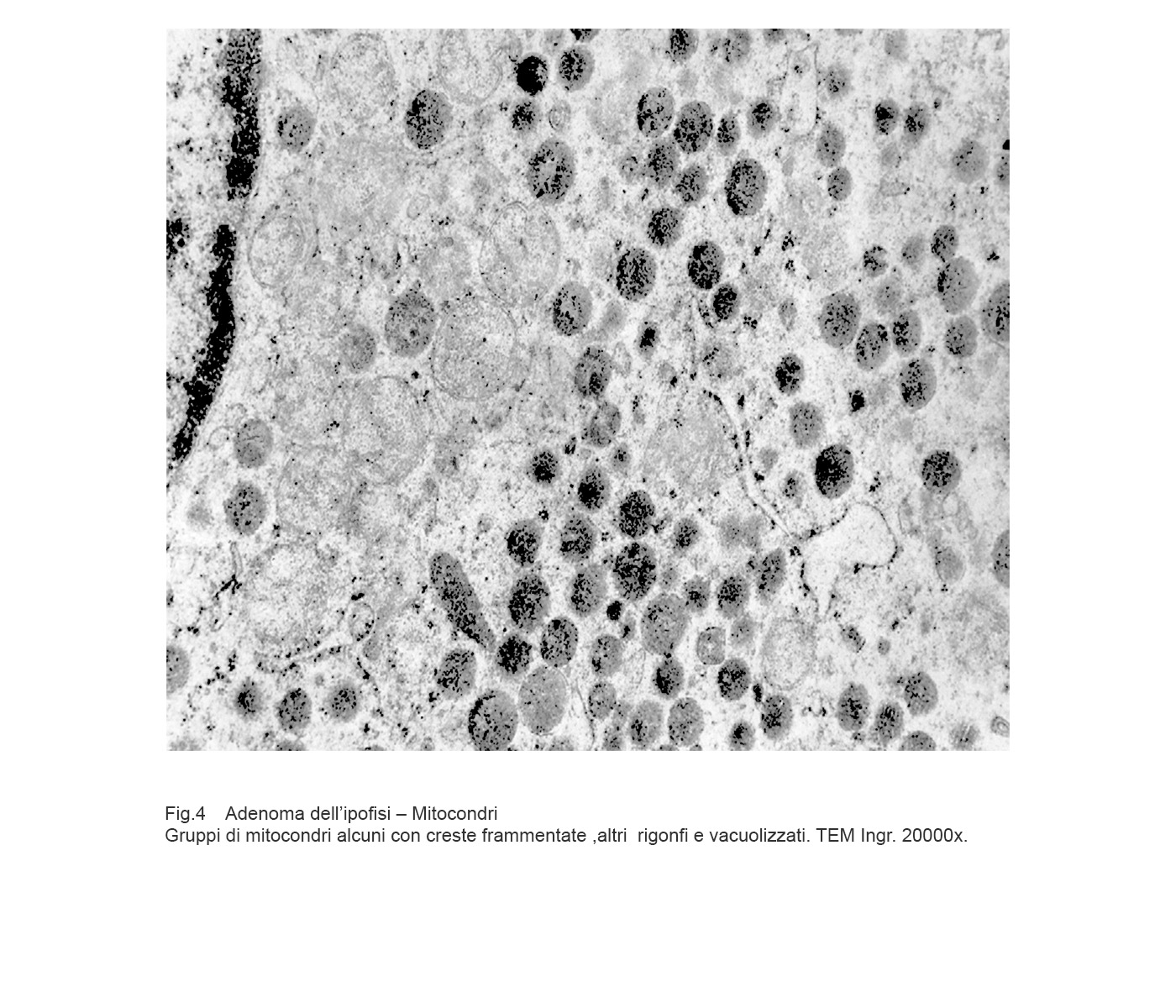
Mitocondri e R.E.: mitocondri con microvacuoli e depauperati di creste sono commisti a dilatazione micro-macrovacuolare del reticolo endoplasmico; alcuni di questi vacuoli sono occupati in modo parziale da materiale amorfo.
Fig.5 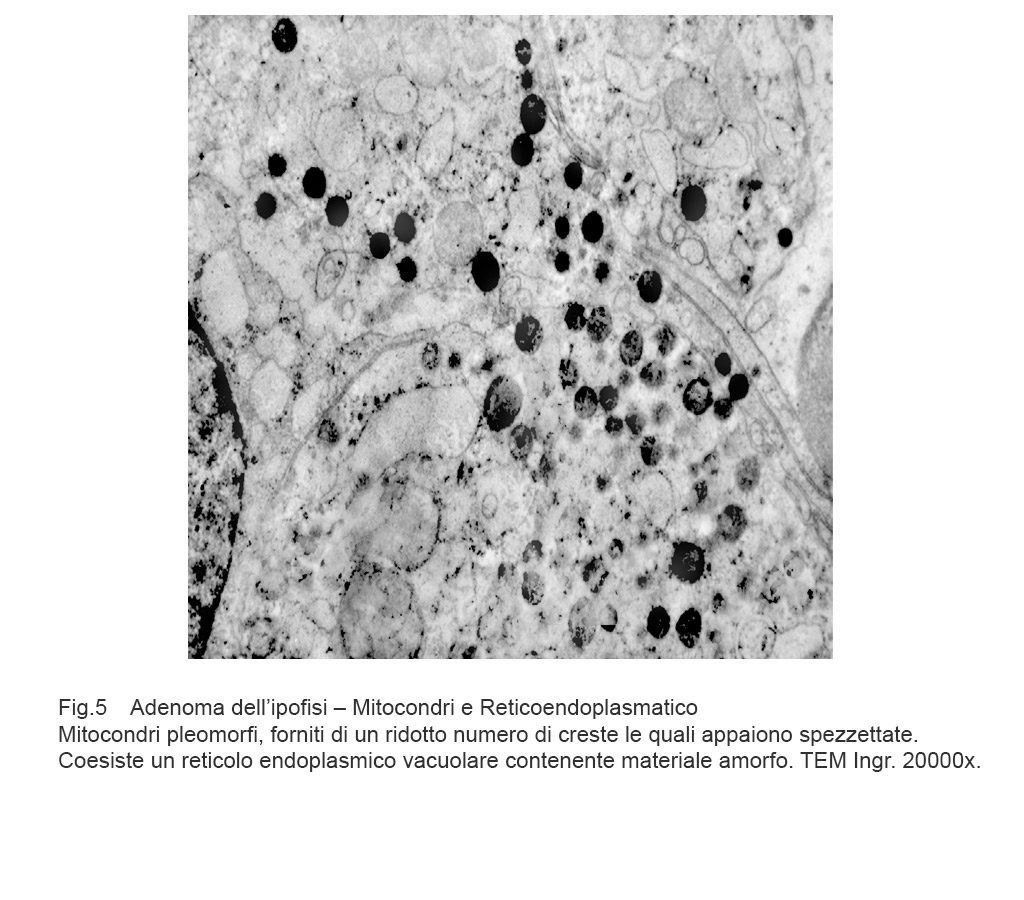 Fig.6
Fig.6 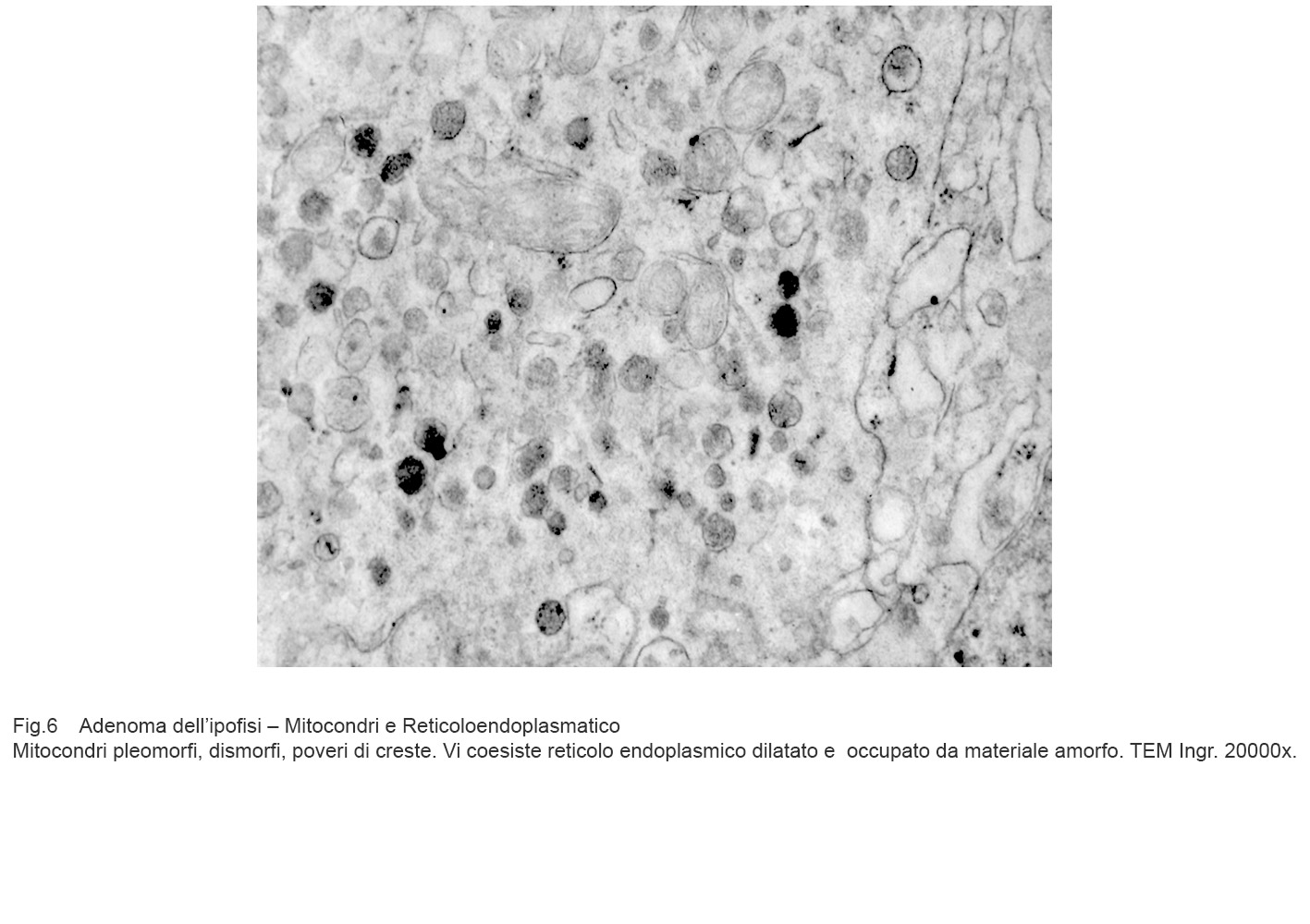
Mitocondri e R.E.: mitocondri rigonfi e privi di creste sono adiacenti ad ampia vacuolizzazione del reticolo endoplasmico; questi vacuoli sono frequentemente occupati da addensamenti di materiale amorfo e filamentoso(Reticoendoplasmatico in stato di stress).
Fig.7 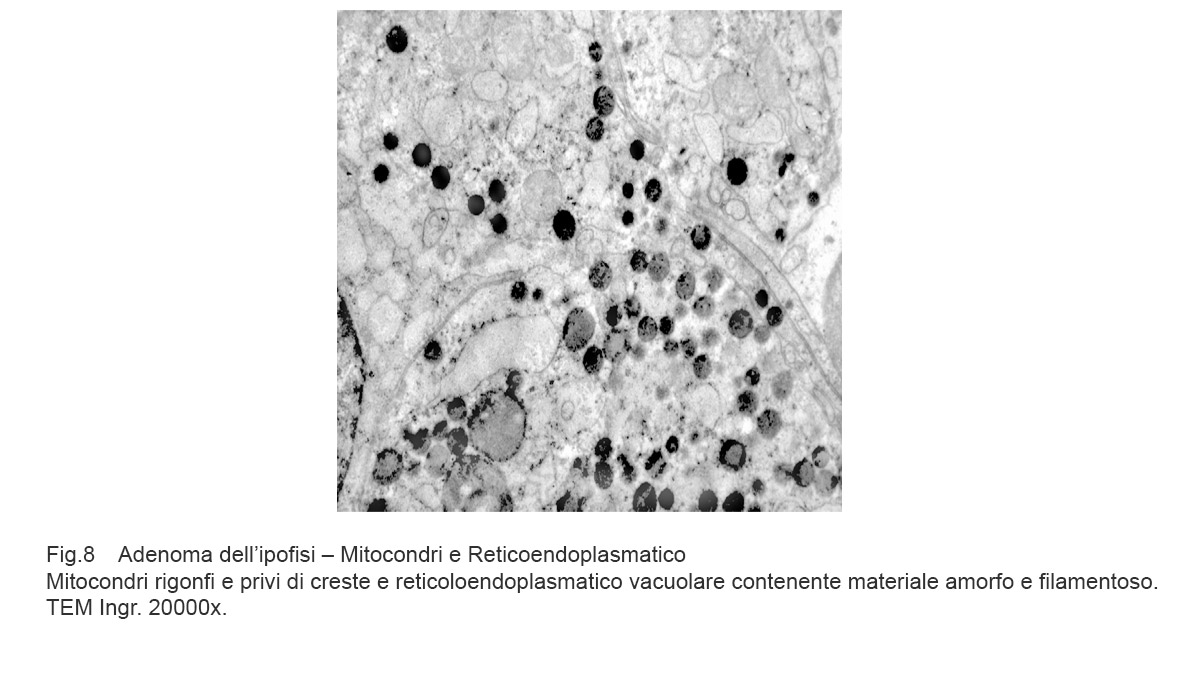
Mitocondri e R.E. : mitocondri piccoli con una quota ridotta di creste sono incestellati da un reticolo endoplasmico che si snoda a rete con aspetto lacunare.(Reticoloendoplasmatico in stato di stress).
Fig.8 
Vasta area citoplasmatica occupata da mitocondri privi di creste, vacuolizzati o in lisi per rottura della membrana esterna.
Fig.9 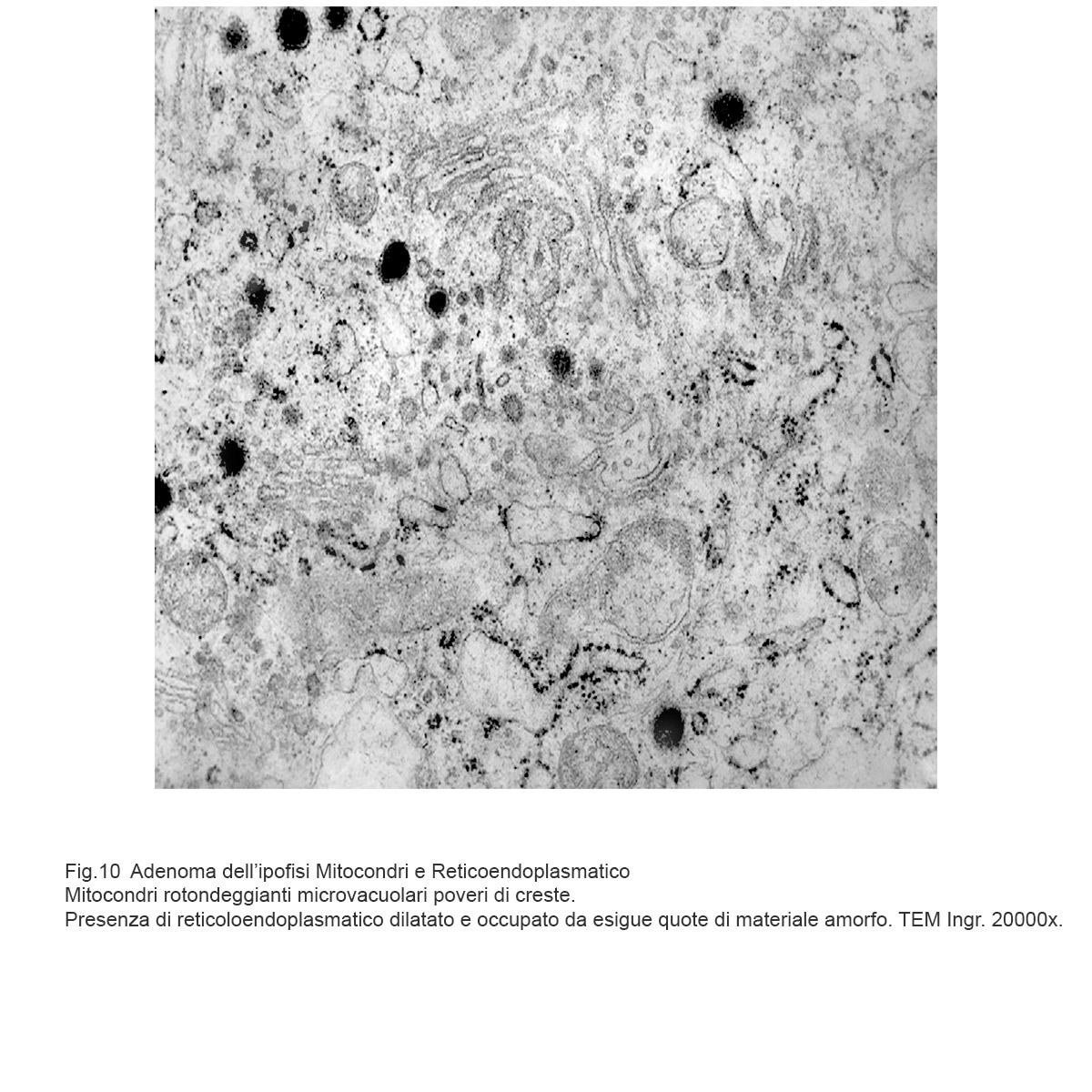
Mitocondri vacuolizzati commisti a focolai di micro-autofagia.
Fig.10 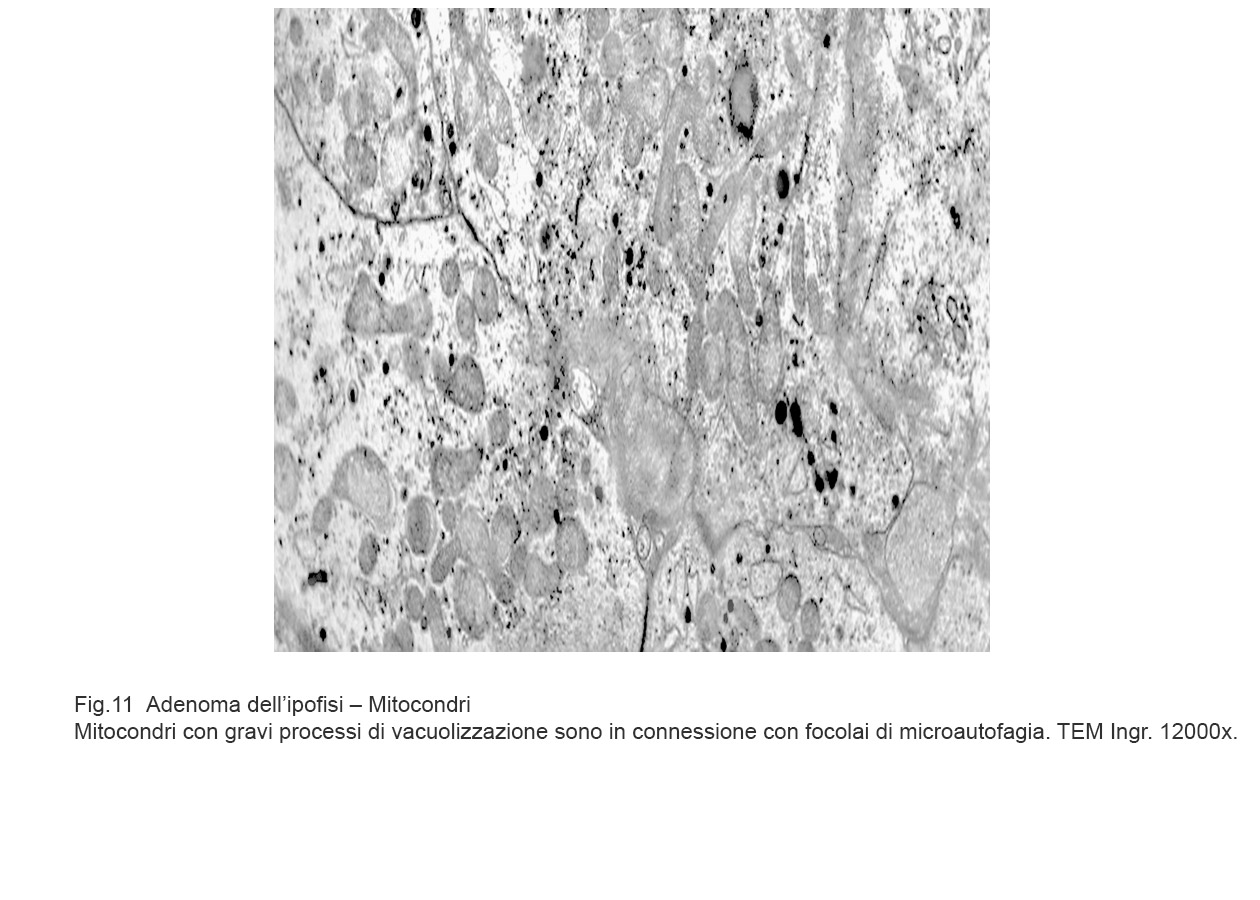
Mitocondri dismorfi accanto a un’area a livello della quale si va disegnando un abbozzo di struttura autofagica.
APOPTOSI
L’apoptosi è una morte cellulare programmata che si manifesta in tessuti o organi in condizioni di fisiologia o in condizioni di varia patologia.
L’apoptosi realizza l’omeostasi numerica delle cellule nei tessuti e negli organi; il suo indice di attività è strettamente correlato a quello proliferativo in modo da garantire finalisticamente il medesimo patrimonio cellulare a seconda della tipologia dei tessuti o organi;questa correlazione numerica non è semplicemente aritmetica ma è inscritta nel quadro di esigenze biologiche,geneticamente programmate,di adattabilità , di resistenza,di reattività a fattori o agenti imprevisti e/o dannosi.
I fattori che inducono l’apoptosi sono diversi Tra di essi si ricordano i fattori dell’embriogenesi, i fattori di crescita genetico- metabolici,gli ormoni, la chinasi della famiglia FHK che regola le connessioni cellula – cellula e cellula – matrice extracellulare,le sostanze tossiche,gli agenti infettivi,le radiazioni ionizzanti,i radicali liberi , i mitocondri disfunzionali, il reticolo- endoplasmatico in stato di stress,l’ ipossia,l’ ipertermia l’eccessivo accumulo di calcio,danni del DNA, eccessivo rilascio di citocromo C, squilibri tra proteine pro-apoptotiche e proteine anti-apoptotiche. (Progr. Mol. Biol. Transl,. Sci. 2015, 135, 407-22).
Reperti
La morfologia delle cellule apoptotiche è ben caratterizzata. Esse si riducono di volume, acquistano una forma sferoidale e perdono i contatti con gli elementi cellulari .
Questi cambiamenti morfologici sono correlati alla frammentazione del citoscheletro e alle alterazioni del nucleo che appare picnotico con blocchi di cromatina marginati a ridosso della membrana nucleare.
Gli organuli citoplasmatici sono sostanzialmente conservati, mentre sulla superficie della cellula si formano vescicole.
Fig.1 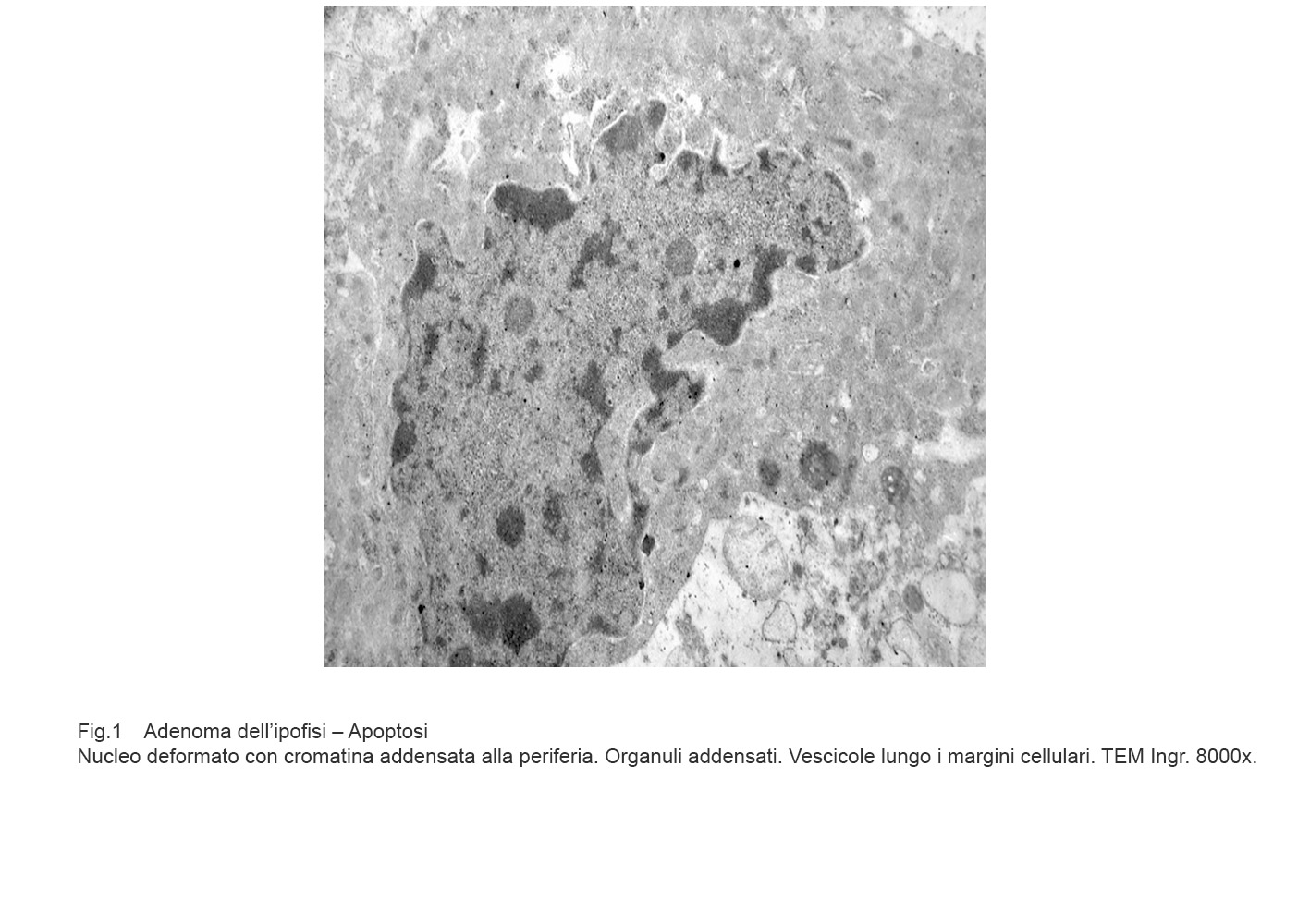
Infine si ha una globale frammentazione della cellula, in piccoli grumi denominati “corpi apoptotici”. L’insieme di questi componenti cellulari degradati sono fagocitati da macrofagi e tale operazione biologica non si accompagna a fenomeni di flogosi reattiva.
APPENDICE: NECROSI
La necrosi è un evento non programmato di morte cellulare; essa si manifesta attraverso fasi non controllabili di destrutturazione della cellula fino alla sua lisi.
Nel processo di necrosi, la cellula aumenta di volume, si rigonfia per il blocco delle pompe ioniche e conseguente penetrazione nel citosol di acqua e sodio.
Si ha il quadro di un processo vacuolare irreversibile pre-necrotico con disaggregazione dello assetto degli organuli intracitoplasmatici, grave rigonfiamento dei mitocondri, dilatazione abnorme delle cisterne del retico endoplasmatico, perdita dei ribosomi, disgregazione del nucleo per rottura della membrana nucleare.
Fig.2 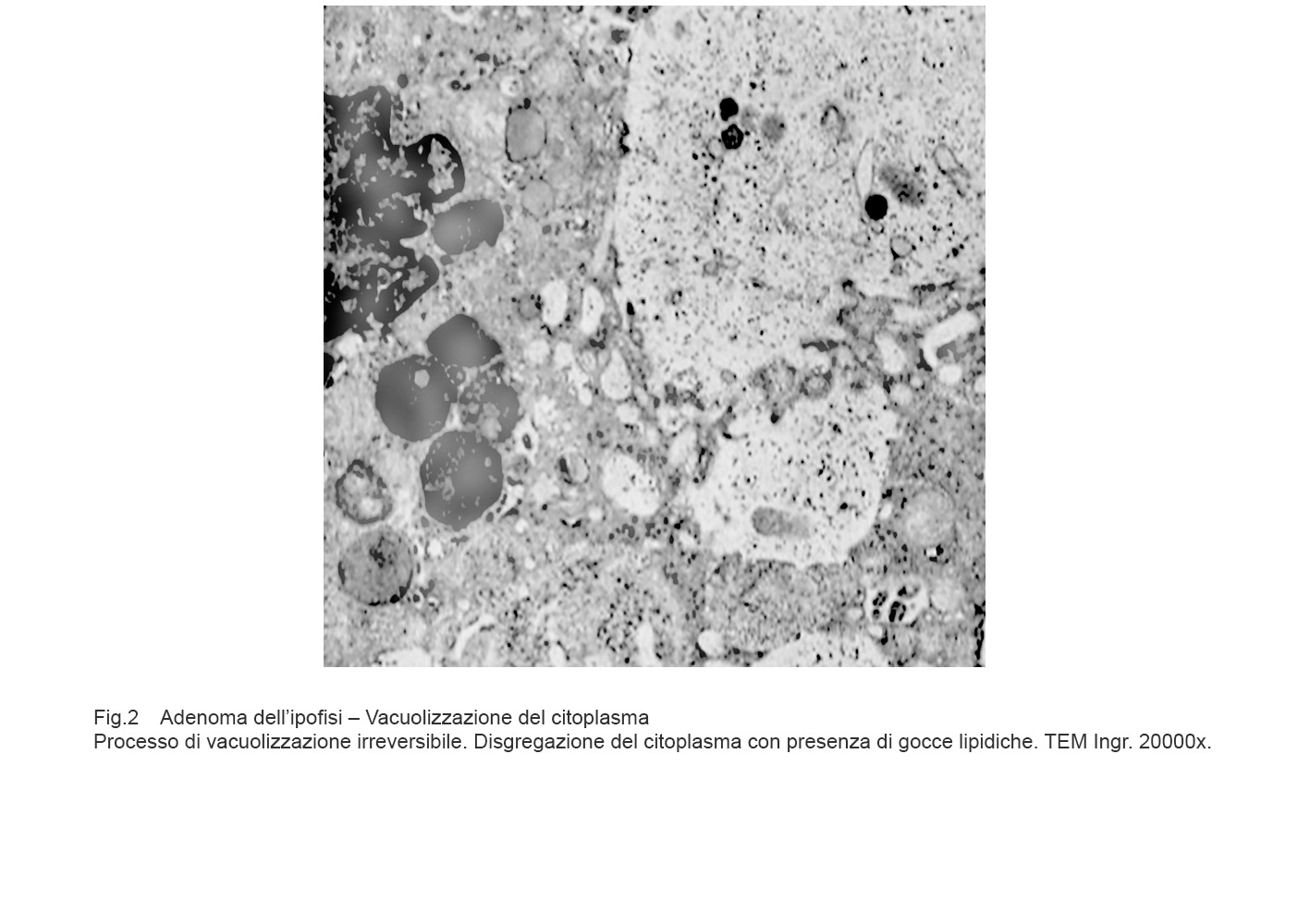
Tali eventi sono progressivi, si condizionano reciprocamente e si concludono con la frammentazione delle substrutture, rotture della membrana plasmatica e sversamento del contenuto negli spazi intercellulari.
Fig.3 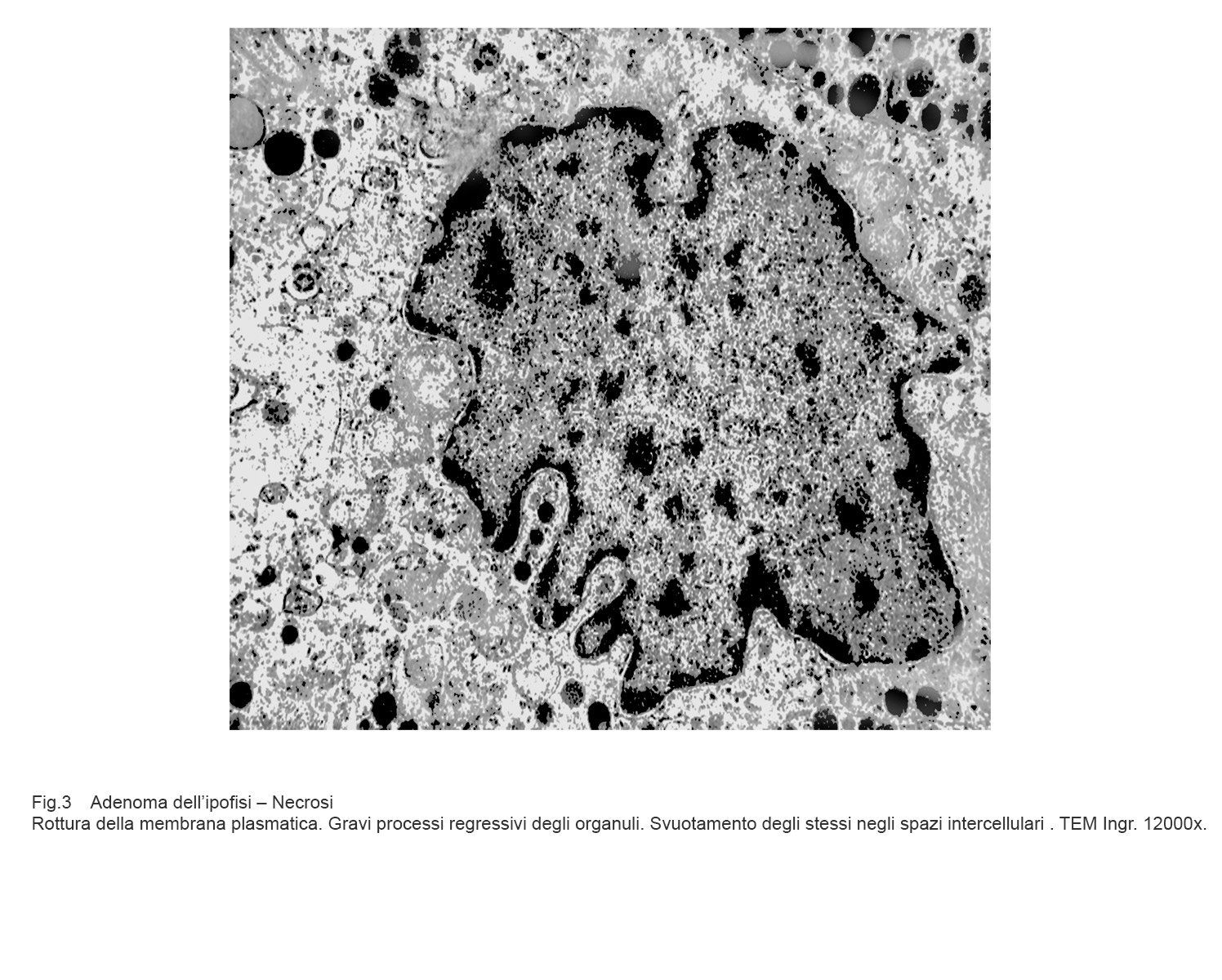 Fig.4
Fig.4 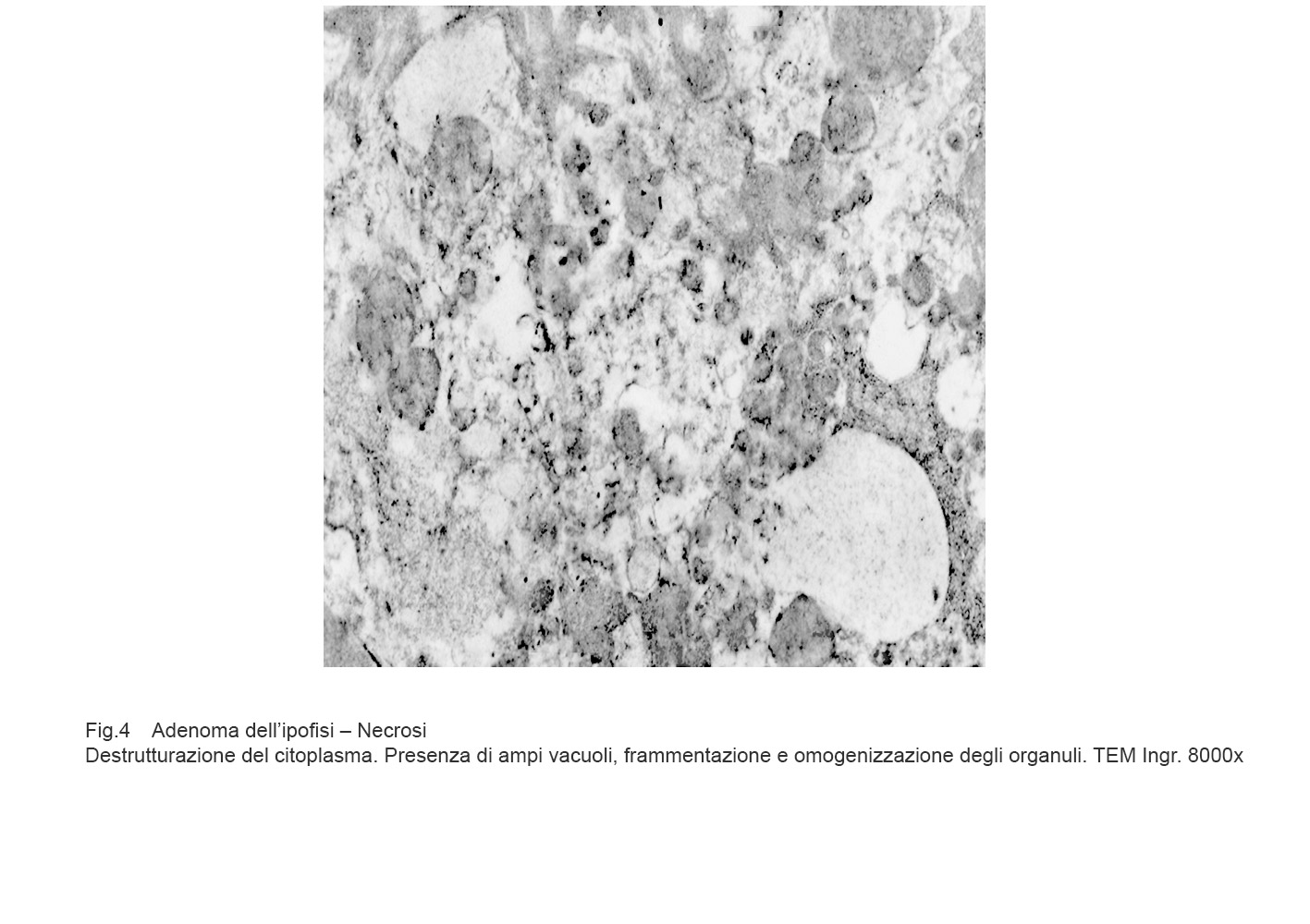
La presenza di enzimi lisosomiali in tale materiale in lisi provoca una risposta infiammatoria linfo-monocitaria con partecipazione di elementi macrofagici.

