Atresia delle vie biliari:
alterazioni mitocondriali, autofagia e autolisosomi
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica dell'Università della Campania "Luigi Vanvitelli"
INTRODUZIONE
L’atresia biliare è un processo fibro-infiammatorio progressivo dei dutti biliari extra epatici con il risultato dell’occlusione del loro lume, blocco del deflusso biliare, e danno cronico evolutivo del parenchima epatico. (Clin. Gastroenterol. Hepatol, 2011; 9 (4): 357-362).
In letteratura, sono descritte due forme di atresia biliare:
La prima è associata a malformazioni congenite quali l’asplenia, la polisplenia, difetti cardio-vascolari, siti inversi, malrotazione intestinale, anomalie della giunzione del dutto coledoco-pancreatico, anomalie di posizione della vena porta e dell’arteria epatica.
La seconda forma, comprendente il 90% dei casi, è caratterizzata da lesioni circoscritte alle strutture biliari extra-intra-epatiche (Archives of Pathlogy and Laboratory Medicine 2012; 136 (7): 746-760).
I casi riguardanti questa seconda forma si manifestano in diversi sottotipi; infatti sono descritte atresie limitate al dutto biliare comune, quelle costituite da cisti dell’ilo epatico comunicante con dutti intraepatici distrofici e quelle coinvolgenti in modo globale i dutti extraepatici (Orphanet J. Rare Dis 2006; 1: 28 doi – 1186/1750) (Nat. Rev. Gastroenterol. Hepatol. 2015; 12(6): 342-352).
Le alterazioni morfopatologiche del parenchima epatico in corso di atresia delle vie biliari non sono specifiche; esse rientrano nel composito quadro delle colestasi da cause ostruttive intra ed extraepatiche.
Questo quadro, ben noto, è progressivo e la sua dinamica dipende dalle situazioni anatomo-cliniche, dalle modalità dell’ostruzione che possono essere intermittenti, incomplete o complete.
Inoltre, i reperti istopatologici variano (nel contesto di un noto percorso patologico evolutivo ben scansionato) in rapporto al periodo in cui cade l’osservazione bioptica.
Se si prescinde da queste differenze strettamente legate al ritmo evolutivo della malattia, l’impianto patologico della “stasi” da colati è ben definito e coinvolge tutte le strutture del parenchima epatico.
Qui di seguito vengono ricordati in breve gli aspetti istopatologico più significativi di questa epatopatia da stasi di colati.
1) Gli spazi portali, nelle fasi iniziali della malattia sono slargati per uno stato di edema interstiziale e per la presenza di elementi flogistici rappresentati da monucleati e da rari neutrofili. Nelle fasi successive, ingravescenti, allo stato di edema subentra la neoformazione di fibrille collagene associata alla comparsa di fibroblasti e di macrofagi. Tutto ciò è l’espressione di un processo che si conclude con il quadro della fibrosi portale.
2) Le vie biliari intraepatiche sono in vario modo coinvolte nelle situazioni di colestasi. I canalicoli sono dilatati e mostrano un lume zaffato di materiale denso, compatto, costituito dai componenti della bile e da frammenti cellulari. Spesso sono circondati da più di due epatociti, formando così immagini “a rosette”.
3) I duttuli, soprattutto se sono in attività proliferativa, hanno lume dilatato e occupato da materiale biliare. Essi derivano da duttuli pre-esistenti o da epatociti che per un processo di metaplasia si sono rimodellati come duttuli (Archives of Pathology and Laboratory Medicine 2012; 136 (7): 746-760).
Ciascun duttulo è ben strutturato, è fornito di una membrana basale, è rivestito di una filiera di epiteli cubici che possono presentare fenomeni regressivi di tipo idropico-vacuolare. In sede periduttulare si raccolgono infiltrati flogistici rappresentati da elementi mononucleati e da qualche neutrofilo (Hystopathology 1993; 23: 590-596).
4) Anche i dutti sono dilatati, sono tortuosi e sono rivestiti da epiteli appiattiti, laminari in conseguenza del materiale biliare accumulato nel lume. Questi epiteli possono manifestare involuzioni regressivo-desquamative oppure fenomeni iperplastico-proliferativi. Lo stroma avvolgente i dutti è edematoso, è sede di focolai flogistici associati a processi di fibrillogenesi indotti da fibroblasti e da altre cellule mesenchimali attivate (Hystopathology 2012; 60: 236-248).
5) Gli epatociti sono particolarmente lesi nel corso della colestasi con reperti di tipo regressivo.necrotico associati a processi di flogosi di natura reattiva.
In gran numero gli epatociti, soprattutto quelli in sede periportale, appaiono voluminosi, rotondi con citoplasma diafano contenente materiale granuloso-pigmentato, rappresentato da aggregati di bilirubina.
Tra questi si ritrovano altri epatociti similari, ma differenziabili per contenere nel citoplasma diafano filamenti facilmente evidenziabili in quanto sono ricoperti da fini granuli pigmentati. Questo reperto, riscontrabile in situazioni di colestasi viene denominato “Degenerazione Piumosa”.
Oltre questi epatociti in fase regressiva, numerosi altri appaiono coartati, addensati per un processo di apoptosi oppure in disfacimento per fenomeni di necrosi. Questo processo di necrosi può riguardare singole unità nell’ambito di una lamina di epatociti, oppure può simultaneamente coinvolgere un gruppo di epatociti tra loro coesi. Si formano così microaree necrotiche, conosciute come “infarti biliari”. Ciascuna di esse si caratterizza per la presenza al centro di materiale biliare circondato da detriti di epatociti in necrosi. Queste microaree sono avvolte, frequentemente, da un sottile cercine costituito da elementi della flogosi.
Nella varietà degli epatociti in corso di colestasi, sono descritti alcuni epatociti contenenti nel citoplasma corpi densi, eosinofili, ipercolorati; questi sono conseguenti ad un processo di aggregazione di citocheratine alterate del citoscheletro; questi corpi sono indicati, in letteratura, come Corpi di Mallory-Denk. (Semin. Liver. Dis. 1986; 6: 199-211). (Exp. Cell Res. 2007; 313: 2033-2049).
In uno stato di colestasi prolungata, le condizioni di alterato trasporto intraepatocitario e di deflusso della bile, provoca una ritenzione di molecole di rame; questo metallo si aggrega a proteine e viene inglobato in lisosomi e rimanendo in loco forma aggregati insolubili di proteine e rame. (Gut 1976; 17: 787-790).
A fronte di epatociti regressivi, apoptosici,e necrotici, si repertano altri con caratteri iperplastici; questi sono voluminosi, giganti, hanno ampio citoplasma compatto e spesso sono bi-nucleati.
6) L’insieme di queste alterazioni degli epatociti porta a un rimaneggiamento microarchitettonico delle lamine epatiche con distruzione del sistema giunzionale dei canalicoli e con deconnessione degli epatociti tra loro.
Si ha la cancellazione della “biliary blood barrier” e rigurgito della bile dai canalicoli al polo sinusoidale con depositi di bile nel citoplasma delle cellule stellate e delle cellule di Kupffer. Infatti, in tali situazioni i sinusoidi sono “capillarizzati”, sono circondati da cellule stellate ipertrofiche e pigmentate e contengono nel loro lume volumisose cellule di Kupffer in attività macrofagica (Am. J. Pathol. 1998; 153 (2): 527-535).
7) L’insieme di questi processi (apoptosi, necrosi, fenomeni regressivi e iperplastici, flogosi asettica, neoformazione di fibrille pre-collagene e collagene) inducono un rimodellamento delle lamine degli epatociti e la formazione di “rosette ”; queste si riconoscono per la disposizione circolare di epatociti avente come punto centrale un canalicolo dilatato e ricolmo di materiale biliare (Liver 1989; 9: 43-51).
8) Nei processi colestatici cronici di lunga data il quadro istopatologico è complicato dalla presenza di tralci fibrosi che sepimentano in modo irregolare il parenchima epatico. Essi sono l’espressione conclusiva dei processi di sclerosi a livello portale e periportale e di quelli post flogistici a livello intralobulare.
Le conoscenze su i reperti istopatologici del fegato in corso di colestasi ostruttiva sono state acquisite mediante le osservazioni ottenute della microscopia luce; un ulteriore contributo alla conoscenza di questa patologia viene fornito dalla microscopia elettronica.
Questa metodologia consente di esplorare le sub- strutture degli epatociti,del polo sinusoidale e di quello biliare e attraverso i dati così acquisiti, procedere ad un approfondimento su i meccanismi patogenetici di tale complesso quadro morboso. Nel segno di questa finalità sono stati rivisitati alcuni aspetti di questa complessa patologia del fegato per cogliere nuove interpretazioni istogenetiche alla luce delle recenti acquisizioni di fisiopatologia epatica.
REPERTI
I reperti ultrastrutturali delle componenti del lobulo epatico in corso di atresia delle vie biliari non evidenziano caratteri di specificità. Si evidenziano alterazioni dei sinusoidi, dei canalicoli biliari e del citoplasma degli epatociti.
I reperti riscontrati saranno esposti in modo analitico secondo una descrizione morfologico-ultrastrutturale dei singoli comparti:
Gli endoteli dei sinusoidi sono rigonfi per edema e appaiono frastagliati. Le cellule di Kupffer contengono in un citoplasma vacuolizzato, diafano, molti lisosomi secondari. Le cellule stellate sono fornite di lunghe propaggini occupate da lisosomi secondari e da vacuoli delimitati da una membrana mono-stratificata.
Fig.1 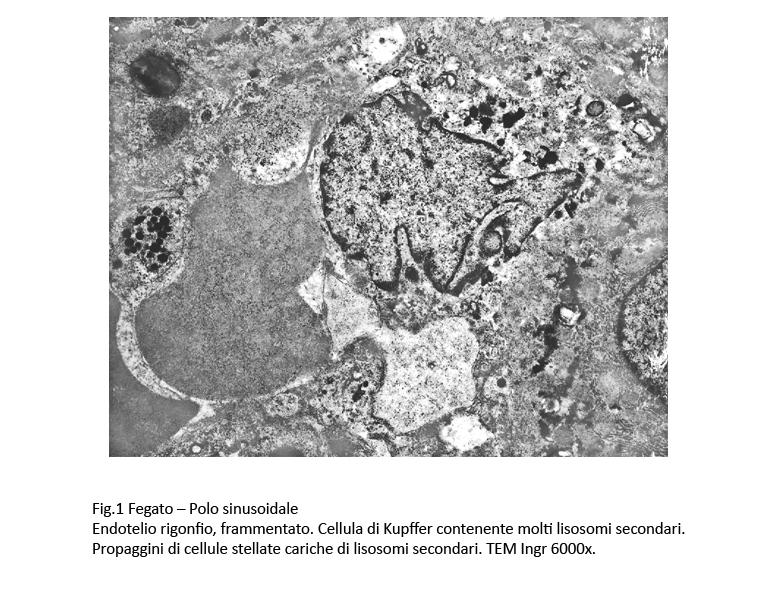 Fig.2
Fig.2 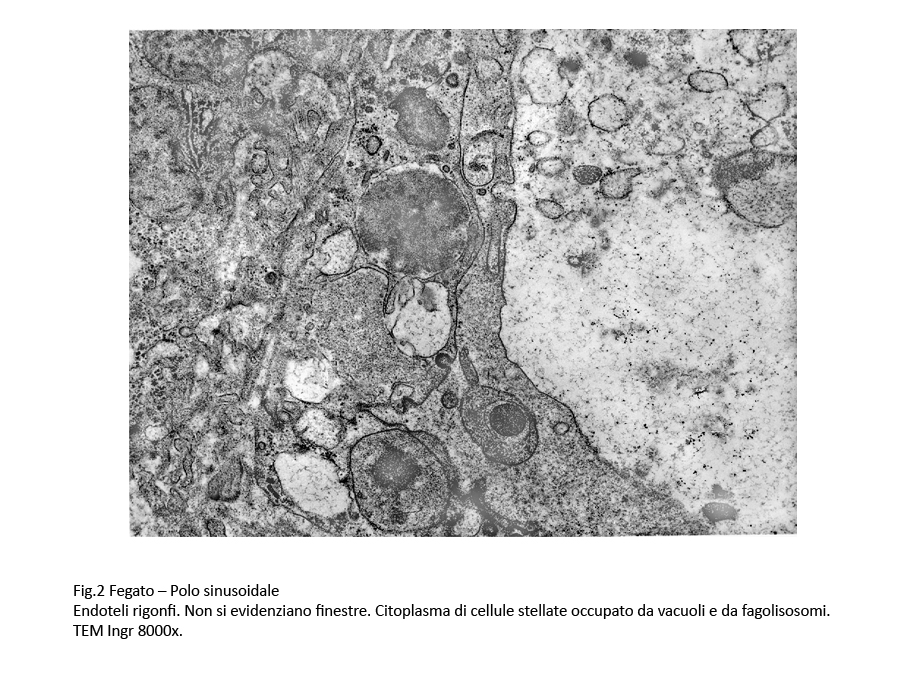
I canalicoli sono dilatati, hanno un profilo irregolare e sono privi di microvilli. La membrana dei canalicoli è discontinua e di conseguenza la componente peri-canalicolare affiora nel lume dei canalicoli.
In sede peri-canalicolare si repertano fasci di microfilamenti che presentano microaree di dissociazione e di frammentazione.
Fig.3 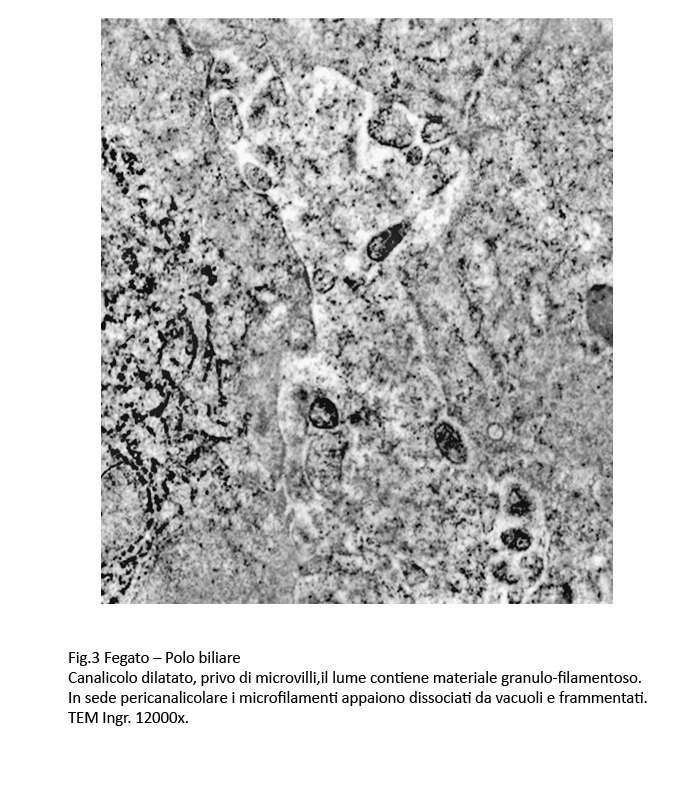 Fig.3bis
Fig.3bis 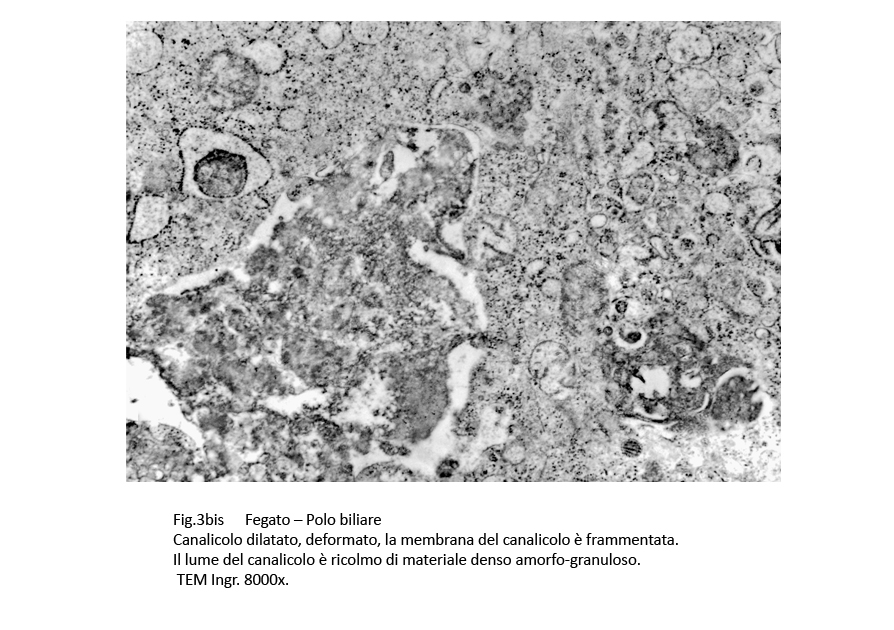 Fig.4
Fig.4 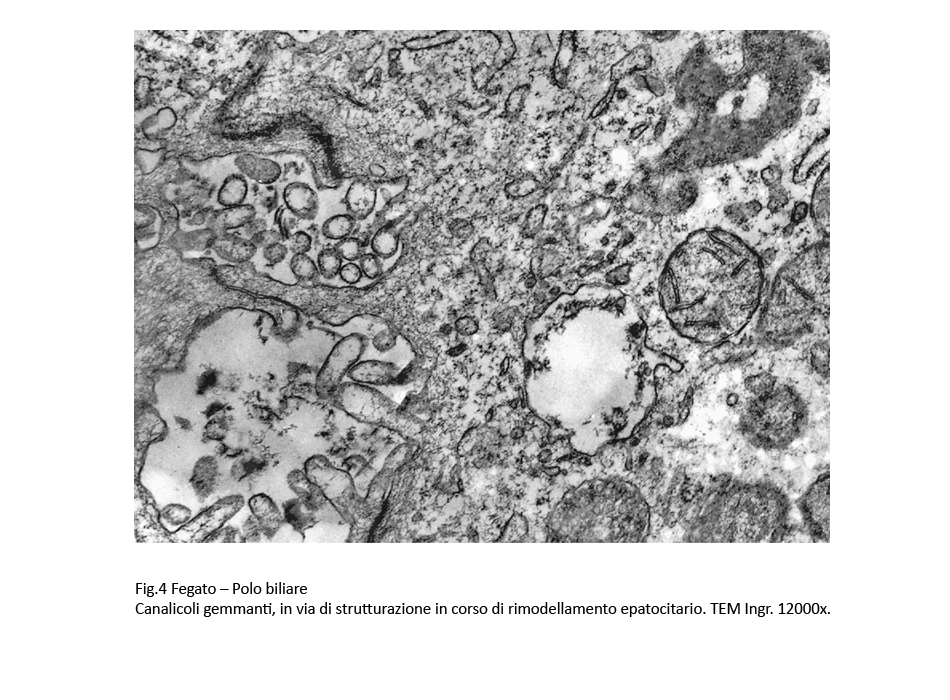
In alcuni canalicoli il sistema giunzionale è dis-aggregato con la formazione di un tragitto aperto tra lume del canalicolo, spazio inter-epatocitari,e percorso libero fino al polo sinusoidale.
Fig.5 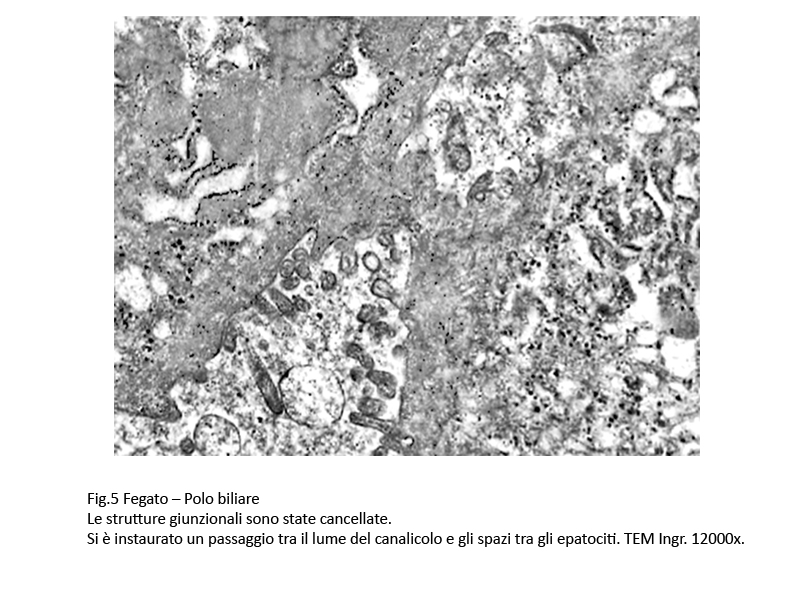
Di conseguenza la “bile-blood-barrier” è stata cancellata e si ha un incontrollato e continuo versamento di materiale biliare nel torrente circolatorio.
La coesione inter-epatocitaria è ridotta o è cancellata; ciò comporta la neoformazione di spazi più o meno ampi delimitati da epatociti deconnessi.
Questi spazi sono occupati da estroflessioni digitiformi vescicolose a partenza dal citoplasma degli epatociti e da materiale amorfo-granuloso.
Fig.6 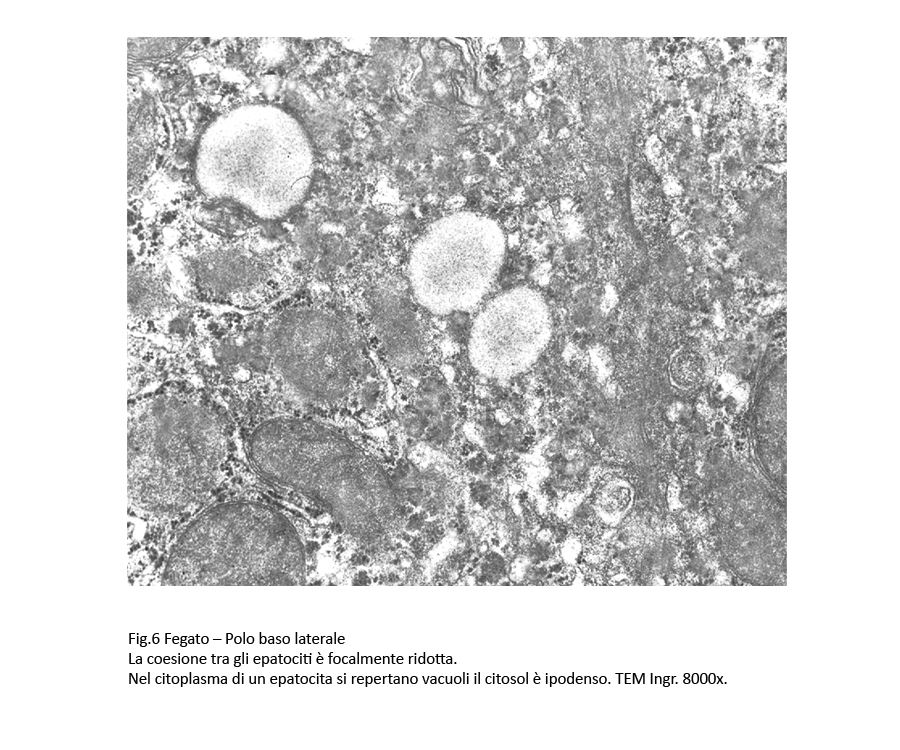 Fig.6bis
Fig.6bis 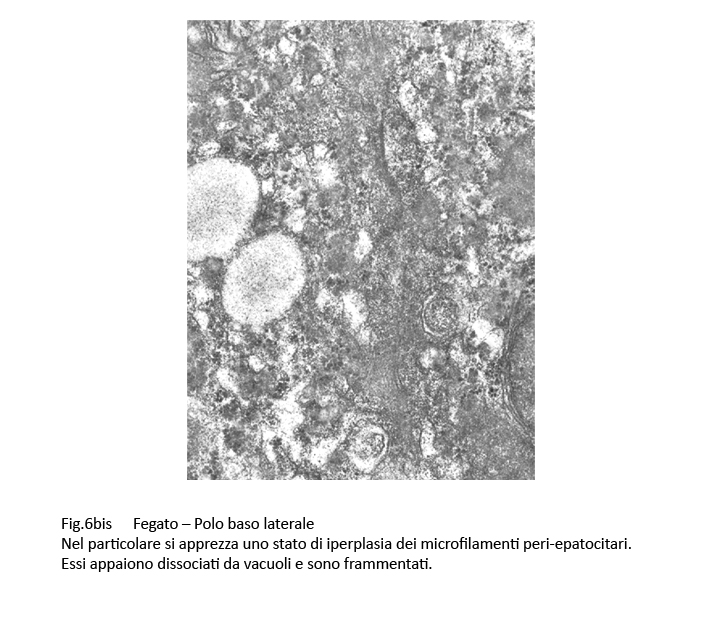
Fig.7 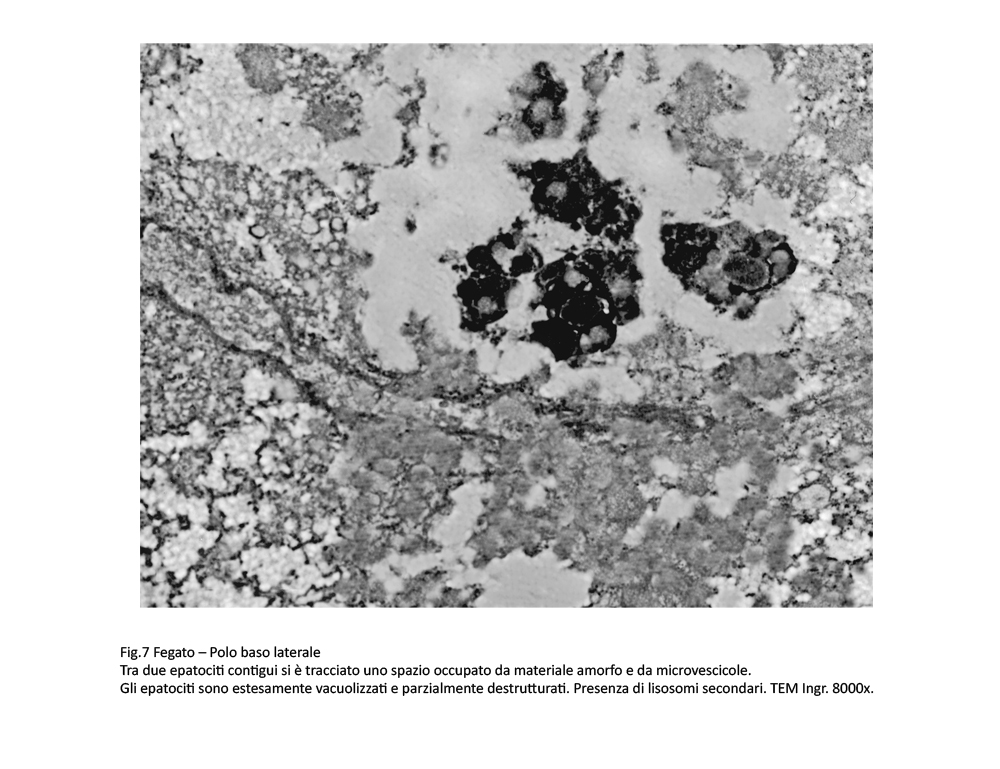 Fig.8
Fig.8 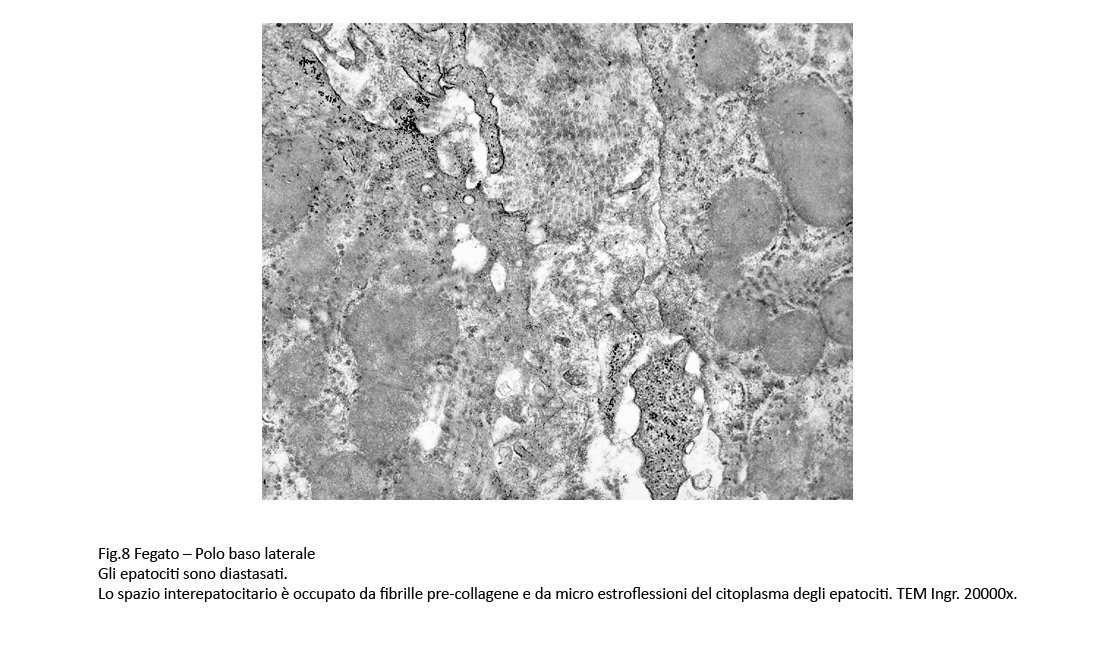
- Citoplasma degli epatociti
Il citoplasma degli epatociti è ricco di organelli e tra questi si riscontra una dominanza di lisosomi primari e secondari, di perossisomi, di corpi autofagici e di autofagolisosomi.
Fig.9 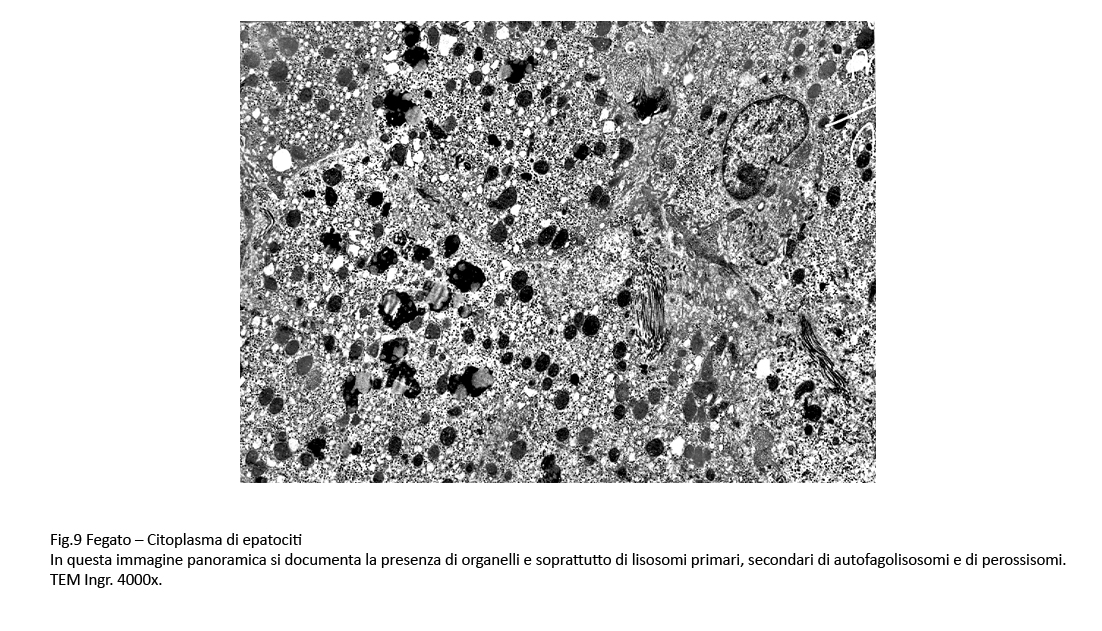
Nella descrizione, si metterà in evidenza, in modo analitico, le modificazioni morfologiche delle seguenti substrutture:
Nel citosol degli epatociti si ritrovano diversi corpi autofagici; questi hanno forma sferoidale, sono delimitati da una membrana a doppio contorno e contengono materiale biologico amorfo commisto a frammenti di organelli del citoplasma.
Fig.12 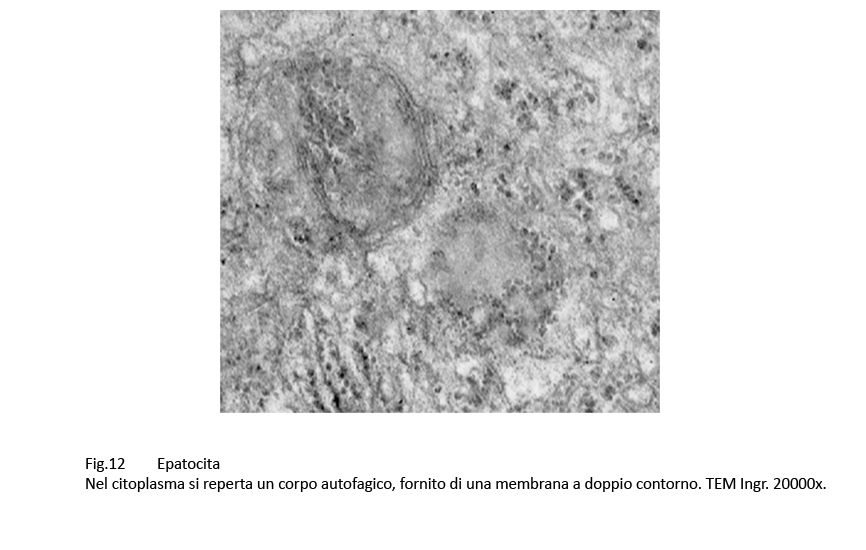 Fig.13
Fig.13 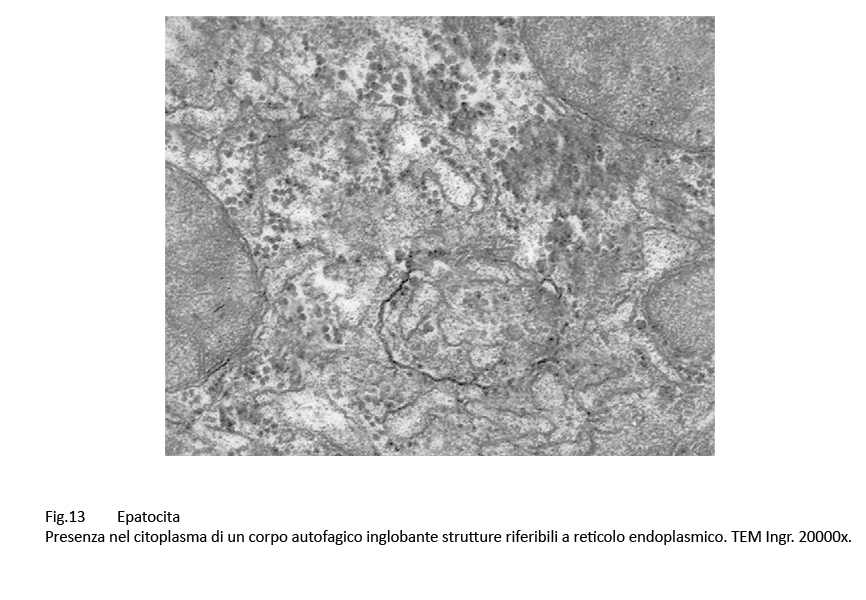
Si repertano numerosi lisosomi primari, secondari e perossisomi. Sono presenti diversi autofagolisosomi di varia forma e grandezza; essi sono delimitati da una membrana a monostrato e la loro morfologia è strutturalmente eterogenea ed appare anche variabile in rapporto alle fasi di demolizione del cargo da parte degli enzimi lisosomiali.
In alcune cellule il numero dei corpi di autofagolisosomi è numeroso tanto da occupare ampie zone del citoplasma; ciascuno di essi appare parzialmente o totalmente svuotato del proprio cargo.
Fig.14 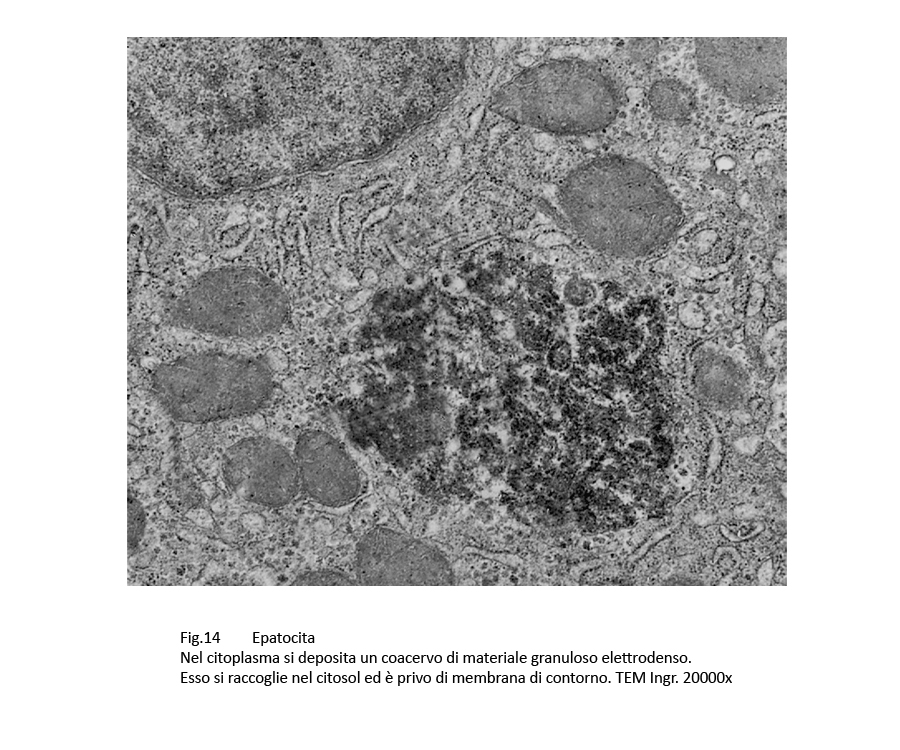 Fig.15
Fig.15 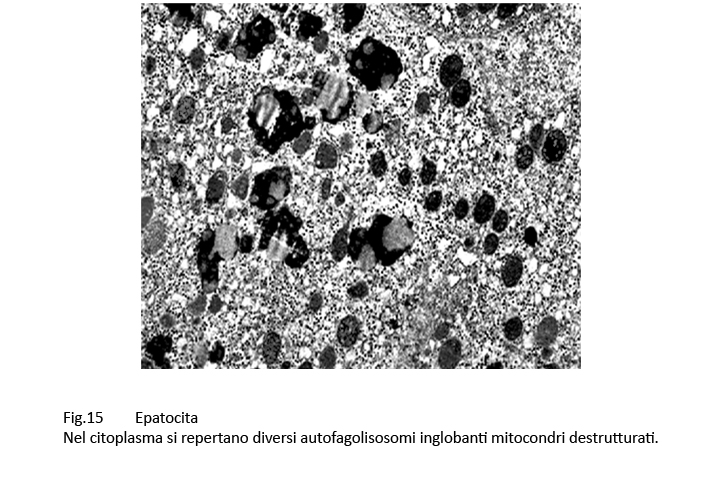
Fig.16 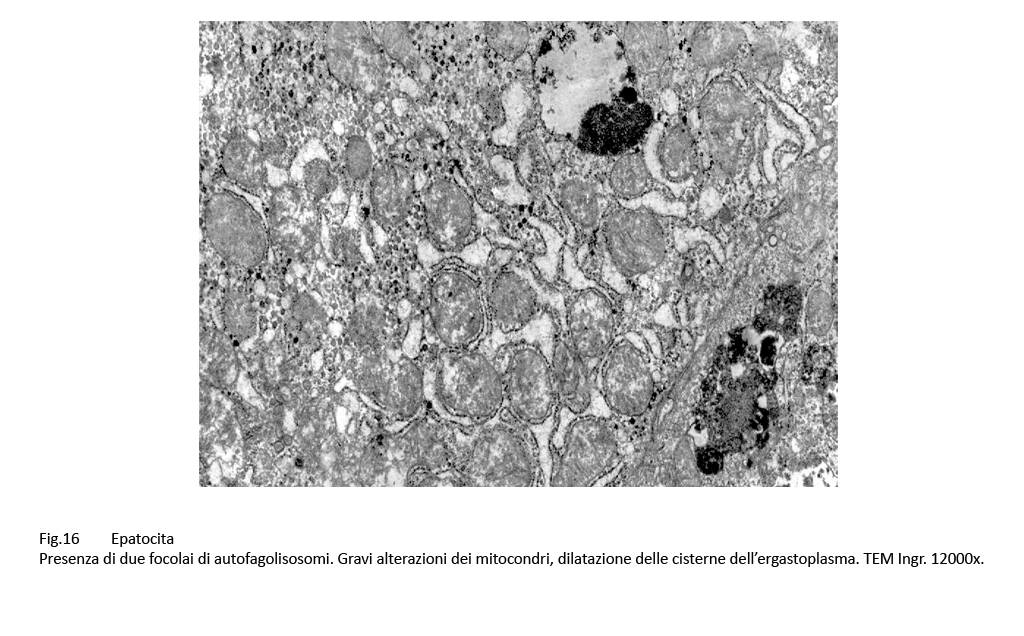 Fig.17
Fig.17 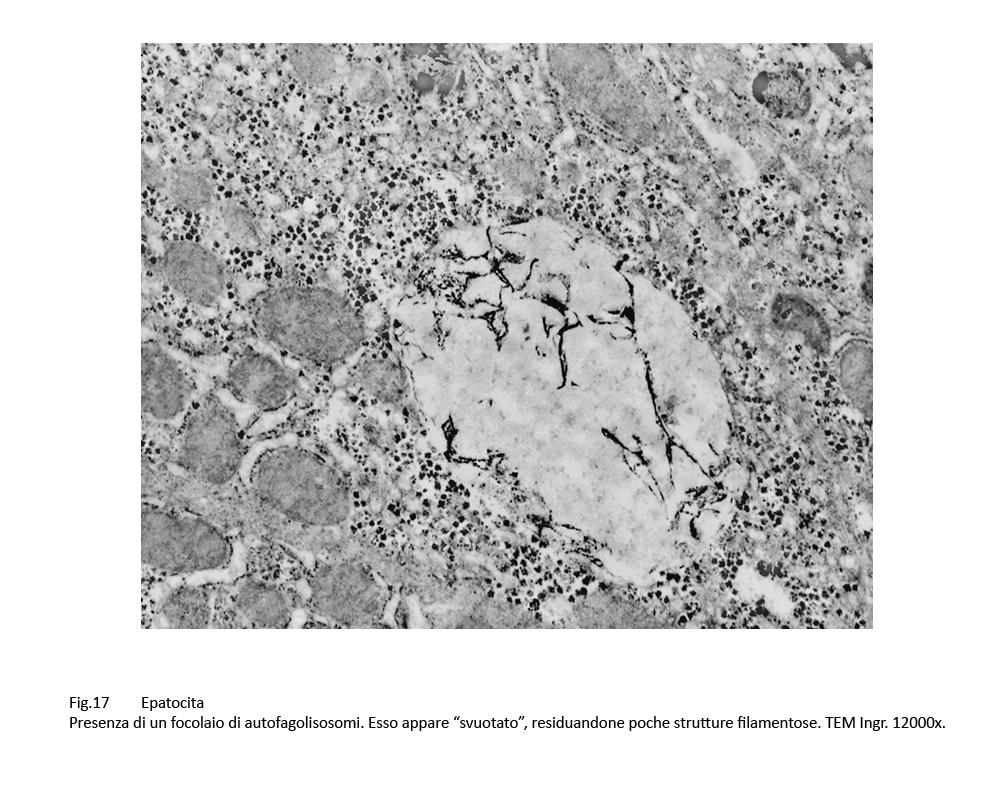
Fig.18 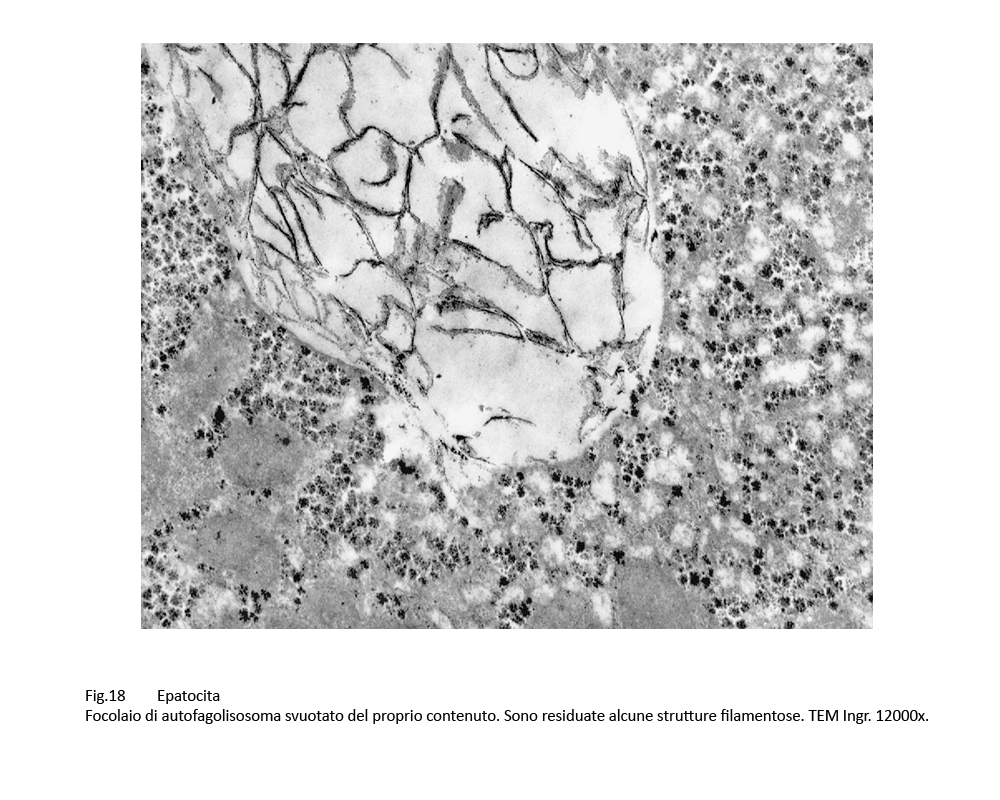 Fig.19
Fig.19 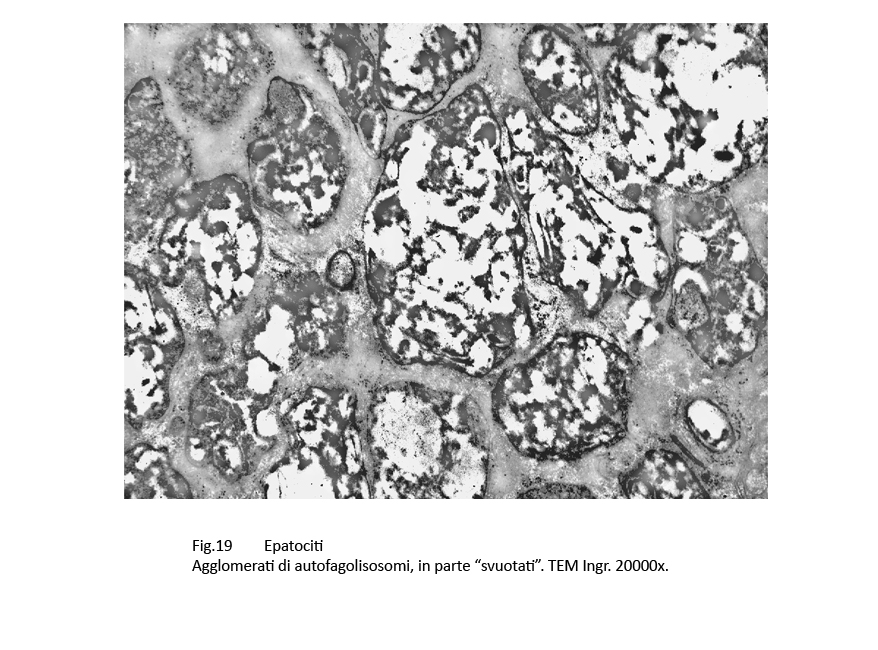
Fig.20 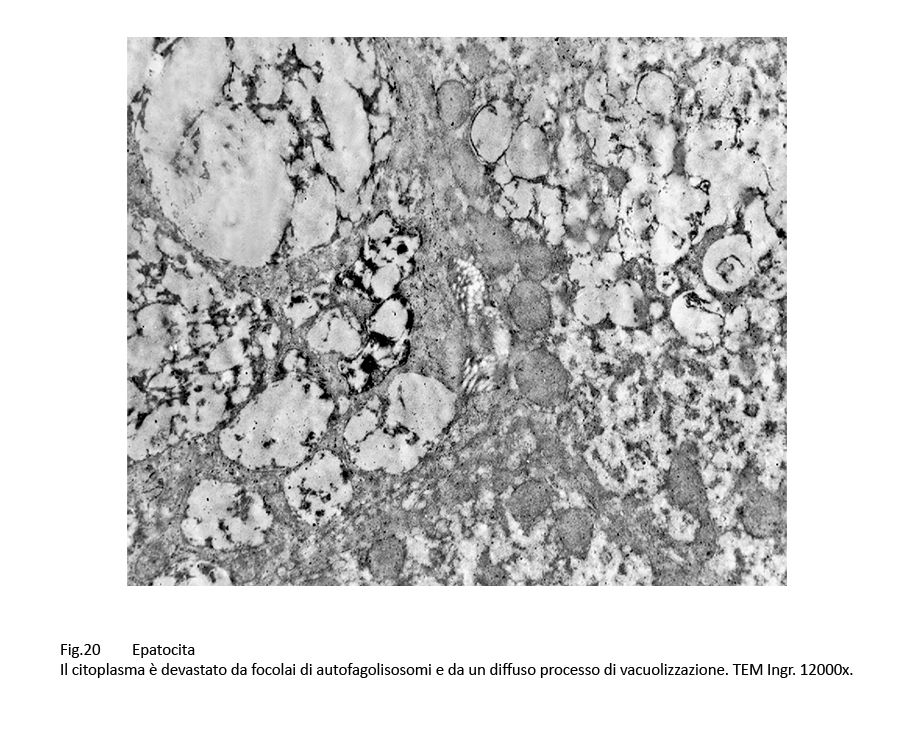 Fig.20bis
Fig.20bis 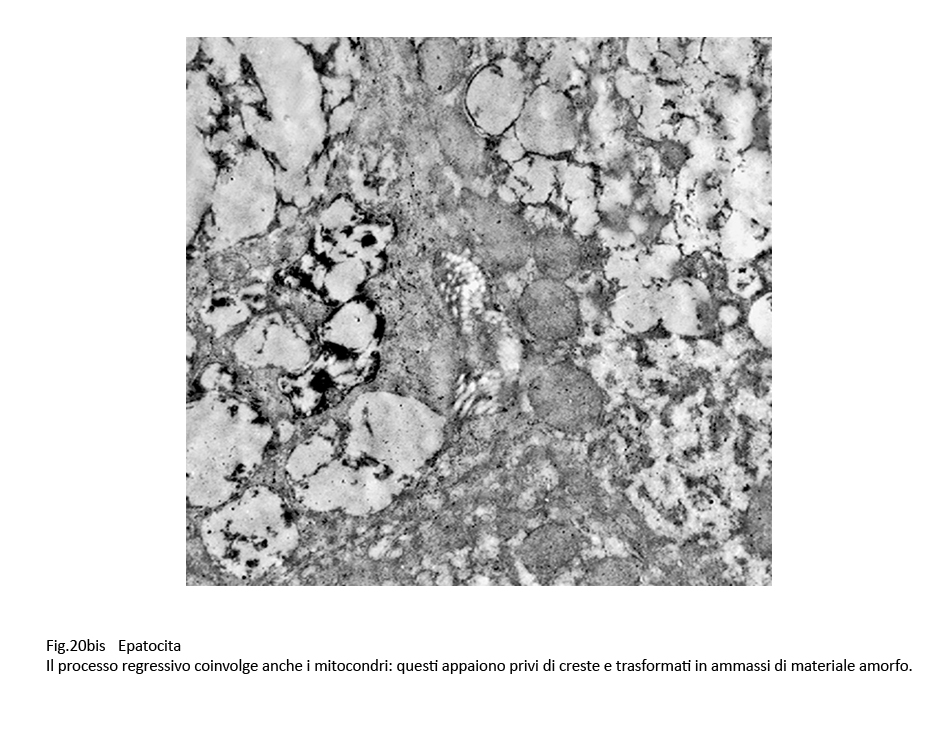
Nel contesto di queste strutture demolitive si repertano anche fagolisosomi il cui cargo è dato da mitocondri destrutturati(mitofagosomi).
Epatociti centrati da un nucleo addensato, deformato, coartato. Il citoplasma è interamente occupato da vescicole, vacuoli e corpi autofagici inglobanti materiale amorfo e granuloso.
Fig.21 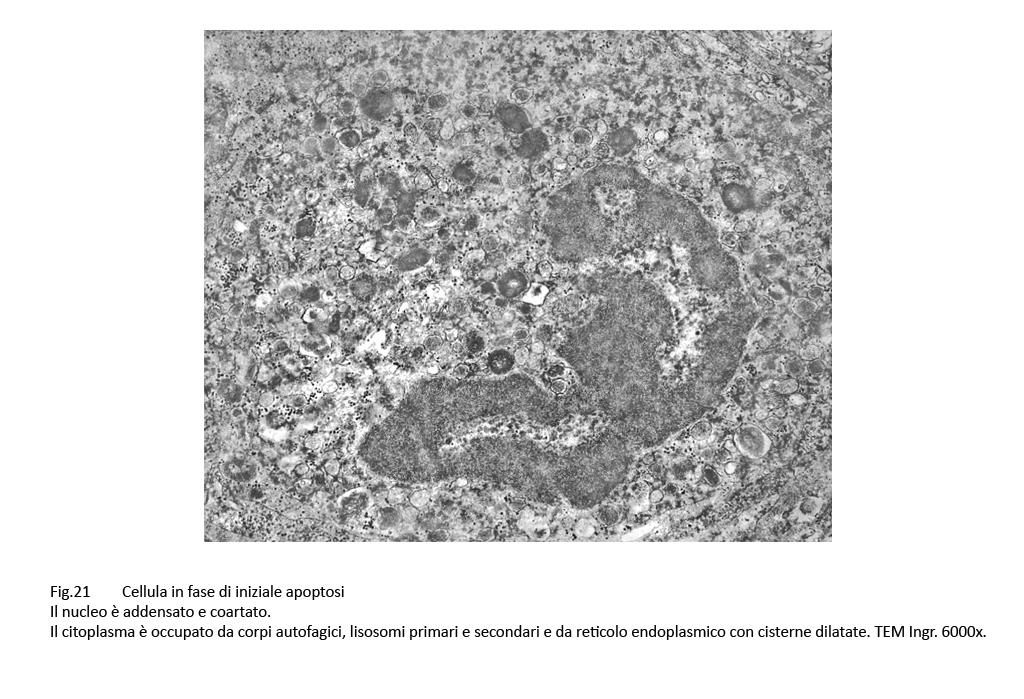
Si ritrovano, a ridosso degli epatociti, cellule mesenchimali voluminose, irregolari con diversi prolungamenti citoplasmatici. Il citoplasma, in associazioni agli abituali organelli, è sede di numerosi lisosomi e di autofagolisosomi.
Fig.22 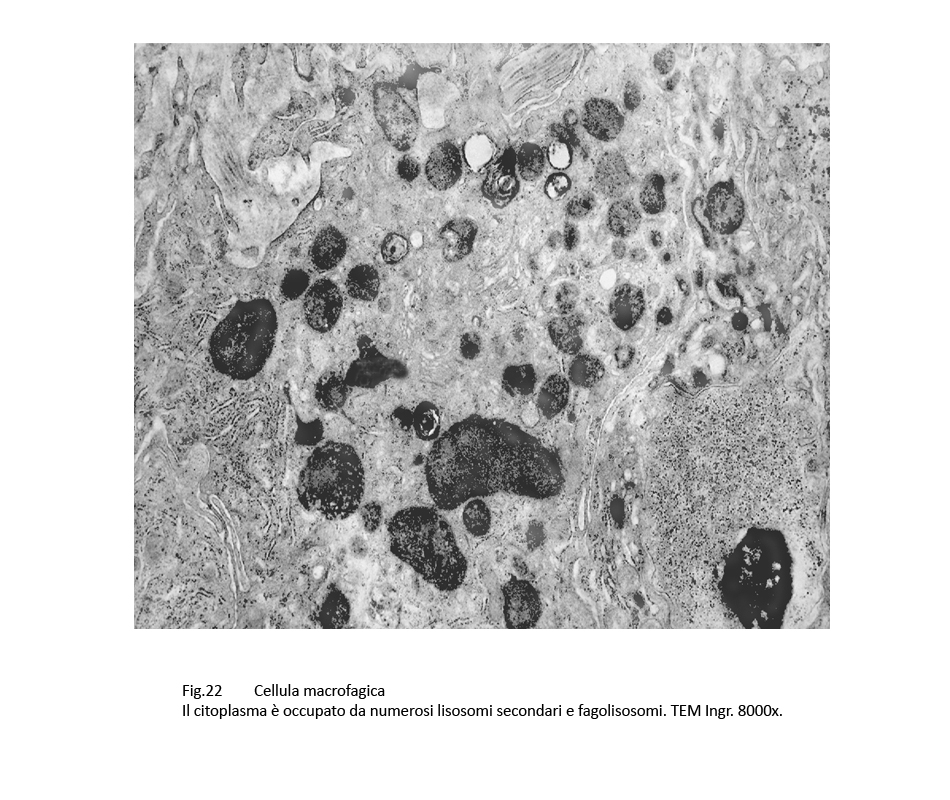
Il lume del colangiolo è slargato ed è occupato da materiale biliare addensato. I colangiociti appaiono rigonfi, hanno citosol ipodenso, contengono numerosi vacuoli e vescicoli sono sede di autolisosomi. Lo strato superficiale del citoplasma prospiciente il lume del colangiolo presenta foci di erosioni e di microulcerazioni.
COMMENTO
Il profilo morfologico delle colestasi ostruttive è ben definito e conosciuto. E’ possibile affermare che in tale composita e progressiva patologia si ritrovino due processi interdipendenti ed interattivi.
Il primo è rappresentato dal ristagno di prodotti biliari lungo le vie biliari con i fenomeni alterativi correlati, il secondo è dato dalle alterazioni degli epatociti con le sue manifestazioni di degenerazione piumosa, di infarti biliari, di apoptosi, di necrosi.
Le successive manifestazioni flogistiche evolventi verso la fibrosi rappresentano una risposta secondaria, reattiva al danno primitivo delle vie biliari e degli epatociti.
I reperti ottenuti al microscopio elettronico sono sovrapponibili a quelli già acquisiti mediante la microscopia luce, ma possono aggiungere alcune riflessioni utili per elaborare qualche spiegazione patogenetica circa il danno degli epatociti nel corso delle colestasi ostruttive.
I reperti degni di attenzione sono dati dallo stato dei mitocondri, dall’azione citopatogena degli acidi biliari e dalla presenza di focolai di autofagia e di autolisosomi.
1) Lo stato dei mitocondri, come è dianzi documentato, si rivela profondamente compromesso ed esso viene confermato ampiamente da quanto è riportato in letteratura.
E’ noto che i mitocondri nelle colestasi sono rigonfi, dismorfi, per una alterata permeabilizzazione della loro membrana esterna con perdita delle selettività di membrana (Anat. Rec. Hobeken 2012; 295(10): 1647-1659).
Questa perdita di permeabilità selettiva consente la penetrazione di soluti nei mitocondri e conseguente alterazione delle membrane interne, fino alla loro frammentazione e versamento nel citosol delle proteine mitocondriali.
Queste alterazioni si traducono a livello funzionale con una compromissione dell’assetto bioenergetico, con la perdita del potenziale di membrana e di ATP,con la riduzione dei processi ossidativi degli acidi grassi e a un aumento del ROS (Gastroenterology 1995;109:1249-1256) (Front. Biosci Elite Ed.) 2012; 4: 2233-2252).
L’insieme di questi processi provoca un alterato bilanciamento tra i processi ossidanti e quelli antiossidanti a livello dei mitocondri, capace di indurre uno stress ossidativo e una liberazione di mediatori favorenti la morte cellulare (Chang Gung Med J. 2009; 32(4): 346-353) (Methods Mol. Biol. 2019; 1981: 117-132).
E’ stato riportato in letteratura che accanto alle alterazioni mitocondriali dianzi descritte esiste anche una deplezione del DNA mitocondriale (mtDNA) e una riduzione di questo in rapporto al DNA nucleare. (J. Hepatol 1999; 30: 149-
2) Ai danni degli epatociti indotti da queste alterazioni mitocondriali,si associano una azione citotossica degli acidi biliari e in particolare quella degli acidi biliari glicocherodeossicolico (GCDCA) e taurochenodeossicolico (TCDCA). (Biochim. Biophys Acta 2013; 1828 (9): 2121-2133) (J. Biol Chem 2014; 289(49): 34074-34088).
Si ritiene che gli acidi biliari determinino alterazioni delle membrane mitocondriali, provochino riduzione dei fosfolipidi mitocondriali con rilascio di fattori pro-apoptotici e attivazioni delle caspasi (Hepatology 1994; 19: 471-479) (Hepatology 2001; 33: 616-626) (Toxicol Sci 2004; 79: 196-204) (Journal of Hepatology 2000; 32: 135-141).
Anche se ancora non si conoscono i meccanismi di azione degli acidi biliari tossici, né sono stati definiti i rapporti causali di queste molecole con le alterazioni epatiche nelle colestasi, viene asserito e sostenuto nella letteratura un ruolo importante degli stessi in tale patologia (J. Hepatol. 2017; 67(3): 619-631).
Si ritiene che questi acidi biliari tossici attivino fattori intrinseci nei mitocondri nel determinare le disfunzioni e inducono fattori estrinseci nel provocare l’apoptosi e la morte cellulare (Gastroenterology 2008; 134: 1641-1654).
Gli acidi biliari tossici attivano anche le cellule di Kupffer, stimolano l’arrivo di elementi della flogosi e provocano attraverso tali induzioni processi di fagocitosi. La attivazione delle cellule di Kupffer potenzia i processi flogistici mediante la secrezione di citochine e chemochine. (Front Biosci 2002; 7: 808-826) (Hepatology 2003; 38: 355-363) (Gastroenterology 2008; 134: 1655-1669).
3)Un altro aspetto dominante a livello degli epatociti nelle colestasi è dato dai focolai di autofagia e di autolisosomi.
E’ noto che l’autofagia svolge un ruolo centrale nel mantenere l’omeostasi delle cellule e nell’eliminare sostanze estranee o patogene.
Essa è stata osservata e documentata in vari tipi di stress citologico, di denutrizione, di lesioni, di organelli citoplasmatici, di aggregati abnormi, di proteine, di alterazioni metaboliche, di invasione di agenti patogeni.
Questo processo, esercita un controllo su gli organelli e i loro cicli biologici e provvede al recupero di aminoacidi, glucosio, acidi grassi, quali molecole sorgenti di energia e riutilizzabili in una nuova biosintesi (Cells 2019; 8(1): 16-24).
Nella formazione dei focolai di autofagia, le membrane a doppio contorno che delimitano i singoli focolai derivano da quelle appartenenti al reticolo endoplasmico, all’apparato del Golgi, a frammenti delle membrane plasmatiche, a endosomi o ad altri organelli (Curr. Opin. Cell Biol. 2018; 53: 29-36)
Il focolaio autofagico nel suo intrinseco dinamismo si accresce fino ad acquistare i caratteri dell’autofagosoma maturo; il successivo passaggio è rappresentato dalla sua fusione con un lisosoma (autolisosoma) mediante il quale si attivano le proteasi per la degradazione dei materiali sequestrati con successivo riciclo delle molecole nutrienti (J. Cell Sci 2017; 130: 1209-1216) (Autophagy 2018; 14: 207-215),
La sua attiva manifestazione è rappresentata dal sequestro di un cargo preselezionato, (rappresentato da organelli, da cumuli di proteine, da detriti cellulari, da agenti patogeni, da materiali estranei o degradati) il quale è sottoposto a un processo di demolizione mediante gli enzimi lisosomiali (Semin Liver Did 2018; 38(4): 308-319).
L’attività autofagica deve essere valutata tenendo conto delle condizioni fisiopatologiche della cellula ospite. Nei casi in cui esistano gravi compromissioni con processi evolventi verso la morte cellulare non è da escludere che l’autofagia contribuisca a provocare la morte cellulare (Int. J. Mol. Sci 2019; 20(2): 300-310)
Molto importante è l’autofagia selettiva che provvede ad eliminare solo gli organelli danneggiati (organellofagia), riciclando le molecole da essi ricavate per la rigenerazione di nuovi organelli (Nat. Cell. Biol. 2018; 20: 233-242). In tal modo l’autofagia selettiva promuove il turnover degli organelli intracellulari ed elimina proteine alterate o agenti patogeni; per questo ultimo motivo essa viene considerata la prima linea di difesa contro le infezioni (Cell Host Microb 2010; 7: 115-127).
L’autofagia selettiva può essere attivata da numerosi fattori causali come, per esempio, da uno stato di ipossia, da una condizione di ossigeno reattivo (ROS), da mitocondri depolarizzati o danneggiati, da agenti patogeni esterni. (Curr. Biol. 2018; 28: R170-R185).
L’autofagia è presente in molte malattie del fegato e tra queste nelle colestasi; in questa patologia il ruolo di questo processo rimane ancora da conoscere in modo esauriente (Int J. Med. Sci. 2019, 20 (2): 300) (Gastroenterology Hepatol. 2014; 11: 187-200) (Gastroenterology 2016; 150: 328-339).
A fronte di queste incertezze interpretative,i reperti istopatologici e ultrastrutturali evidenziano,nelle colestasi numerosi focolai di autofagia e di autofaolisosomi; si ritiene come verosimile che questi focolai siano l’espressione diretta e indiretta delle lesioni destruenti dei mitocondri e delle alterazioni degli organelli provocate dalla azione citotossica degli acidi biliari (Journal of Hepatoly 2017;67:619-631) (Biochem.Biophys. Pres. Commun.20184;4958(1):1541-1547.)
