L’astrocitoma diffuso è un tumore del sistema nervoso centrale, localizzato con maggiore incidenza a livello sopratentoriale; esso è a lenta crescita, è infiltrante ed ha una intrinseca tendenza a trasformarsi in astrocitoma anaplastico e successivamente in glioblastoma (WHO, 2007).
CARATTERI GENERALI
L’astrocitoma diffuso deriva da cellule astrocitarie ed è indovato molto frequentemente nel contesto della sostanza bianca dei lobi frontali e temporali e con frequenza bassa può prendere origine dai lobi occipitali, dal cervelletto, dal bulbo e dal midollo spinale.
Nel suo sviluppo infiltrativo può invadere il setto pellucido, i nuclei della base,e il corpo calloso;in questo ultimo caso può attraversarlo e penetrare nell’emisfero controlaterale; nei casi in cui la corteccia cerebrale è invasa a tutto spessore, le cellule neoplastiche, invadendo gli spazi sub-piali e sub-aracnoidali, possono essere drenate e diffondere per via liquorale.
Questa neoplasia ha un indice di attività molto basso,poichè rare sono le mitosi;essa si espande con modalità non infiltrante e non destruente; infatti, le cellule neoplastiche provocano da una parte compressione, dissociazione, deformazione delle microstrutture vicine, dall’altra si adattano agli spazi disponibili modificando il loro profilo morfologico; nell’ambito di tali aspetti fenomenologici si ritrovano anche immagini di satellitosi rappresentati da filiere cellulari neoplastiche avvolgenti vasi e neuroni.
Questo rispetto incompleto della micro-topografia delle aree colpite può essere cancellato e travolto dalla devianza in senso anaplastico (alto indice di attività proliferativa,atipie e neoangiogenesi) e dal sovrapporsi di fenomeni secondari quali necrosi, emorragie, flogosi, processi degenerativi.
Questo istotipo è fornito di una rete vascolare ben sviluppata e ben strutturata; questa si accresce in modo rapido ed irregolare allorquando si instaurano rapidi processi proliferativi in senso anaplastico e/o glioblastomatoso. Una valutazione semiquantitativa della componente vascolare aiuta a elaborare un giudizio prognostico; infatti, questo parametro assommato ad altri quali l’indice di proliferazione cellulare, le atipie nucleari, etc., consentono di tracciare in abbozzo una valutazione diagnostico-prognostica.
Nel contesto di un astrocitoma diffuso non è infrequente il reperire astrociti reattivi, soprattutto lungo le fasce periferiche della neoplasia, oppure neuroni e fibre nervose intrappolate tra le cellule della neoplasia; sono stati rilevate anche cellule macrofagiche ed elementi immunocompetenti negli interstizi e in sede perivascolare. Ancora è riportato in letteratura la esistenza di quote di cellule microgliali reattive nel contesto di astrocitomi gemistocitici. (Neurosurgery, 2007, 60, 159-68).
L’esame morfologico degli astrocitomi diffusi richiede indagini analitiche macro e microscopiche. La neoplasia in esame deve essere globalmente sottoposta a tagli seriali e da ciascuno di questi frammenti è necessario allestire numerose sezioni microtomiche sia per la istopatologia di base sia per le indagini di immunoistochimica e di genetica Questa mappatura è necessaria per verificare la eventuale esistenza di focolai cellulari aventi i caratteri dell’anaplasia o del glioblastoma.
Questa procedura permette una visione globale della neoplasia documentando la eventuale presenza di micro-macrocisti, di necrosi, del numero di mitosi, delle atipie nucleari, del polimorfismo cellulare, dei livelli di neoangiogenesi, della esistenza di processi secondari, degli eventuali fenomeni di devianza in senso anaplastico. Questo insieme di dati permette di elaborare sia un giudizio diagnostico sia una valutazione prognostica.
La letteratura sul tema riconosce l’articolazione delle seguenti varianti dell’ astrocitoma diffuso (grado II) :
-
-
1. Astrocitoma fibrillare
2. Astrocitoma gemistocitico
3. Astrocitoma protoplasmatico
ASTROCITOMA FIBRILLARE
La neoplasia ha limiti sfumati o indistinti e pertanto essi sono tracciabili con difficoltà; il suo colore è bianco, bianco giallastro con eventuali focolai di colore rosso in conseguenza di emorragie.
La consistenza è sostenuta con possibili variazioni da zona a zona nell’ambito dello stesso reperto per il riscontro di aree mollicce per processi degenerativi oppure per la presenza di foci duri conseguenti a depositi di sali di calcio.
Al taglio, le superfici di sezione sono uniformi e compatte oppure sono sedi di micro-macrocisti contenenti liquido serioso o siero-mucinoso; queste cavitazioni non evidenziano pareti proprie e mostrano i caratteri di escavazioni casuali nell’ambito della neoplasia.
Quando la corteccia cerebrale è infiltrata a tutto spessore dalla neoplasia, si rileva una sua deformazione, per processi di ispessimento, di aumentata consistenza e di volumetria. Anche gli spazi sub-piali e sub-aracnoidali- si possono presentare slargati e imbottiti di cellule neoplastiche con possibili fenomeni di drenaggio lungo le vie liquorali.
Se l’esame macroscopico evidenzia aree rosso-emorragiche e zone colliquate per necrosi il giudizio diagnostico prende in considerazione una eventuale presenza di processi anaplastici o glioblastomatosici.
Caratteri istopatologici
La variante fibrillare dell’astrocitoma diffuso ha una densità cellulare moderata con diversificazioni da zona a zona nell’ambito dello stessa formazione neoplastica .
Si repertano micro-aree ipodense, occupate da pochi astrociti ed altre iperdense con aggregazione tra loro a mutuo contatto .
Il citotipo di base è rappresentato da cellule con lunghi, sottili, flessuosi prolungamenti che si dipartono da un corpo cellulare il quale è fornito di scarso citoplasma eosinofilo ed è occupato da un nucleo sferoidale, normo-cromatinico, apparentemente privo di nucleolo.
Fig.1 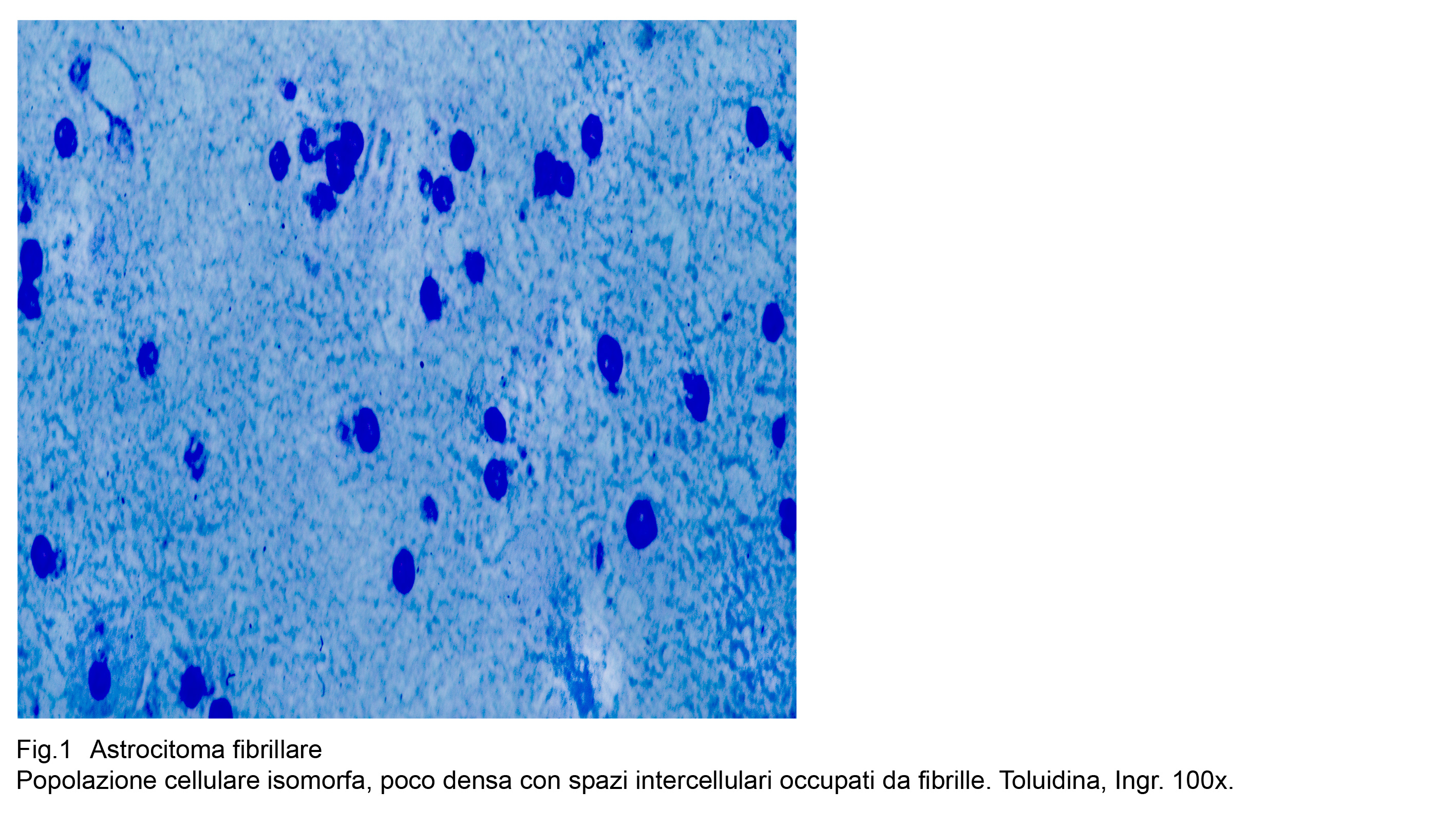 Fig.2
Fig.2 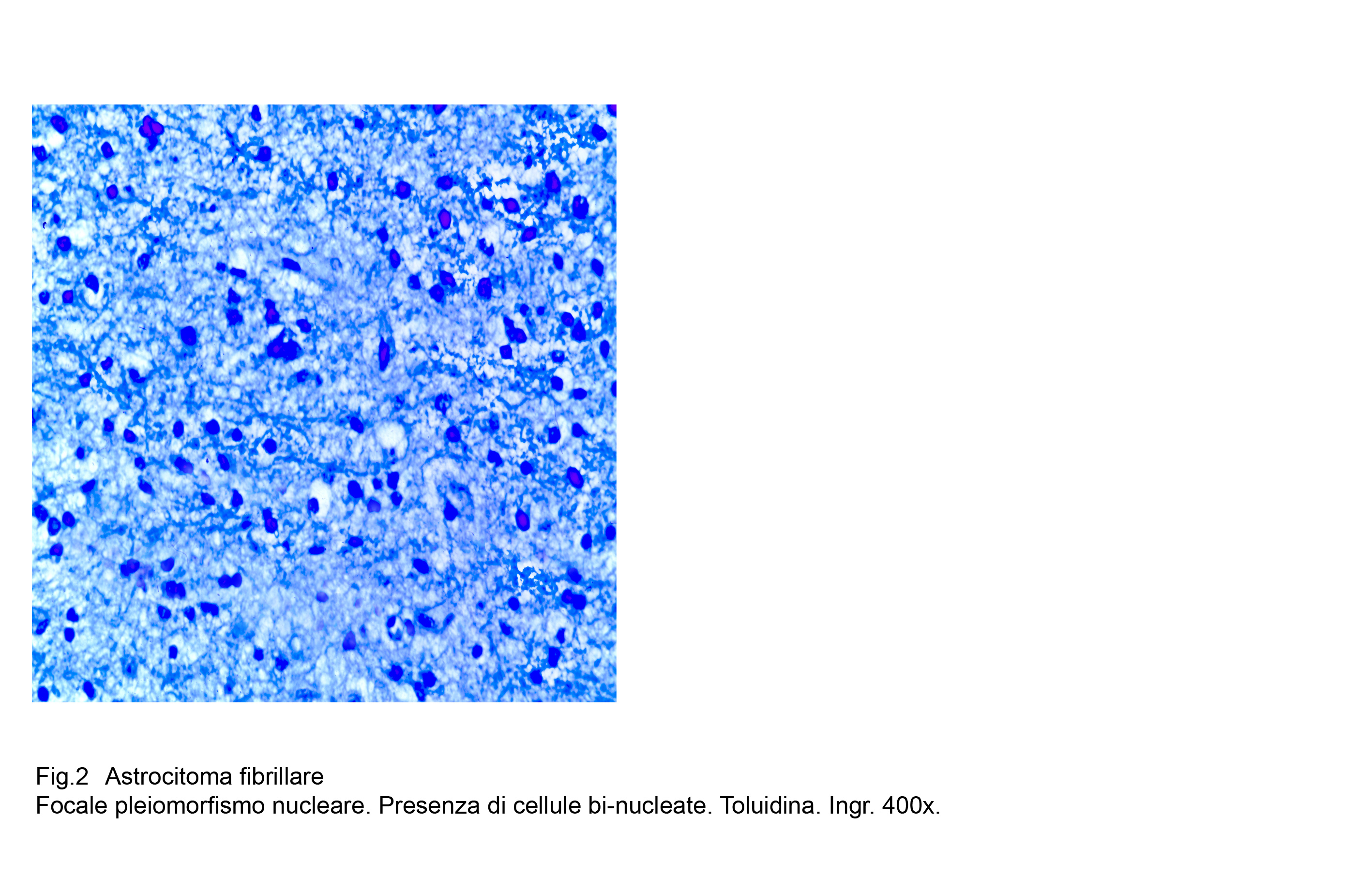
Fig.3 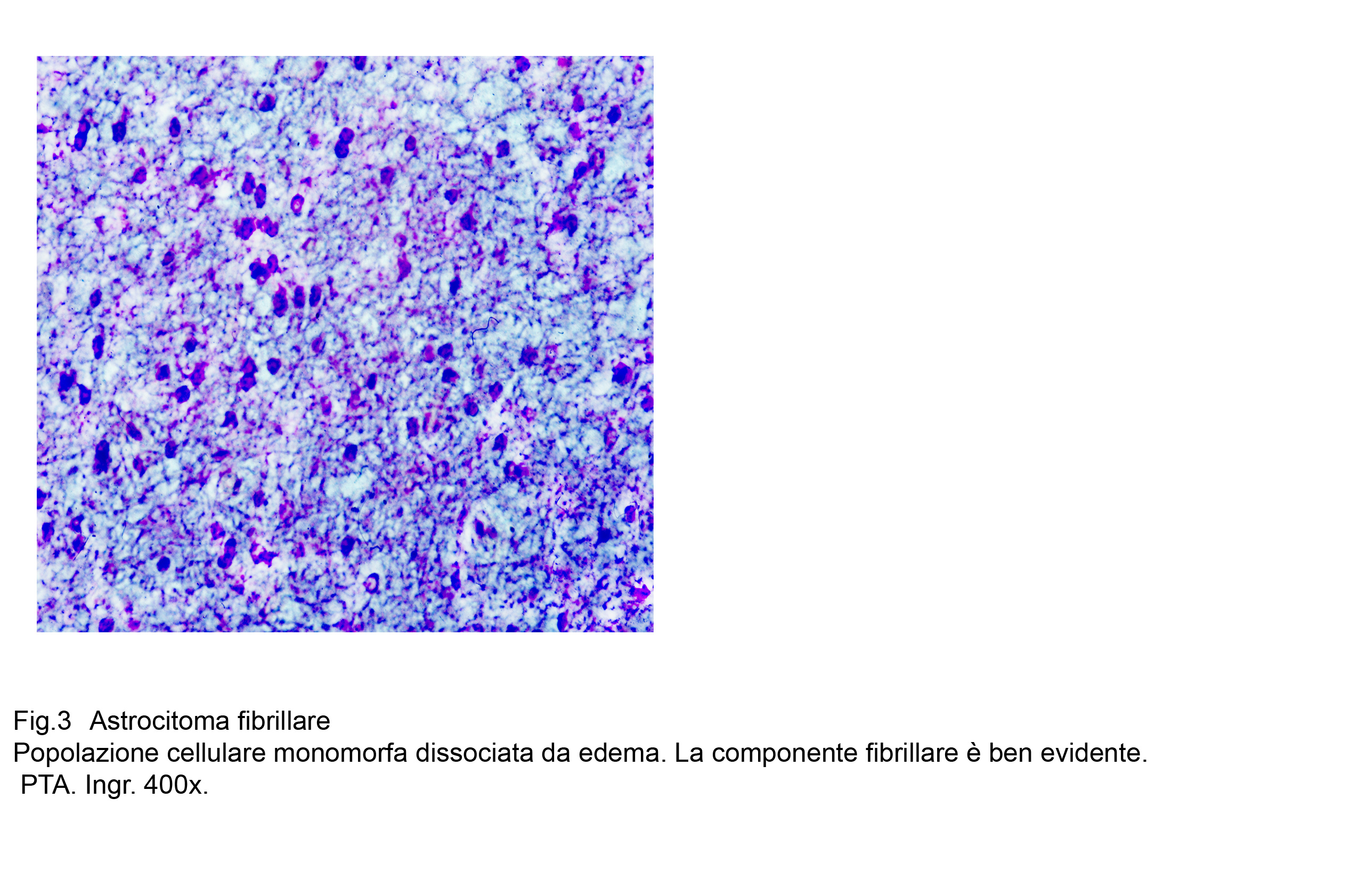 Fig.4
Fig.4 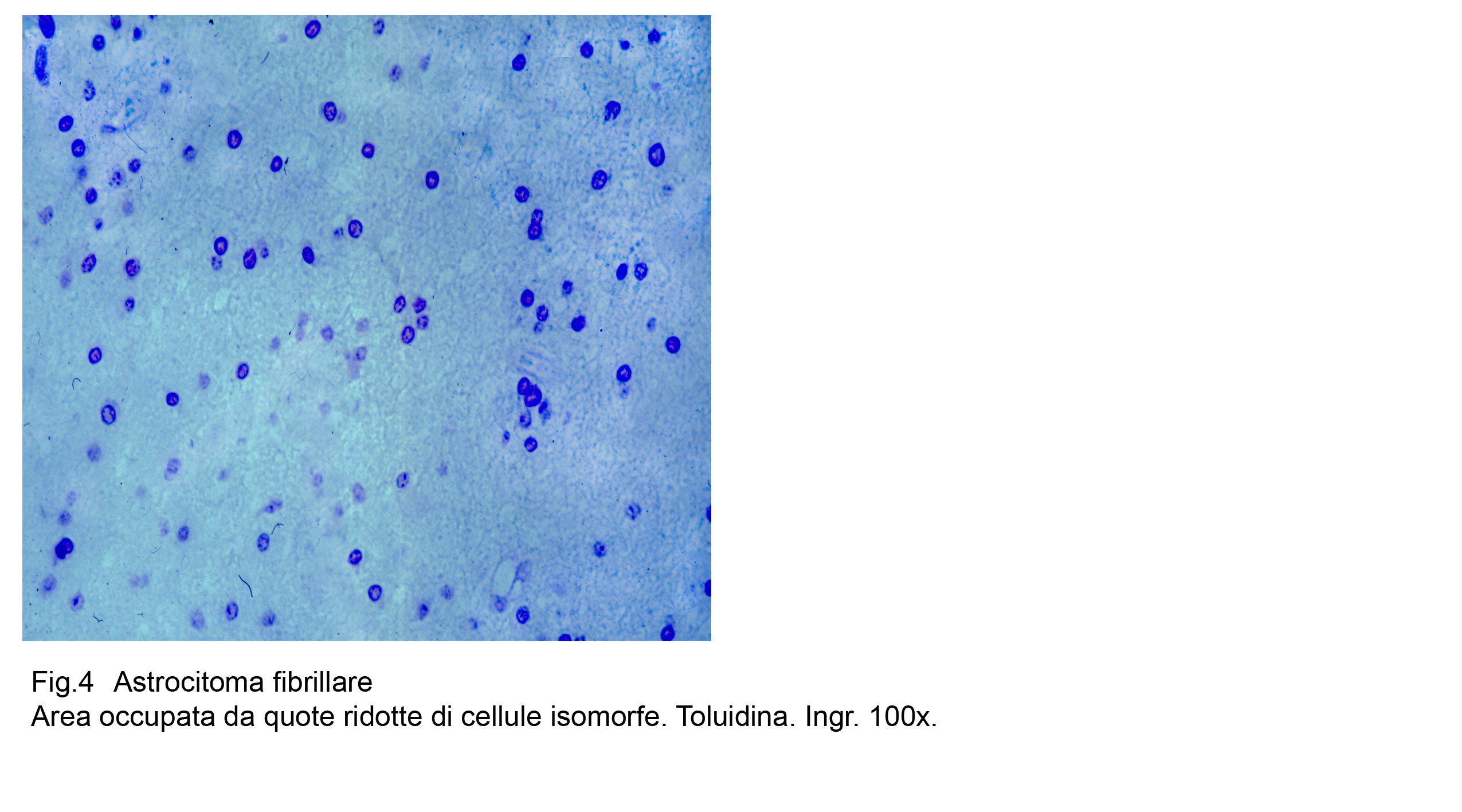
A questi caratteri morfologici di base, spesso si associano altri rappresentati da cellule ovoidali, stellate, triangolari o semplicemente irregolari aventi una componente citoplasmatica più ampia; anche i nuclei sono dismetrici, irregolari, ipercromatinici e possono acquisire i caratteri dell’atipia senza che ciò deponga per una devianza in senso maligno.
Fig.5 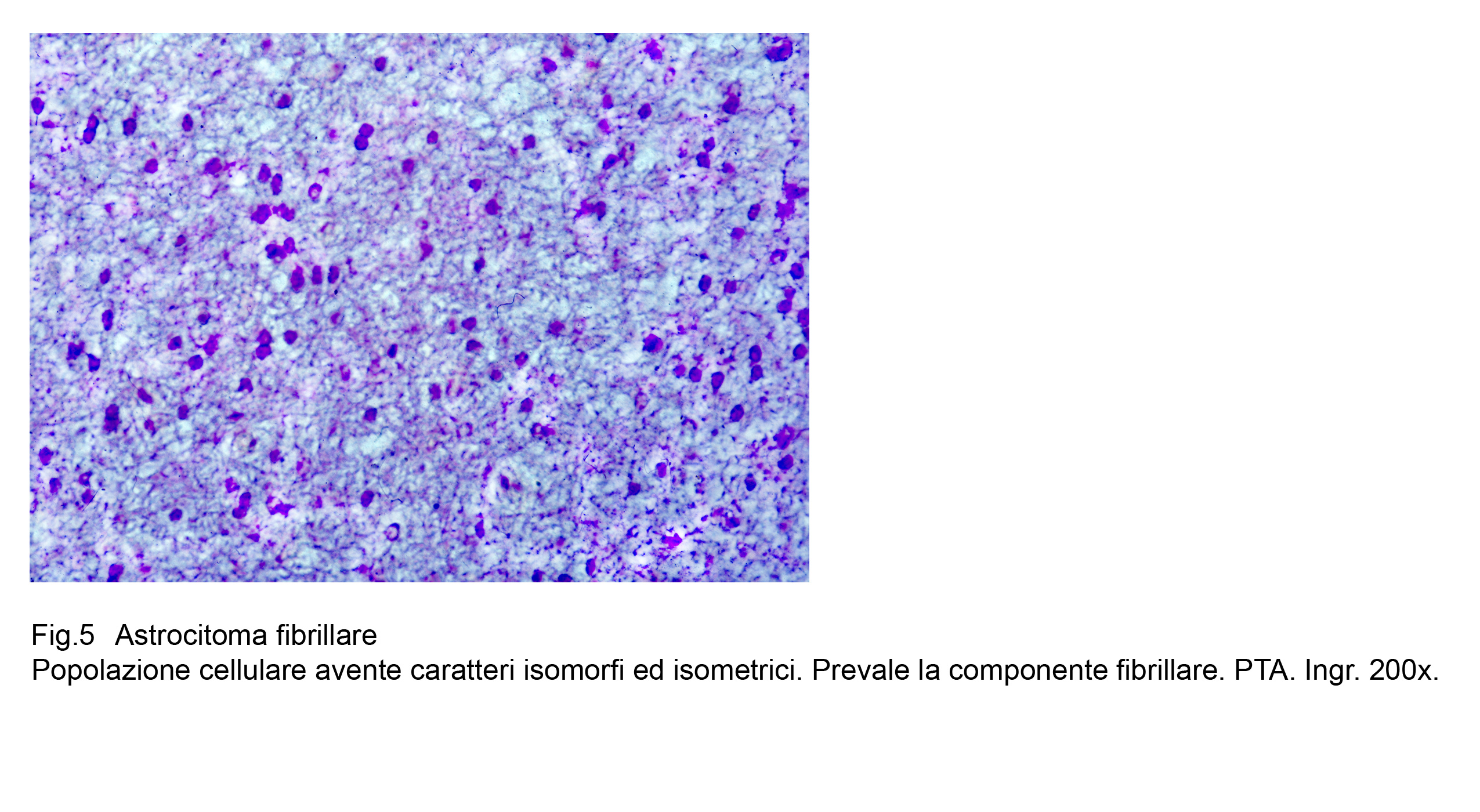 Fig.6
Fig.6 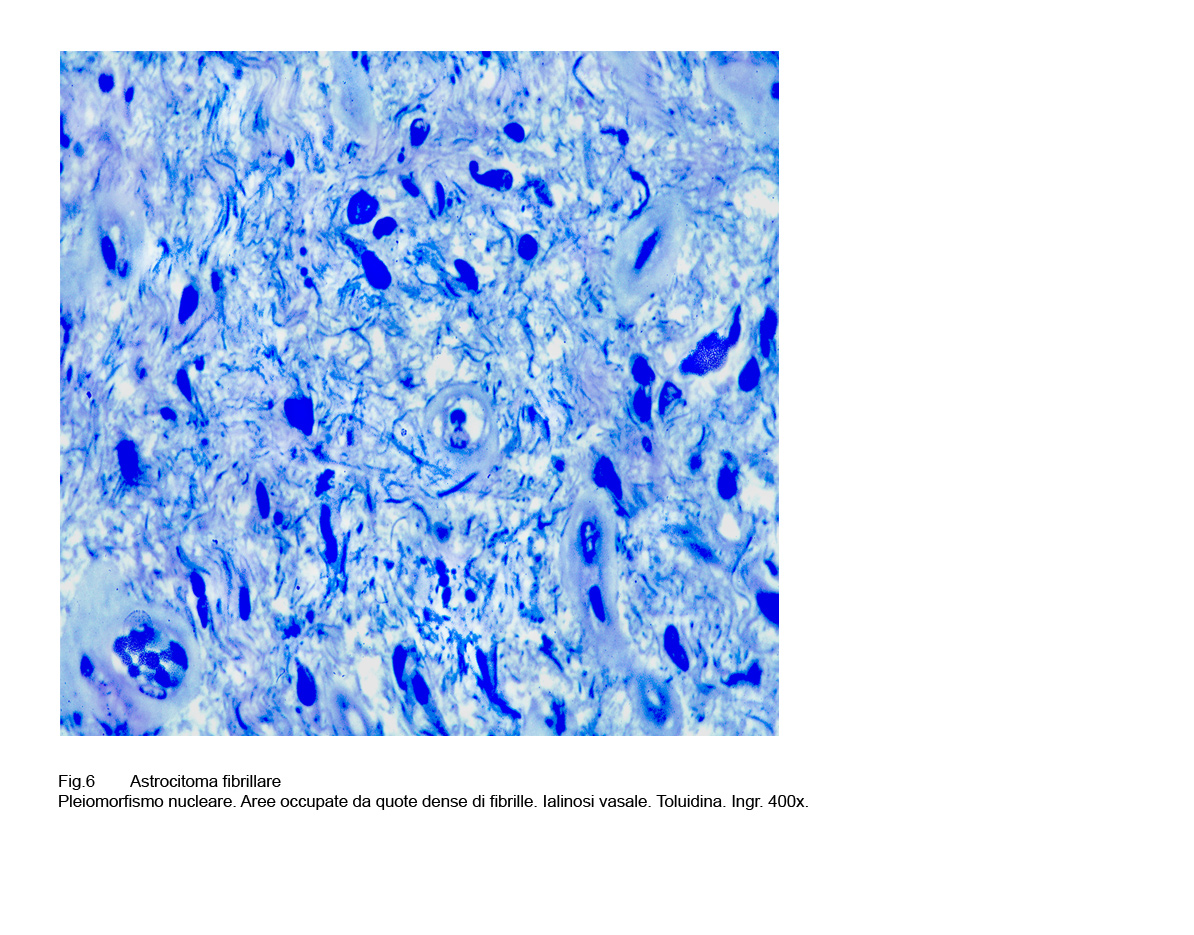
Fig.7 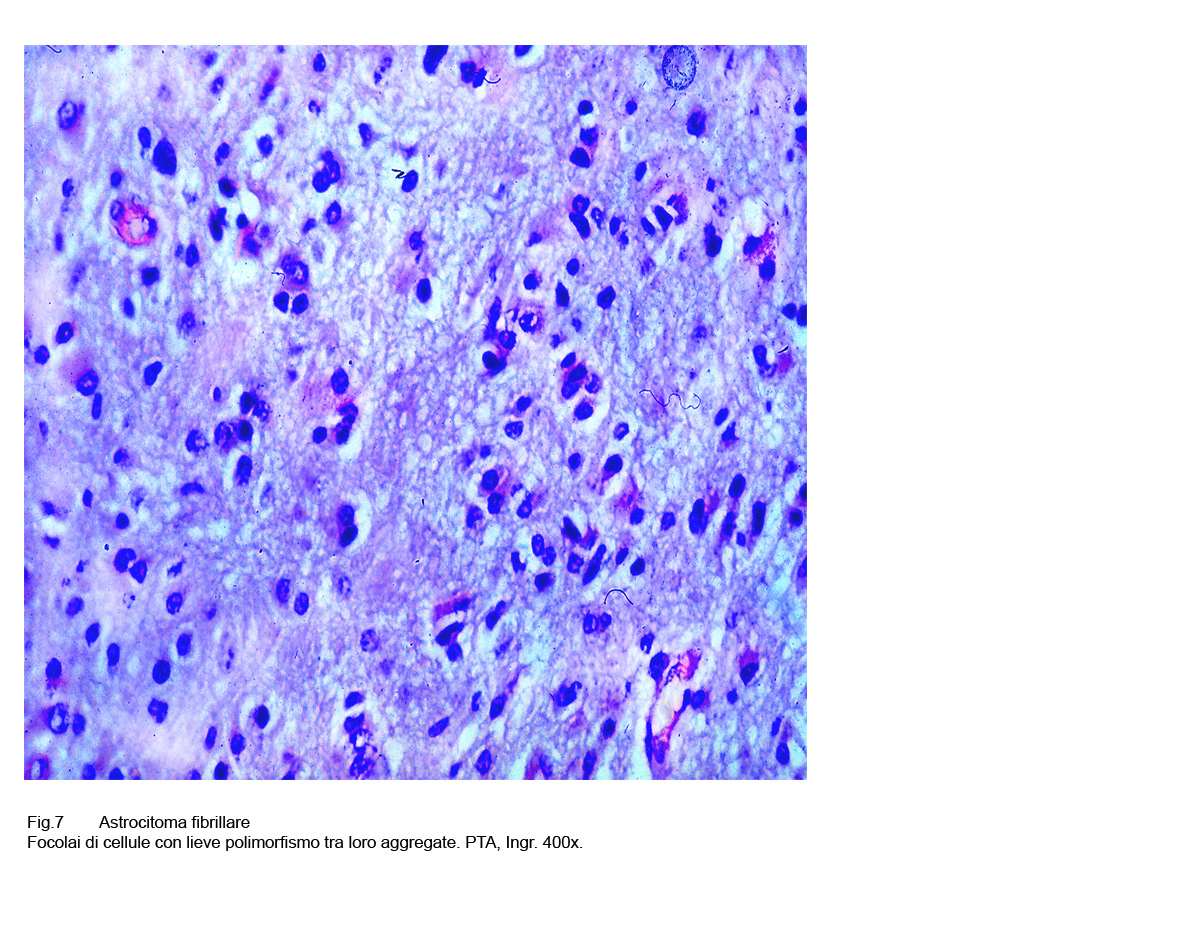 Fig.8
Fig.8 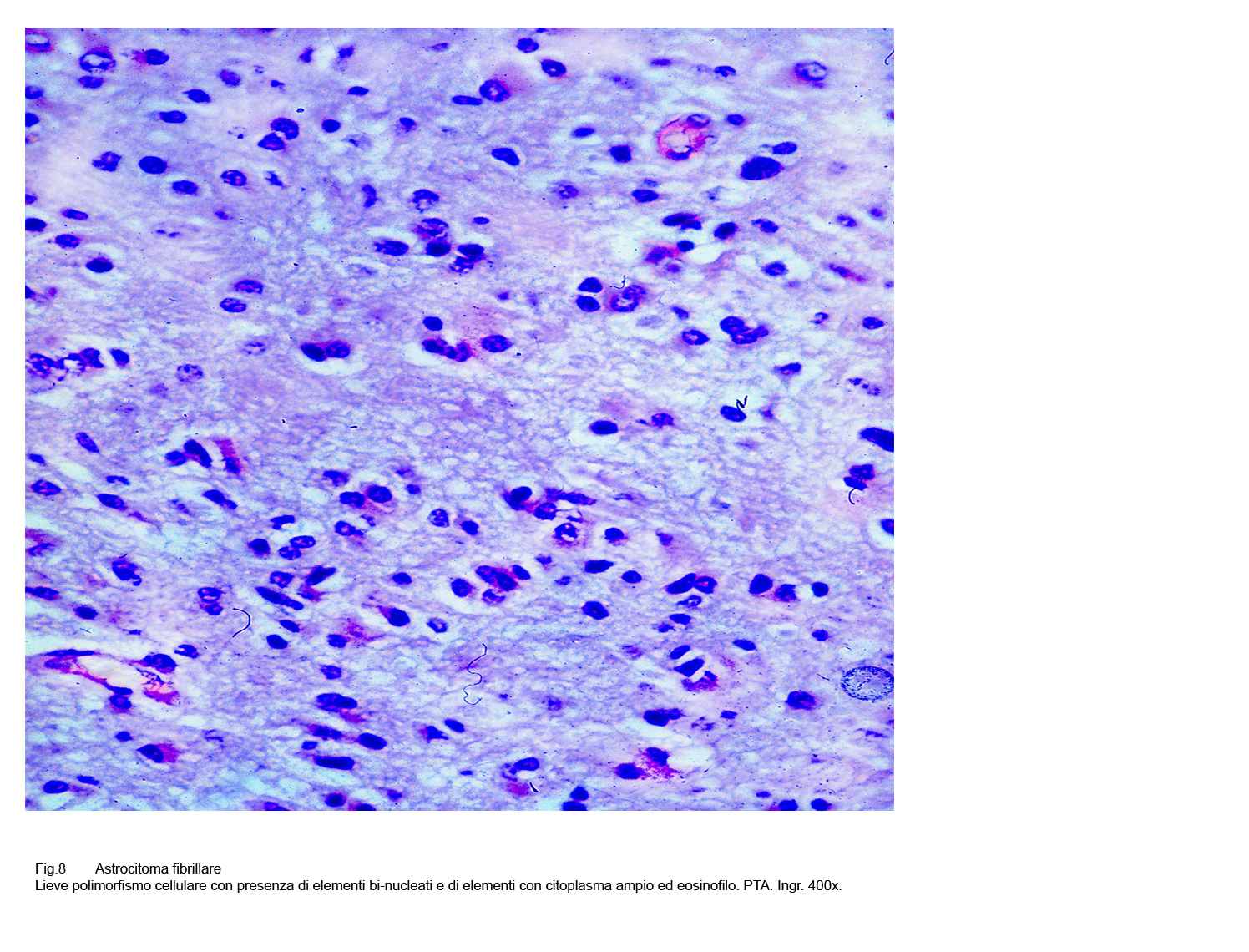
Queste variabilità citomorfologiche non si accompagnano a frequenti mitosi, quali espressioni di attività proliferativa.
I piccoli vasi e i capillari, presenti nel contesto della neoplasia, sono ben strutturati; frequentemente sono tappezzati da endoteli ipertrofici, sono avvolti da periciti e spesso presentano pareti ispessite per sclero-ialinosi; in sede perivascolare si possono stratificare gruppi densi di cellule immunocompetenti o/e di cellule astro gliali neoplastiche.
Frequentemente si possono instaurare processi di edema intercellulare ed extracellulare; questa condizione induce una frammentazione delle glio-fibrille, il citoplasma delle cellule neoplastiche subisce fenomeni di microvacuolizzazione i quali accentuandosi provocano la lisi citoplasmatica;
Fig.9 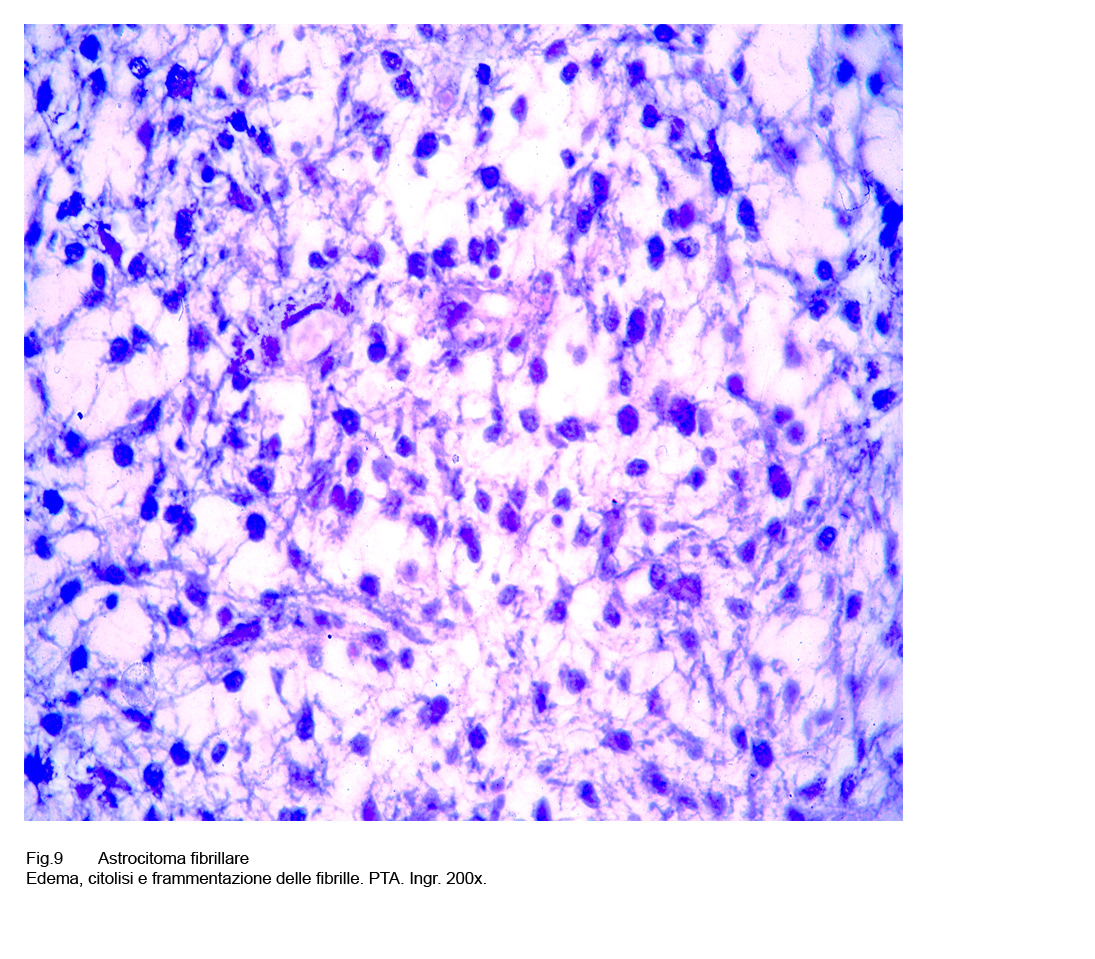
tutto ciò rappresenta l’inizio morfologico delle micro-escavazioni prive di
pareti proprie,le quali per ampliamento centrifugo o per confluenza di microcisti tra loro adiacenti,si trasformano in macro-cisti,spesso occupanti quote cospicue della neoplasia.
IMMUNOISTOCHIMICA
Le cellule dell’astrocitoma fibrillare evidenziano una diffusa e marcata immunoespressività a livello citoplasmatico per la proteina GFAP,espressività ulteriormente accentuata a livello dei prolungamenti citoplasmatici. Questo reperto fornisce una diretta,immediata documentazione su il modo di disporsi spazialmente di questi prolungamenti, su la loro ramificazione,il loro flessibile intrecciarsi e sul modo di disporsi a rete negli spazi intercellulari.
Fig.10 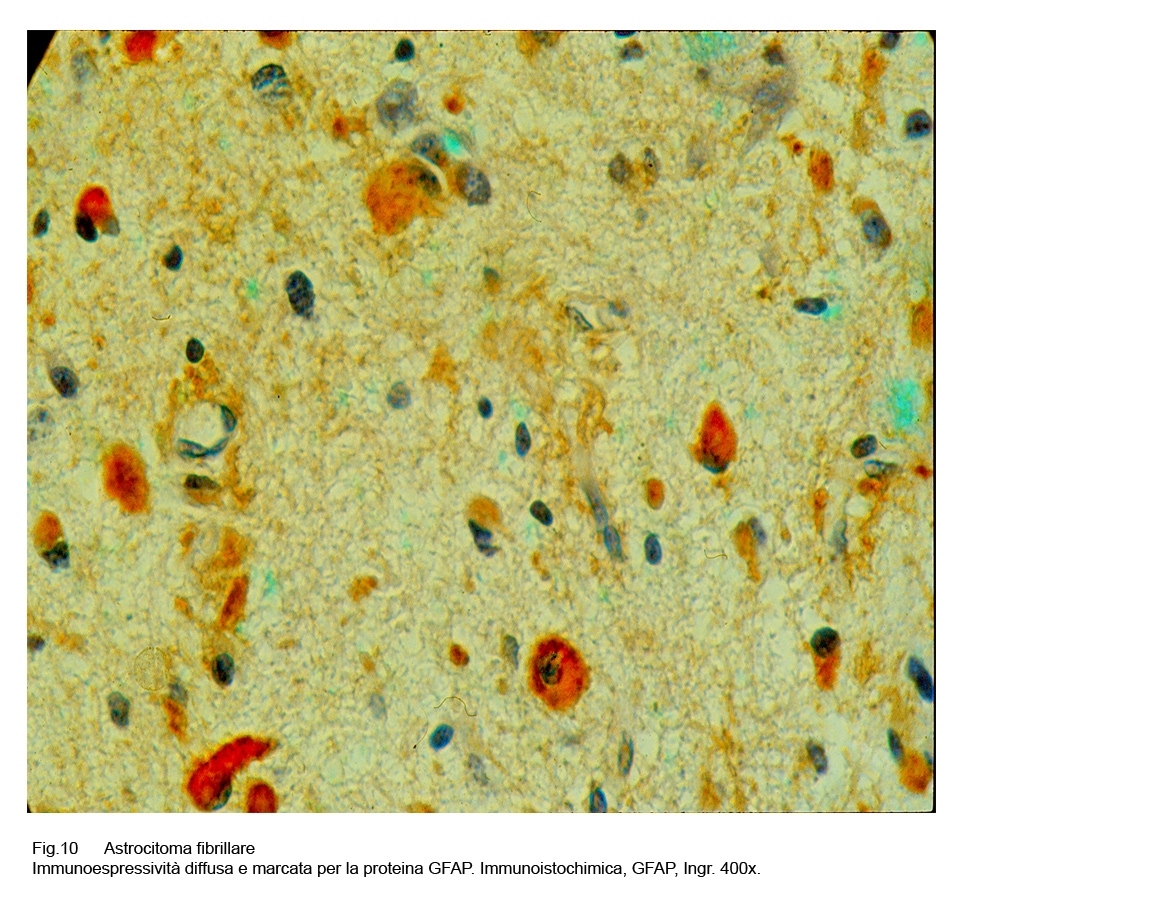
Mediante questa metodica è possibile svelare diversi e lunghi prolungamenti citoplasmatici in elementi cellulari non apprezzabili con le comuni tecniche di istologia.
In questi casi anche la Vimentina è altamente espressiva sul piano immunologico per evidenziare sia le cellule sia la densa componente di prolungamenti citoplasmatici.
Fig.11 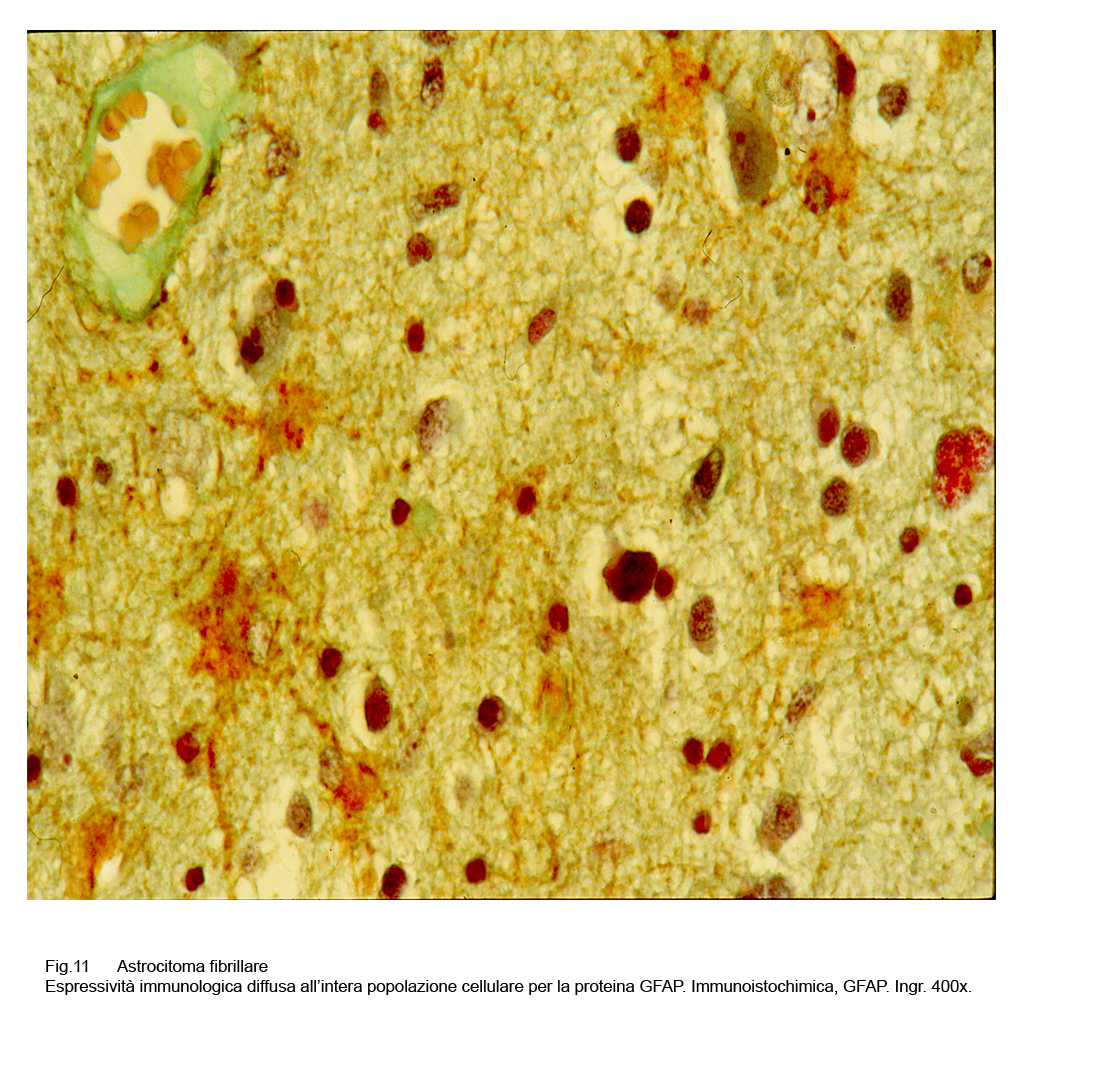 Fig.12
Fig.12 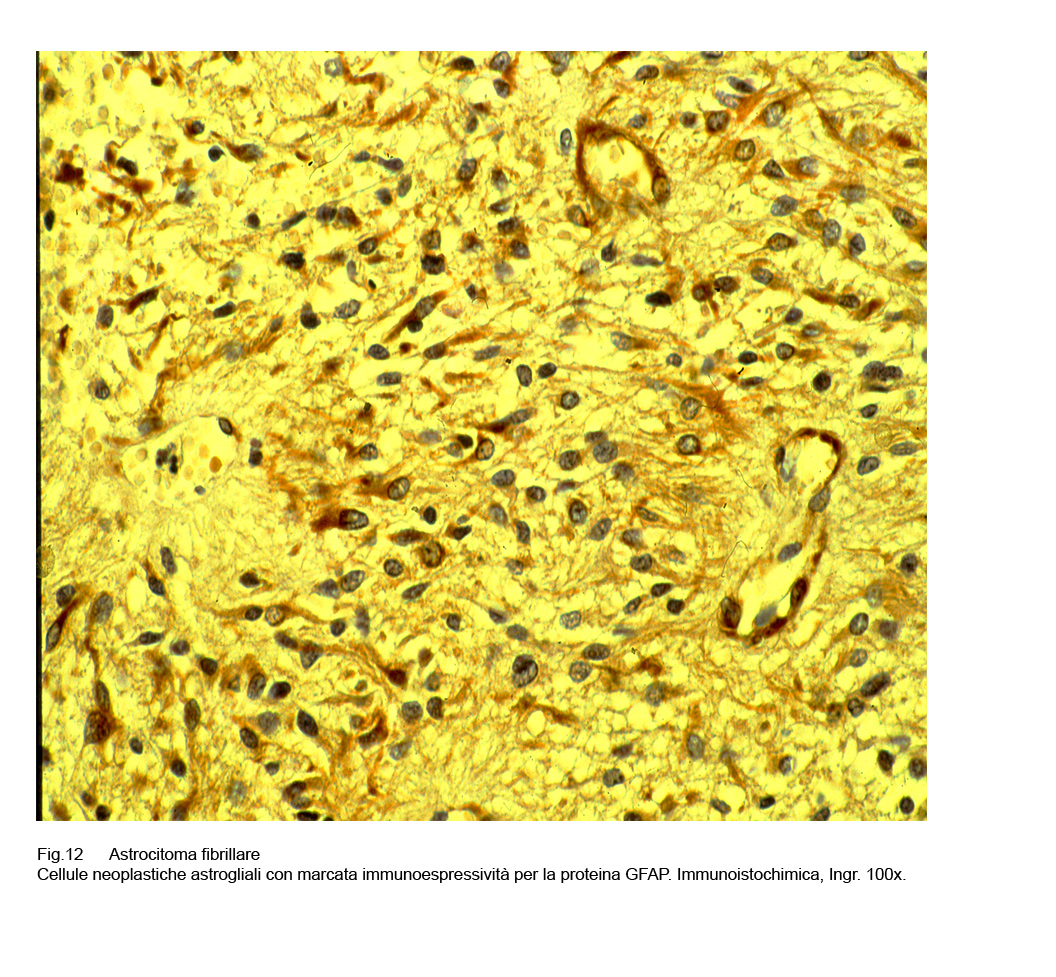
Nel contesto di tali campi microscopici è possibile reperire cellule pseudo-gemistocitiche fornite di discrete quote di citoplasma intensamente positivo per la proteina GFAP.
Mediante la immunoespressività del Fattore VIII è possibile rintracciare abbozzi di capillari in via di cavitazione, delimitati soltanto da filiere di endoteli ipertrofici.
Fig.13 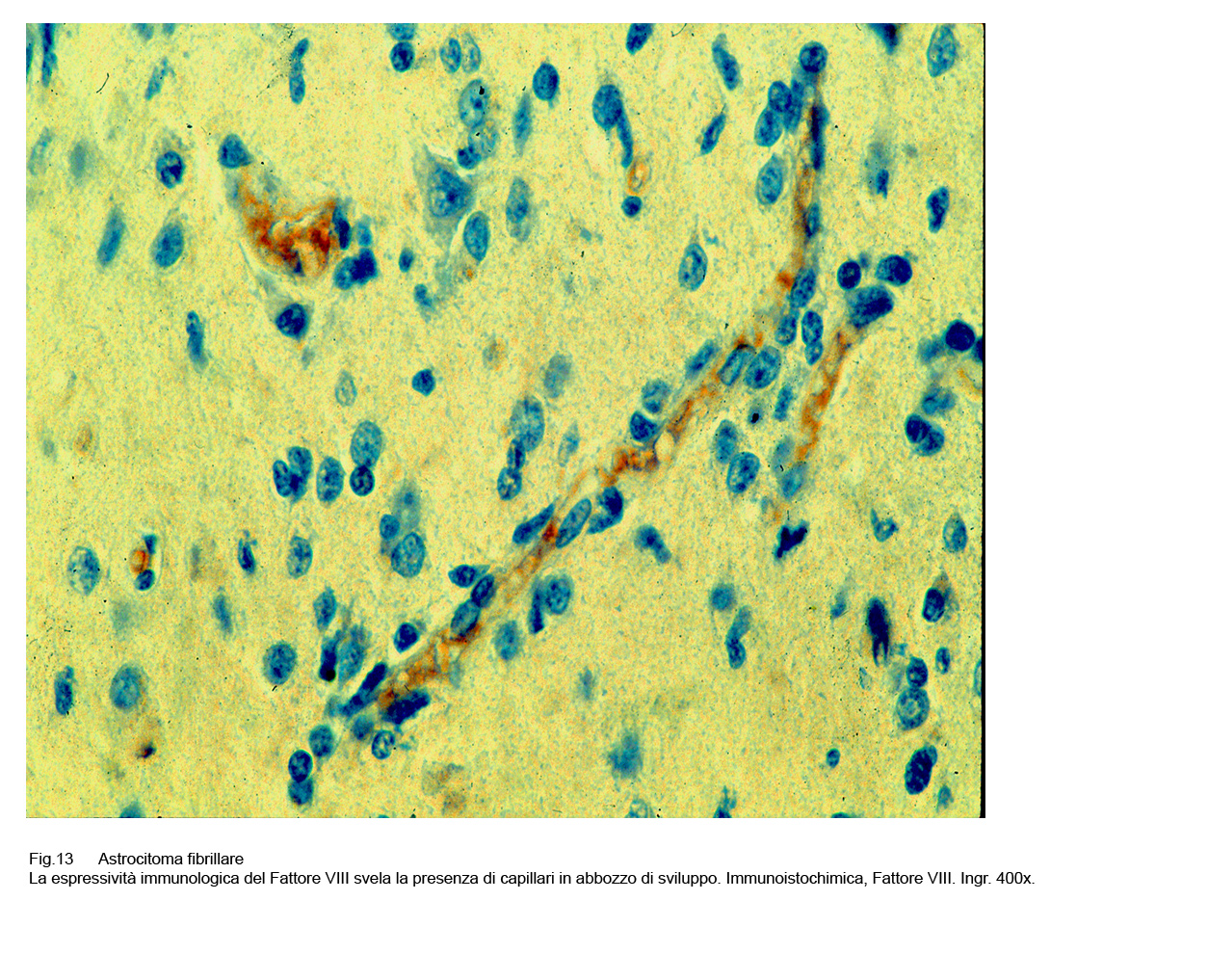
Caratteri ultrastrutturali
Le cellule dell’astrocitoma fibrillare evidenziano al microscopio elettronico un citoplasma compatto ,sottile, sede di numerosi organuli e di sottili fasci di gliofibrille,le quali si ritrovano più numerose ed addensate a livello dei prolungamenti citoplasmatici.
Fig.14 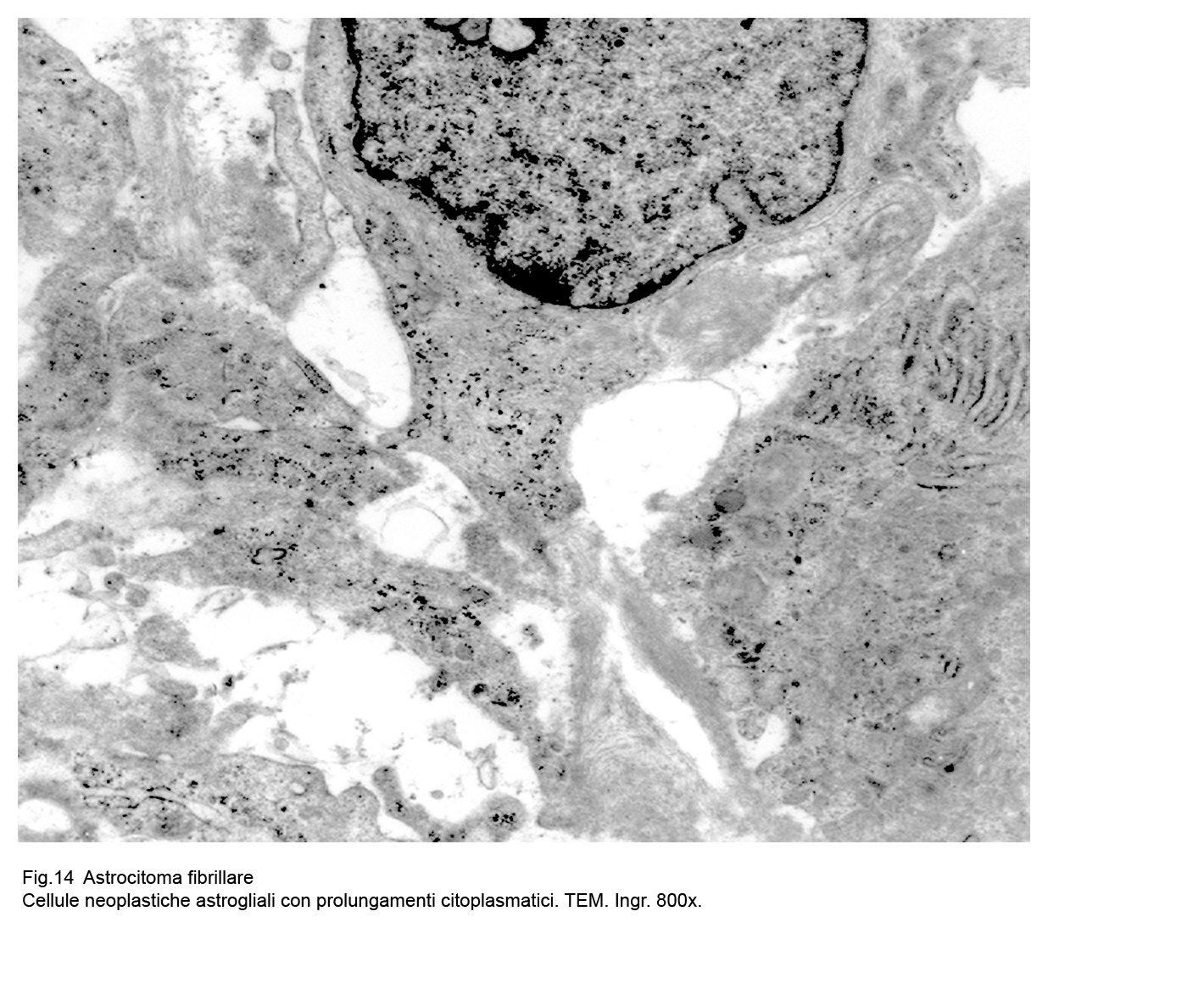 Fig.15
Fig.15 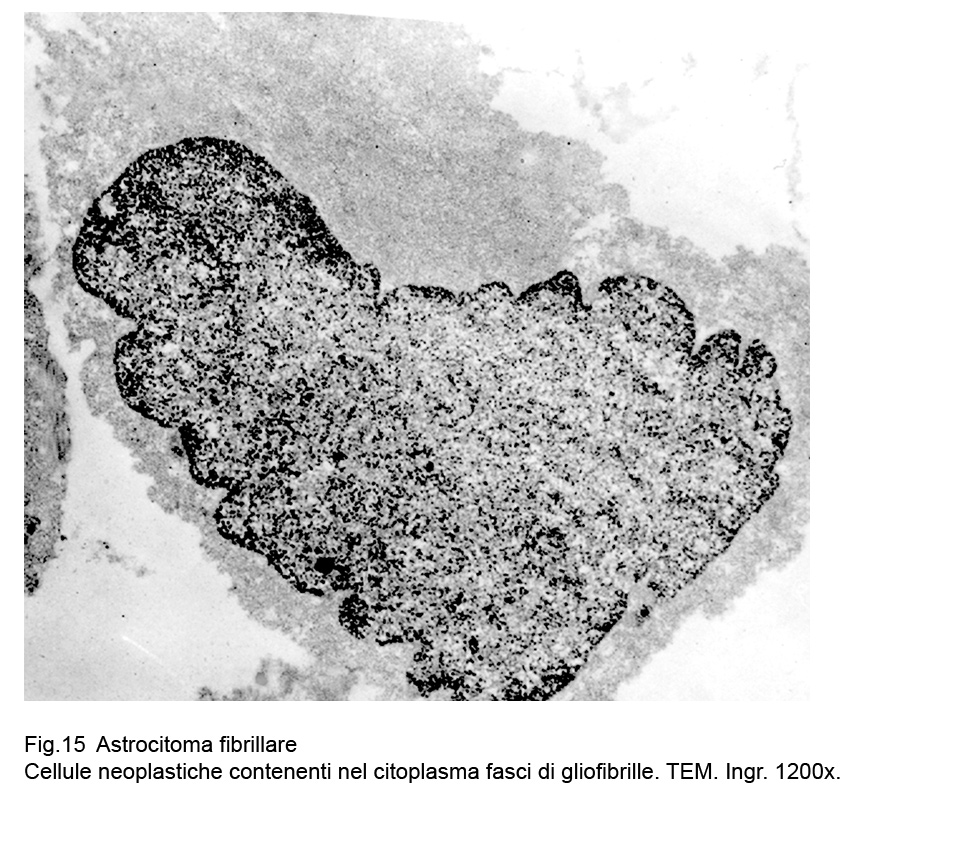
Le cellule sono spesso affiancate e tra loro coese, non mostrano strutture giunzionali e la loro componente gliofibrillare si raccoglie prevalentemente in sede perinucleare e perifericamente a ridosso della membrana cellulare.
Fig.16  Fig.17
Fig.17 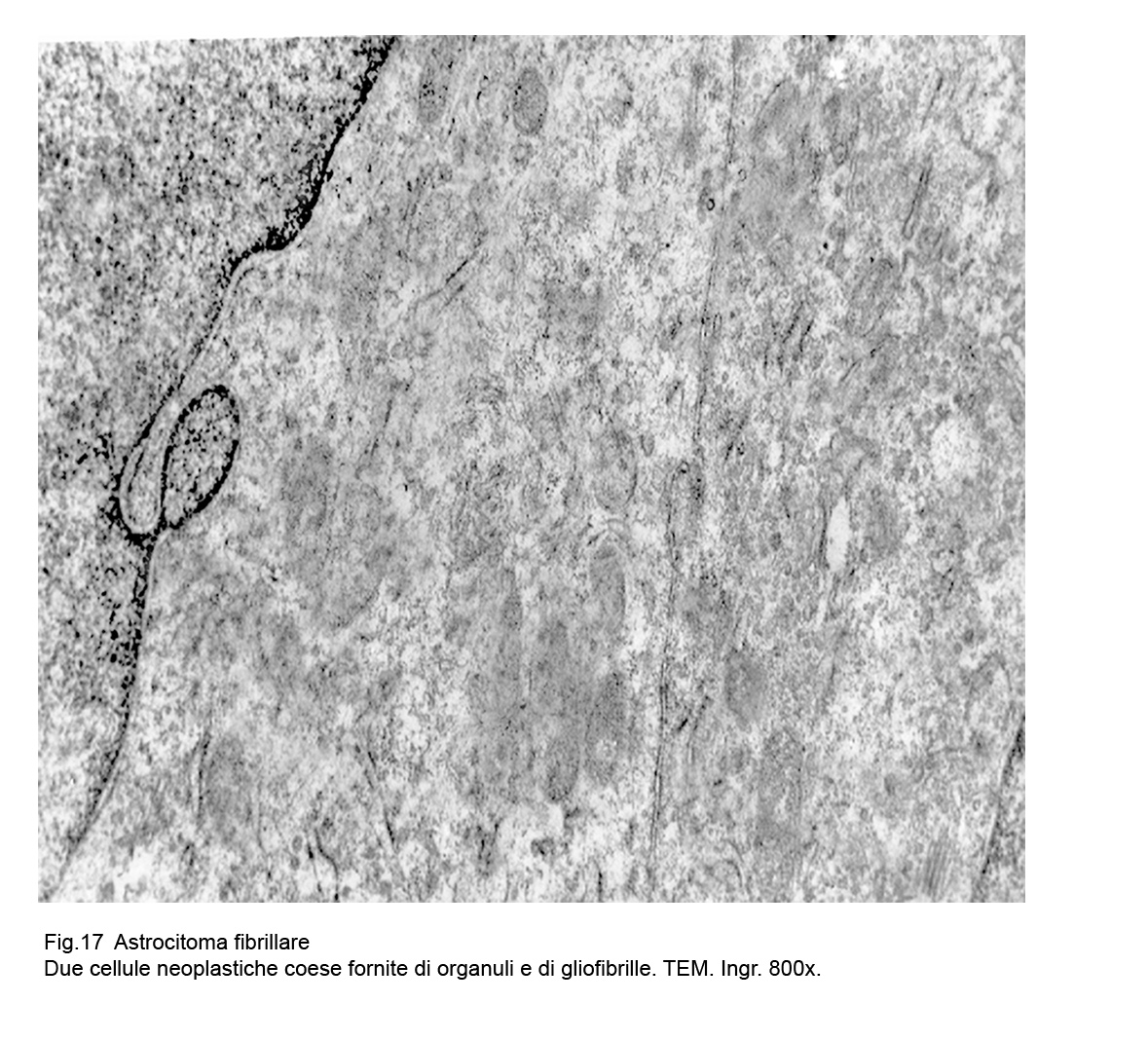
Frequentemente il loro citoplasma è sede di micro vacuoli da edema endocellulare intercalati da strutture gliofibrillari,
Fig.18 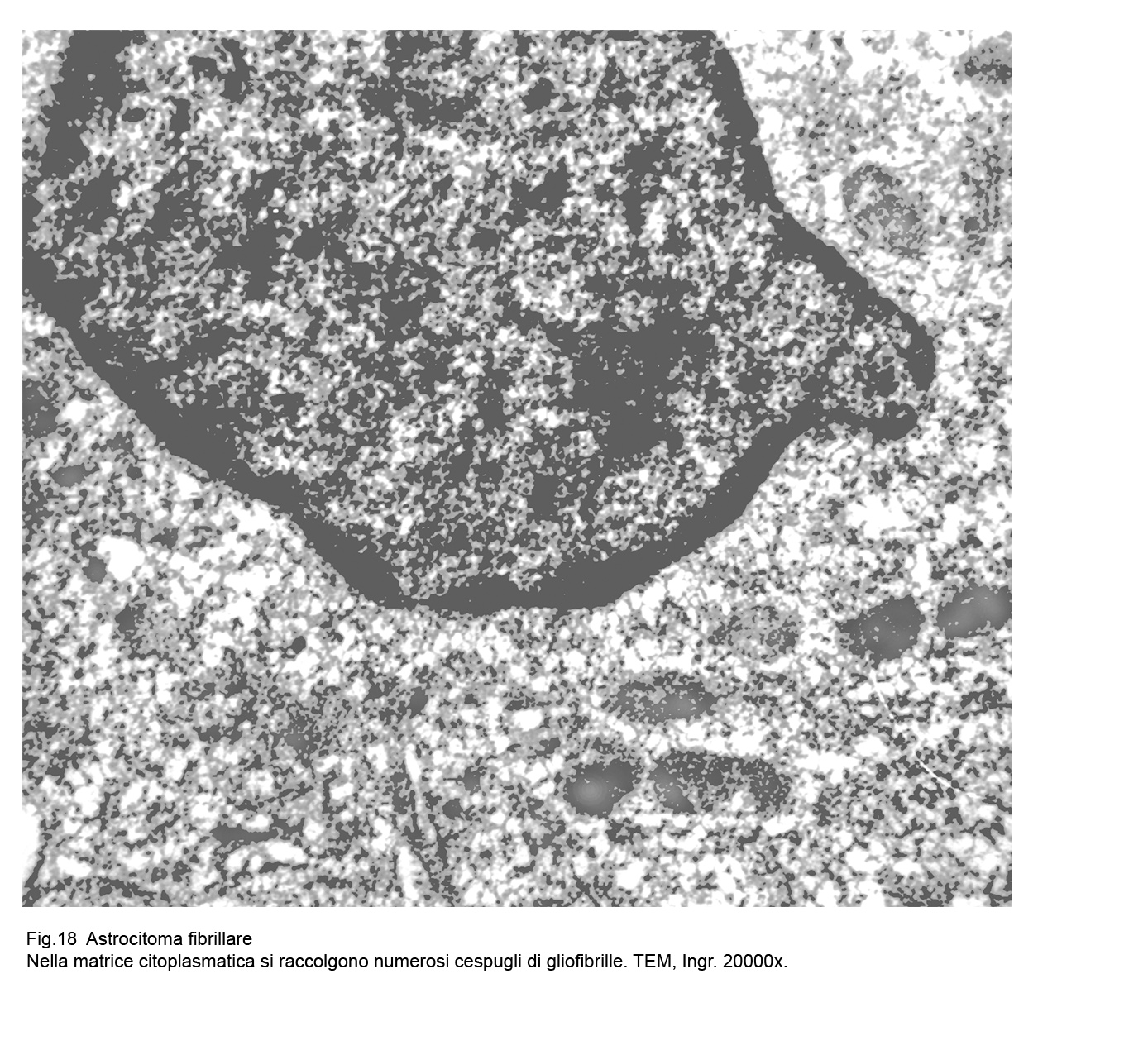 Fig.19
Fig.19 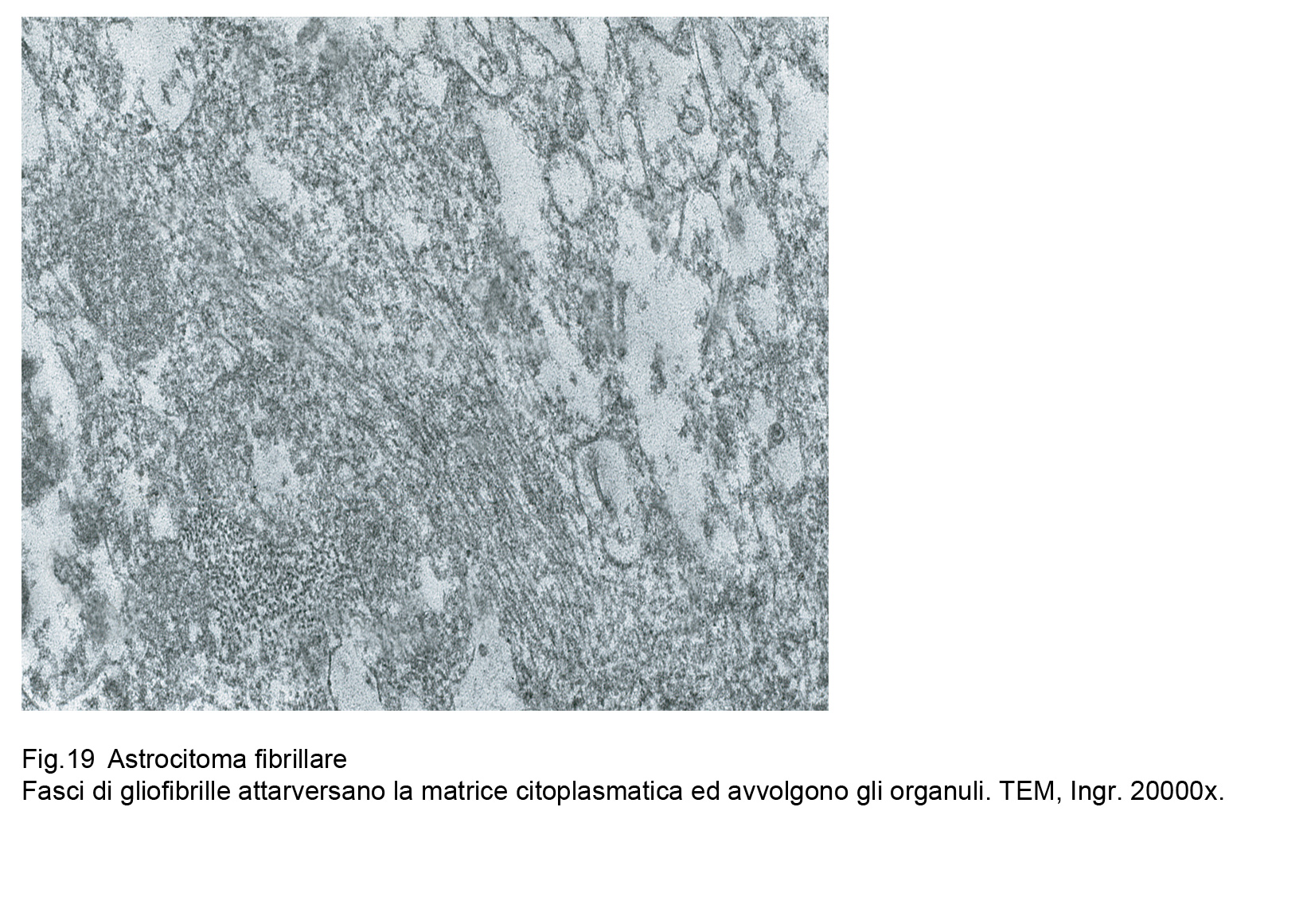
le quali in una fase successiva si dissociano per poi frammentarsi.
Fig.20 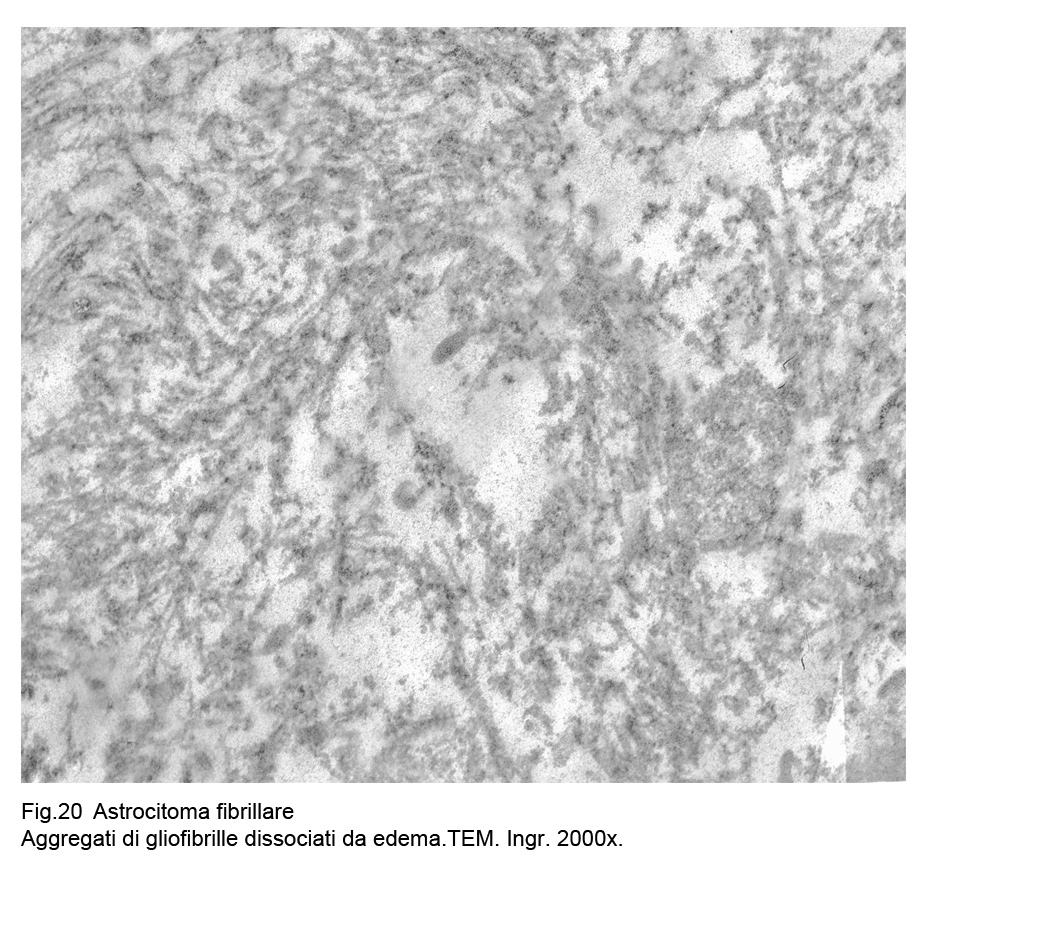
Mediante una analitica ricerca ultrastrutturale è possibile rintracciare e documentare la pervasività delle cellule dell’ astroglioma tra le fibre nervose.
Fig.21 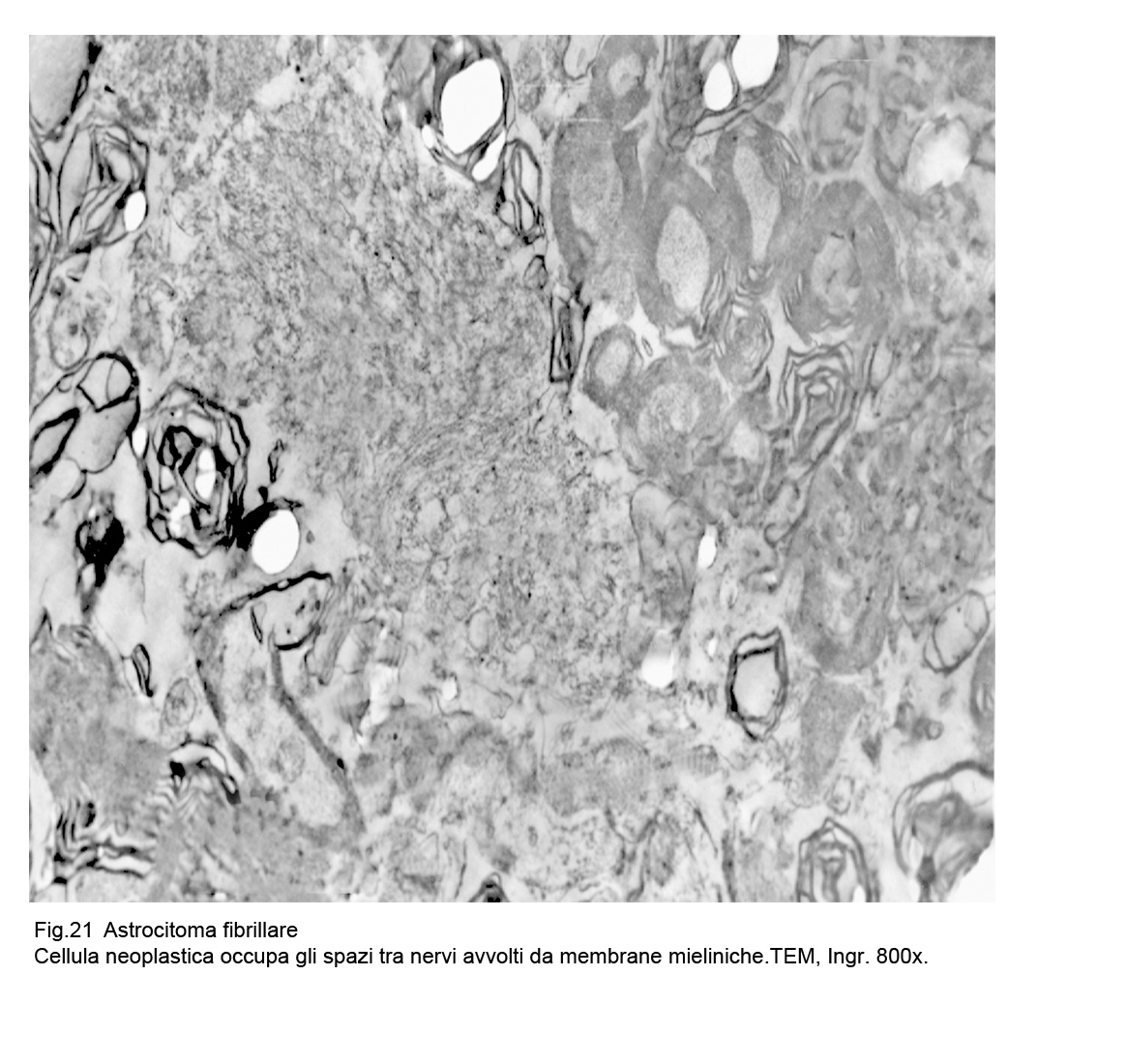
ASTROCITOMA GEMISTOCITICO
Caratteri macroscopici
Questa variante degli astrocitomi diffusi appare circoscritta con margini sfumati,e tracciabili con difficoltà.
Ha una consistenza molle, un colore grigio chiaro con variazioni di tonalità e di uniformità conseguenti a fenomeni congestici e/o a microemorragie.
Al taglio, le superfici di sezione appaiono compatte, omogenee oppure sono sedi di micro-macro cisti contenenti liquido fluido,opalescente,simile a siero;queste cavità sono di numero variabile e distribuite in modo casuale.
Caratteri istopatologici
Il citotipo di questa variante degli astrocitomi è rappresentato da un elemento voluminoso per una cospicua quota di citoplasma e per la esistenza di un nucleo voluminoso ma decentrato ai margini del corpo cellulare;la componente citoplasmatica,oltre la volumetria,risalta per la sua compattezza, l’ intensa eosinofilia e l’ aspetto vitreo.
La forma di questi elementi è lievemente irregolare, ma spesso acquisiscono un aspetto globoide.
Questi elementi si dispongono in modo casuale o a filiere; sono tra loro a mutuo contatto ma non coesi ; possono anche essere separati da ristretti spazi intercellulari nei quali si aggettano corti e radi prolungamenti citoplasmatici.
Fig.22 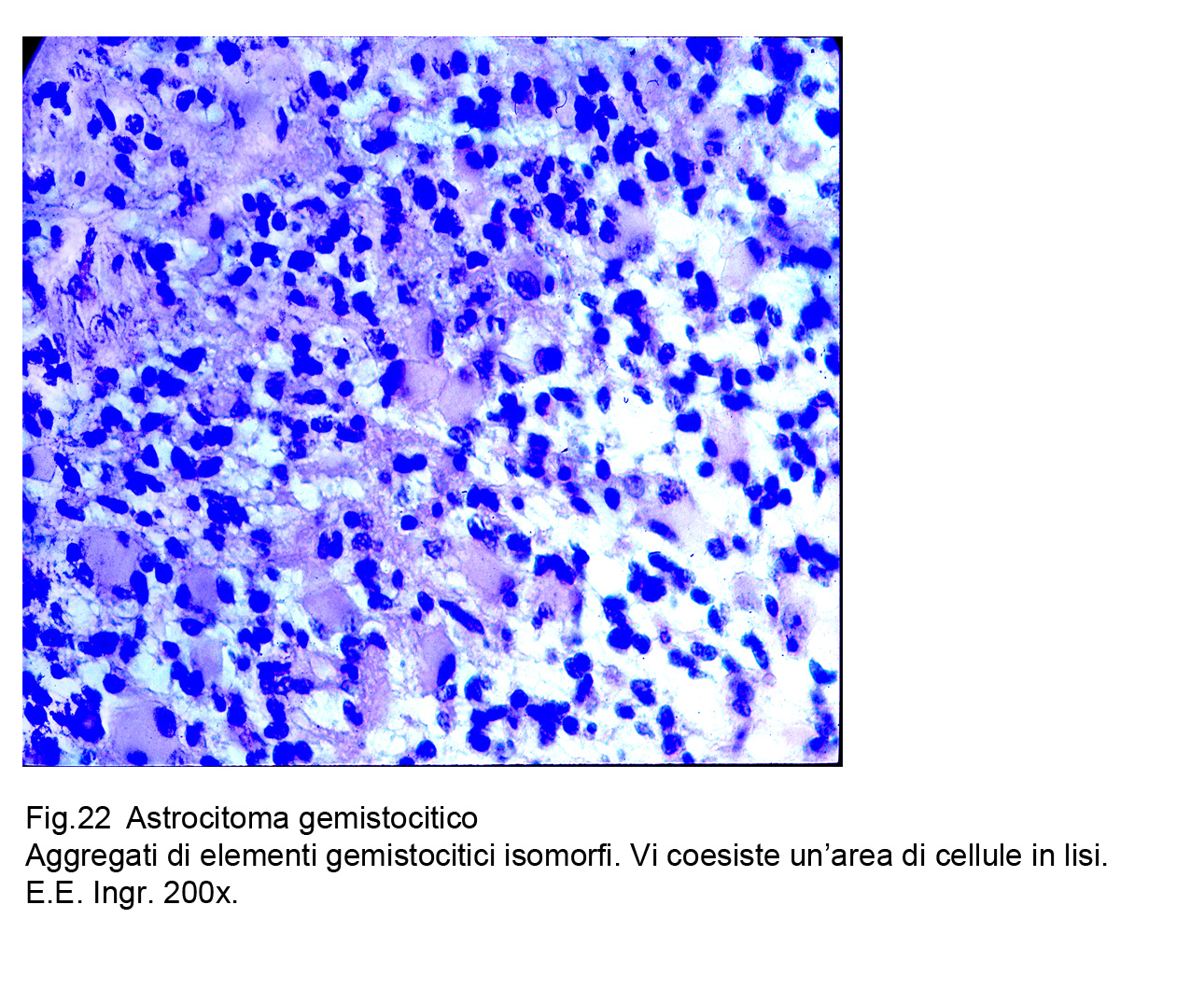
La quota vascolare è ben sviluppata, è formata da piccoli vasi e soprattutto da capillari;tutte queste strutture sono rivestite da endoteli alti,sporgenti nel lume e sono avvolte da discrete quote di periciti;esse risultano maggiormente evidenti all’osservatore poiché sono ammantate da filiere pluristratificate di cellule immuno-competenti.
Nel corso del suo accrescimento possono instaurarsi processi di edema intercellulare ed endocellulare con conseguente vacuolizzazione progressiva del citoplasma fino alla sua lisi ; molto frequentemente la componente vascolare mostra pareti impregnate da materiale ialino e le proprie strutture sono state sostituite da fasci di fibre collagene con co-interessamento anche delle zone perivascolari.
In letteratura sono descritti astrocitomi mini-gemistociti; essi sono di piccole dimensioni e sono organizzati in filiere cellulari le quali sono costeggiate da sottili fibre di stroma pre-collagene.
Sono descritti casi di astrocitoma gemistocitico puro e casi di astrocitoma gemistocitico misto; i primi sono monomorfi in quanto sono costituiti solo da cellule gemistocitiche; i secondi sono plurimorfi per la coesistenza disordinata,casuale di cellule gemistocitiche, fibrillari e/o protoplasmatiche .
Per la denominazione di astrocitoma gemistocitico misto,le quote di cellule gemistocitiche, anche se variabili da caso a caso, non possono ridursi, secondo alcuni AA, al di sotto del 35% della popolazione globale (J. Neuro-Oncol 2006, 76, 175-83).
Fig.23 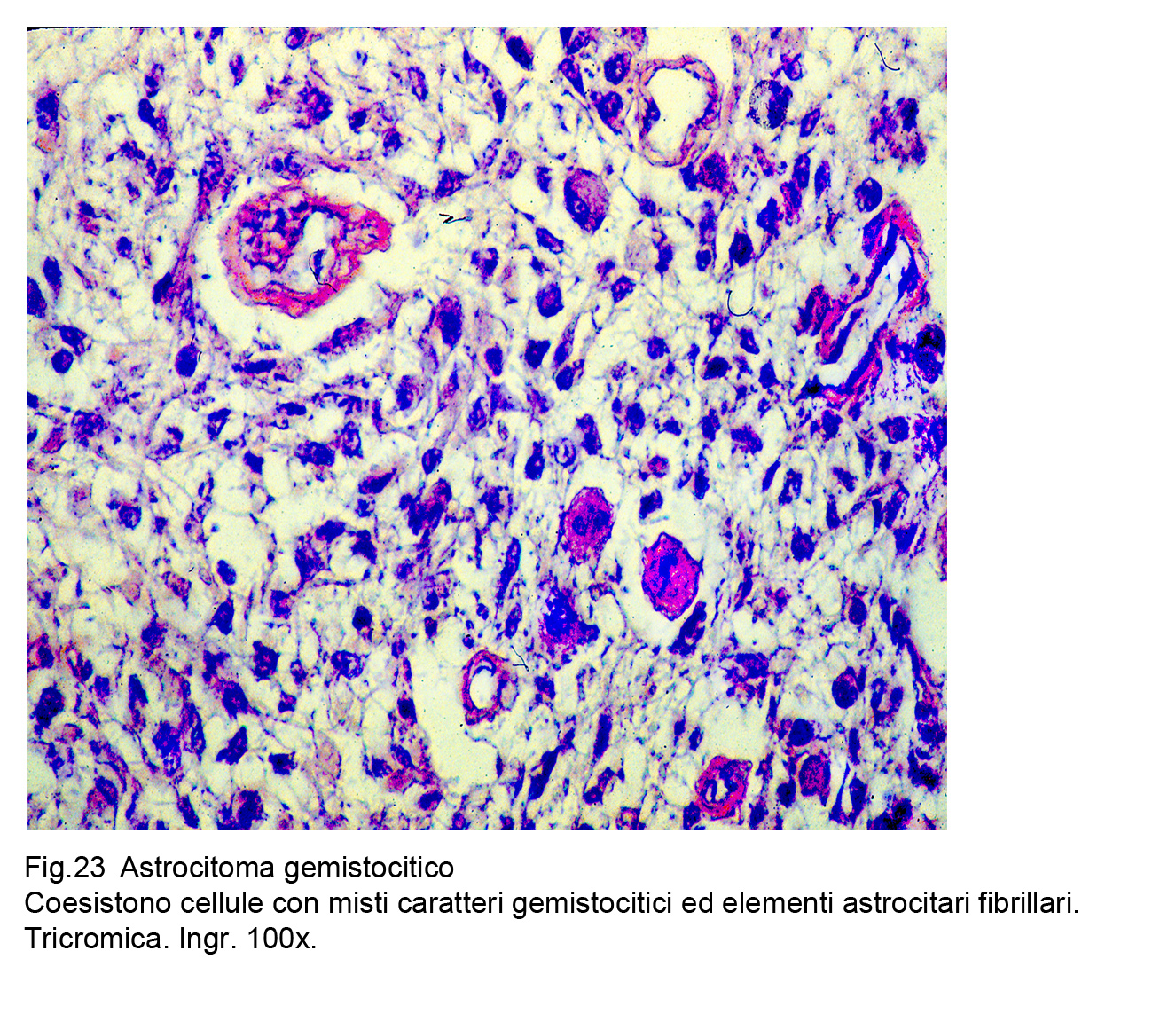 Fig.24
Fig.24 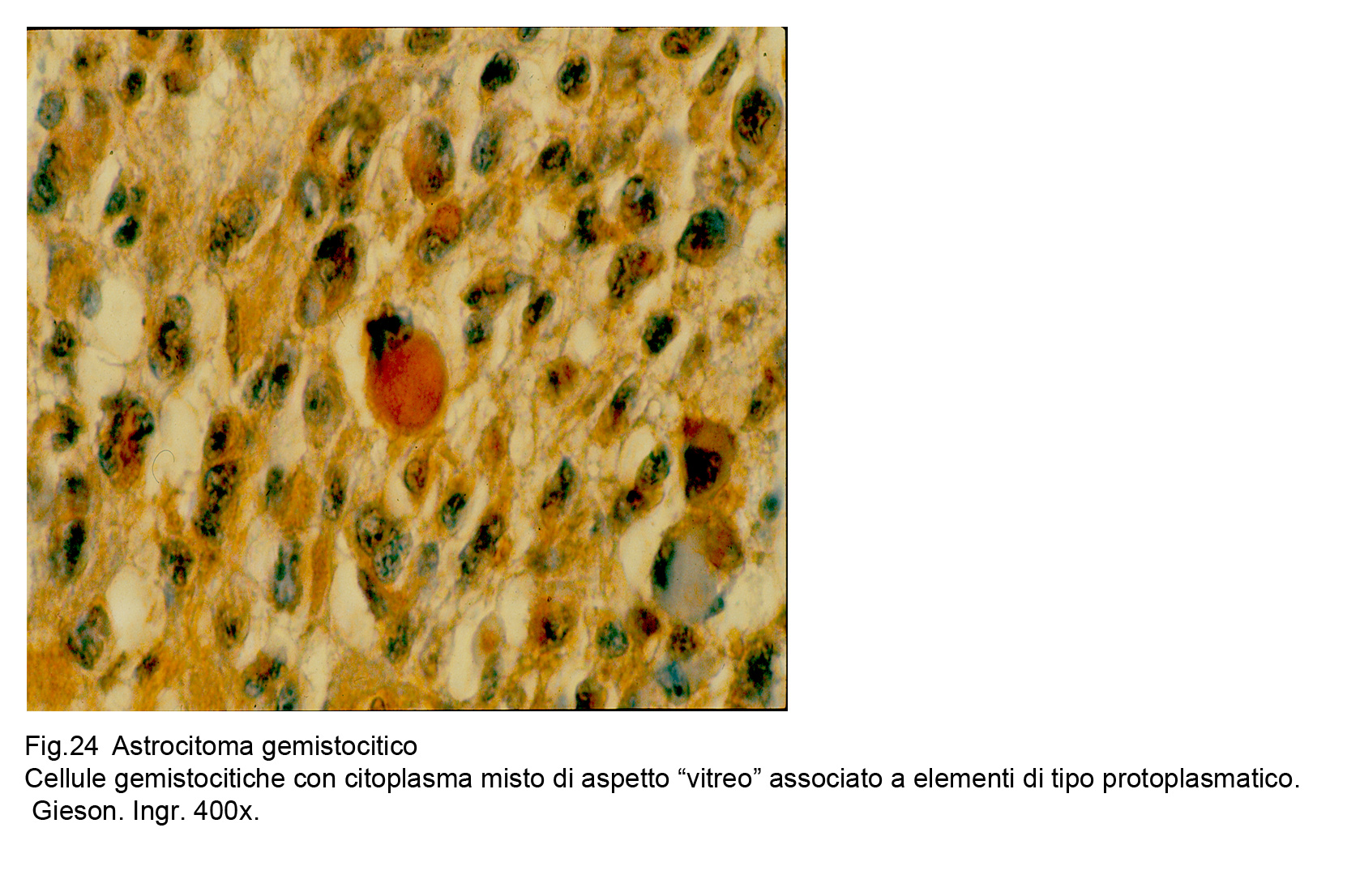
La presenza di cellule gemistocitiche in astrocitomi può essere anche espressione di processi reattivi in conseguenza di processi flogistici di fenomeni ischemico-infartuali.
Fig.25 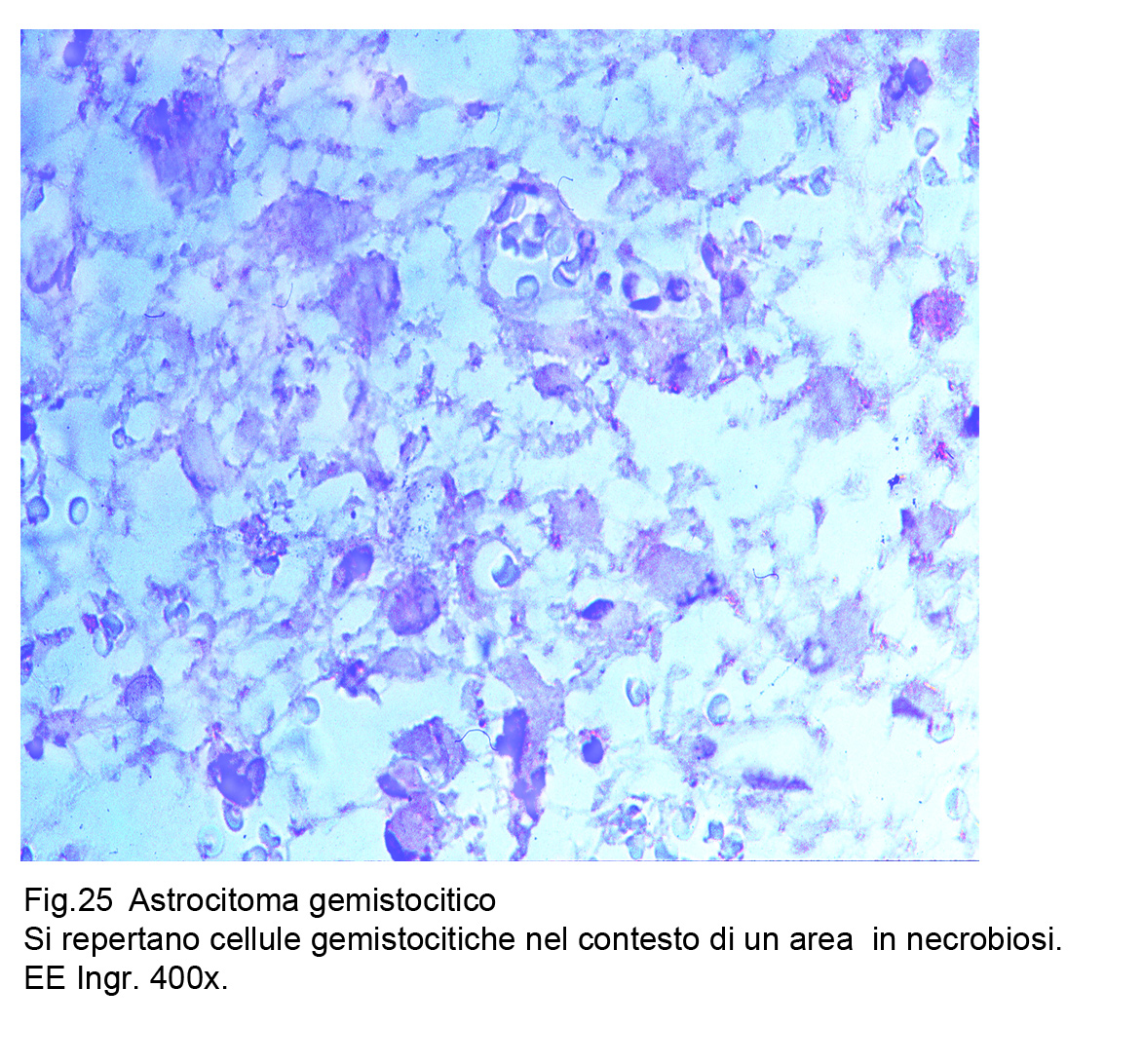
Pertanto, il significato di queste cellule nel contesto di neoplasie gliomastose richiede particolari attenzioni per dirimere l’interrogativo riguardate la loro posizione nosologica; è necessario stabilire se esse siano parti integranti della neoplasia o siano espressioni reattive, specie in conseguenza di fenomeni secondari (J. Neuropathol. Exp. Neurol, 2000, 59, 679-86). L’identificazione di cellule gemistocitiche quali parti integrate nelle neoplasie gliomatose (grado III,IV) si riversa su la valutazione prognostica; questa lettura citomorfologica deve essere completata da determinazioni genetico-molecolari di p-53, bcl-2 e dell’indice di attività proliferativa MIB-1. (J. Neurooncol., 2006, 80, 47-55).
Immunoistochimica
Mediante le metodiche di immunoistochimica è possibile rilevare nei dettagli i caratteri morfologici delle cellule, e descrivere, interpretando, eventuali processi proliferativi o i loro fenomeni regressivi fino alla citolisi.
Nei casi di astrocitoma gemistocitico si ribadisce la possibilità di evidenziare con maggiori dettagli le inevitabili differenze delle popolazioni cellulari ivi presenti pur nella loro forte univocità di una diffusa immunoespressività per la GFAP.
Fig.26 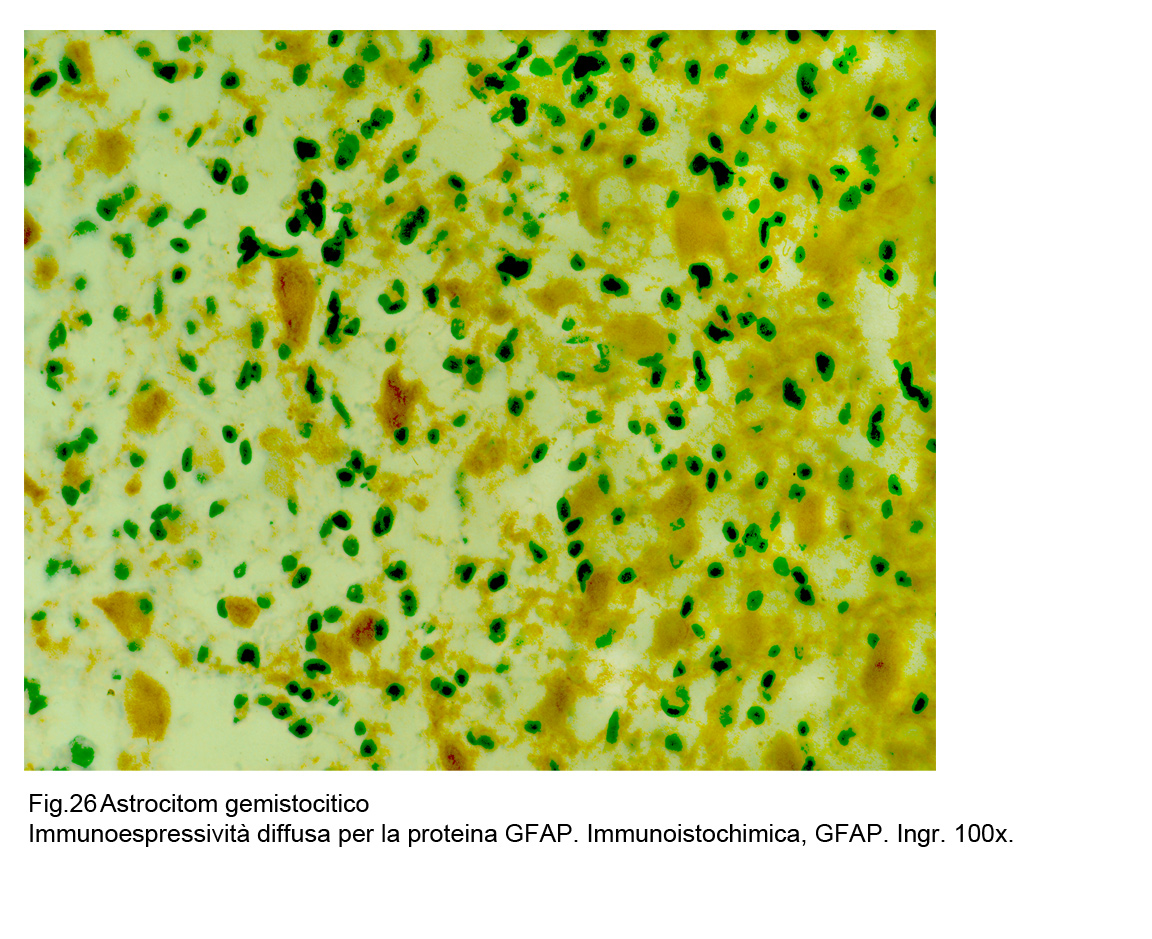
La espressività immunologica della proteina GFAP è presente in tutti gli elementi della neoplasia e con maggiore accentuazione a livello del citoplasma delle cellule gemistocitiche;
questo gradiente,assieme alla citomorfologia,consente di distinguere le forme gemistocitiche pure da quelle miste.
Fig.27 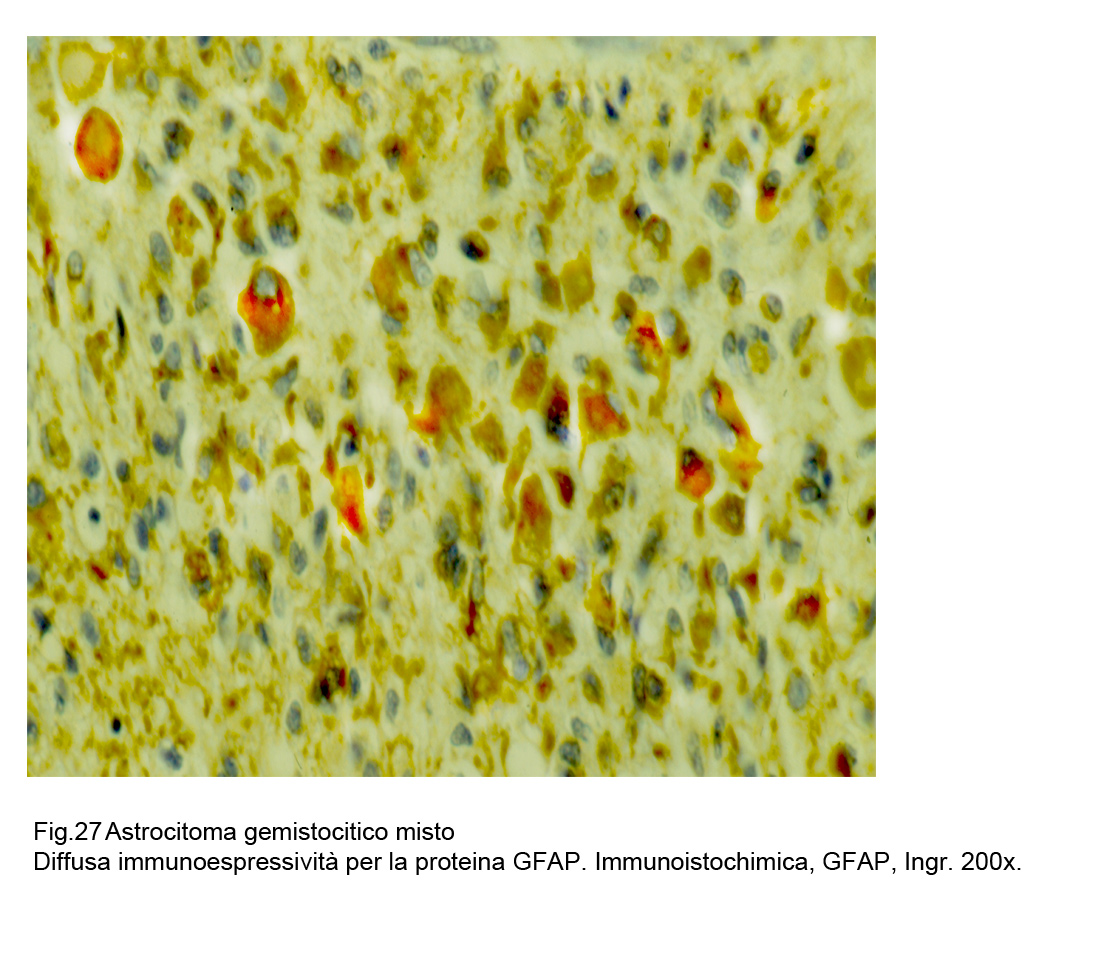 Fig.28
Fig.28 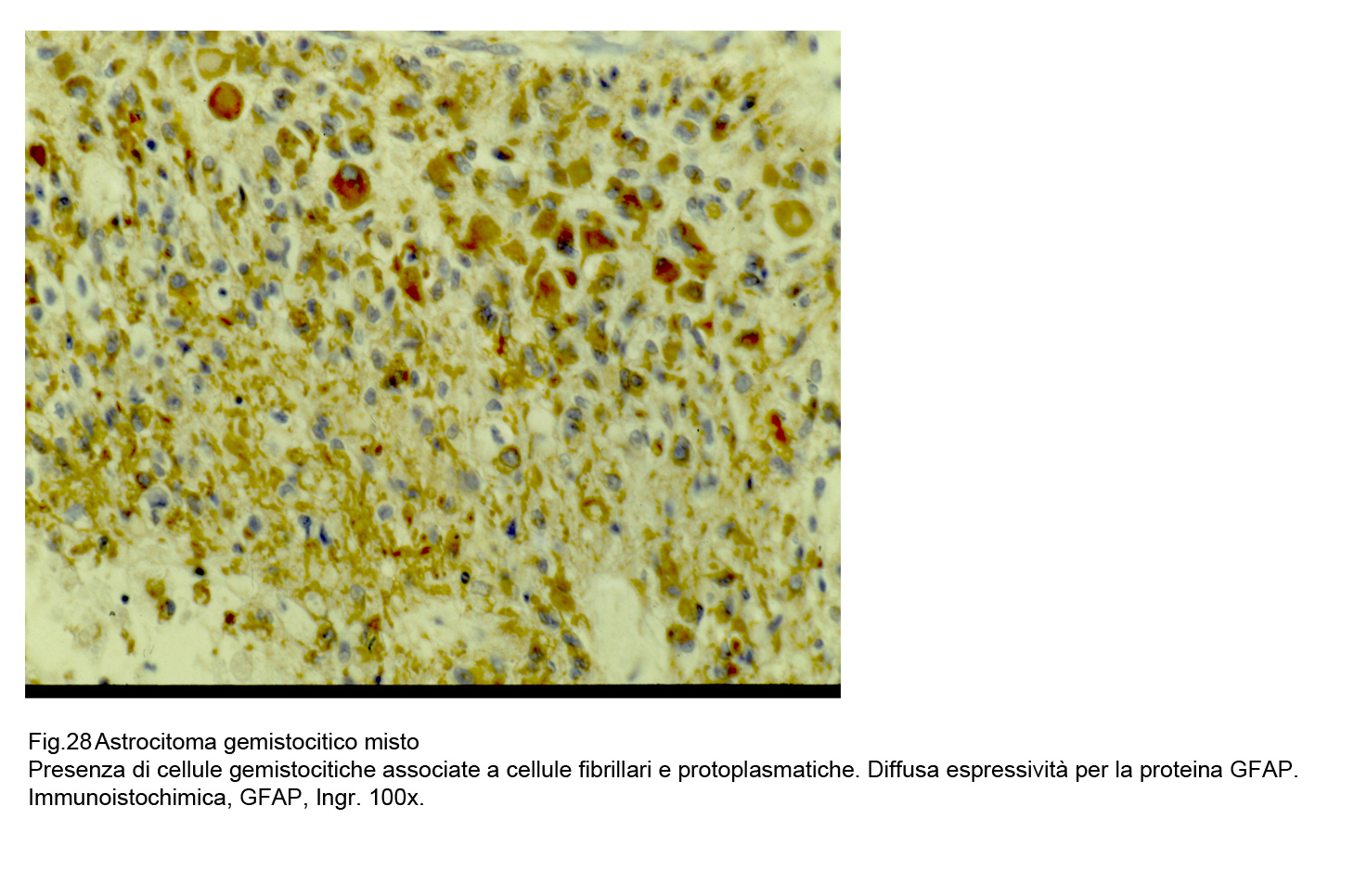
L’applicazione della espressività immunologica della Vimentina traccia in modo evidente il profilo delle cellule gemistocitiche da quelle fibrillari.
Fig.29 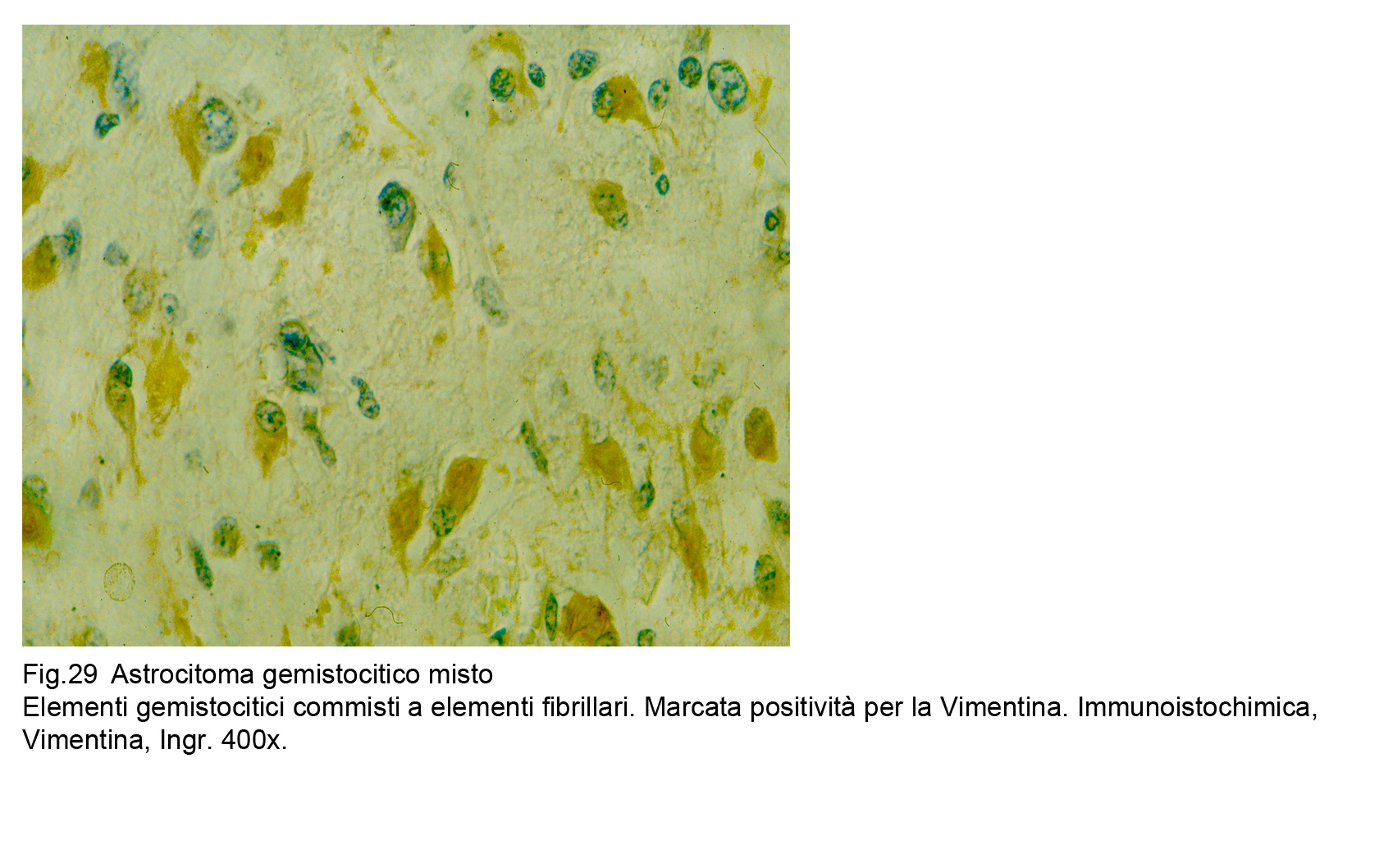
Caratteri Ultrastrutturali
Il citoplasma delle cellule con caratteri gemistocitici evidenzia al microscopio elettronico quasi esclusivamente quote iperdense di gliofibrille; queste si riuniscono in fasci di vario spessore e occupano quasi in modo globale l’area citoplasmatica e gli abituali organuli sono ridotti di numero , sono compressi e ipotrofici;questi fasci gliofibrillari sono compatti,si intersecano e sono orientati spazialmente in modo diverso secondo i tre piani ortogonali.
Fig.30  Fig.31
Fig.31 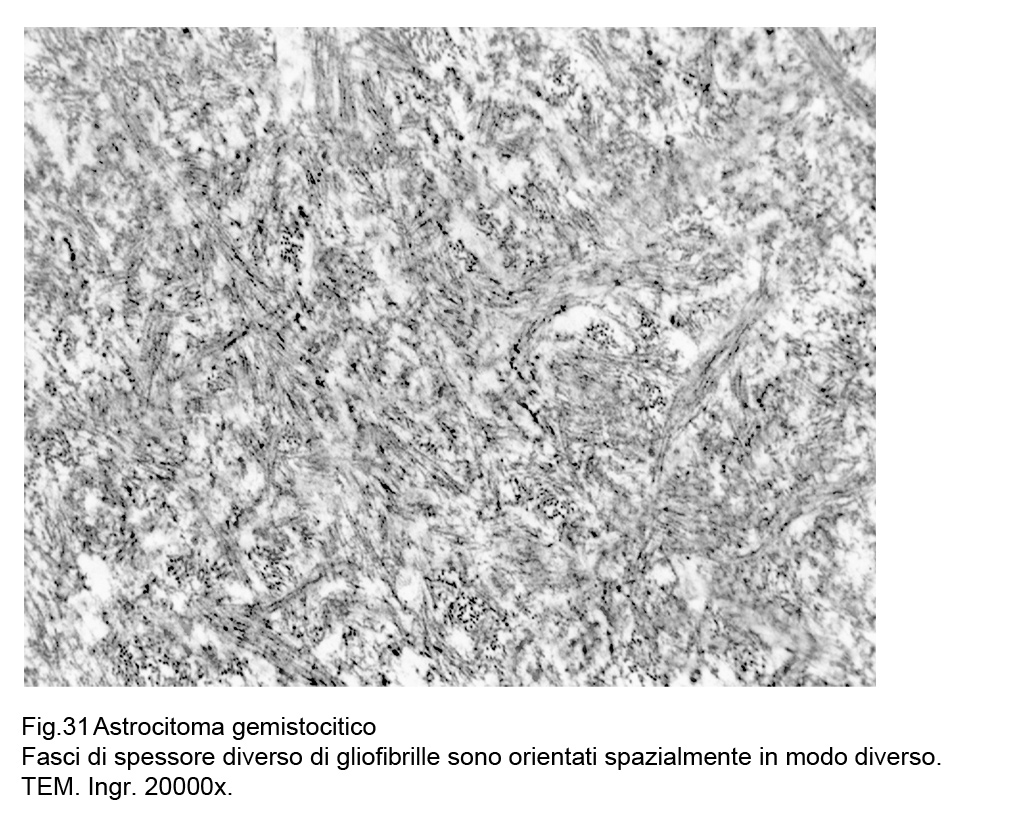
Molto frequentemente,i caratteri di queste sub-strutture vengono modificati o ridotti per il manifestarsi di episodi di edema endocellulare,rarefazione strutturale o di micro-vacuolizzazione.
Fig.32 
ASTROCITOMA PROTOPLASMATICO
Caratteri macroscopici
L’astrocitoma protoplasmatico all’esame ispettivo appare come una neoformazione molle, translucida, di aspetto gelatinoso, di colore bianco-giallastro; al taglio, le superfici di sezione possono appalesarsi di aspetto compatto oppure si rivelano essere punteggiate da numerose piccole cavità prive di pareti proprie contenenti materiale simil-mucoide. E’ possibile il riscontro di cavità pseudocistiche più ampie per la confluenza di microcisti viciniori.
I margini sono tracciabili con difficoltà poiché essi sono sfumati per la presenza di zone transizionali; spesso essi si riconoscono in quanto la neoplasia ha una consistenza molto ridotta rispetto ai tessuti sani circostanti.
Nell’accrescersi della neoplasia la corteccia cerebrale può essere infiltrata a tutto spessore e di conseguenza subire modificazioni di forma, di spessore e di consistenza con il rischio di invadere gli spazi sub-piali-e-aracnoidei.
Caratteri istopatologici
Al microscopio luce, questa neoplasia risulta essere costituita da elementi che sono simili ad astrociti protoplasmatici. Le cellule che compongono questi astrocitomi sono di media taglia, hanno una forma irregolarmente rotondeggiante o poligonale, hanno un discreto alone citoplasmatico acidofilo e sono fornite di nucleo normo-cromatinico e di forma sferoidale.
Fig.33 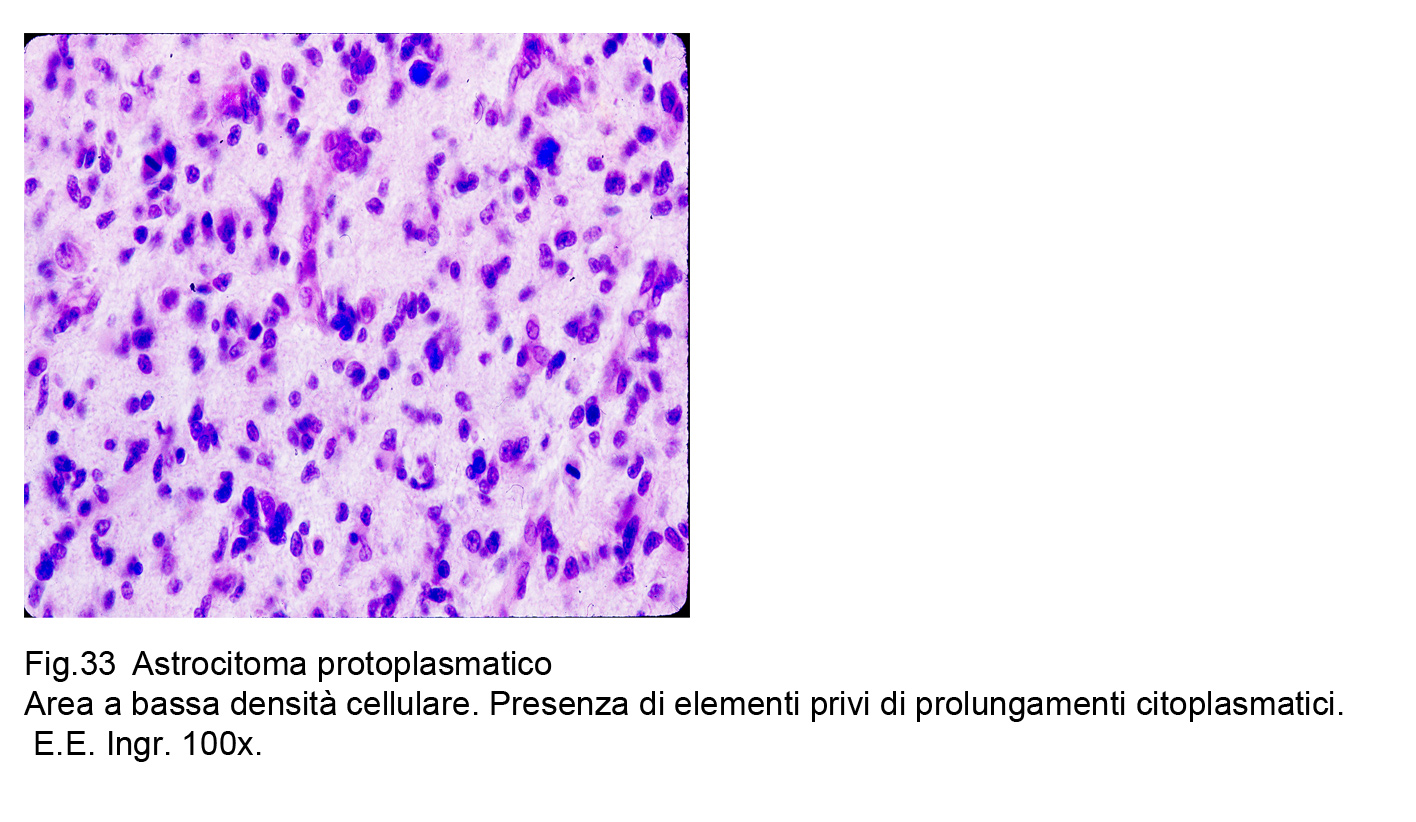
Il loro dato caratterizzante è rappresentato dalla presenza di radi e corti prolungamenti citoplasmatici che protrudono negli spazi intercellulari.
Fig.34 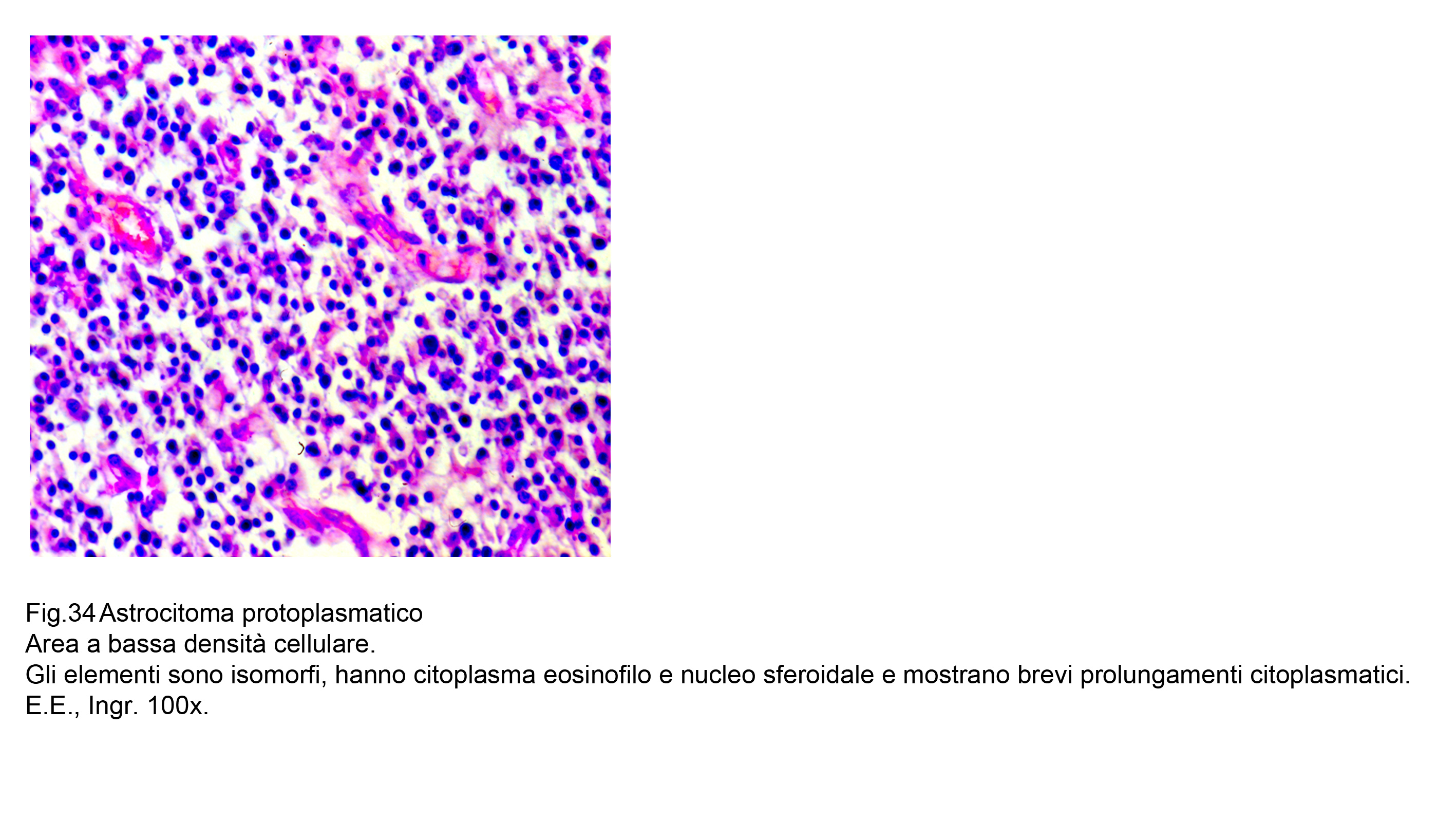
Queste cellule hanno un citoplasma frequentemente micro-vacuolizzato e sono disposte in modo da delimitare spazi intercellulari ampi, privi di gliofibrille ma occupati da materiale mucoide.
A fronte di questi abituali reperti sono riscontrabili anche casi o aree circoscritte a livello delle quali si reperta una popolazione cellulare dismorfa con pleomorfismo nucleare e presenza di elementi bi-nucleati o plurinuleati.
Fig.35 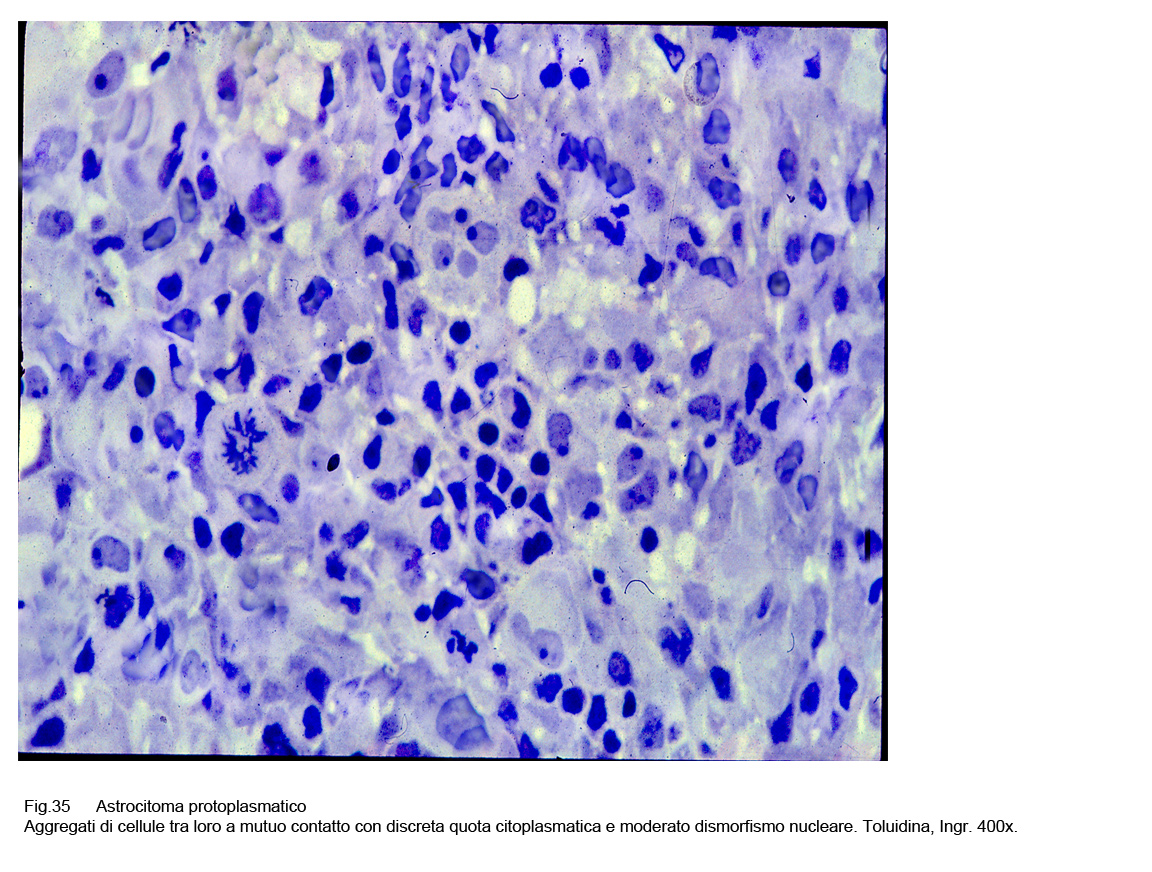 Fig.36
Fig.36 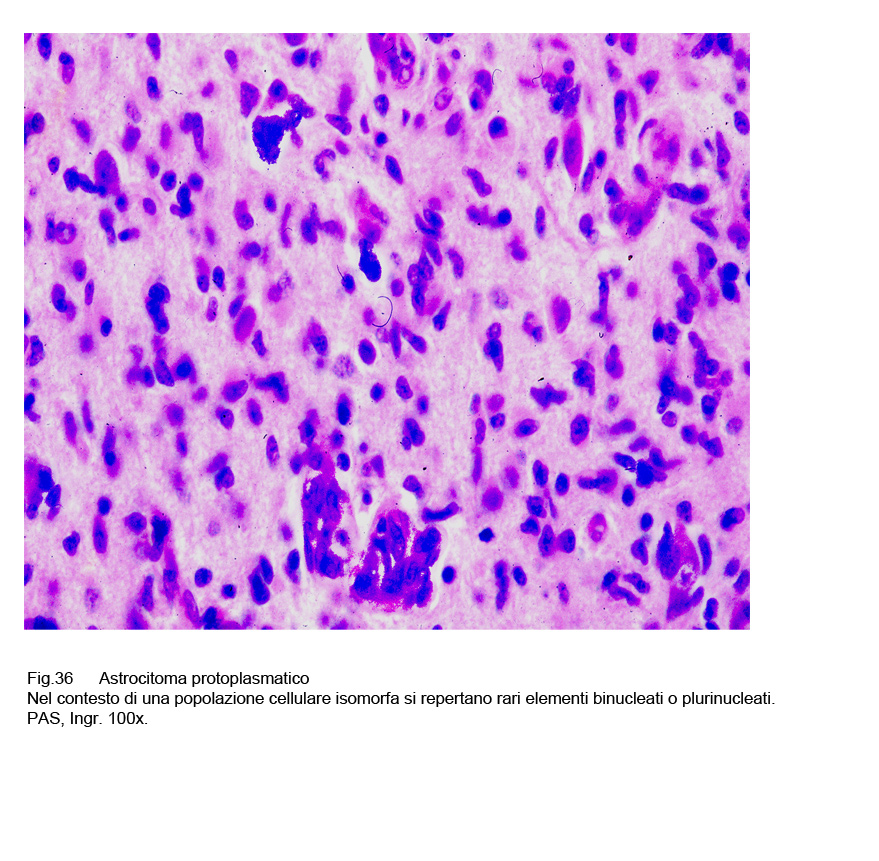 Fig.37
Fig.37 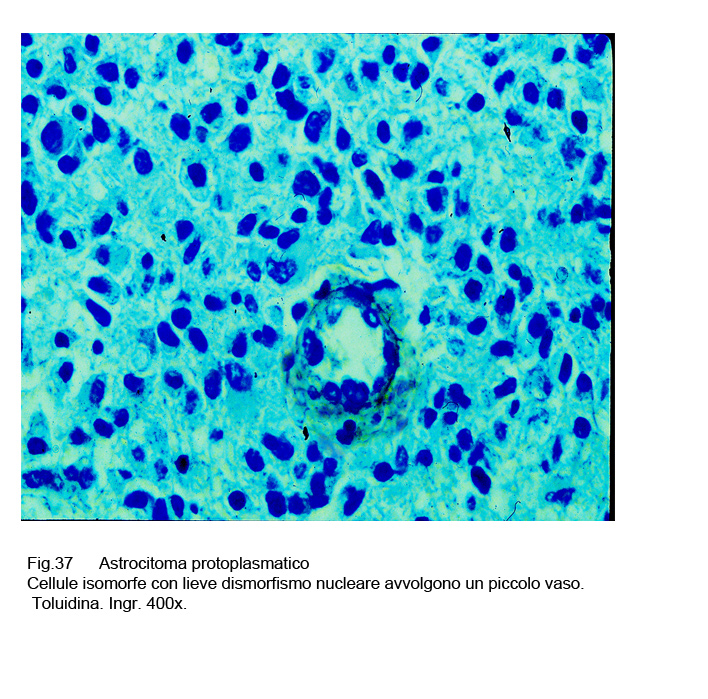
I processi di crescita sono lenti e sono conseguenti alla esistenza di rare mitosi; tuttavia le modalità di accrescimento sono infiltranti con dissociazione,scompaginamento,distruzione delle microstrutture preesistenti.
Anche gli astrocitomi protoplasmatici sono distinguibili in forme pure e forme miste. Le prime, più rare, sono composte esclusivamente da una popolazione di astrociti protoplasmatici; le seconde, più frequentemente riscontrabili, si rivelano essere costituite da astrociti protopalsmatici commisti ad astrociti fibrillari e/o gemistocitici.
Profilo immunoistochimico
Le cellule dell’astrocitoma protoplasmatico evidenziano una immunoespressività per la GFAP discontinua, focale e di basso grado , invece evidenzia una netta immunoespressività per la Vimentina.
Fig.38 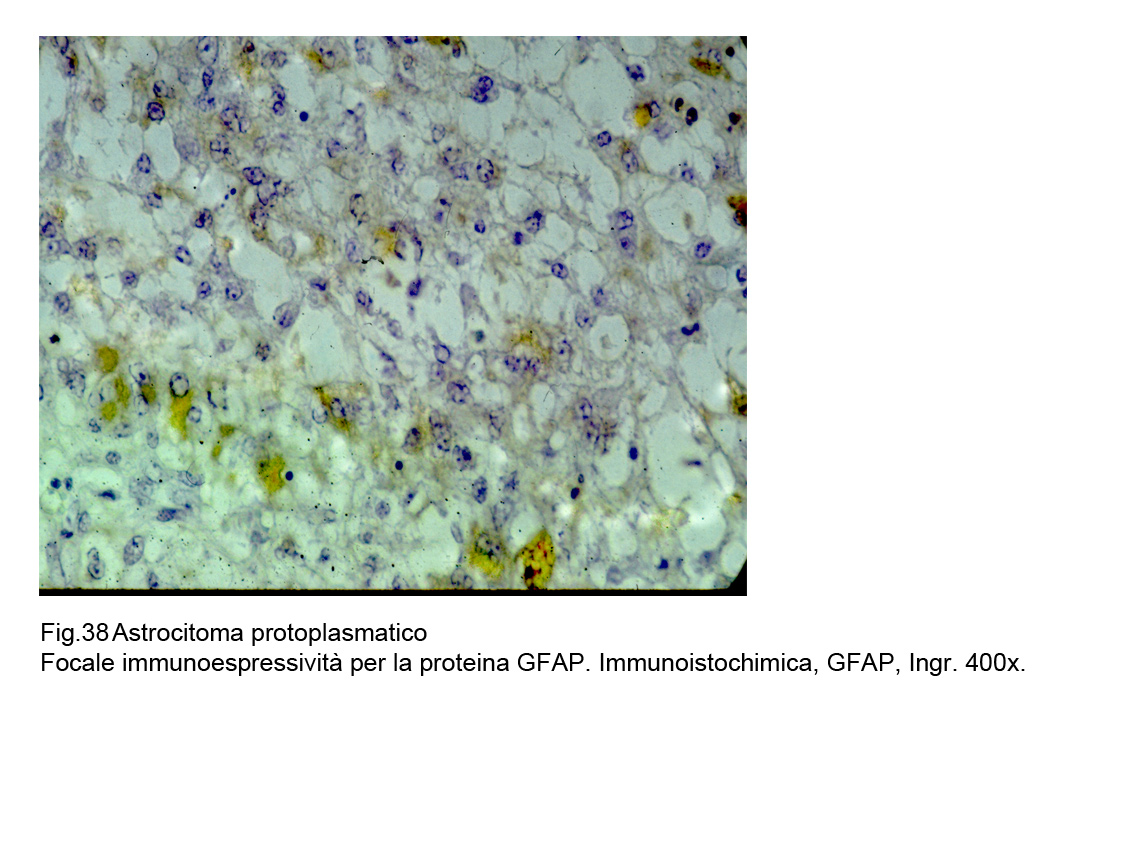 Fig.39
Fig.39 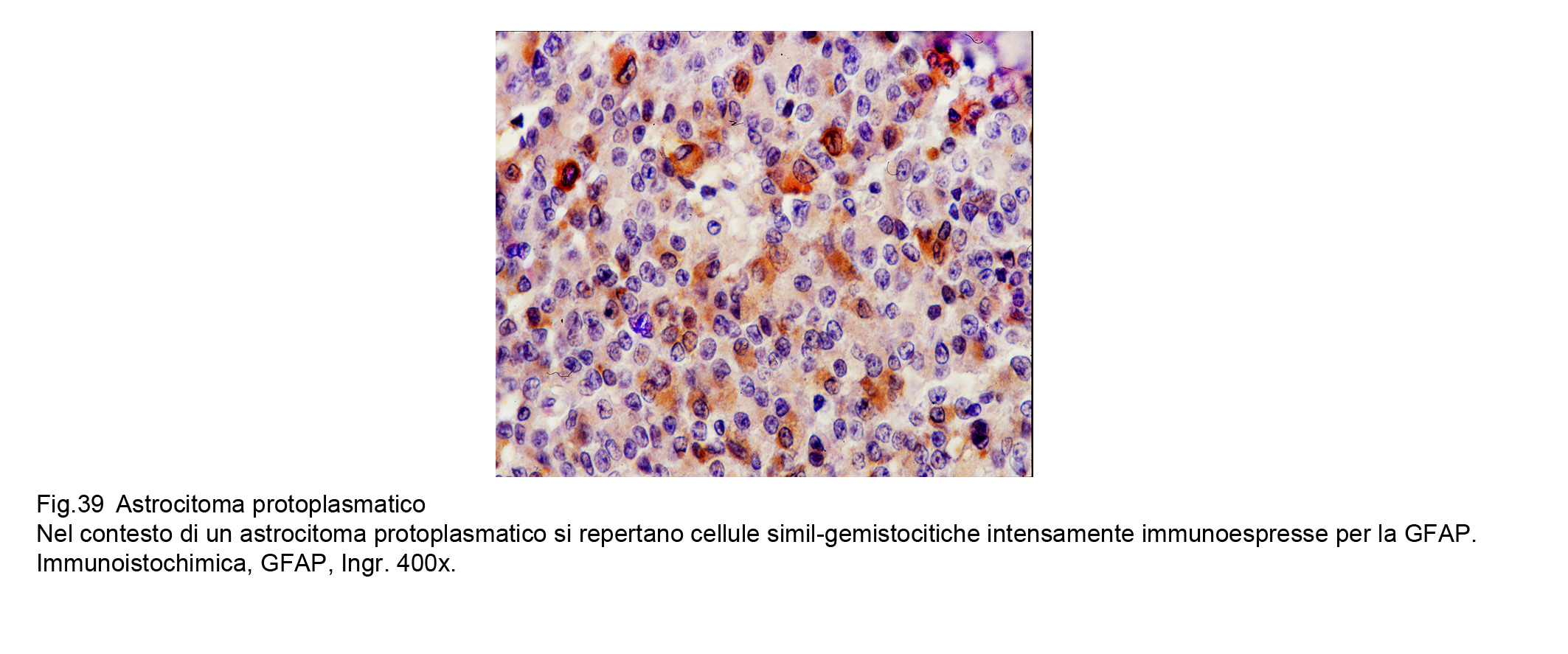
Fig.40 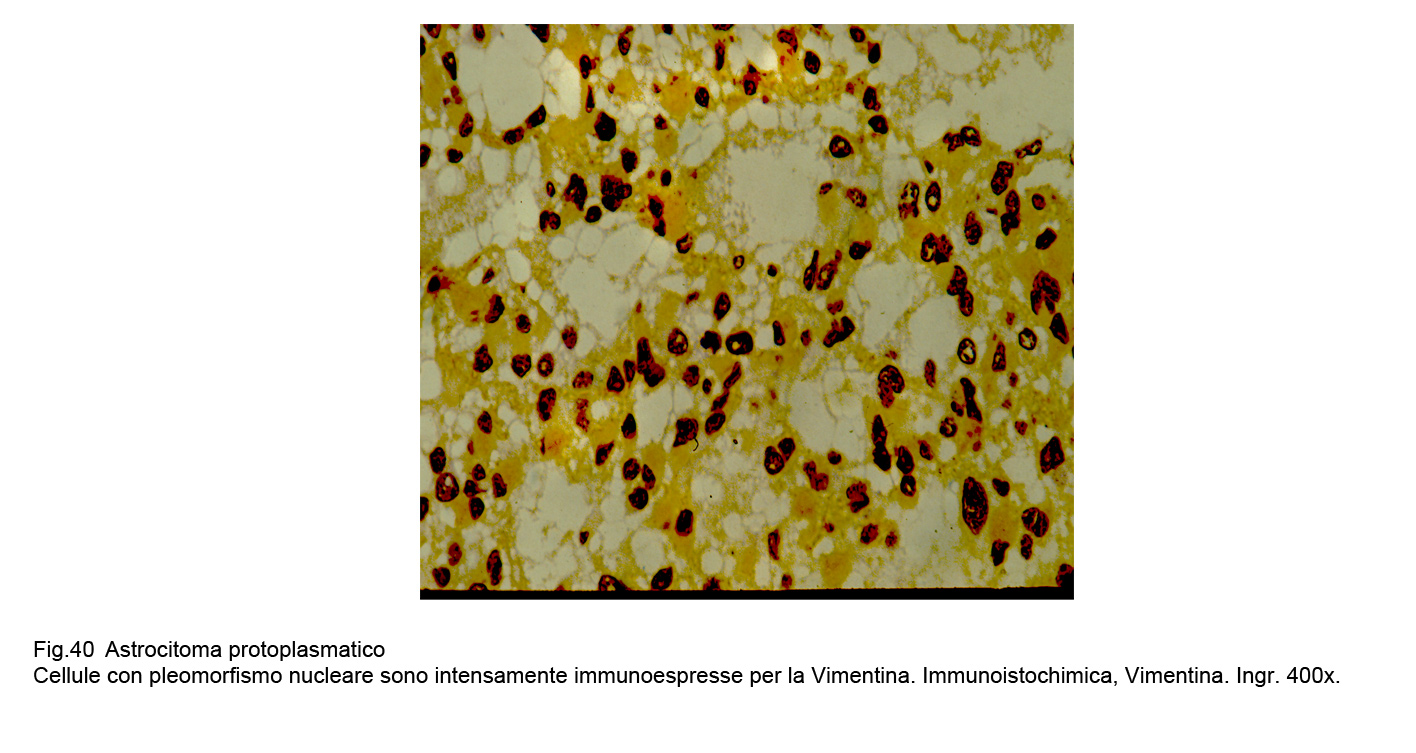
Mediante l’applicazione della espressività immunologica per la Fibronectina è possibile documentare e analizzare la struttura delle pareti dei vasi e del loro rivestimento endoteliale.
Fig.41 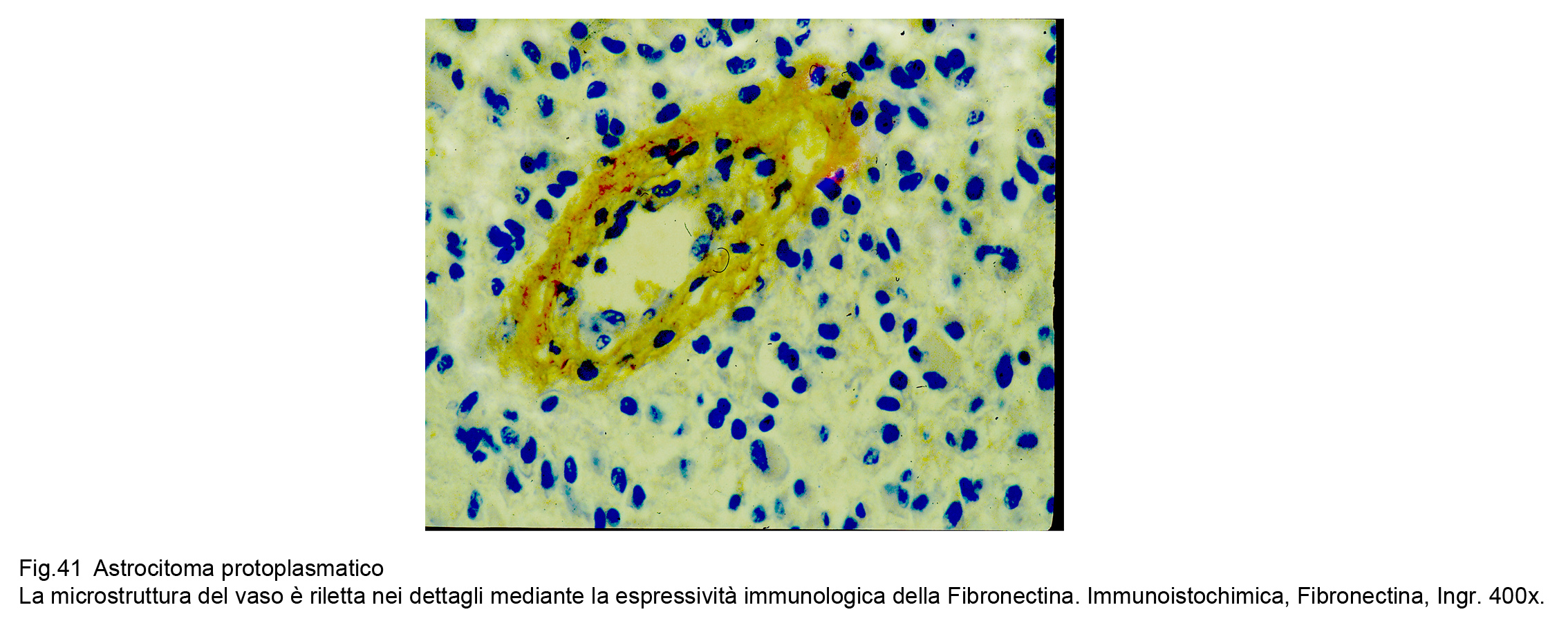
Caratteri ultrastrutturali
Le cellule di questa variante di astrocitoma al microscopio elettronico evidenzia un citoplasma con brevi estroflessioni e una ridotta coesione intercellulare. La matrice citoplasmatica è fornita di quote ridotte di organuli quasi prive di gliofibrille.
Fig.42 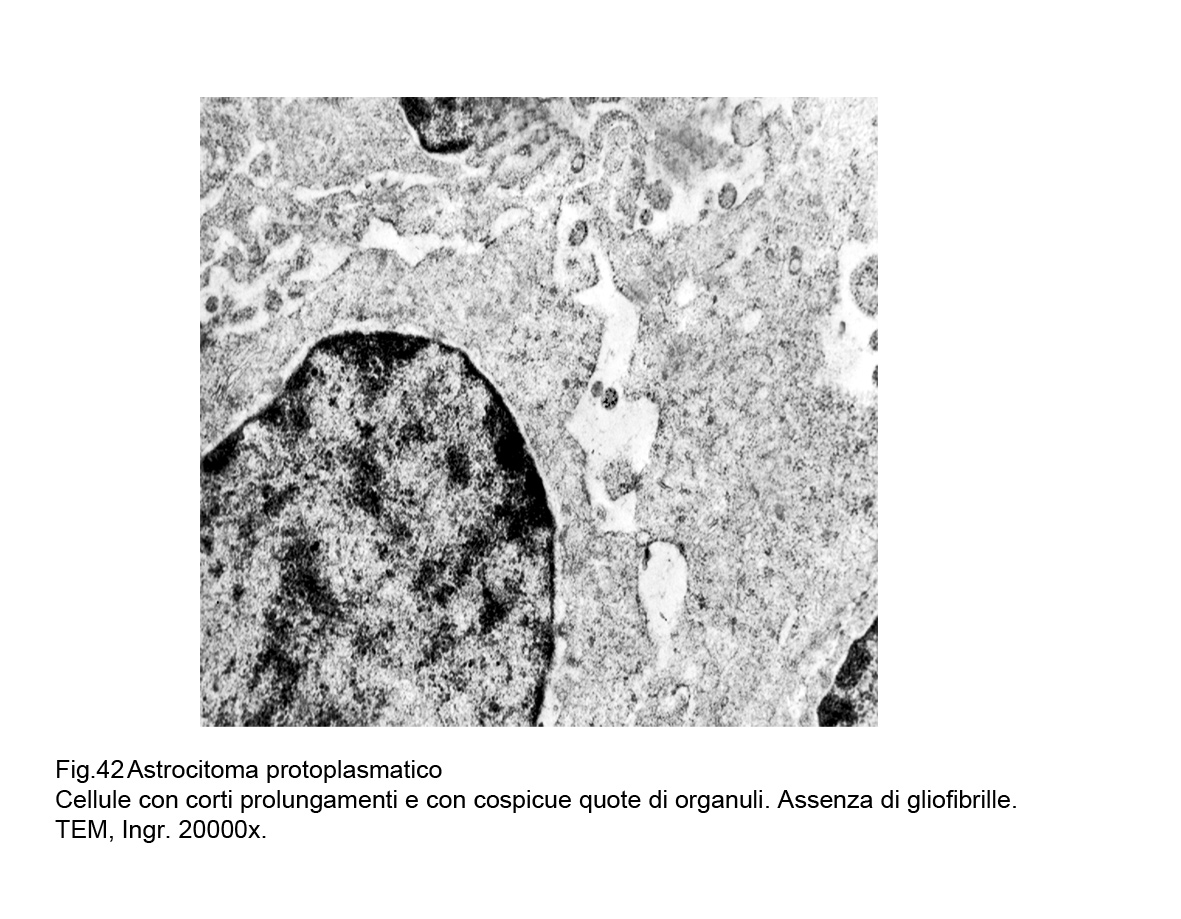
PROFILO GENETICO-MOLECOLARE
Mediante opportune indagini genetico-molecolari è possibile ricavare i dati diagnostici specifici di ogni variante degli astrocitomi diffusi e stabilire in modo predittivo il loro arco di sopravvivenza.
Allo stesso modo è possibile sceverare negli astrocitomi a doppia componente citologica le due popolazioni anche se tra loro strettamente commiste.
Secondo quanto è riportato in letteratura gli astrocitomi diffusi esplicitano la seguente caratterizzazione genetica:
Mutazione di TP53 e di IDH
Perdita di PTEN
Incremento di PDGFR
Metilazione del promoter p14 e MGMT
Amplificazione del cromosoma 89
Amplificazione di EGFR
Amplificazione dei Fattori MIR-200b, CREB-1
(Human Pathol. 2014, 45, 2154-61)
(Adv. Amat. Pathol., 2015, 22, 50-8)
(Cancer Treat. Res., 2015, 163, 15-30)
Gli astrocitomi gemistocitici presentano un assetto genetico-molecolare maggiormente composito; infatti, oltre ai caratteri dianzi elencati, evidenziano anche le seguenti modificazioni genetiche:
Perdita della eterozigosità 10q
Perdita di 1p/19q
Delezione dei geni BRAS e ERCC1.
(J. Neuropathol. Exp. Neurol., 2014, 73, 208-16)
Le metodiche genetiche forniscono informazioni anche circa la esistenza di fasi di transizione delle cellule verso futuri trasformazioni verso quadri di anaplasia.
A tal proposito sono state documentatele seguenti fasi di passaggio da astrocitoma grado II a quello di grado III :
Incremento di PDGFR
Mutazione del gene TP53
Amplificazione del cromosoma 8q
Metilazione del promoter p14 e MGMT
Mutazione di IDH e ATRX
Grado di espressività del recettore di membrana Notch4
(Cancer, 2004, 101, 1028-33)
(WHO,2007)
(Adv. Anat. Pathol., 2015, 22, 50-8)
Mediante le metodiche di genetica è possibile tracciare il ritmo di crescita e di evoluzione degli astrocitomi diffusi.
L’acquisizione di questi dati è fornita dal grado di espressività del PC4, in quanto esso è coinvolto nei processi di riparazione e di replica del DNA.
(J. Neurol. Sci., 2014, 346, 293-8)
E’ possibile pervenire ai risultati circa il ritmo di crescita di questi tumori mediante il tracciante e le aberrazioni semplici o complesse dei cromosomi X e Y, 3, 4, 6, 11.
(Genes., Chromosomes Cancer, 2011, 50, 409-20).
I reperti di genetica dianzi elencati forniscono anche informazioni prognotiche; tra questi sono maggiormente citati in letteratura le seguenti alterazioni:
Mutazione di IDH
Codelezione 1p/19q
Metilazione MGMT
Espressività del PC4.

