Alterazioni mitocondriali in reperti
di medulloblastoma classico
Osservazioni ultrastrutturali
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica
Lo stato bioenergetico delle cellule di organismi eucarioti può essere studiato mediante diversi metodi e tra questi può essere utilizzato anche quello della morfologia ultrastrutturale.
Attraverso l’ultrastruttura si ha la possibilità di esaminare lo stato di organelli endocellulari quali l’ergastoplasma, il reticolo endoplasmico, il patrimonio mitocondriale, l’apparato del Golgi, il sistema lisosomiale, senza tralasciare i rilievi su il citosol, il citoscheletro, i microtubuli, la membrana plasmatica e le sub strutture giunzionali,e senza trascurare i rapporti interattivi tra le cellule parenchimali e quelle stromali oppure tra cellule e capillari o liquidi interstiziali.
Mediante le metodiche di microscopia elettronica,le substrutture endocellulari dianzi elencate, dopo essere state individualmente esaminate, possono essere osservate e valutate secondo un criterio sistemico-globale in quanto interagiscono tra loro, sono interdipendenti al fine di garantire uno stato di omeostasi permanente; infatti, una disfunzione di uno di questi organelli può innescare processi biomorfologici complessi, destrutturanti, progressivi, processi che possono concludersi con uno dei tipi di morte cellulare.
Tra questi organelli, i mitocondri hanno ruoli morfofunzionali indispensabili per la sopravvivenza della cellula, in quanto sono produttori di bioenergia.
Essi sono dinamici, cambiano forma e si distribuiscono nel citosol a seconda degli stati metabolici della cellula; questo dinamismo morfologico, a seconda delle necessità, riguarda tutti i comparti dei mitocondri, coinvolgendo anche le creste che continuamente si rimodellano. (Oncogene, 2006; 25: 4705-4716)
Una importante manifestazione di tale dinamismo è data dai processi di fusione e fissione, i quali sono finalizzati a mantenere in uno stato di equilibrio l’apparato mitocondriale e le conseguenti attività morfofunzionali dell’intera cellula; processi questi regolati da proteine della famiglia BCL-2. (Cell Death and Differentiation, 2008; 15: 1147-1152).(Cell,2012;148:1145-1159).
E’ stato osservato e segnalato che nel gioco di tali equilibri biologici un eccesso di fissione mitocondriale è associato a malattie degenerative e a fenomeni regressivi delle cellule (Science, 2011; 334: 358-362).
I mitocondri hanno contatti interattivi con altri organelli quali lisosomi, perossisomi, apparato del Golgi e si lasciano avvolgere e spostare dal citoscheletro e dai fluidi del citosol; ma il contatto interattivo di maggiore frequenza e importanza è tra mitocondri e reticolo endoplasmico, contatto indicato con l’acronimo MAM= Mitochondrial- Associated- ER- Membranes.
Questi punti di contatto di interfacce, indicati con l’acronimo MAM, non sono statici, inerti ma svolgono funzioni di comunicazione molecolare finalizzate a regolare i processi morfo-funzionali dei mitocondri e del reticolo endoplasmico.
Essi contribuiscono a modulare la morfologia dei mitocondri, lo eventuale stato di stress dell’ER, la sintesi lipidica, l’omeostasi del Ca+2,e l’attivazione dell’autofagia con la partecipazione di diverse proteine tra le quali le MFN-1, MFN-2, DRP-1. (Science, 2011; 334: 358-362),(Biochimica et Biophysica Acta – Bioenergetic, 2014; 1837: 461-469).
Tra le numerose attività, nei siti di contatto tra ER e mitocondri, hanno inizio i processi di fissione con la formazione di substrutture indicate con l’acronimo ERMES (ER- Mitochondria- Encounter- Structure). (Cell Cycle, 013; 12: 3131-3132).
I mitocondri nelle loro molteplici funzioni sono bidirezionali: da un lato garantiscono il metabolismo energetico, dall’altro svolgono ruoli non secondari nei processi di degradazione e morte cellulare. Così, per es., controllano il processo di apoptosi intrinseca, mediante il rilascio di fattori pro-apoptotici, quali il citocromo C e la attivazione delle caspasi.
In diverse condizioni para-fisiologiche o patologiche, i mitocondri sono esposti a modificazioni morfo-funzionali di tipo regressivo. Una delle più frequenti è data dalla permeabilizzazione della loro membrana esterna, indicata con l’acronimo OMM (Outer Mitochondrial Membrane) per la abnorme apertura di pori indicati con lo acronimo MPT (Mitochondrial Permeability Transition).
Si ritiene che questa alterazione sia associata alla presenza di proteine misfolding a livello dei pori di tali membrane,le quali modificano così la normale selettività dell’osmosi molecolare.
Tale permeabilizzazione provoca danni quali la depolarizzazione mitocondriale, il rilascio di citocromo c e fattori apoptogenetici e mitofagici (Oncogene, 2004, 23: 2850-2860) (Arch. Biochem. Biophys, 2007; 462:245-253).
Oltre i suddetti danni, lo stato di permeabilizzazione induce il rigonfiamento mitocondriale per l’arrivo di fluidi dal citosol coinvolgendo anche la membrana mitocondriale interna. In conseguenza di questo progressivo rigonfiamento si può pervenire a rottura della membrana esterna con rilascio dei contenuti molecolari ed erniazione delle membrane interne. (Anat. Rec. 2012; 295: 1647-1659).
Allorquando questo processo di permeabilizzazione si estende anche a carico delle membrane interne provoca modificazioni del ROS (Reactive Oxygen Species), prodotto capace di indurre mutazioni del DNA-mitocondriale, oltre ad altre disfunzioni. (Arch. Biochem. Biophys. 2007; 462: 245-253).
Questa breve introduzione su le disfunzioni e le alterazioni ultrastrutturali dei mitocondri è stata una premessa indispensabile per presentare le acquisite osservazioni circa le alterazioni mitrocondriali presenti in cellule neoplastiche maligne ad alta attività proliferativa e con elevata quota di mitocondri, quali quelle del medulloblastoma. E associare a queste alterazioni mitocondriali quelle degli altri organelli con concrete possibilità evolutive verso forme di autofagia,destrutturazione citoplasmatica e morte cellulare.
REPERTI
Il medulloblastoma è un tumore embrionale del Sistema Nervoso Centrale; esso può essere valutato e classificato secondo metodi di istopatologia o secondo quelli genetico-molecolari.
La classificazione secondo i metodi di istopatologia, elaborata dal WHO (2016), si articola secondo i seguenti istotipi:
Medulloblastoma classico
Medulloblastoma desmoplastico-nodulare
Medulloblastoma a nodularità estensiva
Medulloblastoma a cellule larghe/anaplastiche
I reperti osservati al microscopio elettronico e qui di seguito descritti, riguardano casi di medulloblastoma classico.
Come al microscopio luce, anche al microscopio elettronico è possibile documentare lo stato di ipercellularità che caratterizza questa neoplasia. Si osserva, infatti, la presenza di una popolazione cellulare iperdensa, disposta spazialmente in modo disordinato, anzi casuale.
Le cellule sono abitualmente di piccola taglia, hanno una forma ovoidale o rotondeggiante con livelli diversi di dismorfismo: tutte sono fornite di un nucleo voluminoso, vescicoloso il quale è avvolto da un sottile lembo di citoplasma. Una delle cellule è occupata da un voluminoso auto lisosoma.
Fig.1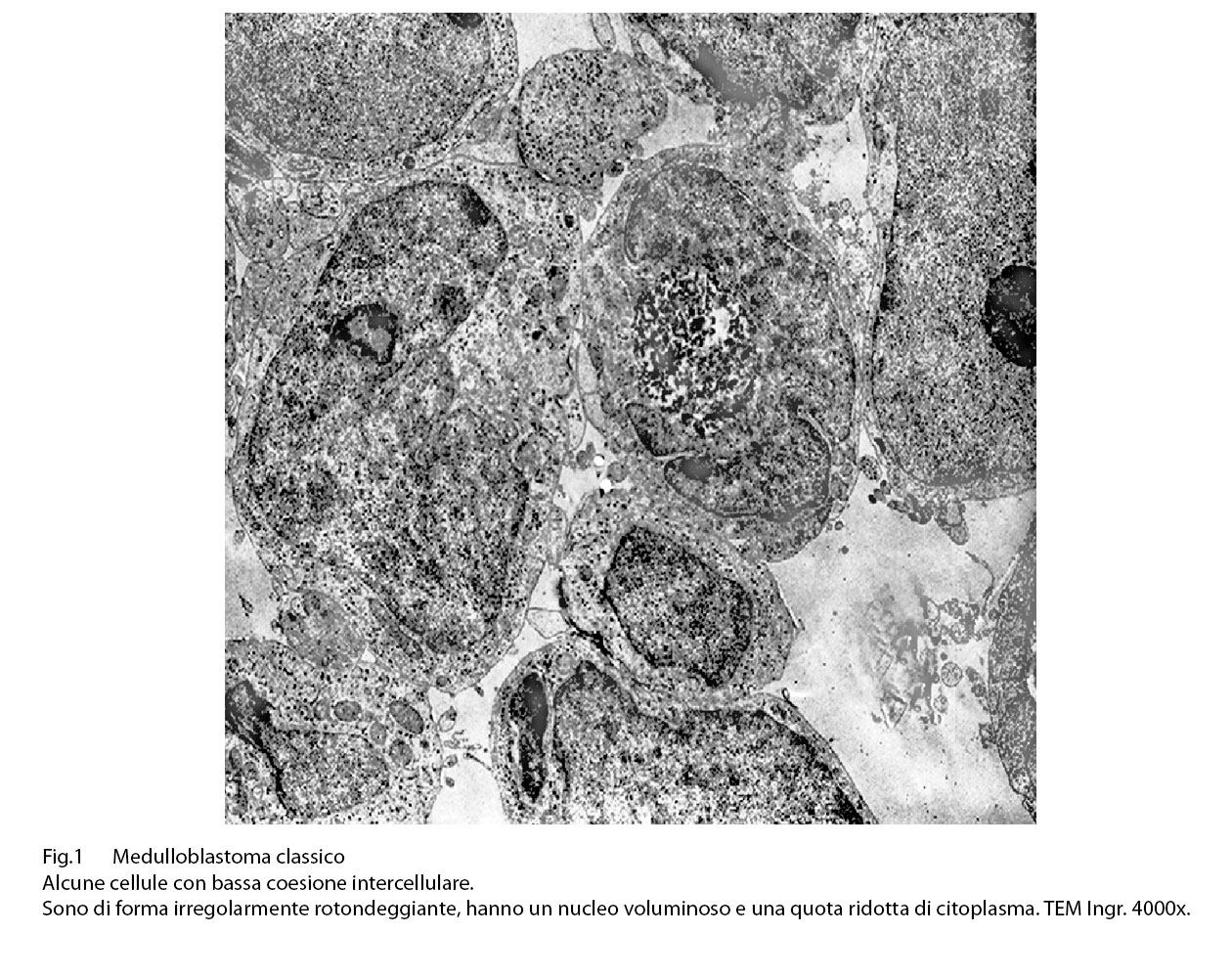
Questo citoplasma è formato dal citosol e dagli abituali organelli endocellulari con una prevalenza di mitocondri,spesso dismorfi e danneggiati.
Fig.2 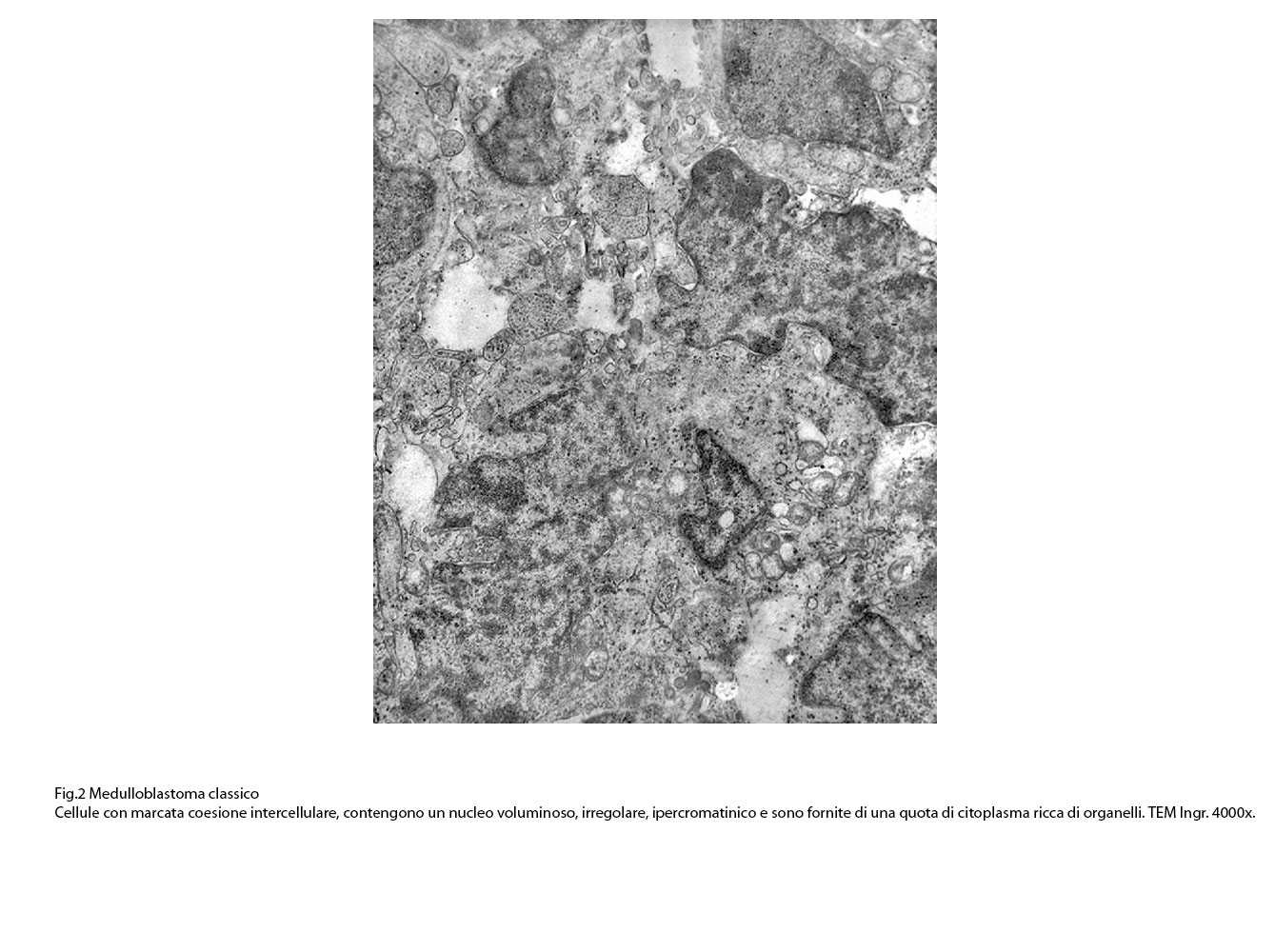
Le superfici delle cellule sono delimitate da una membrana plasmatica ben netta e in alcuni campi microscopici essa presenta estroflessioni del citoplasma che si aggettano negli spazi intercellulari. L’aggregazione di questi elementi varia da zona a zona della neoplasia: si repertano campi microscopici a livelli dei quali le cellule sono scarsamente tra loro adese o addirittura sono isolate; in altri appaiono tra loro coese con presenza anche di strutture giunzionali; non mancano campi microscopici i quali sono occupati da elementi disposti in modo circolare in modo da delimitare uno spazio cavo centrale, dando una immagine di pseudo-rosetta.
Fig.3 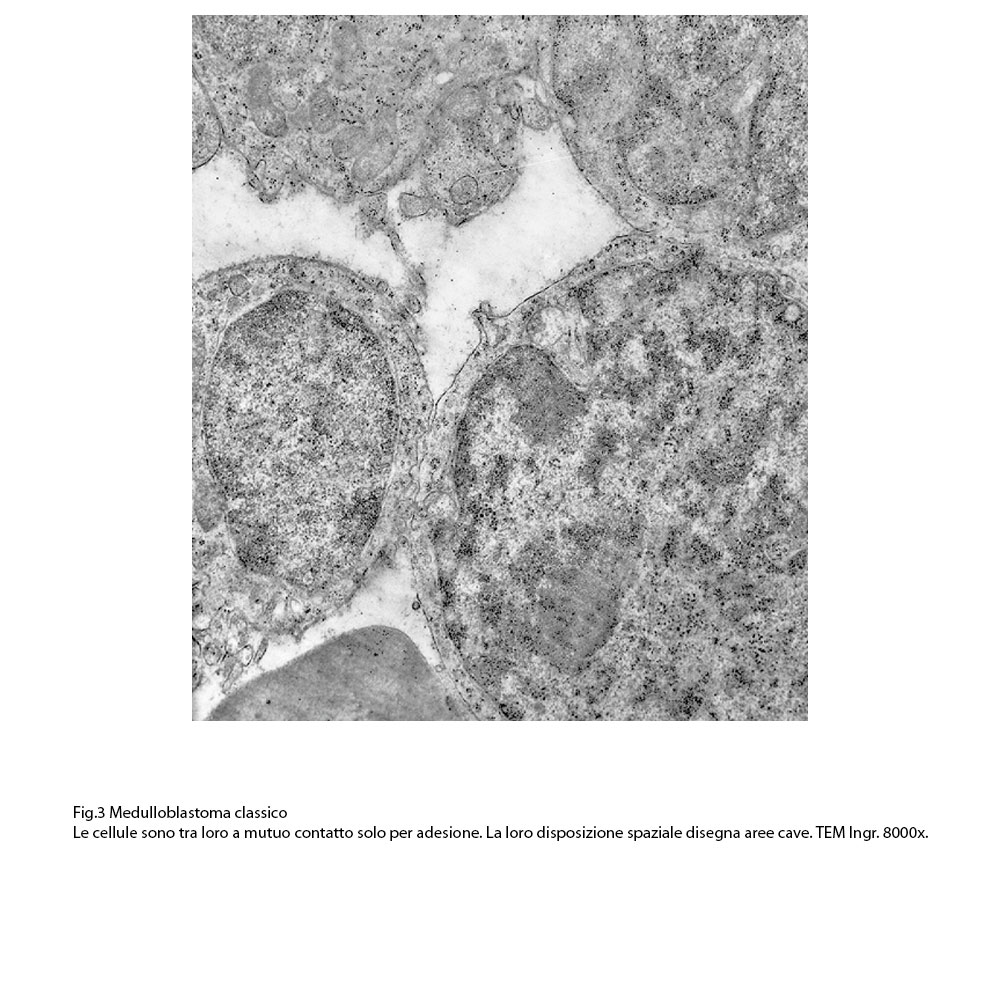 Fig.4
Fig.4 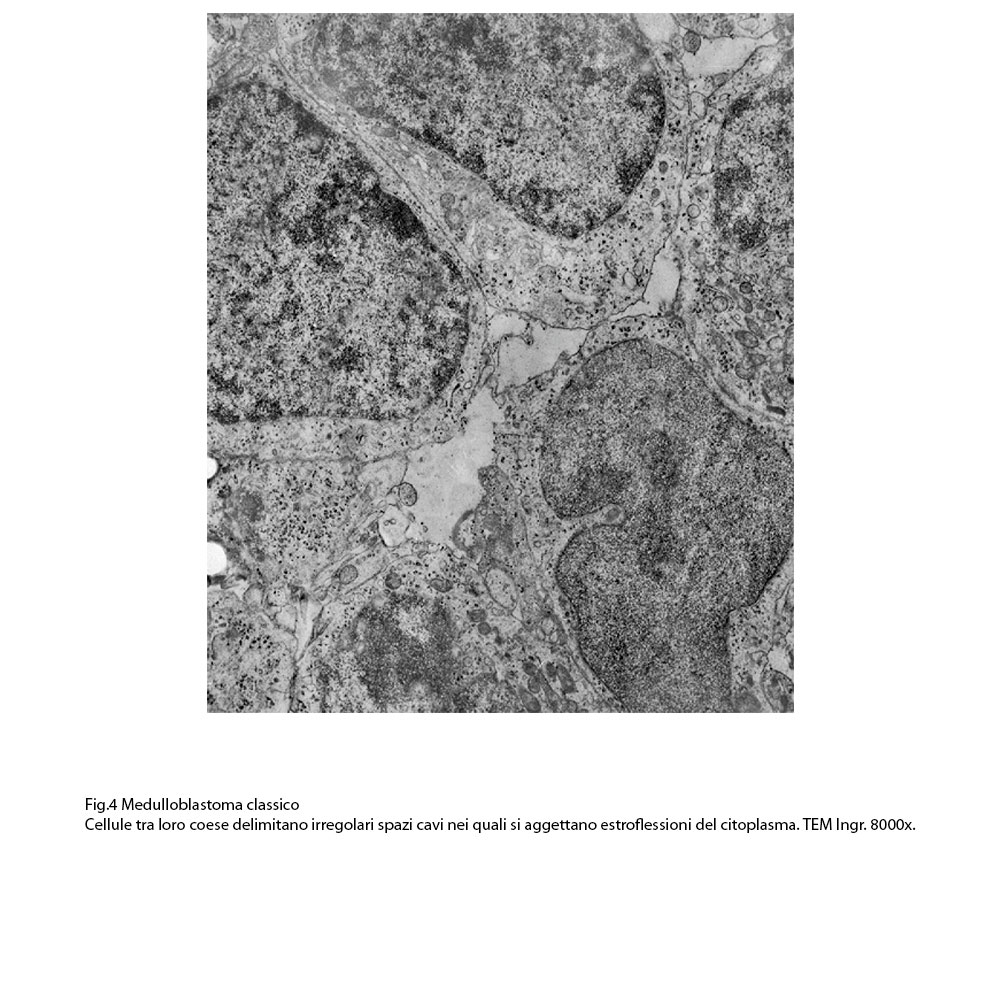
Fig.5 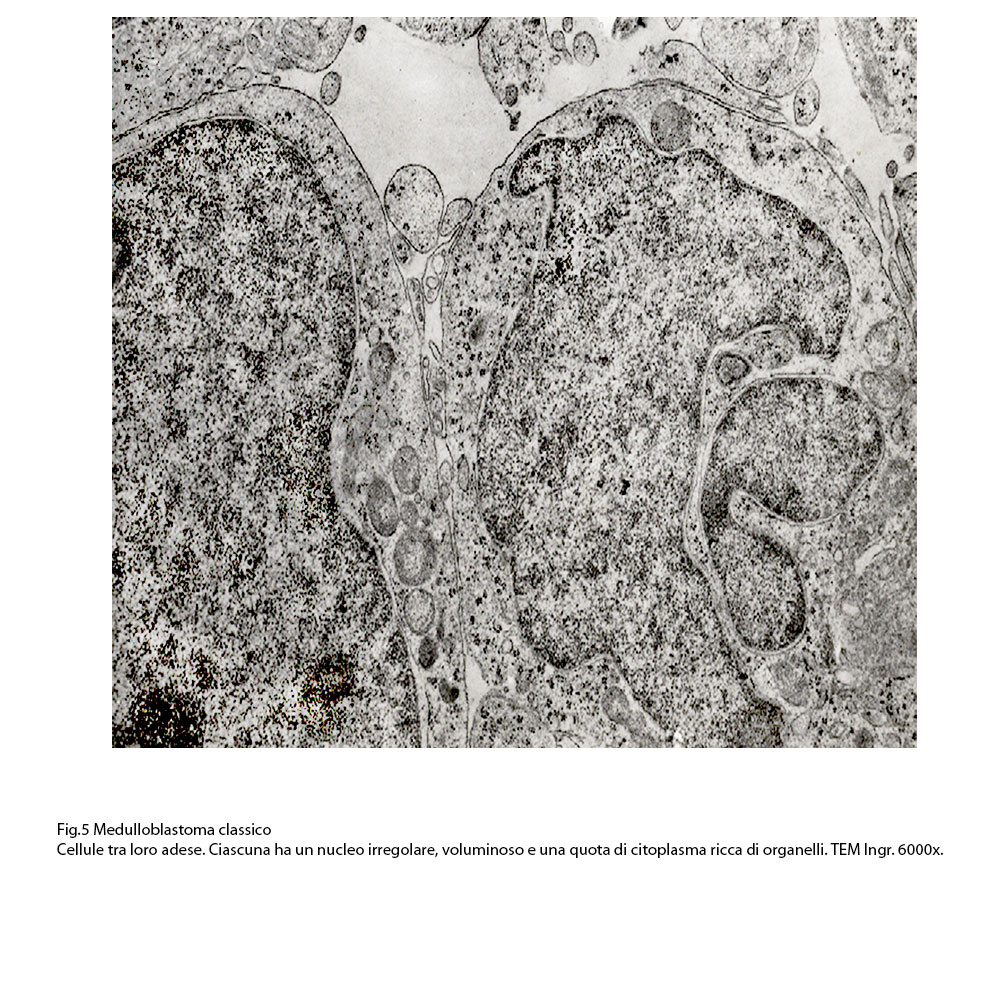 Fig.6
Fig.6 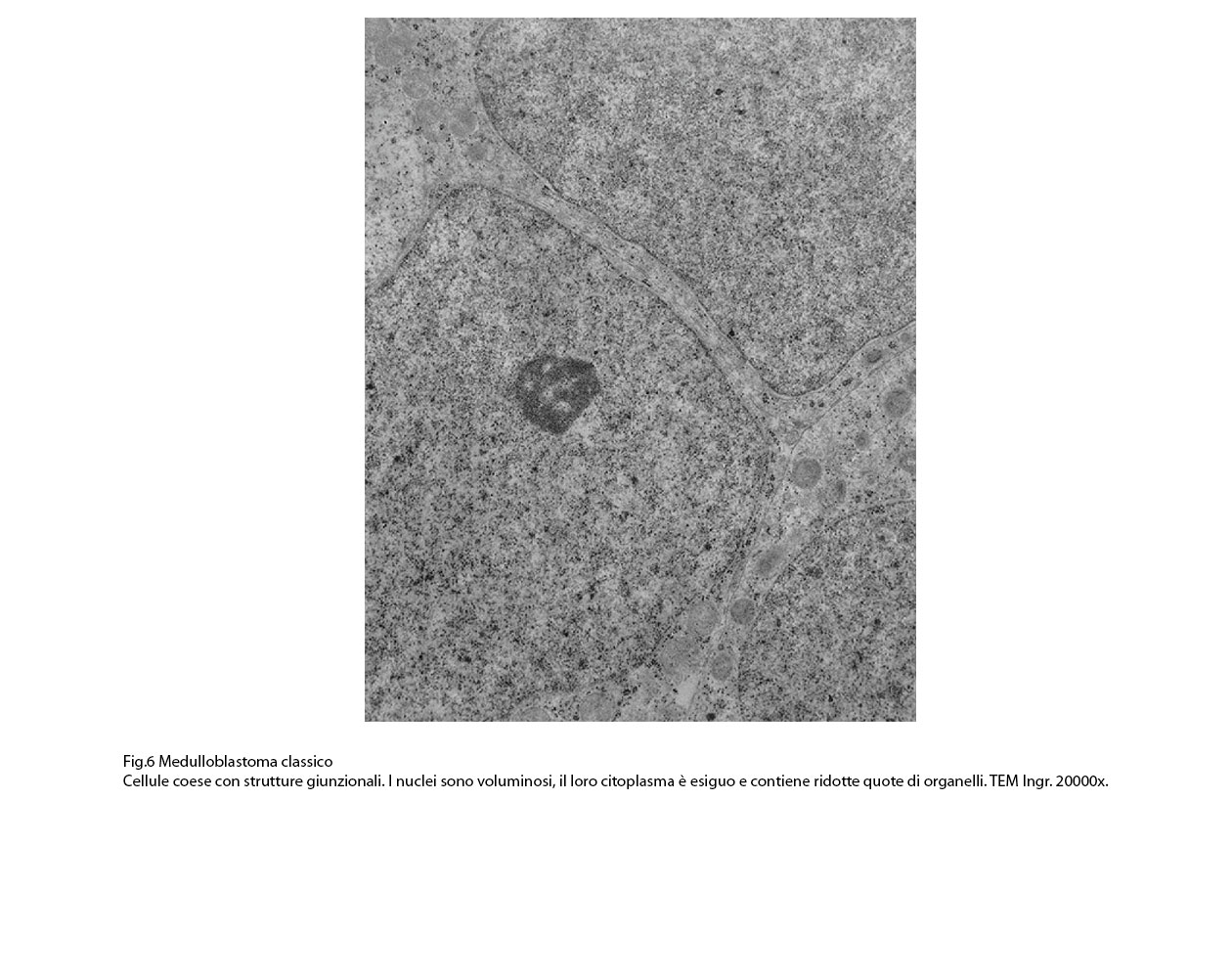
Dopo queste brevi note introduttive, il discorso descrittivo si rivolge a valutare lo stato morfologico dei mitocondri, sia nella loro singolarità sia nel loro rapporto con le altre sub-strutture del citoplasma.
I reperti, pur nella loro variabilità, sono frequenti e ripetitivi, pertanto è possibile procedere a riassumere gli aspetti maggiormente presenti e descriverli nei seguenti punti:
- Presenza di alcune cellule contenenti molti mitocondri immersi in un citosol uniformemente compatto. Questi mitocondri sono cilindrici, fusati, ricchi di creste con membrana esterna ben disegnata e integra.
- Fig.7
 Fig.7 particolare
Fig.7 particolare 
- Qualcuno di questi organelli è sede di microfocolai di vacuolizzazione, qualche altro è sede di restringimenti o di strozzature del loro profilo, quasi a significare un iniziale processo di fissione.
- Fig.8
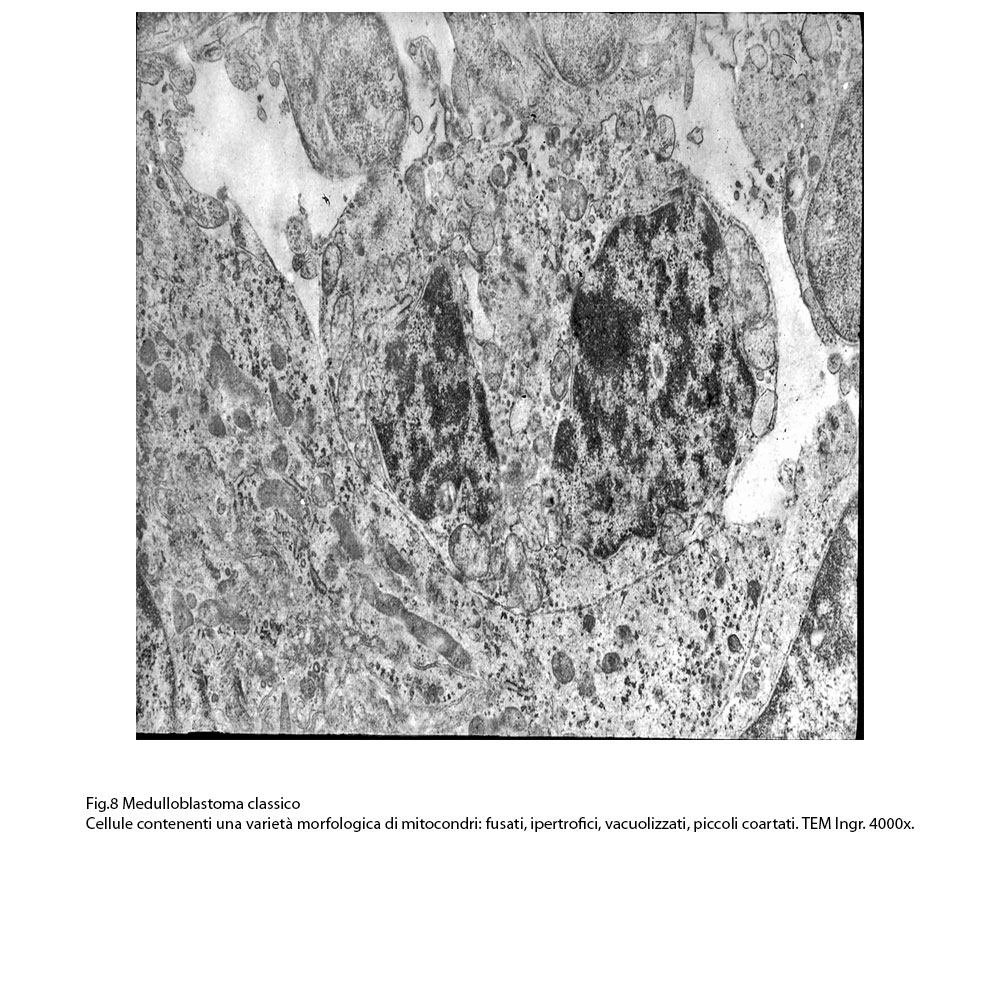
Questi mitocondri sono contestualmente connessi e correlati spazialmente e funzionalmente a quote cospicue di ergastoplasma, di reticolo endoplasmico, di ribosomi, di microtubuli, di ampi campi golgiani.
- La maggior parte delle cellule è sede di un elevato numero di mitocondri rigonfi e danneggiati, fornendo così in apparenza immagini di un citoplasma leso in modo diffuso.
Nel citoplasma di cellule contigue si hanno mitocondri con morfologia diversa; in alcune cellule si ritrovano mitocondri con processi di vacuolizzazione della matrice di dimensioni focali, parcellari, subtotali e globali;in altre cellule i mitocondri appaiono ben strutturati e forniti di un adeguata quota di creste.
Fig.9  Fig.10
Fig.10 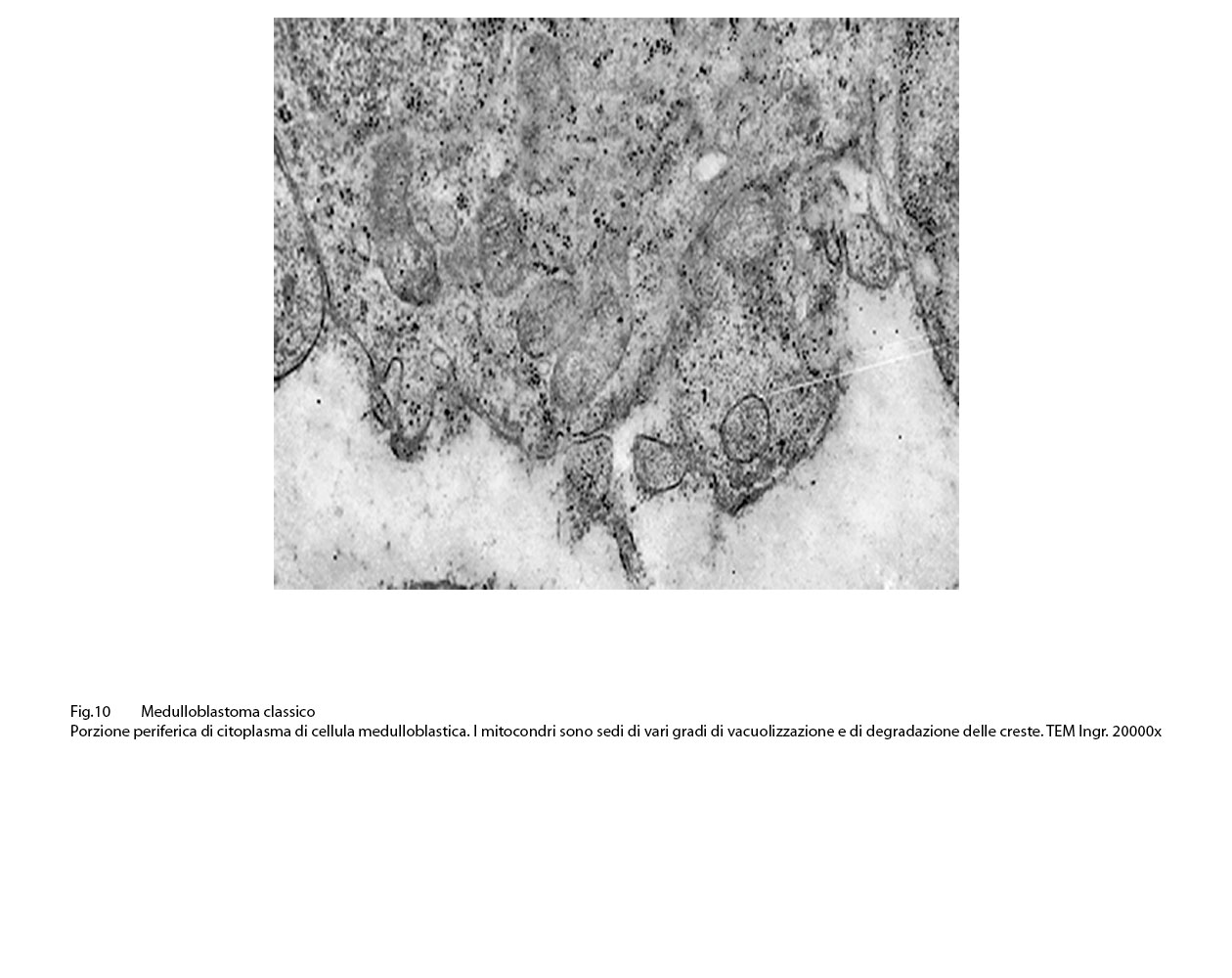
L’ultrastruttura dei mitocondri rimane solo lievemente o moderatamente modificata se il processo di vacuolizzazione è focale o parcellare; invece, essa è profondamente alterata o è sovvertita quando la vacuolizzazione è subtotale o globale.
Infatti, in tali eventi, i mitocondri sono rigonfi, globosi, hanno matrice ampia, iperchiara, lucente o hanno un numero di creste ridotte e quelle residue appaiono spezzettate e/o di aspetto tubulare;si repertano mitocondri globosi ma privi delle membrane interne,essendo ridotti solo alla membrana esterna.
Fig.11 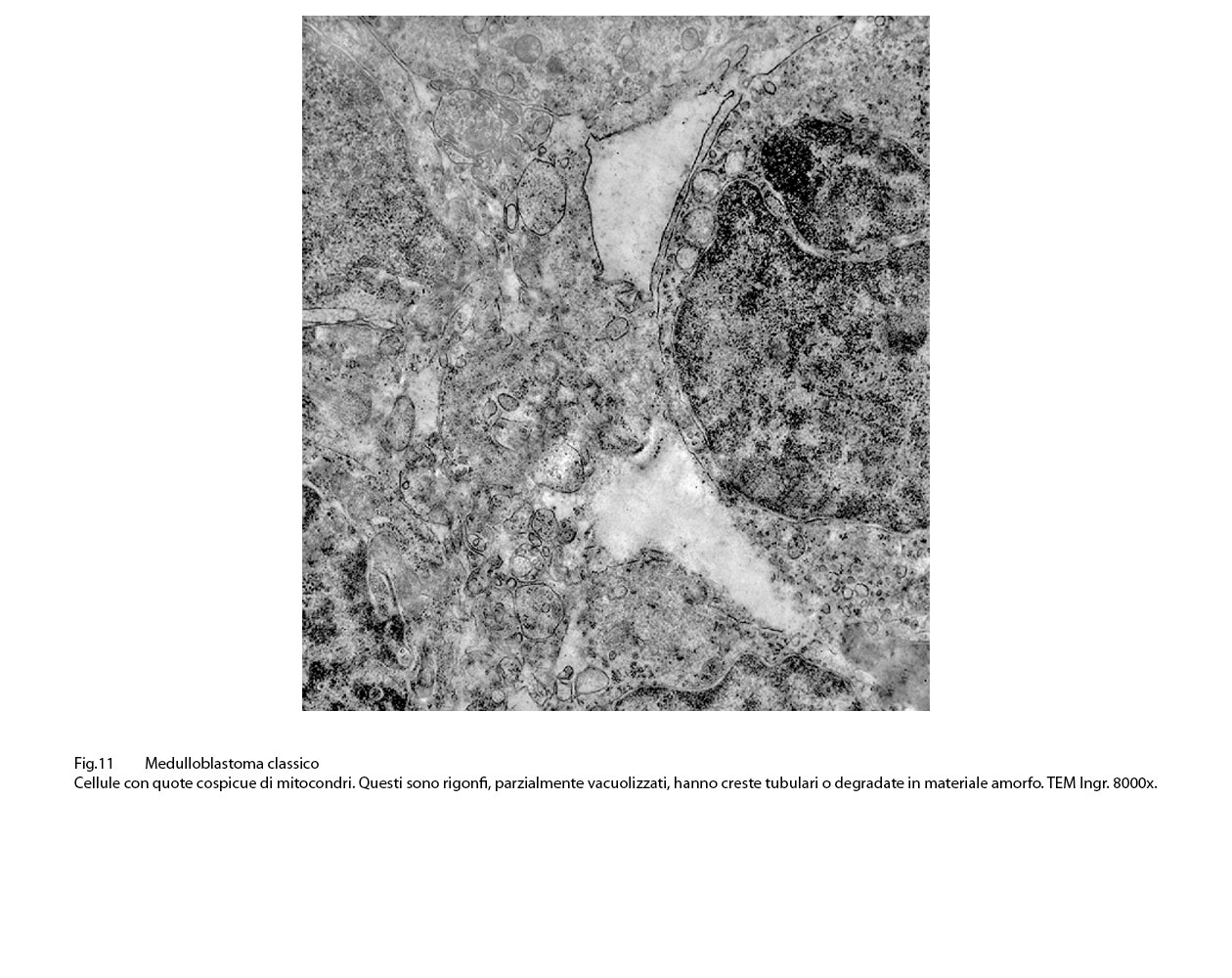 Fig.12
Fig.12 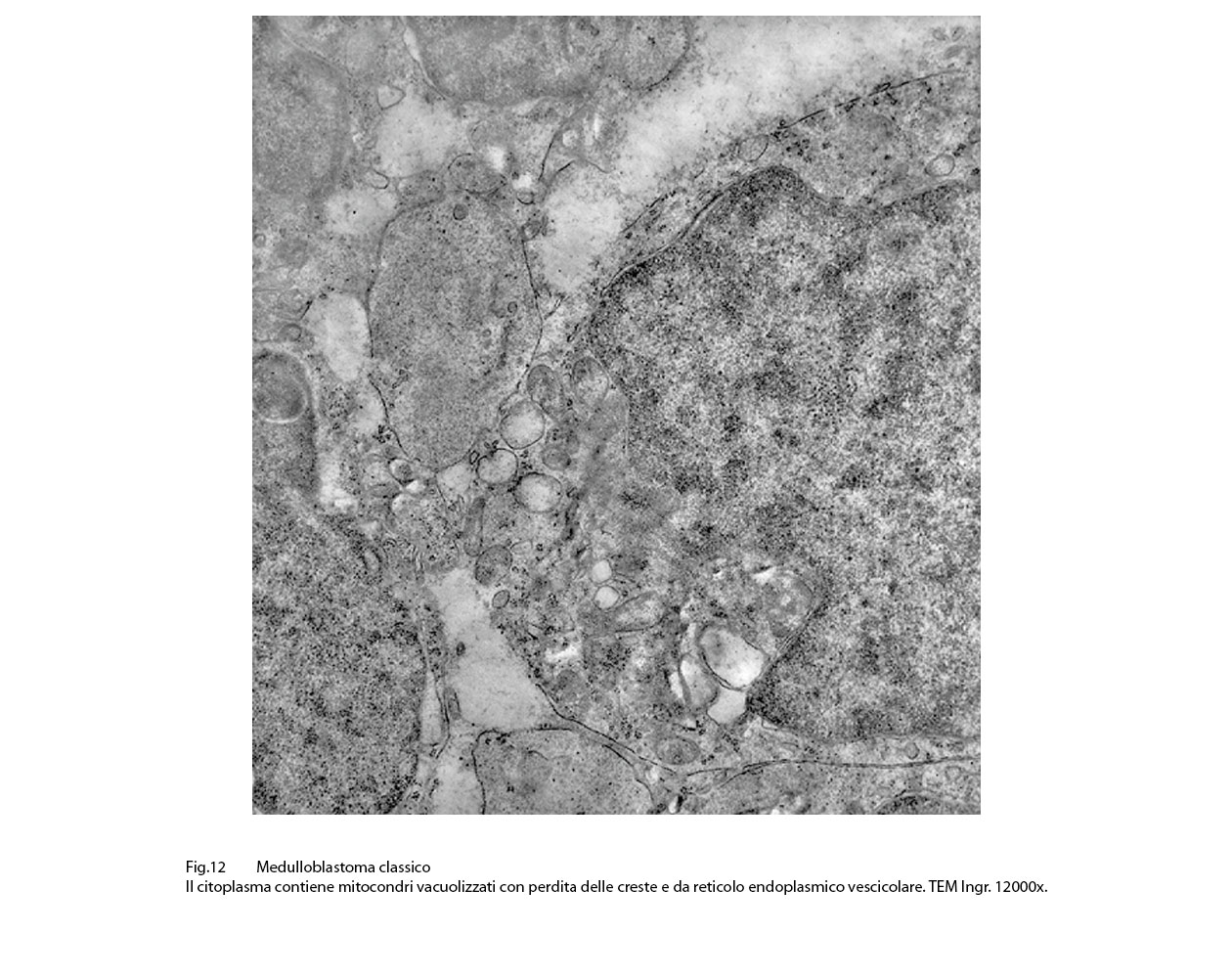 Fig.13
Fig.13 
Spesso, in conseguenza di tale stato di rigonfiamento, si associano lacerazioni della loro membrana esterna e rilascio del contenuto nel citosol.
Fig.14 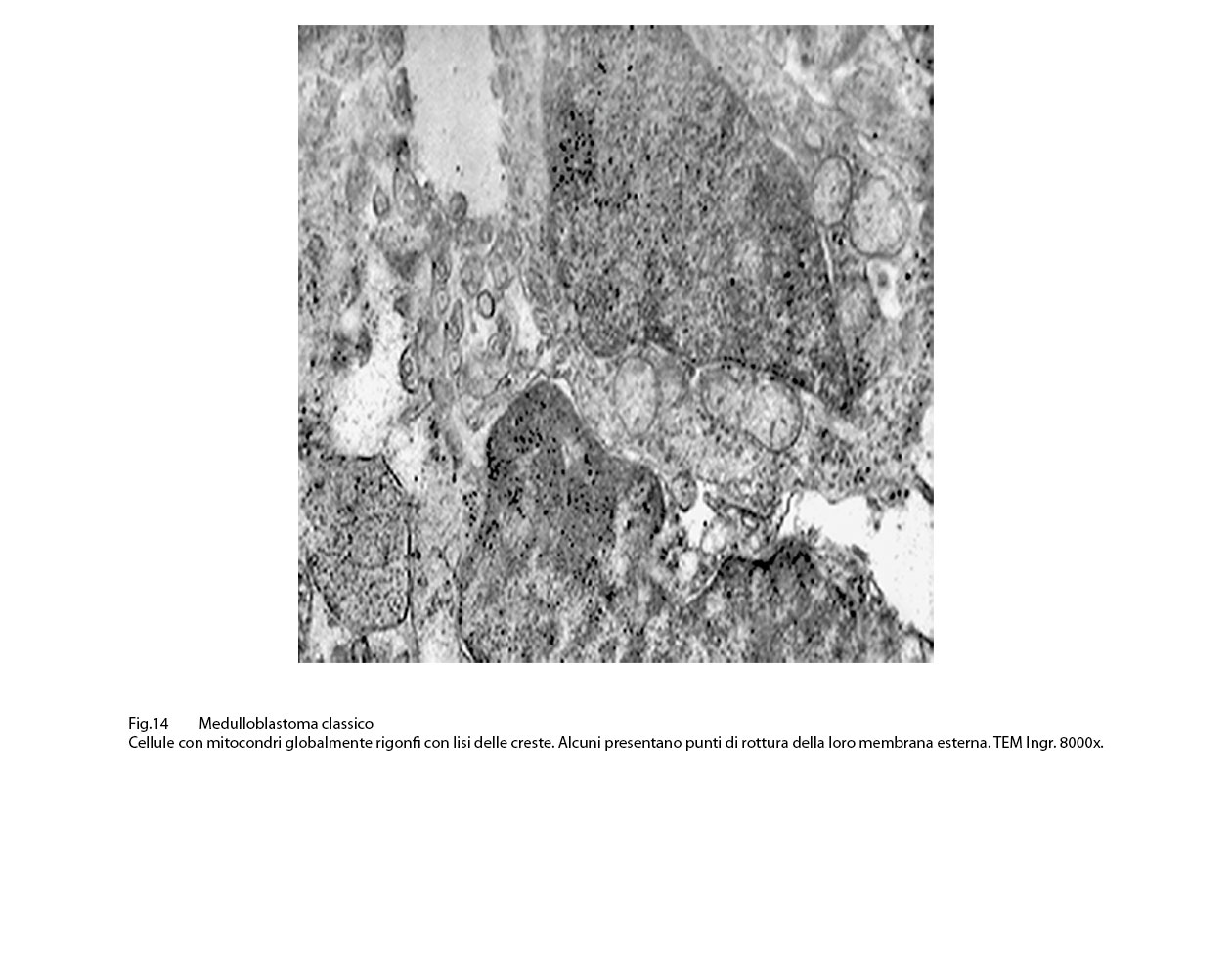 Fig.15
Fig.15 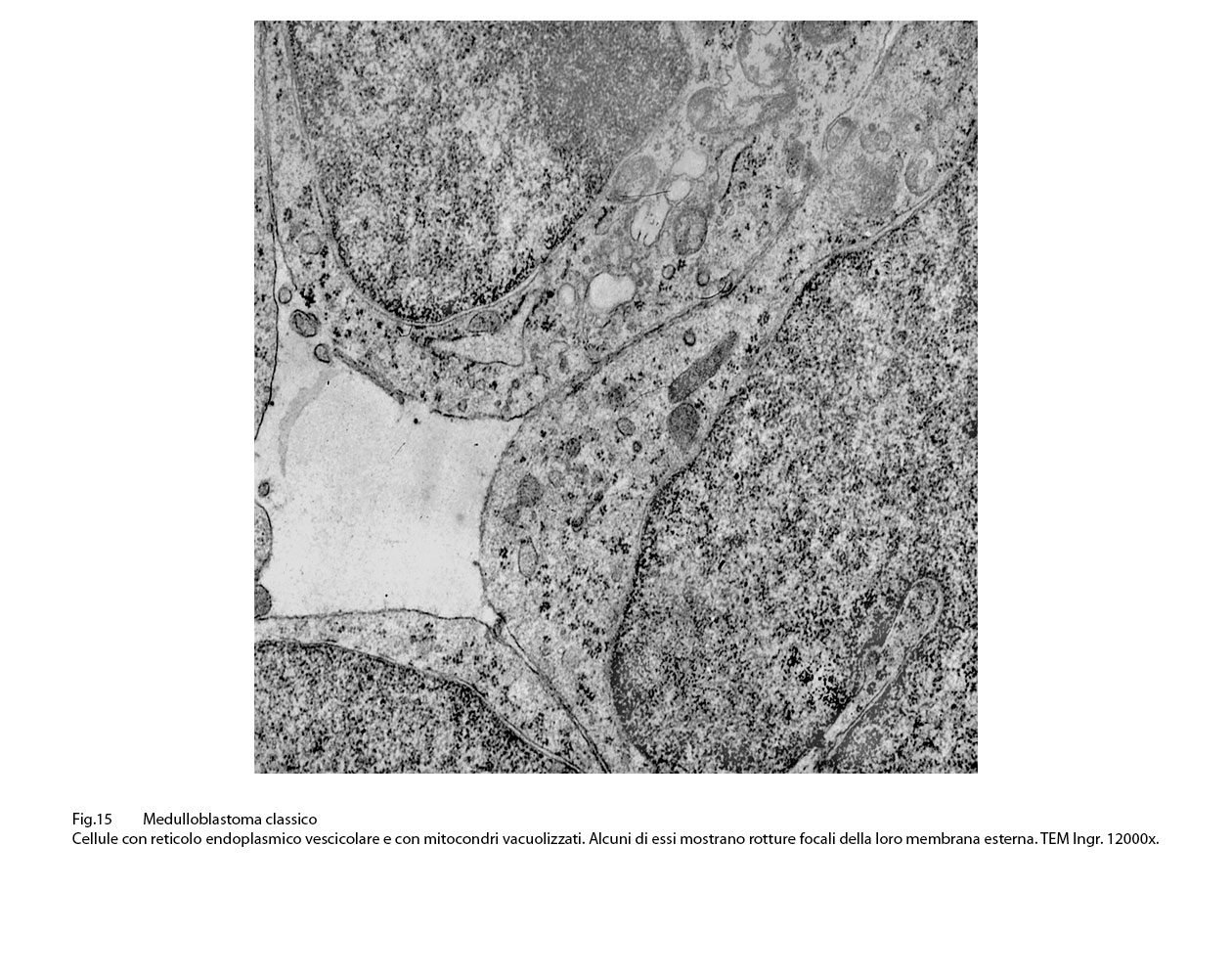 Fig.16
Fig.16 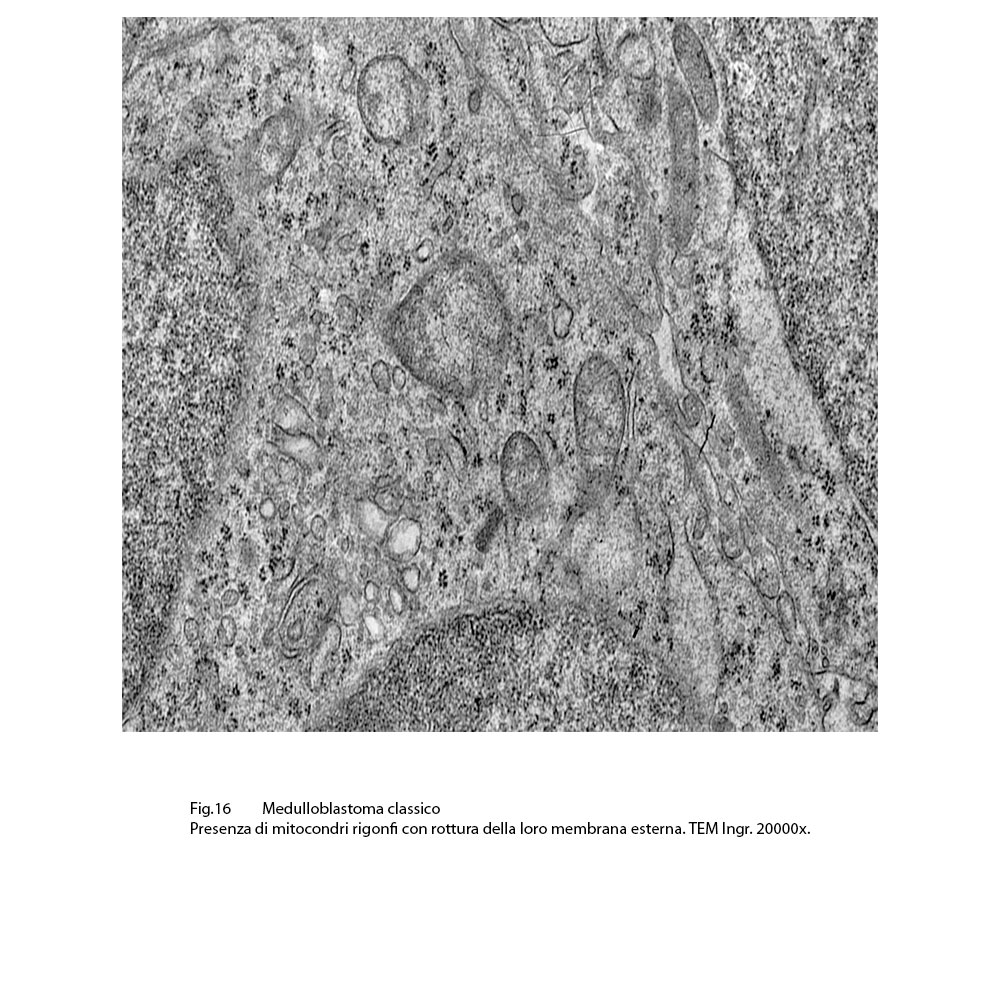
Fig.17 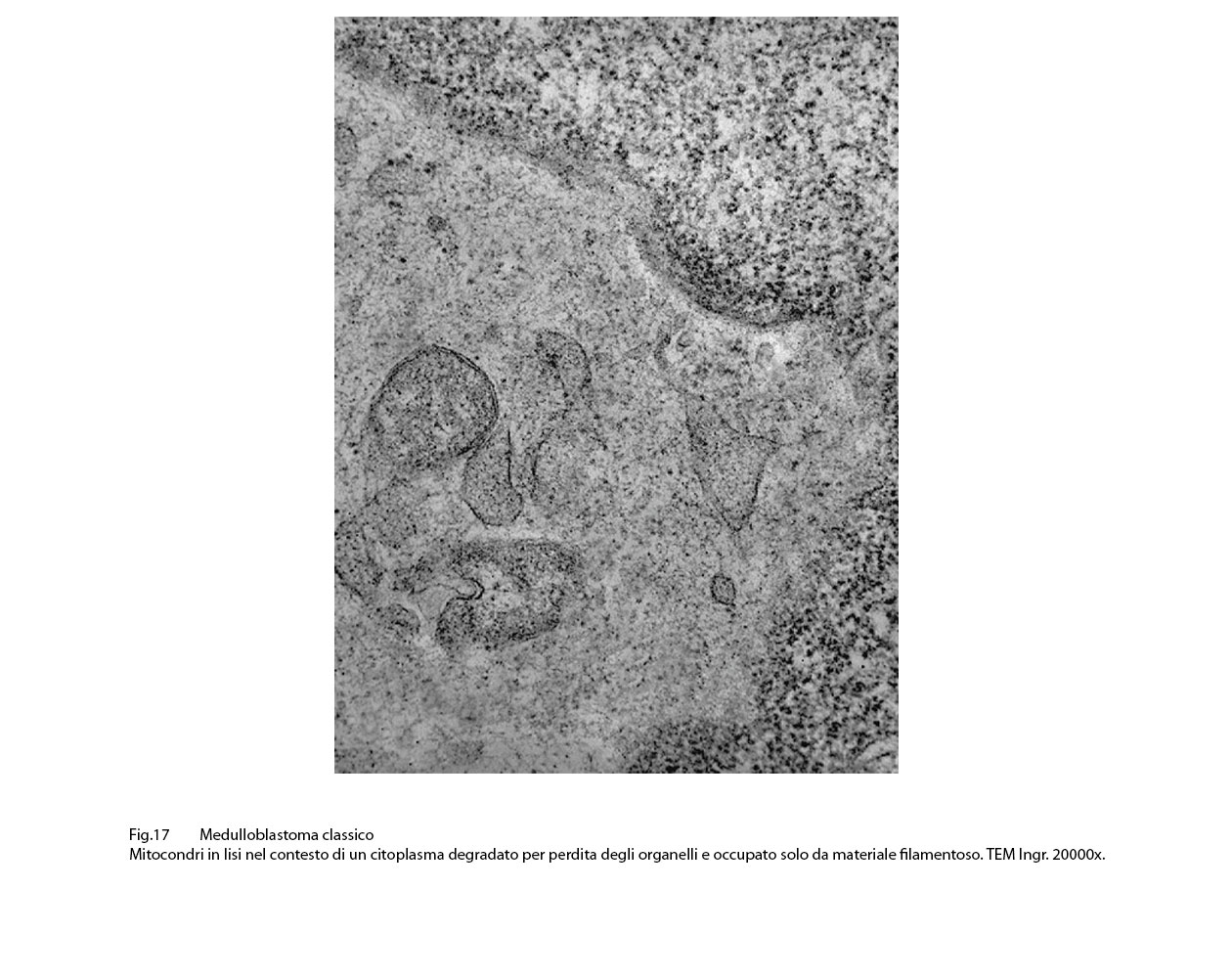 Fig.18
Fig.18 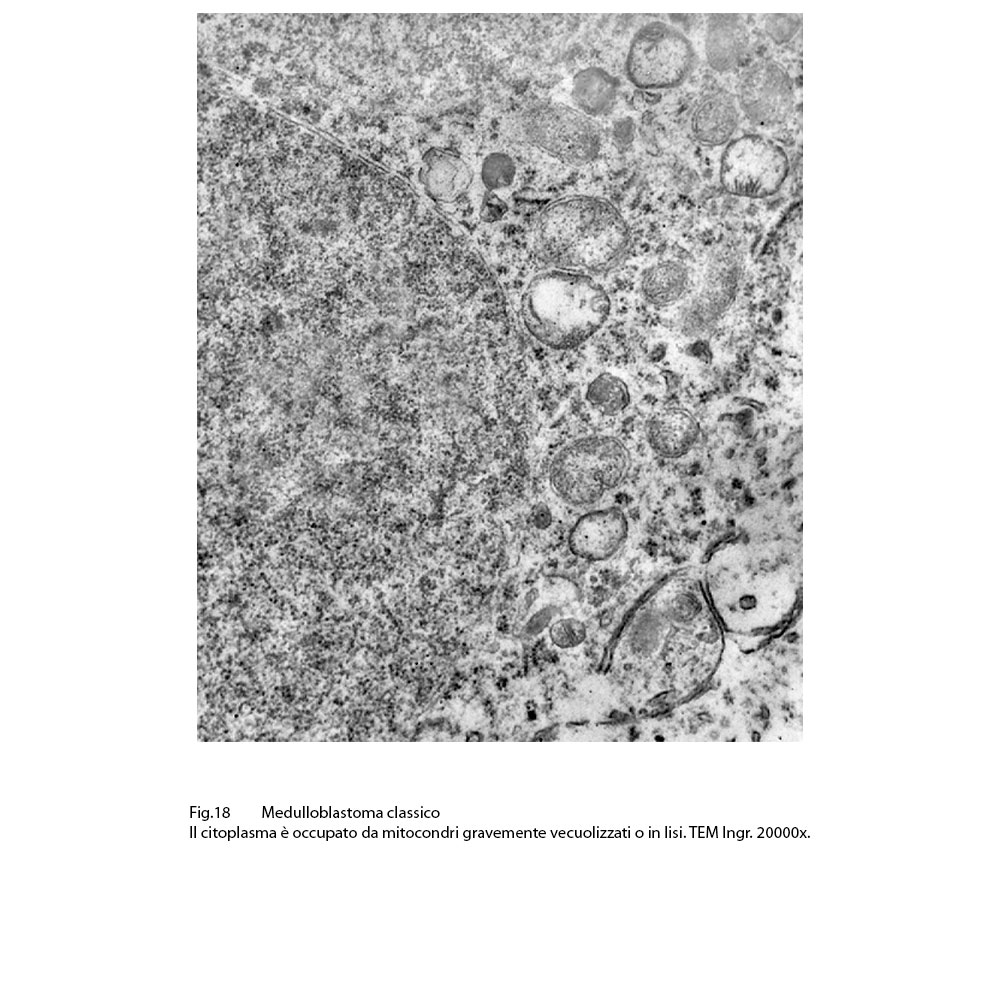
3 Il contesto nel quale questi mitocondri si trovano è rappresentato da substrutture citoplasmatiche che presentano, a seconda delle cellule, alterazioni diverse per tipologia e gravità:
Le alterazioni degli altri organelli sono commiste a quelle mitocondriali, sono composite e, pur essendo gravi, sono in parte mascherate in tutti i reperti dalla dominanza del danno mitocondriale:
Il citosol è rarefatto,diafano,ed è sede di vacuoli o di ampie escavazioni prive di pareti proprie , a confini irregolari, frastagliati ,e in tali spazi non si repertano materiali visibili agli elettroni.
Il reticolo endopasmico appare con cisterne dilatate e apparentemente prive di contenuto; in molti campi esso è a contatto con i mitocondri e sopratutto con quelli rigonfi e danneggiati a livello delle membrane interne. Frequentemente queste stesse sub-strutture si dispongono in modo da avvolgere singoli mitocondri.
Fig.19 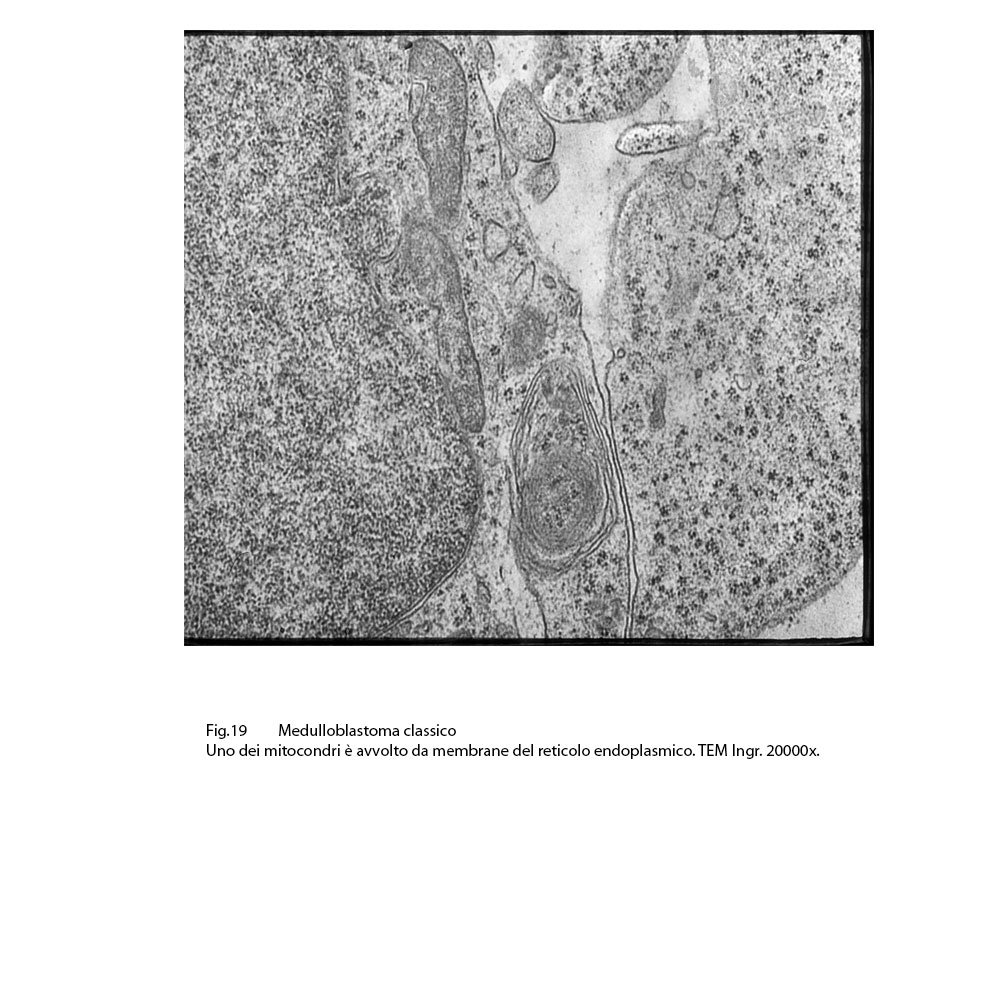
L’ergastoplasma appare in quantità ridotte,non mostra la abituale architettura retiforme ma si presenta frammentato e di aspetto tubulare per collasso delle membrane.
Frequentemente,le lesioni endocellulari si riverberano su la membrana plasmatica,provocandone la lacerazione o la frammentazione con conseguente rilascio del contenuto endocitoplasmatico negli spazi extra-cellulari.
Infine, si ritrovano, nel contesto di citoplasma sedi di mitocondri in vario grado danneggiati, focolai di autofagosomi e di autofagolisosomi.
Fig.20 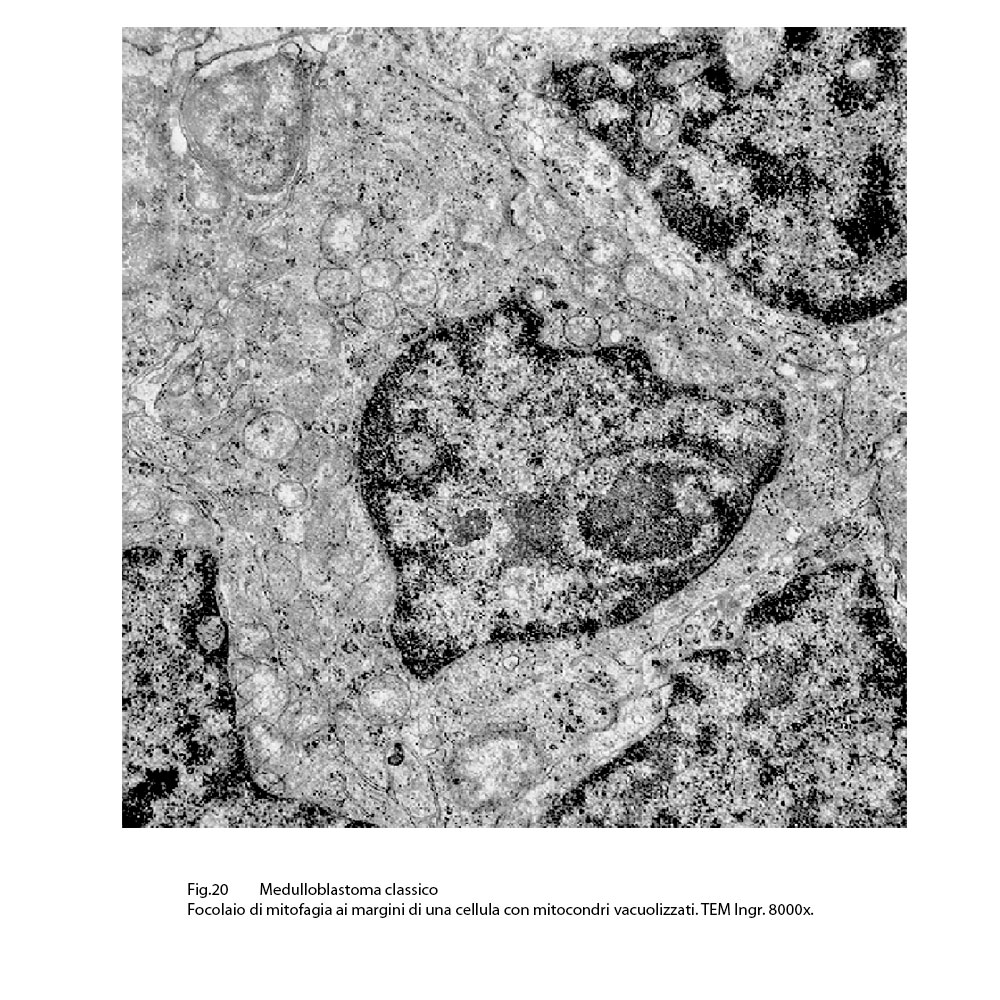 Fig.20 particolare
Fig.20 particolare 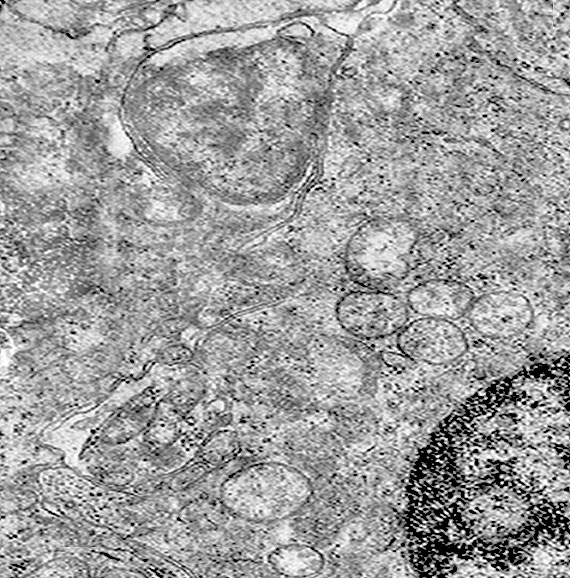
Fig.21 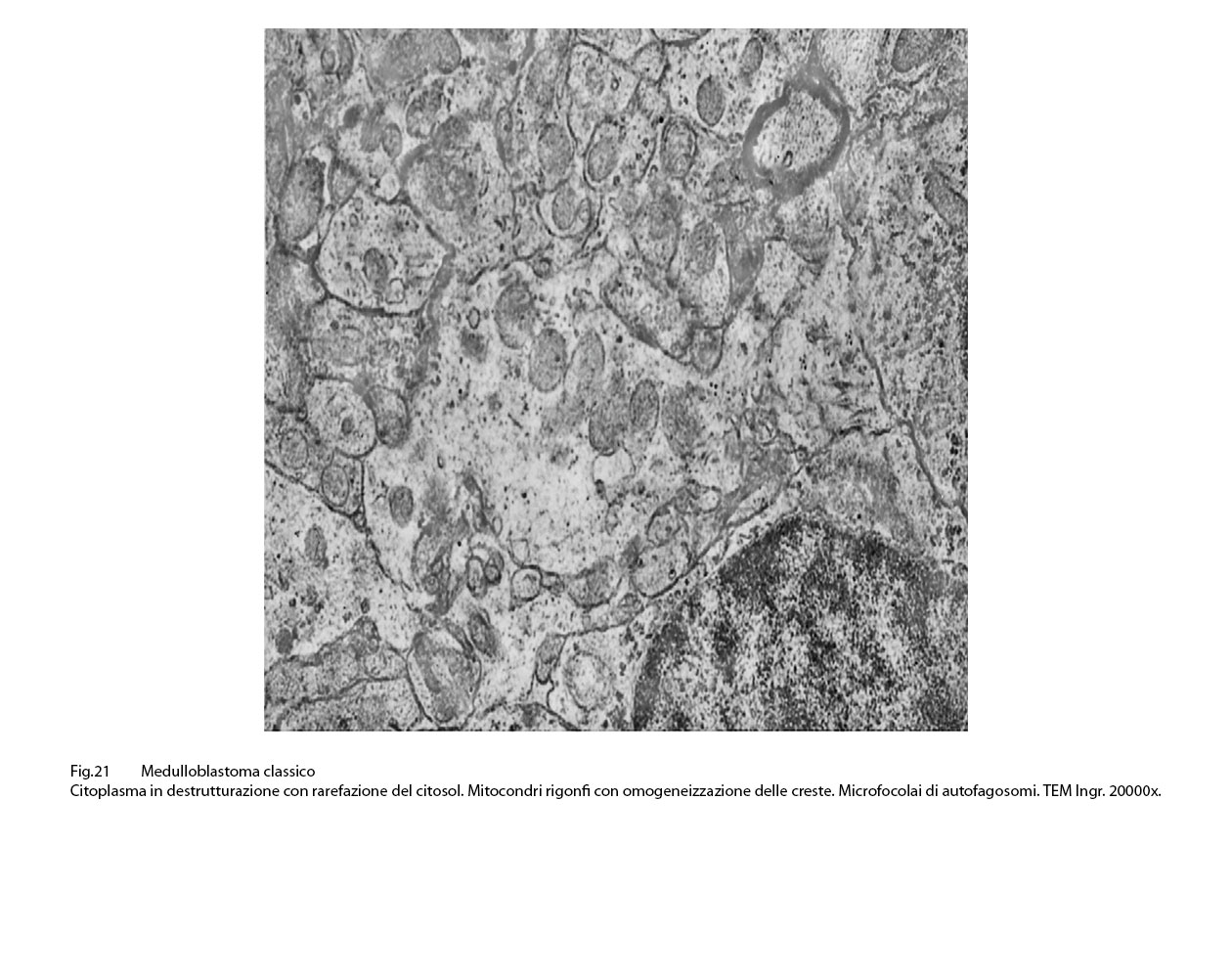 Fig.22
Fig.22 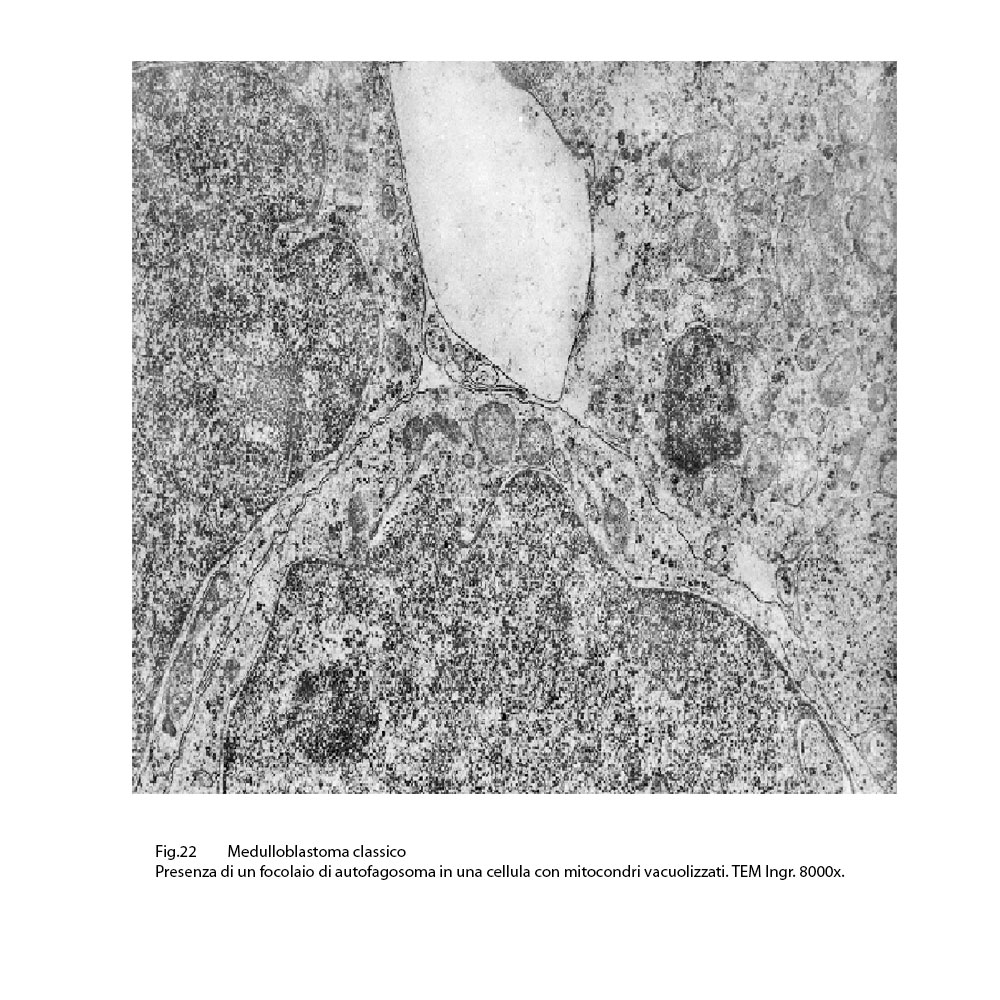 Fig.22 particolare
Fig.22 particolare 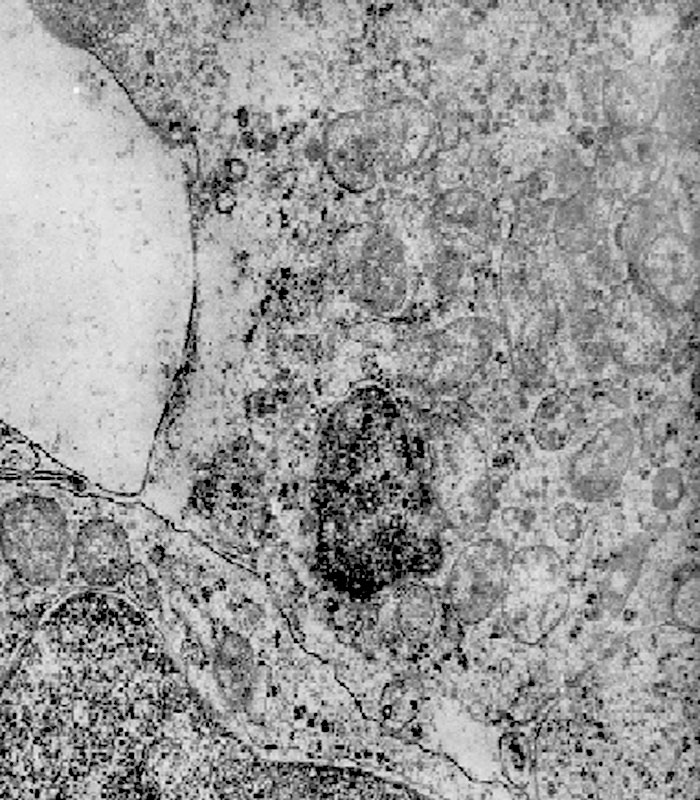
Fig.23 
COMMENTO
I reperti ultrastrutturali dianzi descritti consentono le seguenti riflessioni conclusive:
Le cellule del medulloblastoma classico osservate sono fornite di quote cospicue di mitocondri,contestualizzati sui piani morfologico-funzionali con le altre sub-struttere del citoplasma.
La morfologia di questi mitocondri è diversificata a seconda della cellula; il confronto tra cellule contigue fa emergere concrete differenze: in una i mitocondri sono ben strutturati, nelle altre sono in vario grado danneggiati.
Il danno consiste in un rigonfiamento intra- mitocondriale che per entità può essere focale,parcellare,subtotale,o globale;in questa estrema evenienza si rileva anche una riduzione delle creste con distorsione e frammentazione delle stesse oppure totale cristolisi. (Bioenergetics 2011;1807:602-608 )
Allorquando il danno è globale con distruzione delle creste,il mitocondrio è ridotto a una vescicola globosa delimitata solo dalla membrana esterna; questa,per accumulo di liquidi, subisce una progressiva iperdistensione fino alla sua lacerazione con svuotamento del contenuto nel citosol.
La fuoruscita di questi liquidi può realizzarsi anche a livello di mitocondri apparentemente integri per modificazioni con perdita della selettività della membrana esterna.
Alla base di tale processo, si manifesta una alterazione transitoria della permeabilità che interessa le membrane interne e la matrice mitocondriale. ( Anat. Rec. 2012;295:1647-1659)
Tale alterata permeabilità provoca la perdita del potenziale di membrana, perdita dell’ATP,rilascio del citocromo c,e liberazione di fattori pro-apoptosici. ( J.Cell Biol. 208;182:685-701; Cell 2010;141:656-667 )
I mitocondri così gravemente danneggiati sono sequestrati in vacuoli autofagici (mitofagia),oppure sono fusi con lisosomi,formando autofagosomi o autofagolisosomi. (J Cell Mol. Med. 2013;17:12-29 )
Un altro aspetto morfofunzionale riscontrato in questi reperti di medulloblastoma classico è il contatto interfacce tre reticolo endoplasmico e mitocondri; come è stato riportato,mitocondri integri o parzialmente danneggiati sono avvolti da tali membrane e questi eventi sono conseguenti a stress e rappresentano la piattaforma di partenza per la formazione di focolai di autofagia. ( Biochimica Biophysica Acta Bioenergetics 2014;183:461-469 )
Come è stato documentato,il processo di vacuolizzazione ha coinvolto non solo i mitocondri ma anche l’intera cellula del medulloblastoma classico con formazione di vaste escavazioni direttamente nel citosol e quando il processo regressivo diventa di estensione totalizzante si hanno micro lacerazioni delle membrane plasmatiche e fuoruscita del contenuto endocellulare negli spazi extracellulari.
Tra le varie ipotesi causali e concausali, le alterazioni dianzi descritte possono essere associate a uno stato di ipossia cronica. Tale condizione si riscontra nei tumori maligni per l’elevata proliferazione cellulare rispetto a una rete vascolare insufficiente. Anche se le cellule neoplastiche sintetizzano VEGF (Vascular Endothelial Growth Factor), atto a stimolare una neovascolarizzazione, permane uno squilibrio tra la necessità e la disponibilità della tensione di ossigeno e delle molecole nutrizionali.
Nell’ambito di una massa neoplastica si riconoscono le cellule sensibili allo stato di ipossia e quelle resistenti a tali situazioni ambientali. Le prime presentano fenomeni regressivi fino alla morte cellulare (rigonfiamento dei mitocondri, vacuolizzazione del citosol e del reticolo endoplasmico, autofagia, citolisi); le seconde conservano il loro profilo ultrastrutturale (mitocondri ben strutturati, adeguata conservazione degli organelli ultracitoplasmatici), si adattano all’ambiente e rivelano caratteri biologici più aggressivi (Int. J. Biochemic. Cell. Biol. 2009; 41: 2062-2068) ( Cell Death Dis., 2016; 7: 2434).
