ADENOMA DELL'IPOFISI
Luigi Cuccurullo
|
L’adenoipofisi può essere sede di numerose quanto diverse forme di patologia; se si scorre l’indice sull’elenco elaborato dalla patologia sistematica sull’argomento si passa da processi malformativi (aplasia, ipoplasia, ectopia) ad alterazioni vasculo-circolatorie (micro-aneurismi, emorragie focali, infarti, apoplessia) ed ancora ad alterazioni metaboliche (amiloidosi, emosiderosi); questo elenco riporta anche diversi processi infiammatori primitivi sia su base infettiva sia a patogenesi autoimmunitaria con caratteri aspecifici e specifici nonché focolai flogistici secondari a partenza da infezioni generalizzate o derivanti da processi dell’apparato meningo-encefalico. Fanno parte di questa patologia sistematica anche le modificazioni del profilo e della volumetria dell’adenoipofisi per fenomeni di iperplasia o per la presenza di una cisti (cisti a partenza dalla tasca di Rathke, cisti aracnoidali, cisti dermoidi-epidermoidi, etc.) o per la comparsa di tumori benigni o maligni. Tra i tumori benigni si annoverano gli adenomi, i cranio-faringiomi, gli schwannomi, i cordomi, gli angiomi; e tra quelli maligni si ricordano i carcinomi, i linfomi, i gliomi maligni, i sarcomi e i tumori metastatizzati. Nell’ambito di questo composito spettro di neoplasie diverse per i loro caratteri e la loro istogenesi, gli adenomi sono di particolare interesse per i loro complessi caratteri morfologici e funzionali.
Adenoma dell’ipofisi
L’adeno-ipofisi è composta da 6 distinti tipi cellulari, tutti ben differenziati a livello morfologico-funzionale, tutti capaci di sintetizzare e di secernere specifici ormoni biologicamente attivi. Ciascuno di questi citotipi è esposto non solo a processi necrotico-degenerativi primitivi o secondari ma anche a manifestazioni di tipo proliferativo quali le semplici iperplasie o i processi neoplastici benigni (adenomi) e maligni (carcinomi). Lo studio morfo-funzionale degli adenomi dell’ipofisi è complesso e richiede indagini integrate di istopatologia, di citologia, di immunocitochimica, di microscopia elettronica, il tutto in correlazione con i reperti biochimici e genetici. L’utilizzo coordinato di queste metodiche permette di tracciare per ciuascun caso un dettagliato profilo morfologico-funzionale che, opportunamente innestato nel quadro anamnestico-clinico si apre a uno schema terapeutico ragionato.
Dopo i dati acquisiti dall’esame macroscopico si raccolgono quelli offerti dalla microscopia e luce; questo strumento consente di rilevare la micro-architettura che può essere diffusa, trabecolare, sinusoidale o pseudopapillare e di distinguere le cellule in rapporto alla tangibilità del loro citoplasma in acidofile, basofile e cromofobe.
E’ indispensabile effettuare questo esame microscopico in modo globale e seriato poiché è possibile repertare non solo adenomi strutturati in modo monomorfo ma anche adenomi pleomorfi con organizzazione strutturale e citologica variabile da zona a zona. Questo insieme di cellule è sostenuto da un delicato graticciato fibrillare di tipo reticolare ed è servito da una ben sviluppata rete vascolare, formata soprattutto da capillari. Questo discorso inizia attraverso una valutazione dei reperti microscopici di questo tumore; un primo punto prende in considerazione la volumetria raggiunta dalla neoplasia, distinguendo i micro-adenomi come formazioni al di sopra di tale valore. Questa distinzione ha un significato che può andare oltre il reperto dimensionale perché frequentemente i microadenomi sono sedi di elementi in mitosi, pleomorfi, bi-nucleati o multimucleati oppure sono coinvolti da fenomeni secondari destruenti quali necrosi e/o emorragie. Un secondo punto della valutazione macroscopica degli adenomi ipofisari poggia su le modalità di crescita del tumore. In letteratura sono descritti adenomi a crescita espansiva con contorni netti, ben disegnati e definiti ed adenomi a crescita infiltrativa con proiezioni neoplastiche invadenti le strutture circostanti (ossa, dura, seni, etc.).
L’avvento delle tecniche di immunocitochimica ha rivoluzionato la sistemazione nosografica degli adenomi dell’ipofisi. Queste procedure, altamente selettive in quanto supportate da una immunoreattività monoclonale, hanno consentito di svelare la presenza di molecole ormonali nel citoplasma delle cellule adenomatose. La possibilità di questo mezzo così selettivo quanto sensibile ha permesso di determinare anche livelli quantitativi delle capacità secretive, di poter tracciare il percorso intra ed extracellulare delle molecole sintetizzate e secrete e non ultimo di riconoscere le molecole biologiacemente attive da quelle incomplete e quindi non funzionanti. L’applicazione delle tecniche di microscopia elettronica ha permesso di poter descrivere nei dettagli la ultrastruttura delle cellule adenomatose.
E’ stato, così, possibile conoscere l’assetto degli organuli intracitoplasmatici, il grado di coesione e gli spazi intercellulari, i rapporti con i capillari e in particolare sono state condotte osservazioni dettagliate su i granuli di secrezione. Mediante questi sistematici studi sono state stabilite le loro diverse volumetrie, la loro disposizione spaziale nell’ambito del citoplasma, i loro rapporti biologici con l’ergastoplasma e l’apparato del Golfi, i processi di escrezione e il loro depositarsi negli spazi intercellulari.
L’integrazione articolata e ragionata dei suddetti metodi morfologico-funzionali è indispensabile sia per una notevole variabilità dei caratteri citologici, ma anche per una frequente dissociazione tra morfologia e funzione.
Sono descritti adenomi plurimorfi e pluri-ormonali, caratterizzati da popolazioni cellulari diverse, secernenti ogni sub-tipo un ormone; accanto a questi si ritrovano adenomi plurimorfi ma con attività secernente mono-ormonale. All’inverso, sono stati osservati adenomi formati da una popolazione cellulare monmomorfa ma capace di sintetizzare contemporaneamente diversi ormoni. Mediante le indagini combinate di immunocitochimica e di microscopia elettronica sono stati individuati deficit riguardanti la sintesi e/o i meccanismi di escrezione delle molecole ormonali.
In tal modo sono stati identificati adenomi impossibilitati a sintetizzare molecole ormonali oppure atti a sintetizzare molecole ormonali incomplete e come tali non funzionanti (adenomi nulli). Come pure sono stati rilevati adenomi normalmente in attività secernente ma privi dei regolari meccanismi escretivi e di conseguenza privi di manifestazioni funzionali (adenomi silenti). Abitualmente le popolazioni cellulari degli adenomi simulano quelle dei citotipi dell’adenoipofisi normale; questa similitudine, in rari casi non è rintracciabile perché le cellule sono molto differenti di quelle delle ipofisi normali, oppure evidenziano caratteri embrionali o ancora la neoplasia adenomatosa è stata coinvolta da processi secondari destruenti quali necrosi massive o sub-massive, da infarcimenti emorragici, da flogosi croniche granulovatosiche plurifocali e molto estese.
Quanto è stato riassunto è bastevole per riportare la complessità della patologia e la chimica riguardante gli adenomi dell’ipofisi. Un riflesso di tale stato dell’arte è rintracciabile nella esistenza di numerose classificazioni tendenti a sistemare in modo organico e razionale questo capitolo della patologia. Qui di seguito sono riportate alcune classificazioni ciascuna delle quali mette in evidenza una metodologia di studio e quegli aspetti significanti e determinanti come espressive delle metodologia adottata.
A completamento di tale esposizione viene riportato uno articolato schema operativo per procedere a un razionale approccio diagnostico degli adenomi dell’ipofisi.
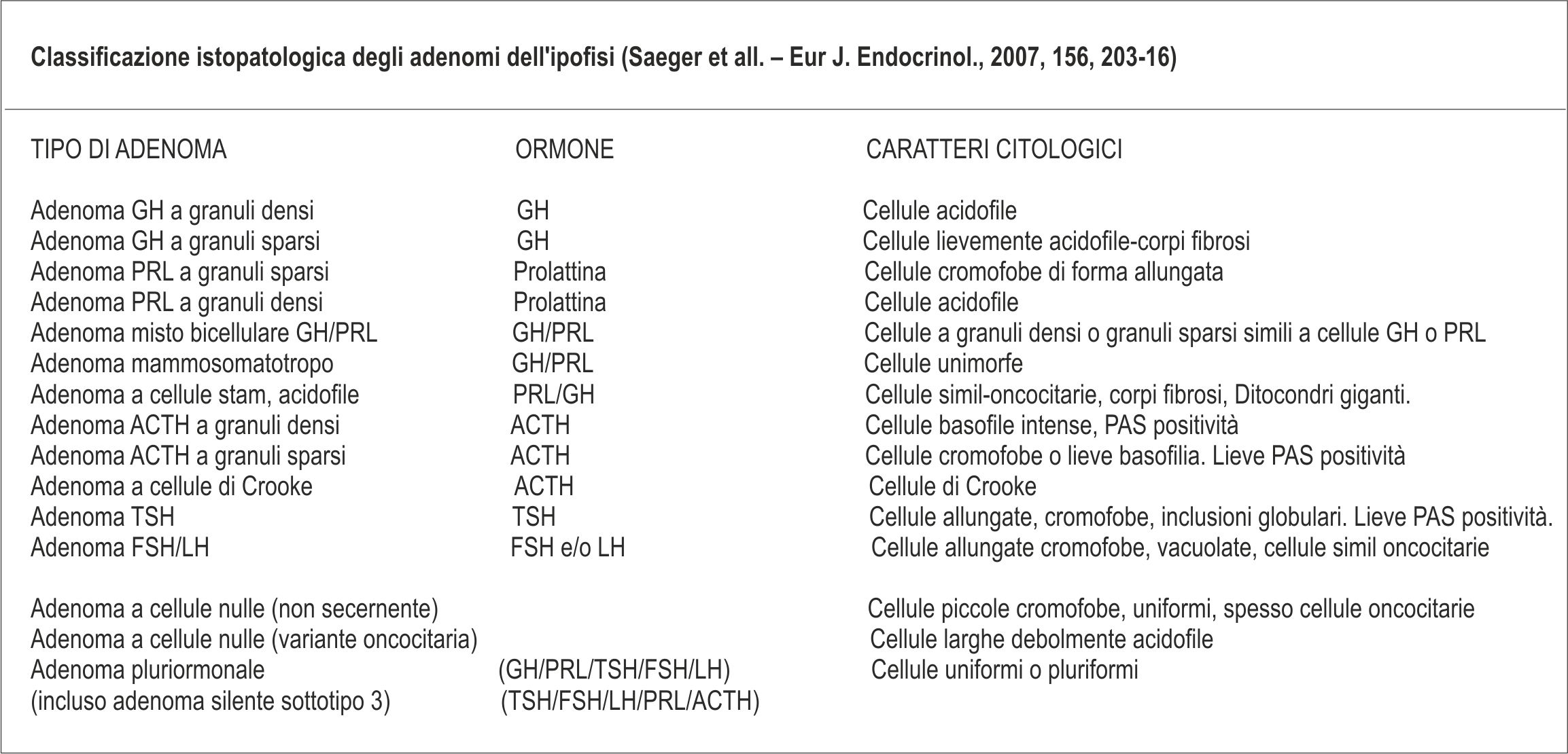
CLASSIFICAZIONE DEGLI ADENOMI DELL’IPOFISI (WHO, 2004)
Adenoma secernente GH
Adenoma a granuli densi
Adenoma a granuli sparsi
Adenoma misto
Adenoma somatotropo
Adenoma a cellule stem acidofile
Adenoma secernente PRL
Adenoma a granuli densi
Adenoma a granuli sparsi
Adenoma a cellule stem acidofile
Adenoma secernente TSH
Adenoma secernente ACTH
Adenoma secernente ACTH, silente
Sottotipo I
Sottotipo II
Adenoma secernente gonadotropine
Adenoma pluriormonale
Adenoma sottotipo III, silente
Adenoma immunonegativo
Oncocitoma
Carcinomi
Adenoma atipico



E’ stato elaborato e presentato in letteratura uno schema di approccio diagnostico dei tumori ipofisari integrando i dati clinici, biochimici e di diagnostica per immagine con quelli istologici, immunoistochimici ed ultrastrutturali (Solcia E., Kloppel G., Sobin L.H., Histological typing of endocrine tumors – W.H.O., Springer, Berlin, 2000)
Questo schema, altamente composito è organizzato secondo cinque livelli di approfondimenti diagnostici, valuta in modo articolato e analitico tutti i processi proliferativi dell’ipofisi in modo da contestualizzare in modo ragionato gli adenomi.
I Il primo livello si affida ai dati clinici e ai dosaggi degli ormoni nel sangue.
II Il secondo livello si avvale dei reperti ottenuti dalla diagnostica per immagini e dai campioni operatori. Si ottengono così informazioni su la grandezza del tumore e su le modalità di crescita espansiva o infiltrante.
III Il terzo livello si realizza attraverso gli esami istopatologici dei reperti operatori. Mediante queste indagini è possibile tracciare linee di diagnosi differenziate tra gli adenomi e altre patologie quali: ipofisiti, cisti, processi iperplastici dell’ipofisi, carcinoma dell’ipofisi, tumori metastatici o ancora processi espansivi non neoplastici, etc.
IV Il quarto livello utilizza le tecniche di immuno-citochimica, mediante le quali è possibile identificare le molecole ormonali presenti nel citoplasma delle cellule dell’adenoipofisi.
Mediante marcatori mirati è possibile ottenere informazioni su gli indici di proliferazione e quindi su una valutazione prognostica.
V Il quinto livello si esplica attraverso indagini ultrastrutturali delle cellule in esame; mediante la microscopia elettronica è possibile tracciare in modo analitico il profilo morfologico di tali elementi e contestualmente della loro attività secretiva ed escretiva.
Nel suo insieme lo studio e la diagnostica degli adenomi ipofisari si avvale delle seguenti metodologie:
- Una valutazione circa le attività funzionali per diagnosticare l’ormone o gli ormoni secreti e per poter identificare gli adenomi silenti o nulli.
- Un profilo morfologico macroscopico mediante la neuroradiologia per tracciare i limiti volumetrici del tumore e per stabilire le eventuali infiltrazioni degli organi circostanti.
- Indagini istopatologiche e immunocitochimiche per svelare la presenza del tipo di ormone presente nelle cellule.
- Ricerche ultrastrutturali per confermare nei dettagli i caratteri delle cellule, il loro grado di differenziazione, l’assetto citoplasmatico degli adenomi pluriormonali, il blocco degli adenomi silenti, il profilo ultrastrutturale degli adenomi a cellule stam.
Adenomi secernenti GH
L’adenoma dell’ipofisi secernente in eccesso l’ormone di crescita è formato da cellule secernenti GH, oppure da cellule secernenti GH/PRL e più raramente da cellule secernenti GH/ACTH.
Al microscopio luce le cellule di questo tipo di adenoma hanno citoplasma acidofilo con esiguo numero di cellule con citoplasma cromofobo. Al microscopio elettronico e all’immunoistochimica le cellule di questo adenoma rivelano caratteri morfo-funzionali diversificati e aggruppandoli in 5 sottotipi:
- Adenoma a granuli densi secernente GH
- Adenoma a granuli sparsi secernente GH
- Adenoma pluriormonale mammosomatotropo
- Adenoma misto somatotropo-lattotropo
- Adenoma a cellule stam. Acidofile
-
Adenoma a granuli densi secernente GH
Questo adenoma è composto da cellule di media e grossa taglia, di forma rotondeggiante o poliedrica con citoplasma acidofilo. Il nucleo è rotondeggiante, normocromatico e raramente in mitosi. Al microscopio elettronico il citoplasma di queste cellule è ricco di organuli e in particolare ha un sistema ergastoplasmatico ben sviluppato e ha un numero elevato di granuli di secrezione della grandezza di 400-500 nm.
fig.1 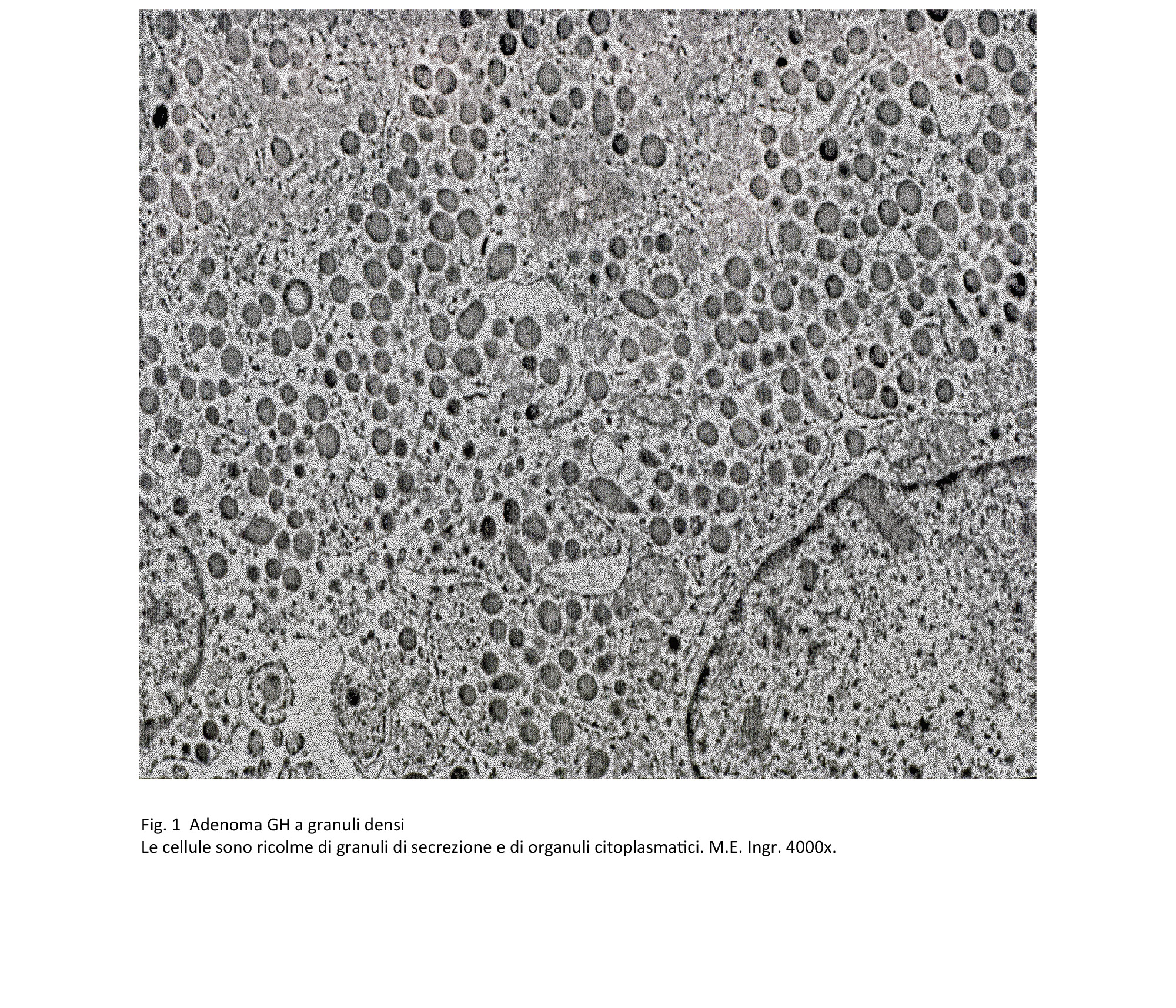 fig.2
fig.2 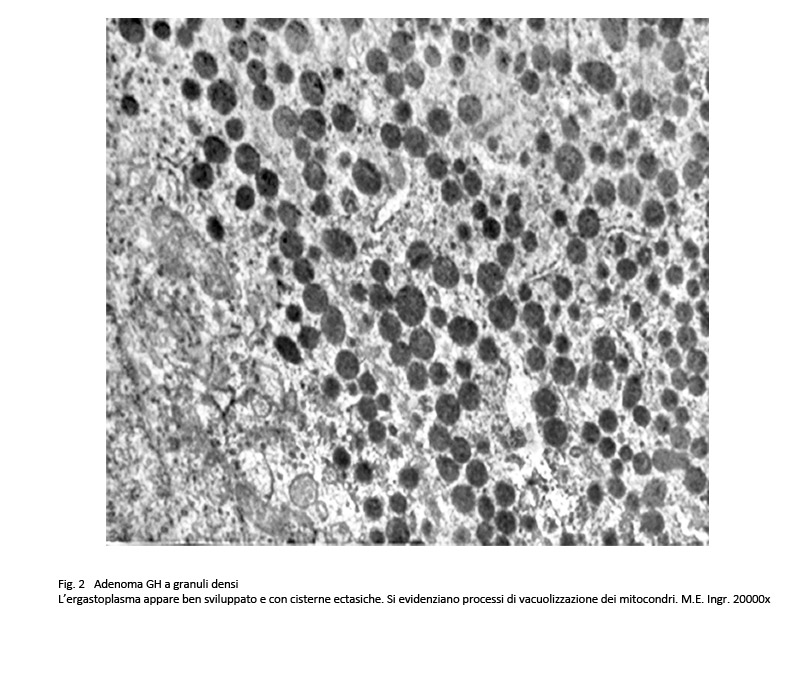 fig.3
fig.3 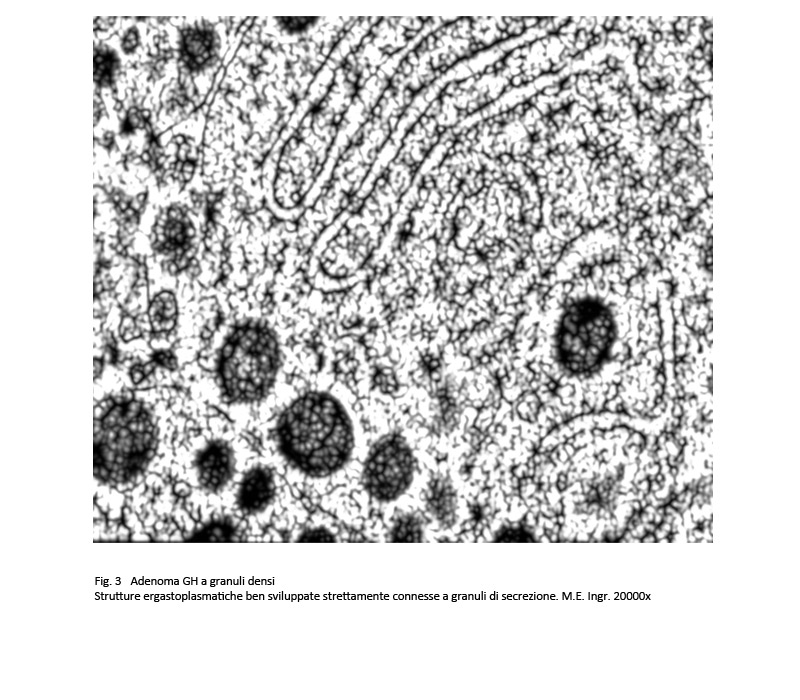
fig.4 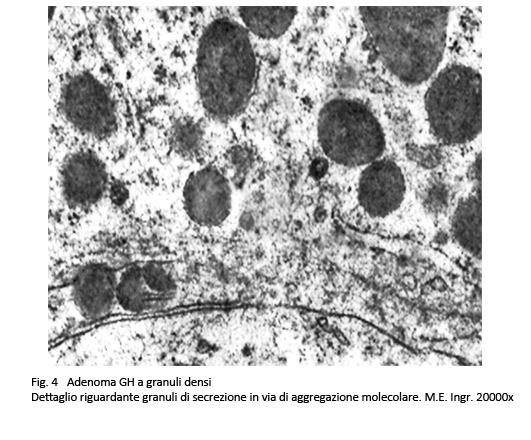 fig.5
fig.5 
Le tecniche di immunoistochimica hanno permesso di evidenziare una intensa quanto diffusa immunoreattività per l’ormone GH e un basso indice di attività proliferativa rilevato tramite la marcatura del MIB-1.
fig.6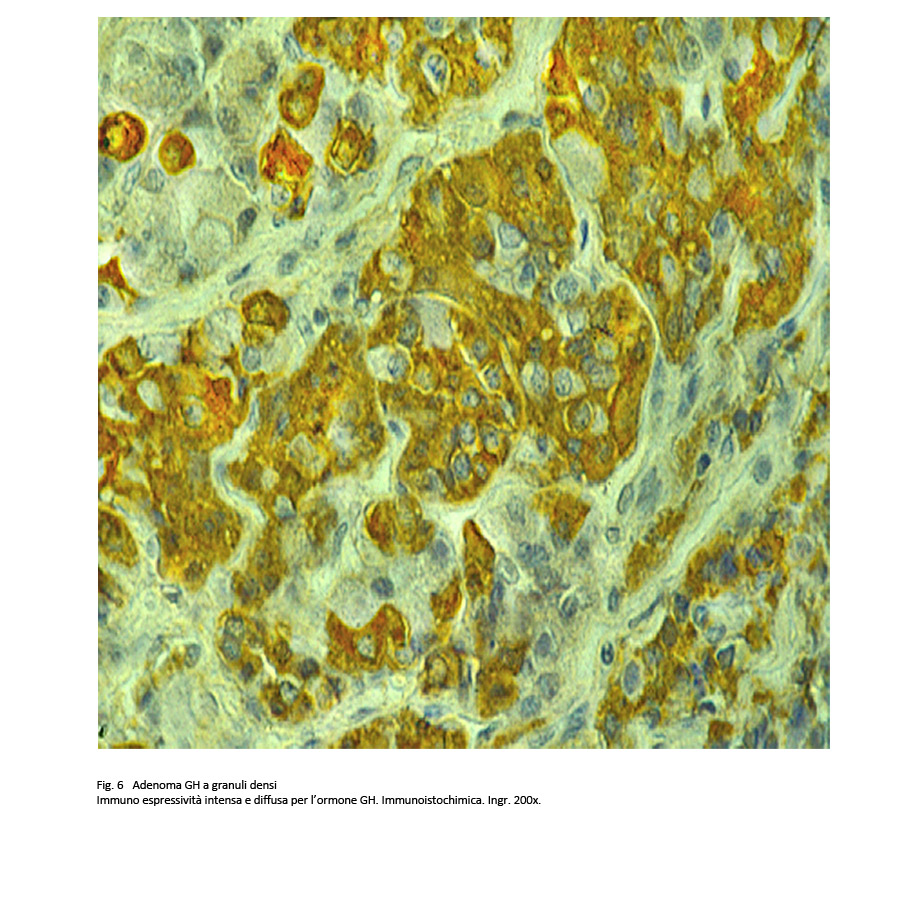
Il valore di questo indice rispecchia le modalità di crescita, lente e di tipo espansivo.
-
Adenoma a granuli sparsi secernente GH
L’architettura microscopica di questo adenoma ripete quella del sottotipo precedentemente descritto. Le cellule sono di piccola – media taglia e hanno un citoplasma lievemente acidofilo o cromofobo.
I nuclei sono rotondeggianti o frequentemente pleomorfi, sono ipercromatinici e sono forniti di un preminente nucleolo; in sede paranucleare si possono repertare aree chiare e “corpi fibrosi”.
fig.7 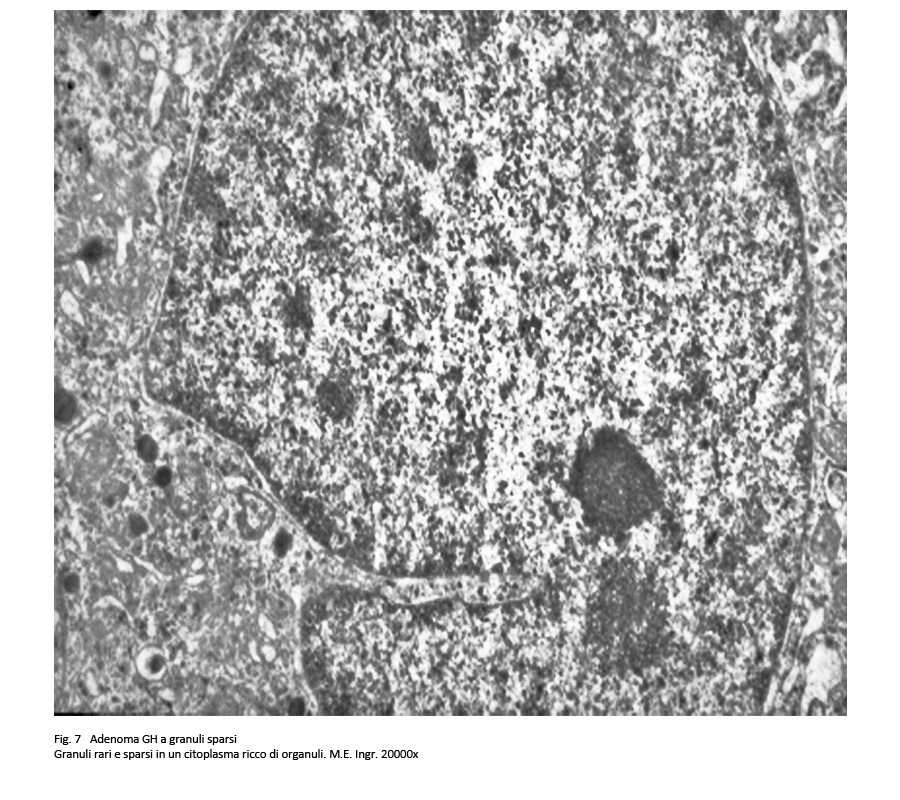 fig.8
fig.8 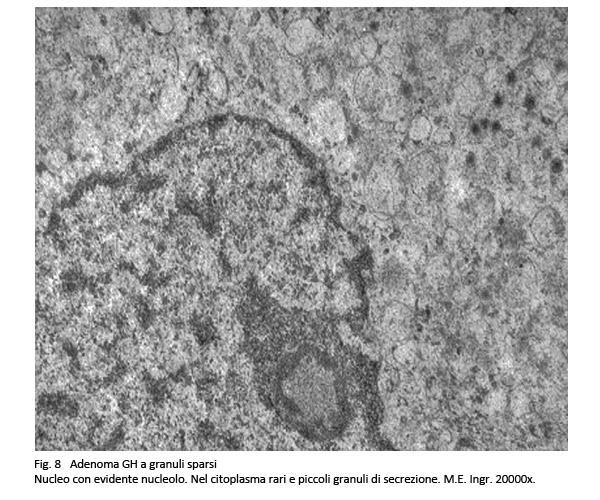 fig.9
fig.9 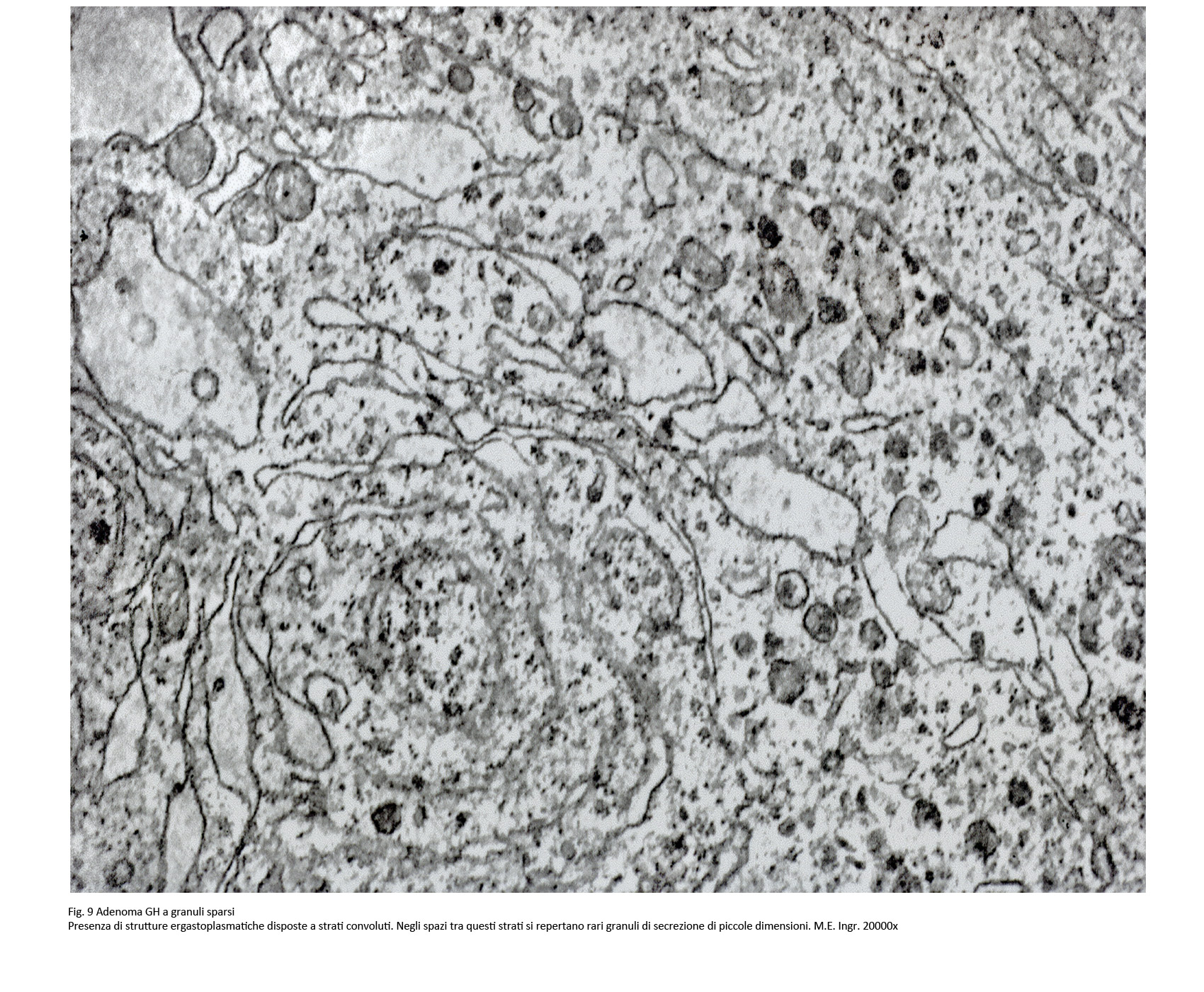
Al microscopio elettronico si rivelano nel citoplasma quote cospicue di ergastoplasma rugoso con una disposizione a forma di strutture convolute; a queste si associano granuli di secrezione di piccola taglia, 100-250 nm, distribuiti in modo sparso e la presenza di aggregati addensati di filamenti intermedi e di reticolo endoplasmico, quale espressione ultrastrutturale dei “corpi fibrosi”.
Le ricerche di immunoistochimica hanno evidenziato una ridotta immunoespressività per l’ormone GH, e un indice di attività proliferativa, ricavato attraverso la espressività al MIB-1, vicino allo zero; queste indagini hanno esplicitato una positività immunologica per la citocheratina a basso peso molecolare e in particolare per la citocheratina.
Le modalità di crescita sono frequentemente infiltranti e possono colpire le strutture anatomiche circostanti.
-
Adenoma mammosomatotropo, GH/PRL
Questo adenoma è composto da un solo tipo cellulare (monocellulare) il quale evidenzia la attitudine a secernere due differenti ormoni, GH e PRL (adenoma bi-ormonale). Al microscopio luce, questo adenoma ha abitualmente una struttura solida, diffusa ed una popolazione cellulare monomorfa, di media taglia. La maggior parte di questi elementi evidenziano un citoplasma con una tingibilità acidofila e in numero molto esiguo un citoplasma con tingibilità cromofoba.
Al microscopio elettronico le cellule di questo adenoma sono simili a quelle dell’adenoma GH a granuli densi e presentano come unico carattere di distinzione una variabilità di volume dei granuli di secrezione; frequentemente questi granuli si ritrovano raccolti lungo le fasce periferiche delle cellule e ancora di più negli spazi intercellulari dopo i processi di esocitosi.
fig.10 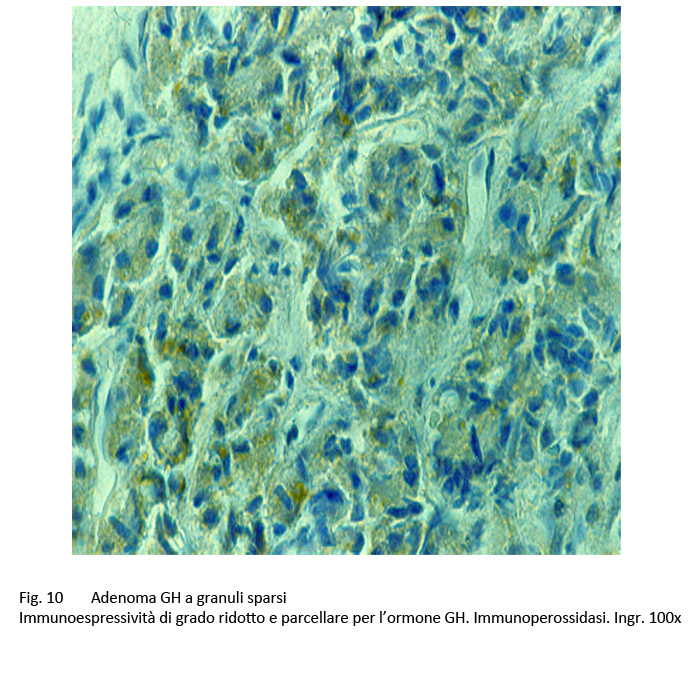 fig.11
fig.11 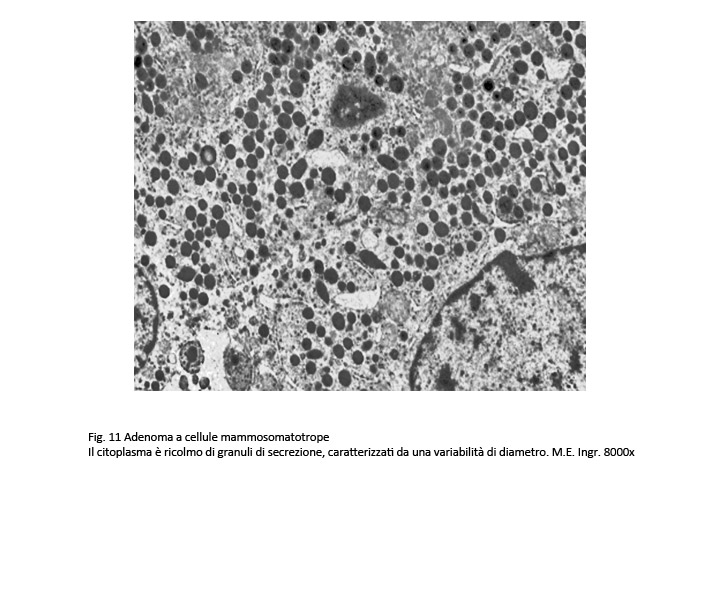 fig.12
fig.12 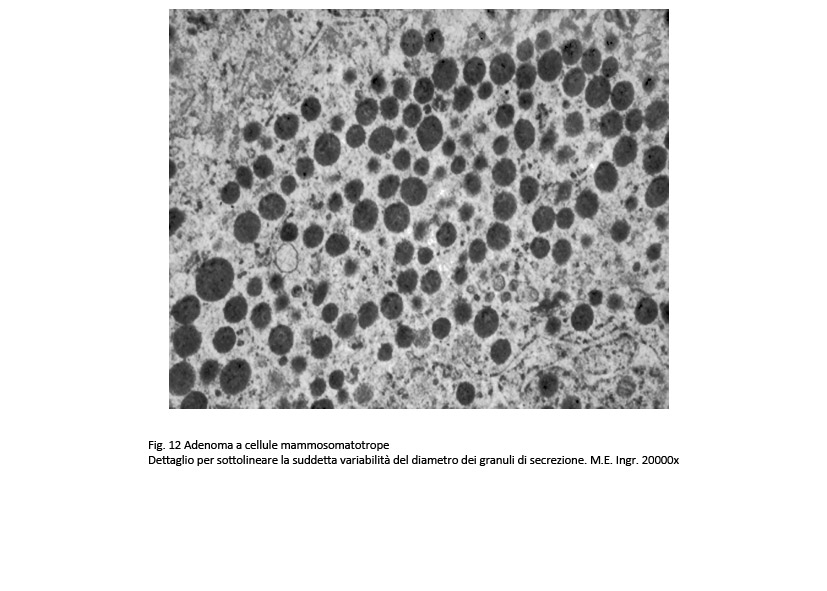
fig.13 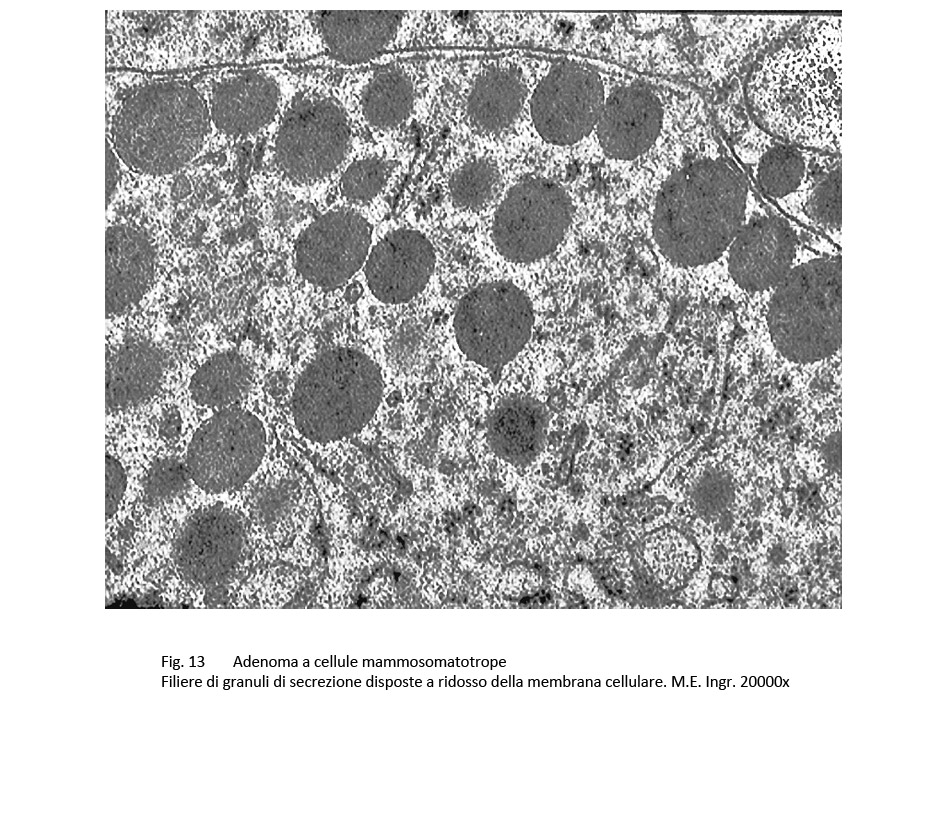 fig.14
fig.14 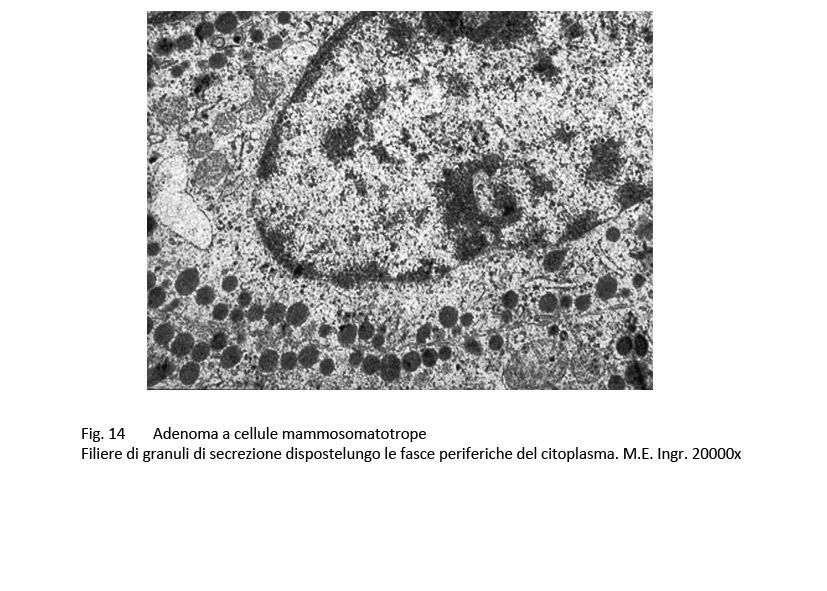 fig.15
fig.15 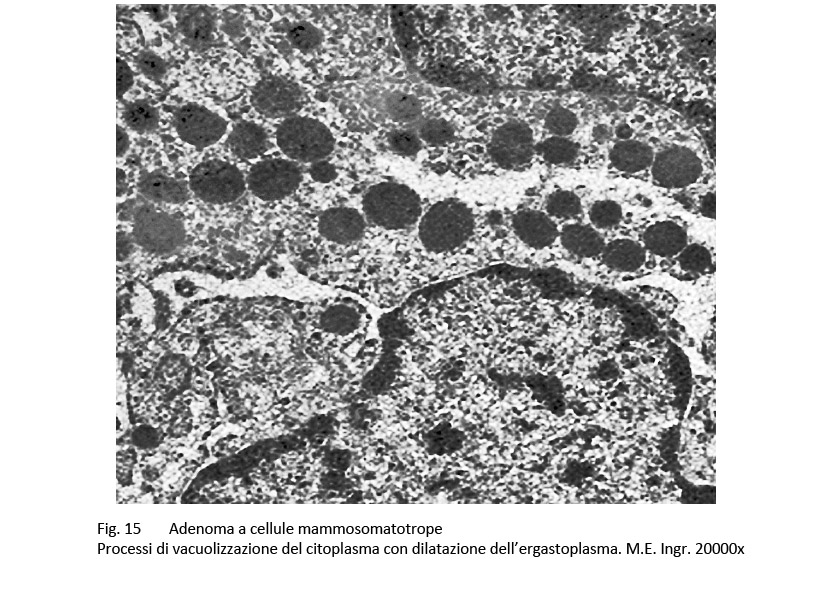
fig.16 
Le tecniche di immunoistochimica hanno evidenziato estese espressività immunologica per l’ormone GH e in quota ridotta, plurifocale, una espressività per l’ormone PRL¸a questi reperti si aggiungono positività per le cheratine a basso peso molecolare e per la sub-unità-alfa-1.
-
Adenoma misto somatotropo-lattotropo
Sono, questi, adenomi bicellulari e bi-ormonali, essi appaiono essere costituiti da una commistione di elementi aventi i caratteri morfologici riferibili agli adenomi GH e agli adenomi PRL.
Al microscopio luce si rileva una tingibilità citoplasmatica di tipo acidofilo e una disposizione strutturale diffusa e/o trabecolare.
E’ stata documentata una variabilità plurizonale del grado di acidofilia citoplasmatica e questo reperto di tingibilità ha trovato la sua giustificazione nell’esame ultrastrutturale. Infatti, al microscopio elettronico è possibile repertare cellule con citoplasma colmo di granuli di secrezione accanto ad elementi aventi un citoplasma fornito di granuli esigui distribuiti in modo irregolare.
fig.17 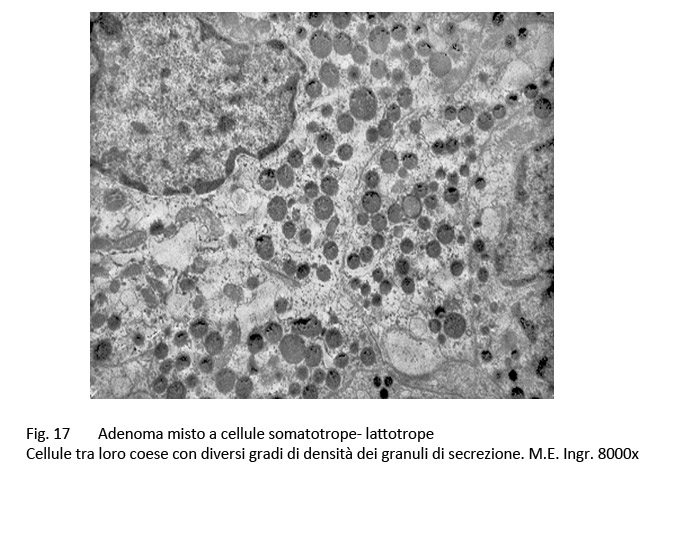 fig.18
fig.18 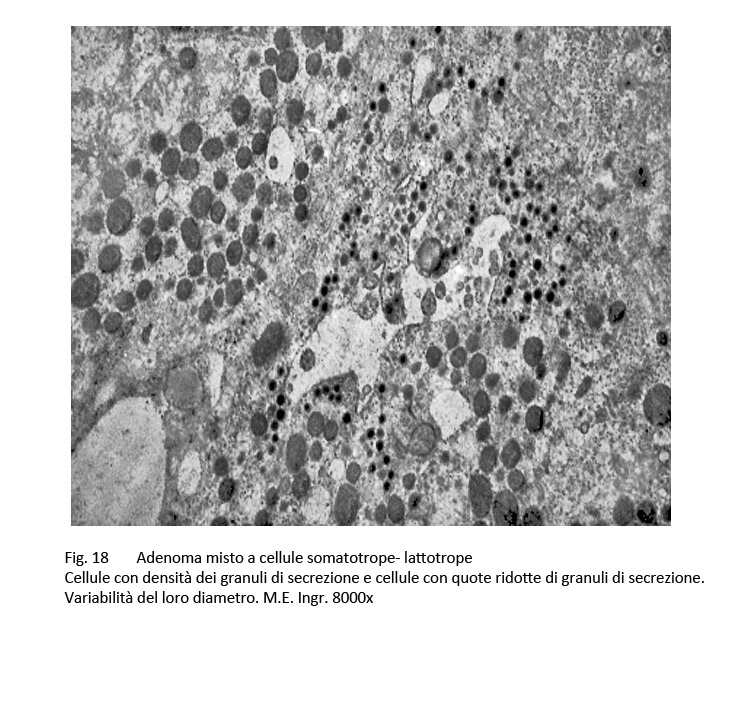 fig.19
fig.19 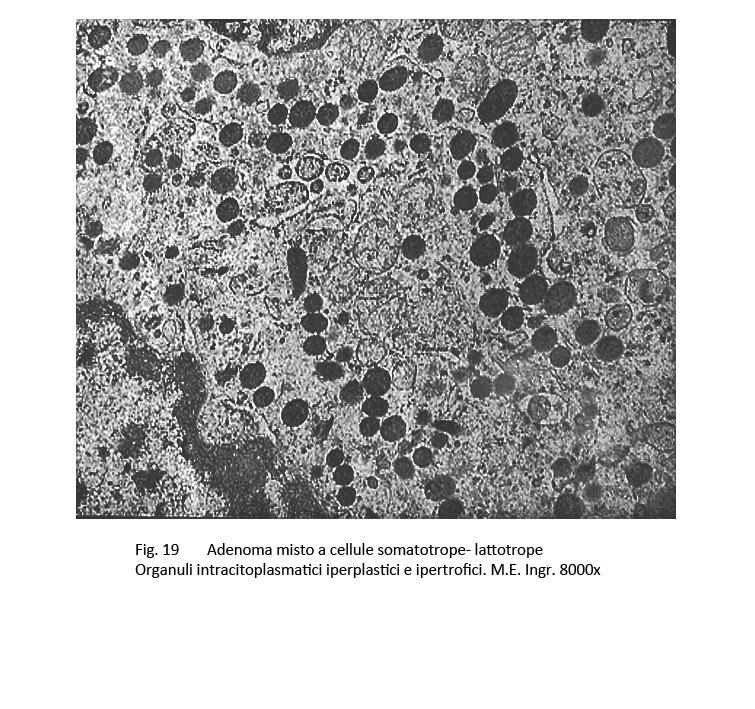
fig.20 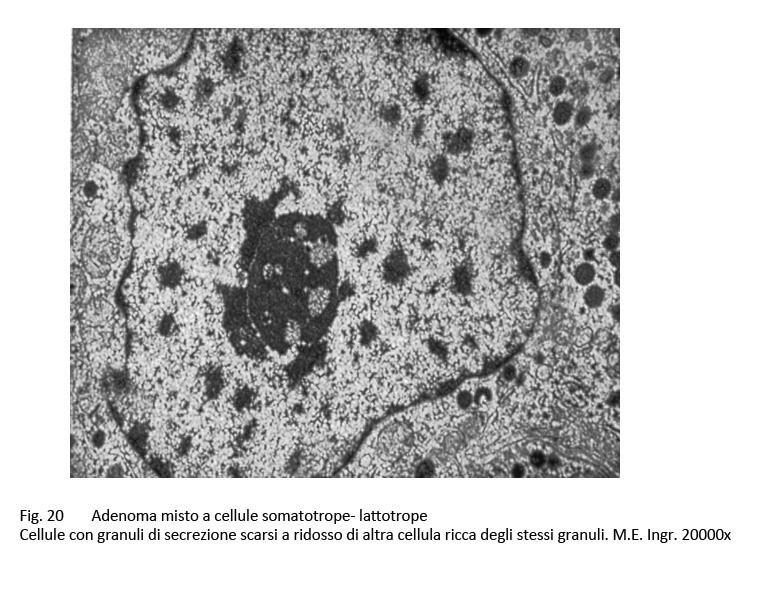 fig.21
fig.21 
Mediante le tecniche di immuno-istochimica monoclonali è stato possibile dimostrare la presenza di cellule secernenti GH accanto ad altre cellule secernenti PRL.
-
Adenoma a cellule stam. acidofile
Questi adenomi sono costituiti da un unico tipo di cellule (adenoma monomorfo) fornito di capacità funzionale per sintetizzare gli ormoni PRL e GH.
Al microscopio luce questo istotipo evidenzia frequentemente una architettura diffusa ed è costituito da cellule lievemente pleomorfe con un grado ridotto di acidofilia. Il loro citoplasma non appare omogeneo ma è sede di vacuoli, di fini granuli o è iper-chiaro, quasi trasparente. Non è infrequente la presenza nell’ambito di tale popolazione di quote di cellule oncocitarie. Queste cellule sono fornite di quote cospicue di mitocondri con una ridotta componente di ergastoplasma e un apparato del Golgi parzialmente involuto si possono repertare in adenomi gonadotropi e in quelli a cellule nulle.
I reperti ultrastrutturali confermano questa varietà di reperti da vacuoli e rarefazione della matrice citoplasmatica e da granuli riferibili a mitocondri giganti e a grossi corpi fibrosi.
fig.22 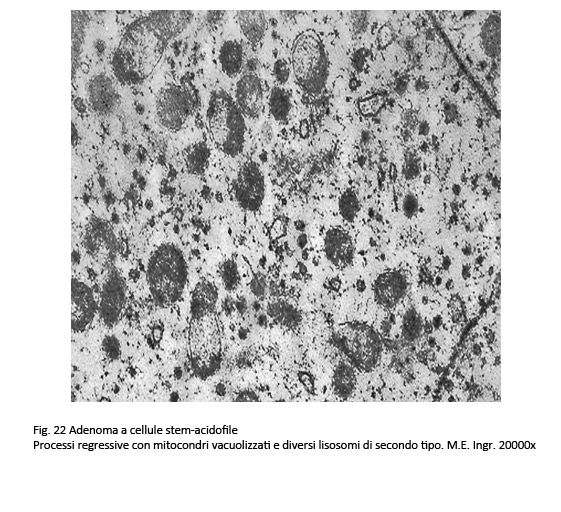 fig.23
fig.23 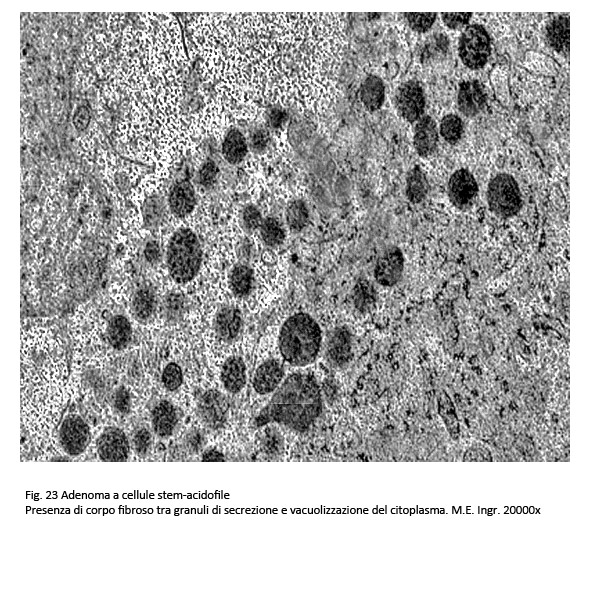 fig.24
fig.24 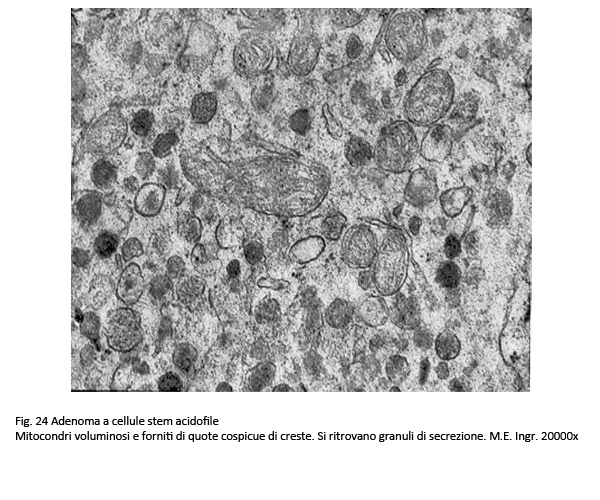
fig.25 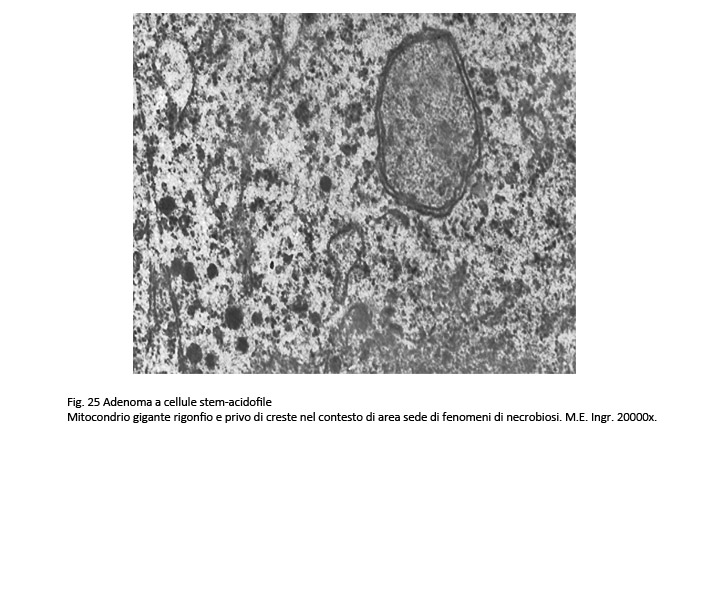 fig.26
fig.26 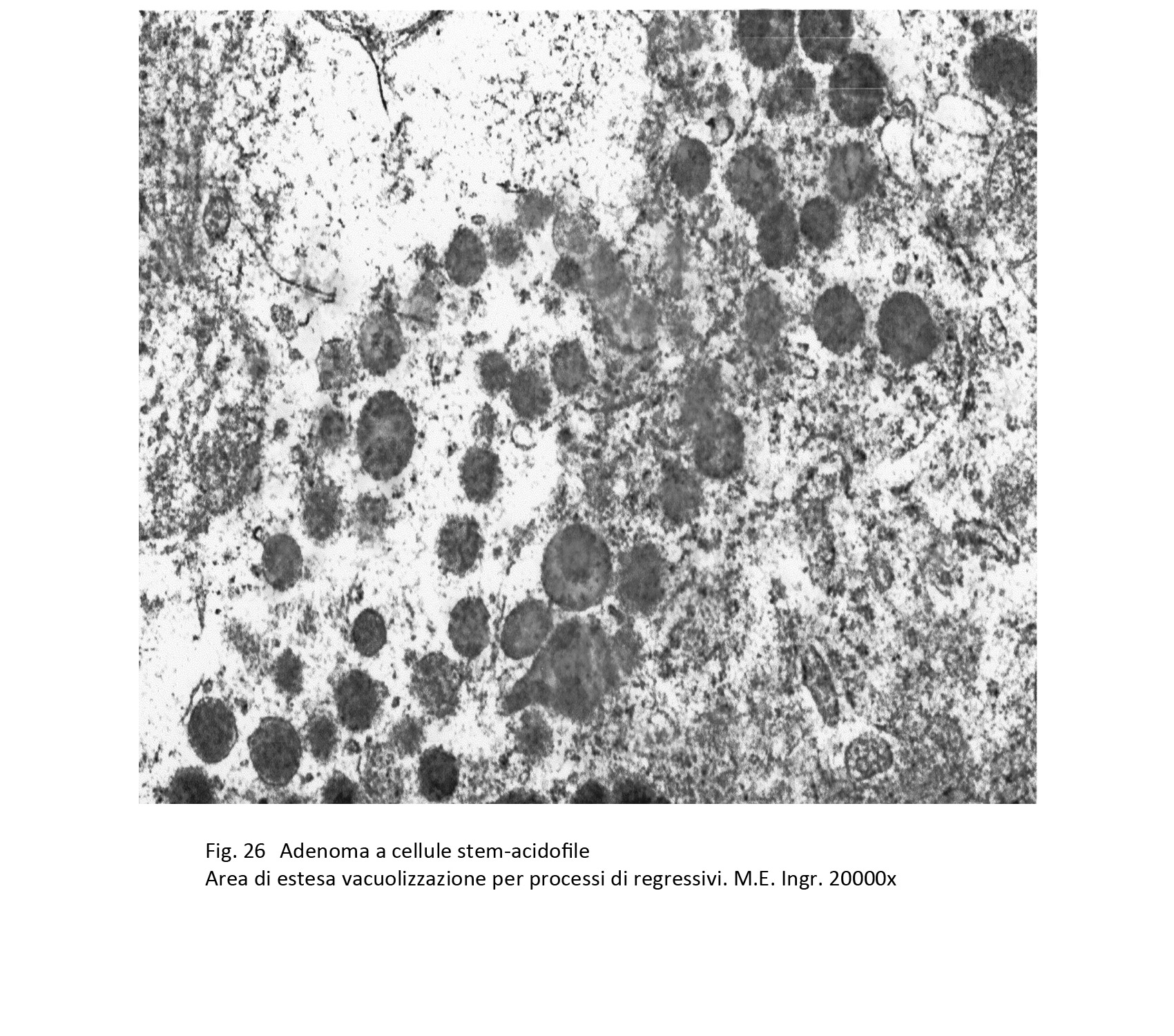
Le metodiche di immunoistochimica svelano la esistenza di una immunoespressività di vario grado sia per l’ ormone GH sia per quello PRL.
Questo reperto mette in evidenza circa la possibilità di una dissociazione tra morfologia e attività funzionale e della capacità di una cellula di secernere uno o più ormoni.
Adenomi secernenti PRL (Prolattina)
-
Adenoma PRL a granuli sparsi
L’adenoma PRL a granuli sparsi appare al microscopio luce strutturato in forma diffusa, o trabecolare o pseudo papillare con la possibilità del riscontro di casi con caratteri architettonici misti.
Le cellule di questo adenoma sono larghe, poliedriche e molto frequentemente predominano elementi allungati contenenti un nucleo ipercromatico e orientato secondo l’asse maggiore della cellula.
La quota rappresentata è ben sviluppata ed evidenzia una tingibilità cromofoba o lievemente acidofila.
Frequentemente si riscontrano processi secondari di tipo regressivo, questi sono rappresentati da fenomeni di vacuolizzazione del citoplasma, dai depositi intercellulari di materiale amiloide, da micro-aggregati di sali di calcio o dalla formazione di corpi psammomatosi.
Al microscopio elettronico si evidenziano nel citoplasma quote cospicue di organuli e in particolar modo uno sviluppo di ergastoplasma rugoso con possibili formazione di strutture ergastoplasmatiche disposte a strati concentrici; tra questi organuli si distribuiscono in modo disordinato e sparso quote ridotte di granuli di secrezione di piccole dimensioni (100-300 /n, granuli che sono frequentemente raccolti negli spazi intercellulari dopo un processo di esocitossi.
fig.27 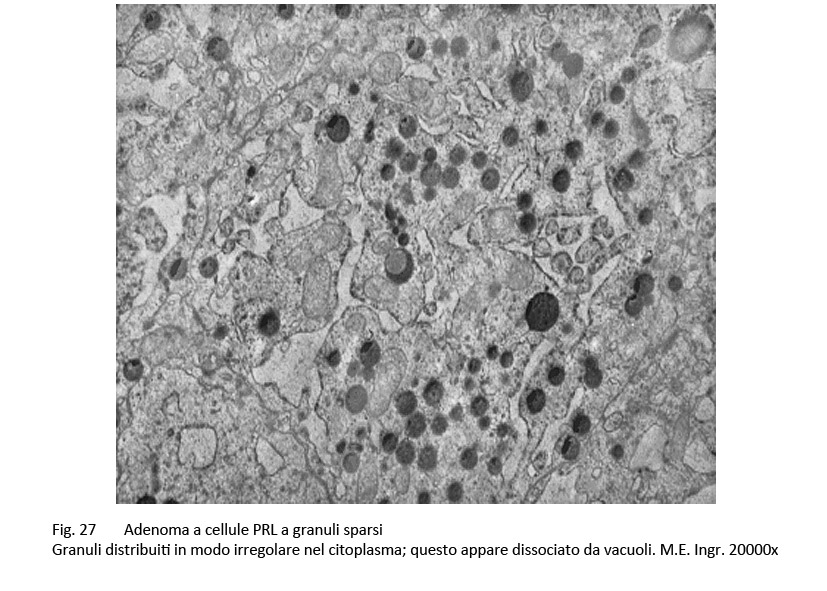 fig. 28
fig. 28 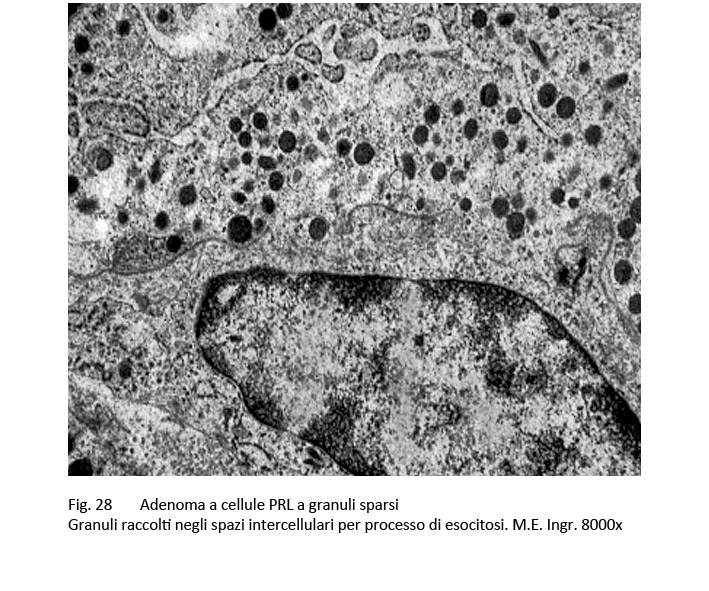 fig.29
fig.29 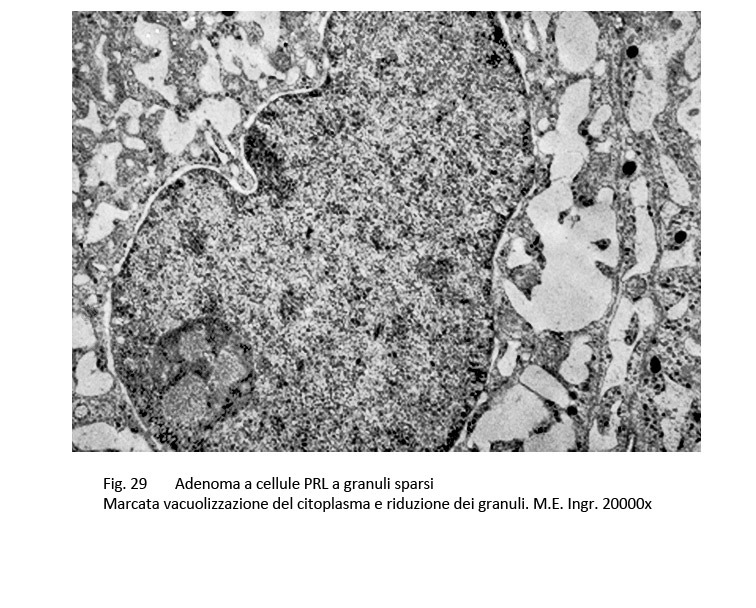
Le indagini di immunoistochimica rivelano una bassa immuno-reattività per l’ormone PRL e una ridotta espressività per l’indice di attività proliferativa valutato secondo il MIB-1. Infatti questo adenoma è a lenta crescita con le modalità di tipo espansivo.
fig.30 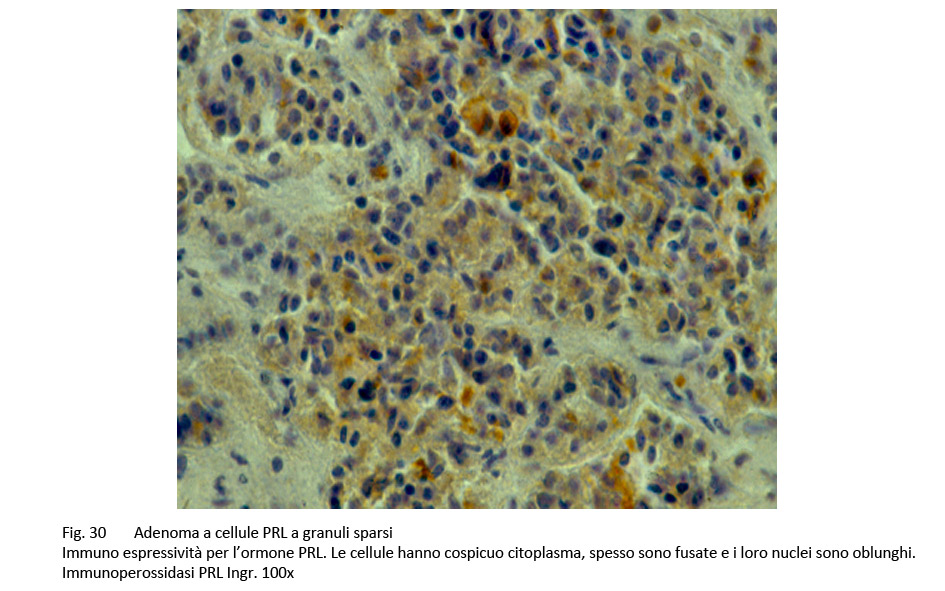
-
Adenoma PRL a granuli densi
-
L’adenoma PRL a granuli densi, al microscopio luce, evidenzia una micro-architettura variabile da caso a caso rappresentata da disegni trabecolari, compatti, papillari o misti.
Le cellule sono larghe, hanno ampio citoplasma e hanno forma ovoidale o fusata, il nucleo occupa la porzione centrale del corpo cellulare, è ipercromatinico, ha un aspetto compatto e una forma allungata.
Al microscopio elettronico si rivelano nel citoplasma molti organuli con particolare riguardo alla quota ergastoplasmatica e un elevato numero di granuli di secrezione; questi si ritrovano spesso stratificati a ridosso della membrana cellulare e/o si repertano piccoli gruppi negli spazi intercellulari.
fig.31 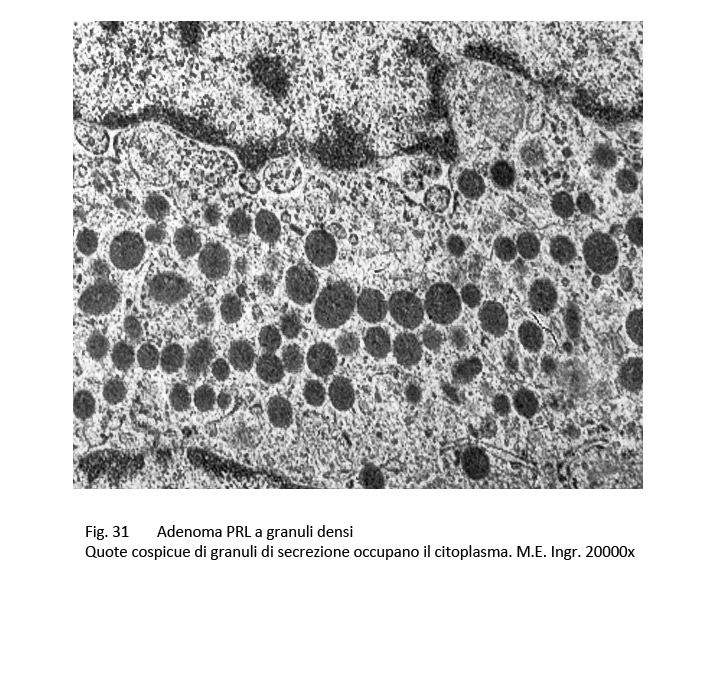 fig.32
fig.32 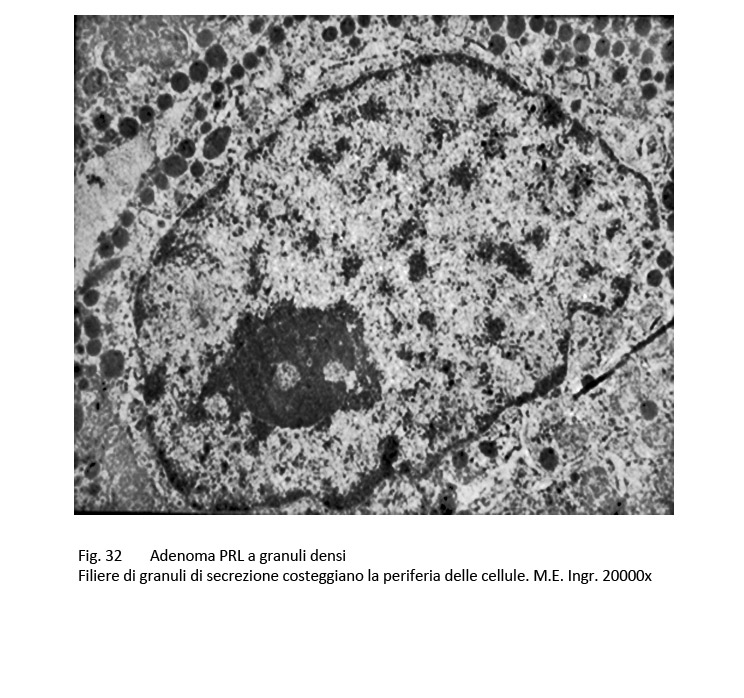 fig.33
fig.33 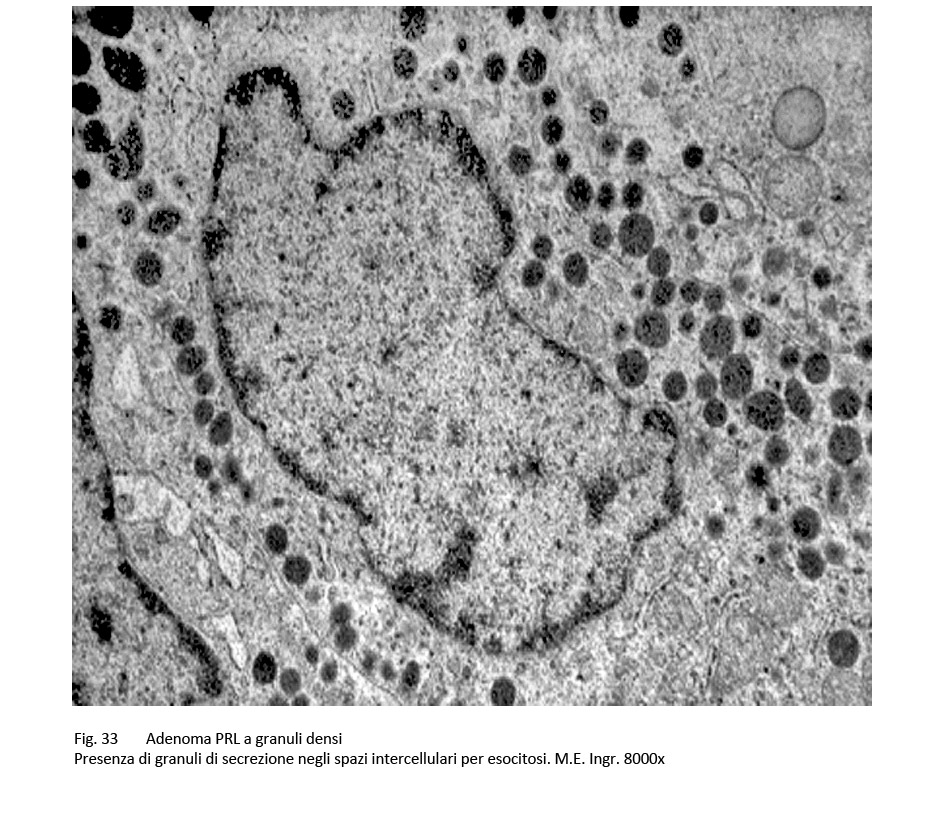
La diagnostica immuno-istochimica evidenzia una diffusa e netta immuno-reattività citoplasmatica per l’ormone PRL e una bassa immuno-reattività per il MIB-1, quale espressione di un basso indice di crescita della neoplasia.
fig.34 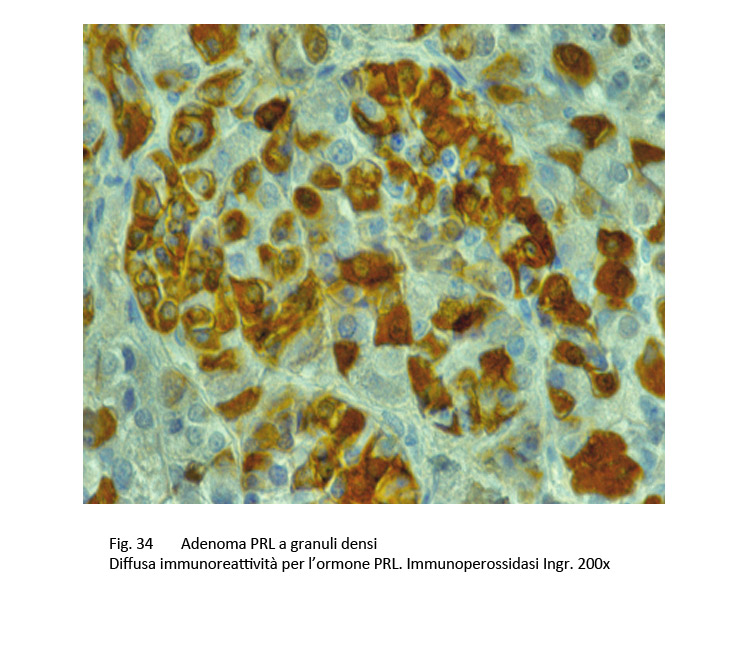
Gli adenomi secernenti ACTH si manifestano secondo i seguenti tre sottotipi: 1) adenoma corticotropo a granuli densi; 2) adenoma corticotropo a granuli sparsi; 3) adenoma corticotropo a cellule di Crooke.
-
Adenoma corticotropo a granuli densi
Questo adenoma corticotropo al microscopio luce ha una architettura compatta, diffusa o sinusoidale. Le cellule sono di media taglia, sono monomorfe o lievemente pleomorfe, evidenziano un citoplasma basofilo e positivo al PAS. Il nucleo è in porzione centrale, ha forma sferica, ovoidale o irregolare ed è fornito di un evidente nucleolo.
Al microscopio elettronico il citoplasma contiene discrete quote di molti ribosomi liberi ed è sede di una elevata componente di granuli di secrezione aventi un diametro oscillante tra 200-450 nm.
fig.35 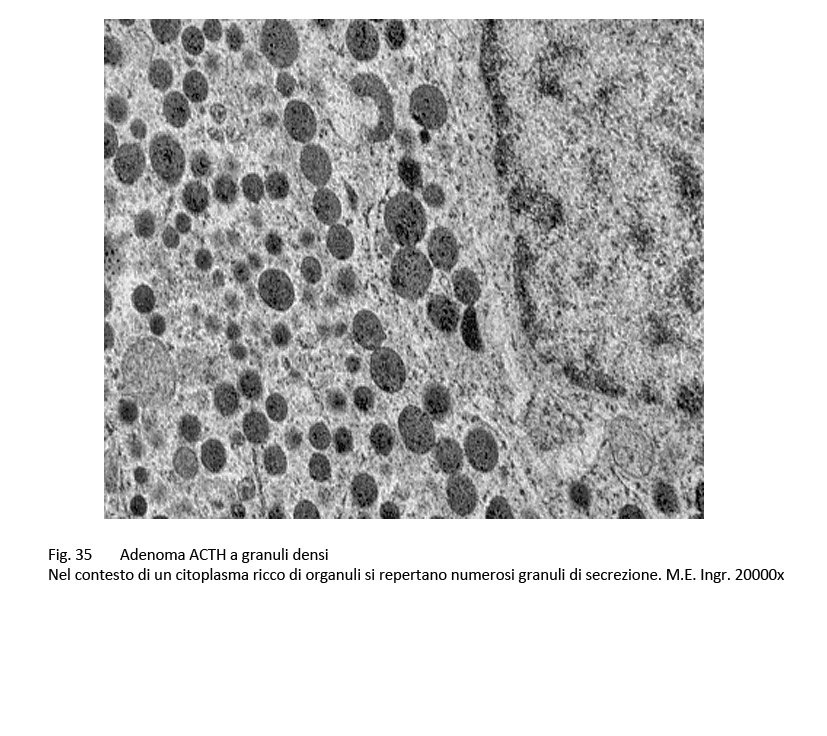 fig.36
fig.36 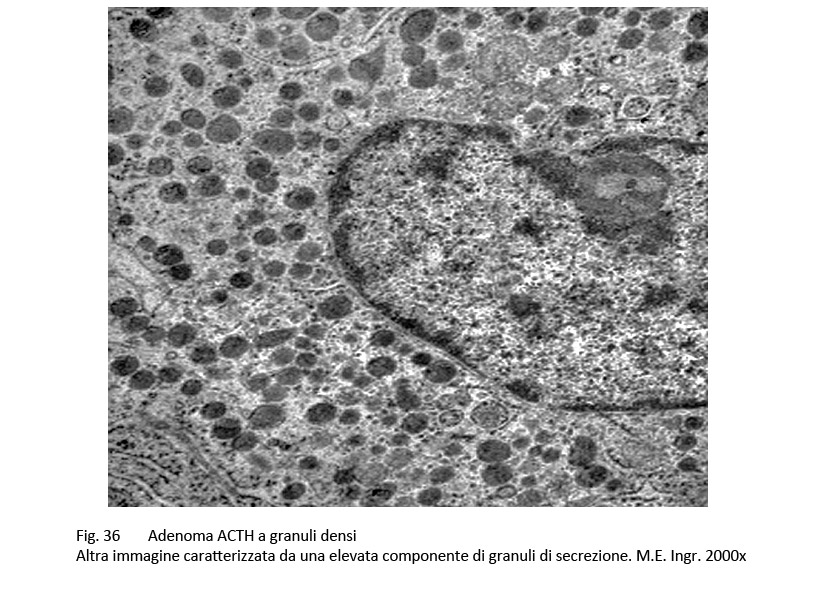 fig.37
fig.37 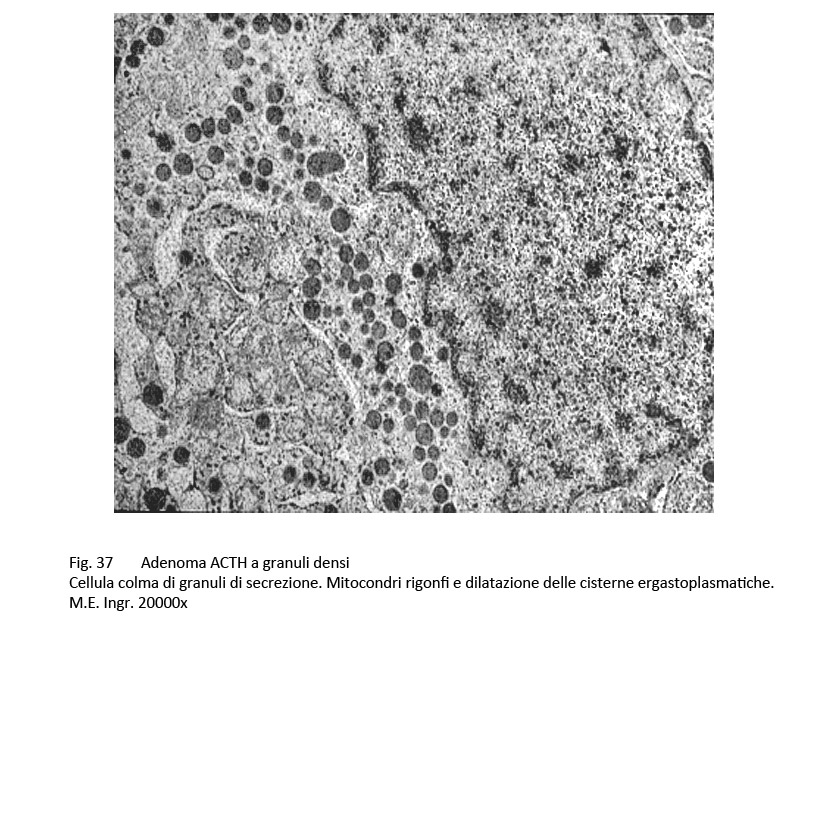
Le cellule adenomatose associate alla malattia di Cushing contengono fasci di filamenti di citocheratine disposte attorno al nucleo. Ricerche di immunoistochimica hanno dato una diffusa immuno-reattività per l’ormone ACTH, per la beta-endorfina e per altri peptidi POMC- derivati.
fig.38 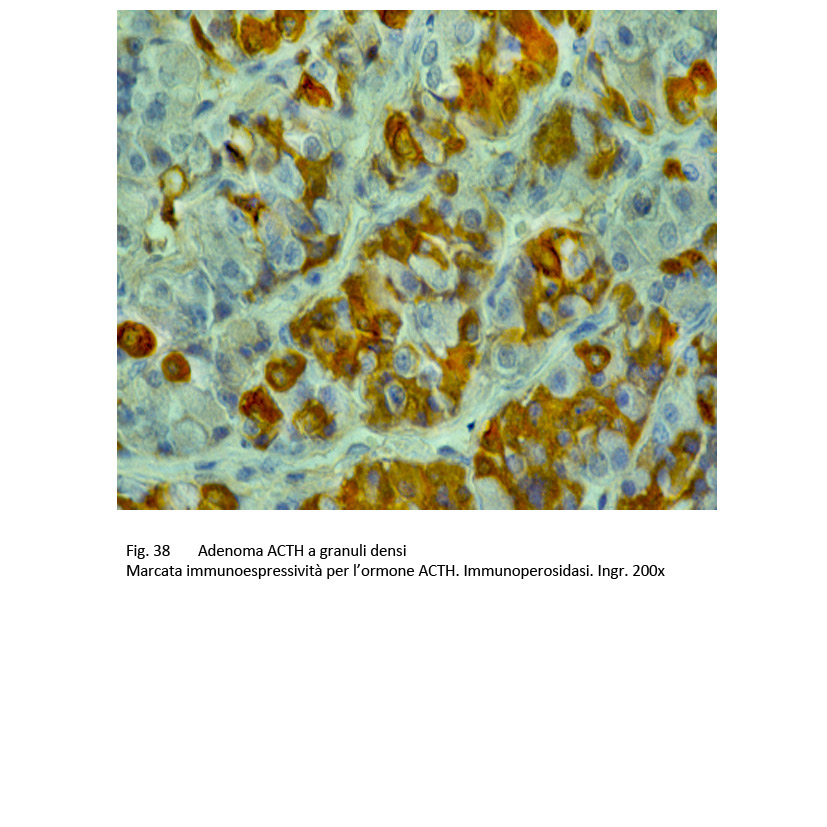
L’esperienza anatomo-clinica ha documentato la esistenza di adenomi corticotropi a granuli densi clinicamente attivi e il riscontro di adenomi del tutto simili silenti per assenza di attività escretrice e quasi clinicamente inattivi.
-
Adenoma corticotropo a granuli sparsi
L’adenoma corticotropo a granuli sparsi ha la medesima architettura istopatologica di quello descritto nel precedente paragrafo.
Le cellule possono mostrare un pleomorfismo di vario grado ed essere centrate da un nucleo dismorfo e nucleolato. Il citoplasma è cromofobo o lievemente basofilo e può mostrare focali positività al PAS. Al microscopio elettronico, queste cellule evidenziano componenti ergastoplasmatiche e golgiane ben sviluppate in contrasto con un ridotto numero di granuli, distribuiti in modo disordinato nella matrice citoplasmatica e caratterizzate da una notevole variabilità di volume e di densità agli elettroni.
fig.39 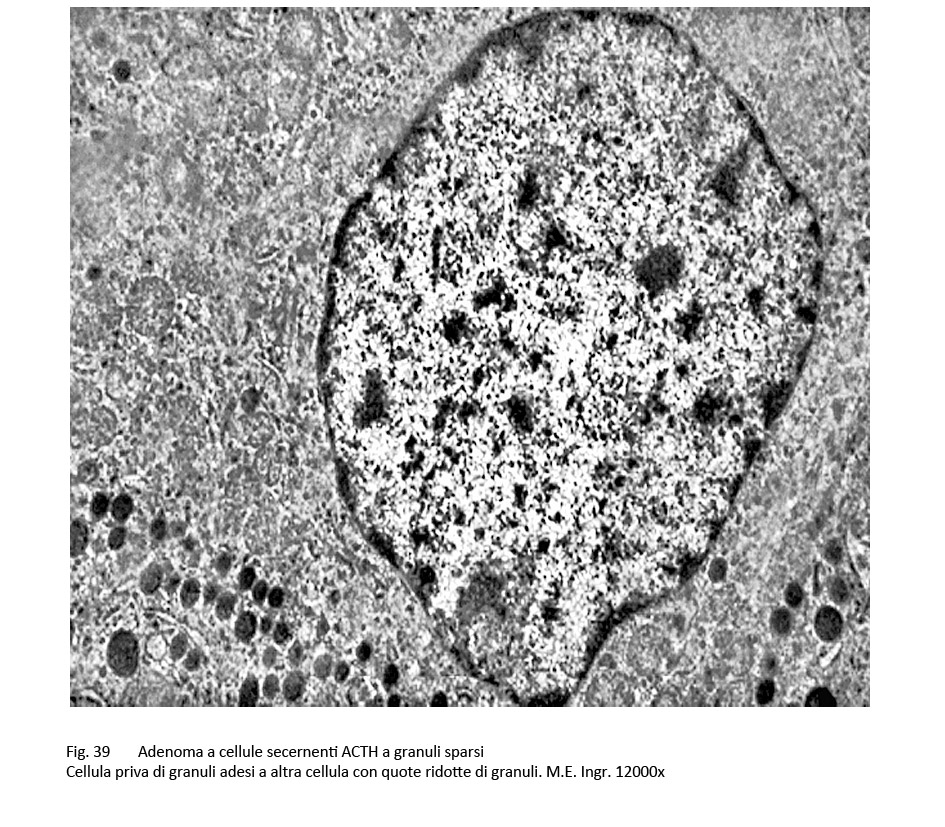 fig.40
fig.40 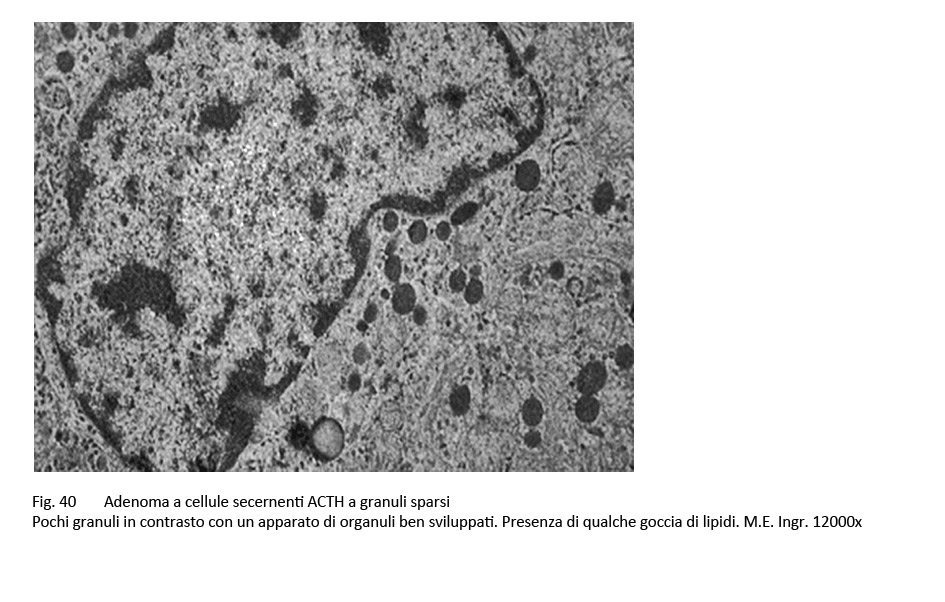 fig.41
fig.41 
Le tecniche di immunoistochimica consentono di apprezzare soltanto una lieve immunoespressività per l’ormone ACTH o più semplicemente una risposta diffusamente negativa.
fig.42 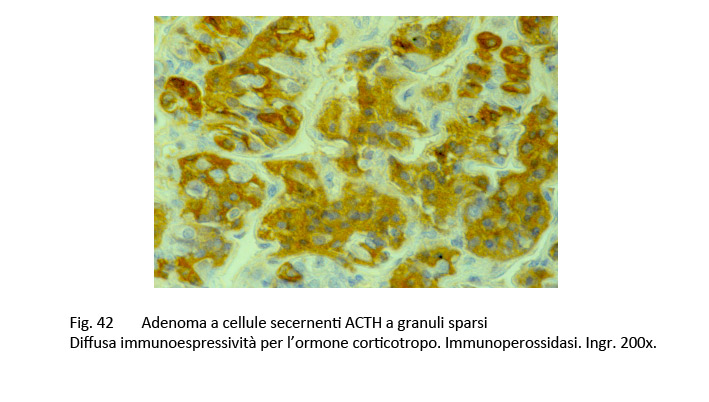
Anche questo adenoma, come l’omonimo a granuli densi, può manifestarsi secondo due varianti: la prima è clinicamente espressa, la seconda risulta essere clinicamente muta per blocco dei processi escretori.
Frequentemente questo adenoma può acquisire i caratteri del macro-adenoma e si manifesta in associazione alla sindrome di Nelson.
-
Adenoma corticotropo a cellule di Crooke
Questo adenoma ha una micro-architettura simile a quella dei due sottotipi precedentemente descritti.
Al microscopio luce, esso si caratterizza per la presenza di elementi cellulari particolari, denominati “cellule di Crooke”. Questi elementi sono larghi, hanno un citoplasma occupato da vacuoli e da materiale ialino disposto in modo anulare attorno al nucleo, e possono presentare caratteri di atipia nucleare e citoplasmatica.
Al microscopio elettronico si repertano grossi lisosomi spesso raccolti nei vacuoli e fasci addensati di filamenti di cheratina, quale espressione ultrastrutturale del materiale ialino riscontrato al microscopio luce. I granuli di secrezione sono sparsi e preferenzialmente si raccolgono in sede peri-nucleare e/o lungo le fasce periferiche. Mediante le tecniche di immuno-istochimica è stata osservata una ridotta immunoespressività per l’ormone ACTH.
Le cellule di Crooke non sono specifiche degli adenomi corticotropi; esse si possono manifestare in tutti gli stati ipercortisolemici.
L’adenoma tireotropo evidenzia al microscopio luce una microstruttura sinusoidale ed è costituito da cellule monomorfe di media taglia; separate da tralci di fibrosi e inframezzate da psammomi. Il citoplasma di questi elementi è e può contenere granuli che risultano essere PAS positivi. Il nucleo appare voluminoso, ipercromatinico e pleomorfo. Al microscopio elettronico, le cellule sono ricche di organuli in particolare di lisosomi, di ergastoplasma rugoso, grossi lisosomi e di un apparato del Golgi che appare spesso loboide; vi coesistono anche granuli di secrezione ormonale, questi sono rotondeggianti e di piccola taglia, variando tra 150-250 nm e raramente delle dimensioni di 350 nm. Tutti questi granuli tendono a raccogliersi a ridosso della membrana cellulare.
fig.43 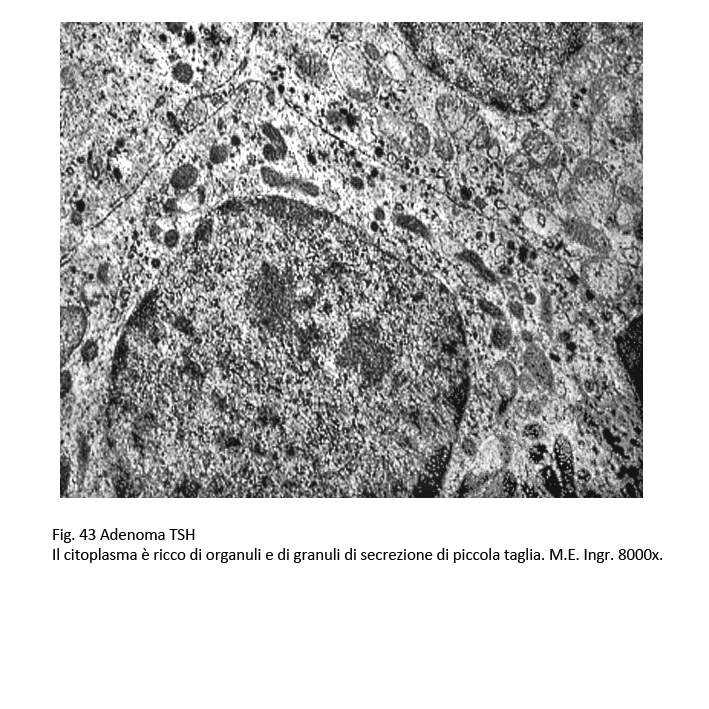 fig.44
fig.44 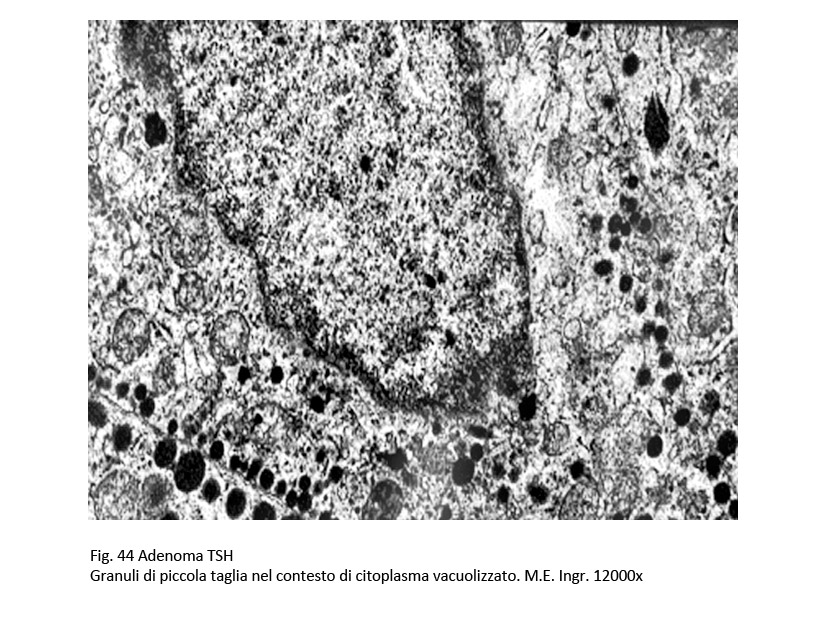 fig.45
fig.45 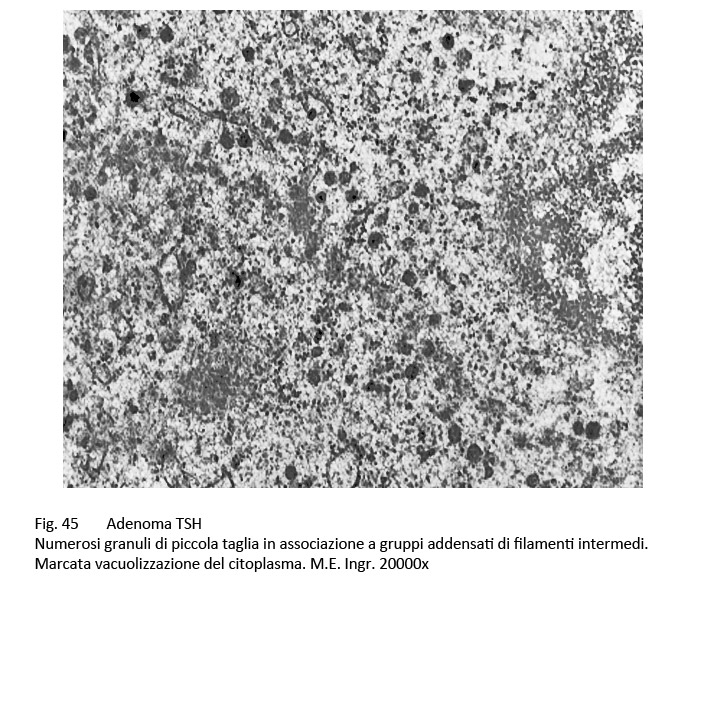
Nel citoplasma, accanto all’ergastoplasma e tra i granuli di secrezione si repertano anche voluminosi lisosomi. Alle indagini di immunoistochimica si apprezza uno stato di immuno-espressività di vario grado per l’ormone beta-TSH e per l’alfa-sub-unità.
fig.46 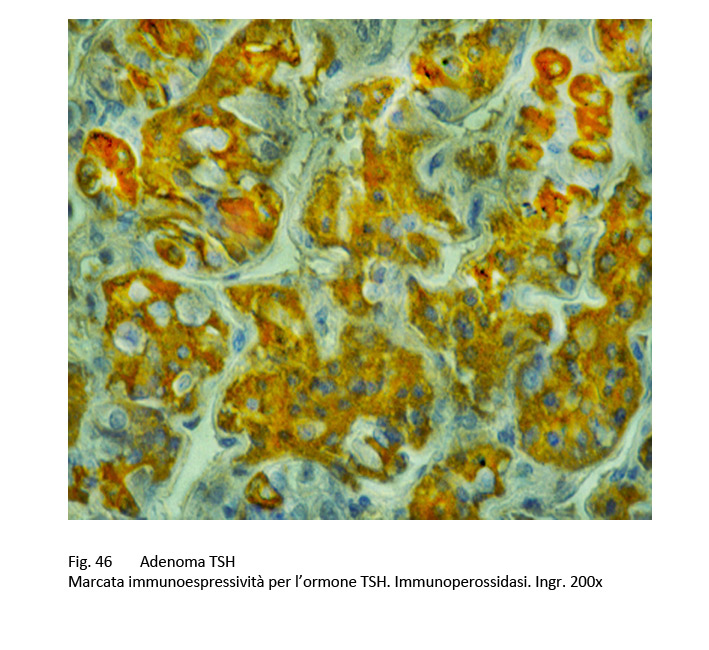
-
Adenoma secernente gonadotropine
L’adenoma gonadotropo è abitualmente un macroadenoma ed evidenzia al microscopio una architettura variabile di tipo diffuso, papillare o trabecolare, in molti campi le cellule si dispongono a formare anche abbozzi follicolari o pseudo rosette attorno ai capillari.
Il citoplasma ha una tingibilità quasi nulla (cromofobia) e il nucleo è voluminoso e ipercromatinico. Nel contesto di tale popolazione cellulare è frequente la presenza di cellule oncocitarie con citoplasma acidofilo. Al microscopio elettronico sono distinguibili due citotipi, il primo è ben differenziato, l’altro è scarsamente differenziato.
Il primo è fornito di organuli e di granuli densi di secrezione; il secondo è povero di organuli, sono presenti fenomeni di vacuolizzazione e dilatazione dei sacculi del Golgi ed è fornito di una quota esigua di granuli, dispersi sul citoplasma. In ambedue i tipi cellulari i granuli di secrezione sono piccoli ed evidenziano un diametro intorno ai 250 nm.
fig.47 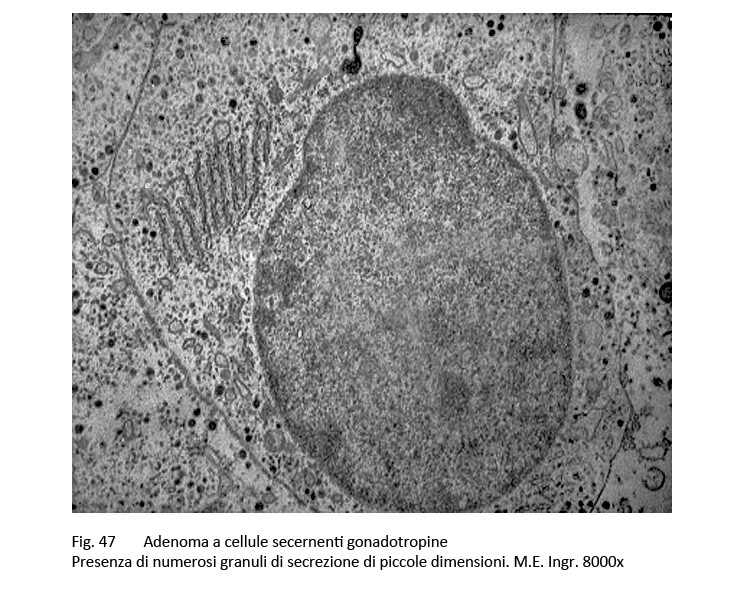 fig.48
fig.48 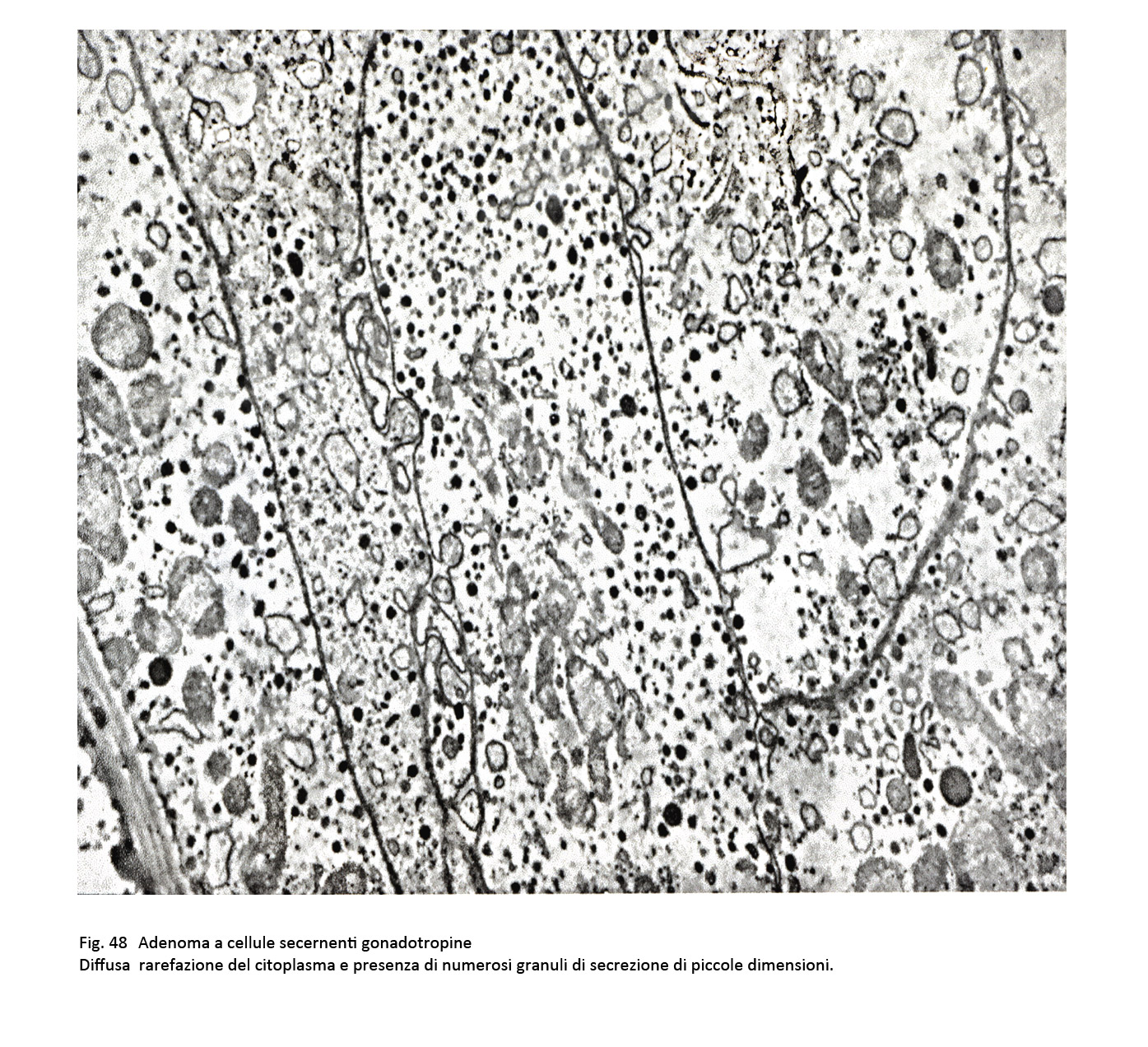 fig.49
fig.49 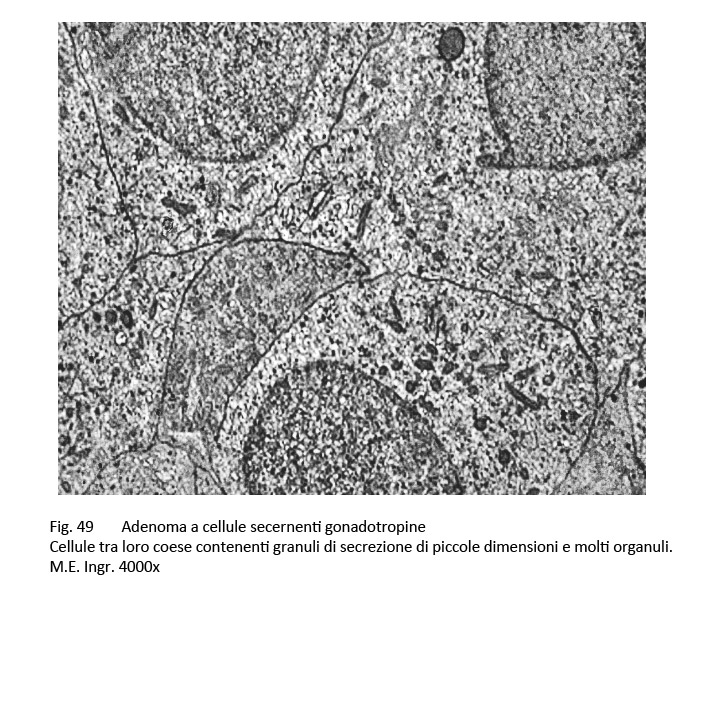
Le indagini di immunoistochimica hanno documentato una espressività per l’alfa-sub-unità, per la beta-FSH e la beta-LH.
-
Adenoma a cellule nulle (non secernenti)
Gli adenomi nulli sono neoplasie le quali sono fornite di cellule prive di attività secretiva e pertanto incapaci a indurre una condizione anatomo-clinica di eccesso di ormone.
Questo stato di mancata sintesi ormonale può essere riscontrato in tutti i tipi di adenoma, ma con maggiore frequenza è stato descritto nei casi di adenomi gonadotropi.
La microarchitettura, al microscopio luce, degli adenomi nulli è di tipo sinusoidale oppure disegna aspetti microfollicolari e/o pseudorosette. Le cellule hanno largo citoplasma il quale appare cromofobo alle colorazioni di routine e si presenta PAS-negativo. Al microscopio elettronico si nota una ridotta componente di organuli associata a fenomeni di vacuolizzazione e di formazioni microcistiche per dilatazione delle cisterne ergastoplasmatiche e dei sacculi golgiani. Si repertano pochi granuli di secrezione, di dimensioni ridotte e dispersi nel citoplasma.
fig.50 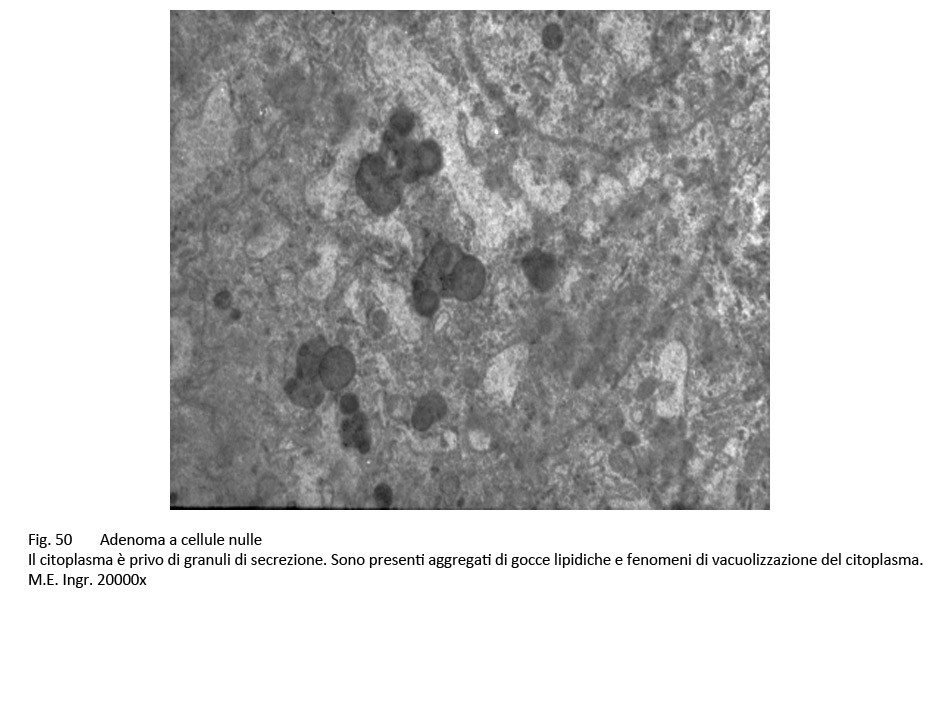 fig.51
fig.51 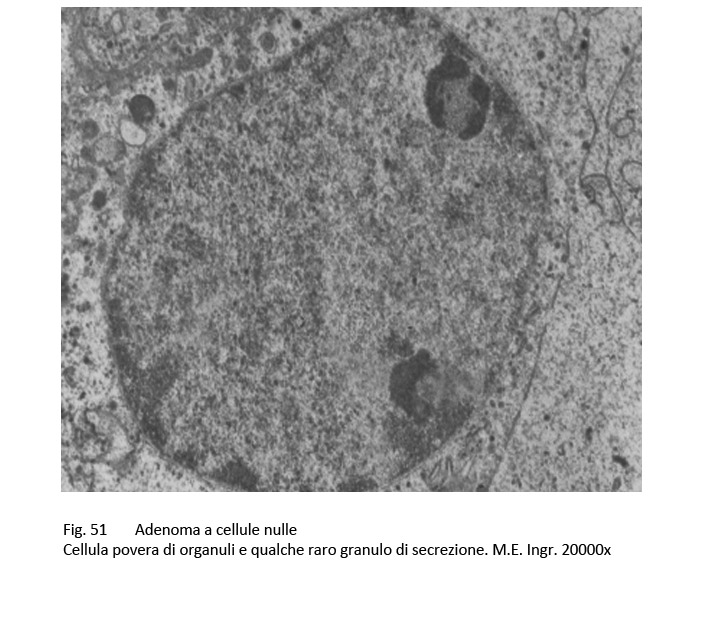 fig.52
fig.52 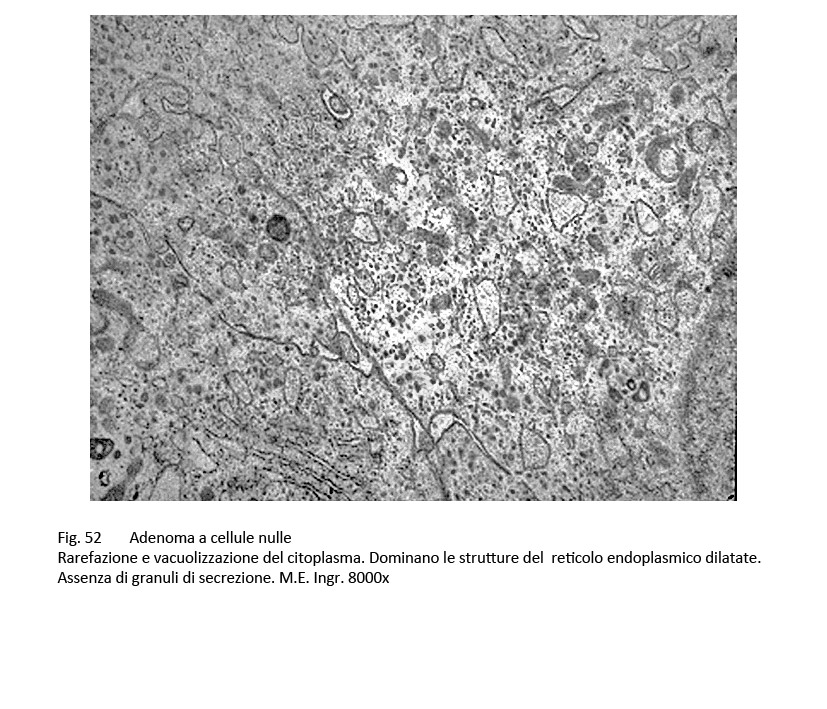
La ricerca immunoistochimica è abitualmente scarsa o nulla; in diversi casi si può apprezzare una lieve immunoespressività per FSH e/o per LH.
-
Adenoma a cellule nulle, variante oncocitaria (non secernente)
Questo adenoma a cellule nulle è una variante citologica della forma precedente in quanto è costuituito da elementi con caratteri oncocitari.
Al microscopio luce mostrano una microstruttura sinusoidale o a pseudorosette e la popolazione cellulare è data da elementi larghi, di media-grossa taglia con ampio citoplasma debolmente acidofilo; il nucleo occupa la porzione centrale della cellula, è voluminoso ed è ipercromatinico. Al microscopio elettronico, il citoplasma appare occupato da un’elevata quota di mitocondri, da una esigua componente ergastoplasmatica; i granuli di secrezione sono dispersi nel citoplasma, sono poco numerosi e mostrano una variabilità di diametro. Le indagini di immunoistochimica possono dare risultati negativi o lievi positività per gli ormoni FSH o LH o per cromogramina.
-
Adenomi a cellule nulle per processi secondari
Gli adenomi dell’ipofisi possono essere sede di processi regressivo-destuenti, di varia estensione provocando di fatto ogni attività di secrezione ormonale. Sono stati descritti reperti riferibili a focolai emorragici di varie estensioni, da trombosi endovasale, da aree sub-massive e massive di necrosi ischemica e da processi di tipo regressivo riguardanti il citoplasma delle cellule.
Sono considerati tali i fenomeni di vacuolizzazione e di rarefazione del citoplasma, quelli conseguenti allo accumulo di gocce lipidiche, quelli legati a rigonfiamento dei mitocondri con rottura delle creste, quelli espressi da una frammentazione e una dilatazione dell’ergastoplasma. Questa riduzione o ancor peggio questo depauperamento degli organuli endocellulari a causa un blocco delle attività di sintesi degli ormoni rendendo l’adenoma di fatto privo di attività secretiva (adenoma nullo).
-
Adenomi secernenti ormoni plurimi (adenomi pluri-ormonali)
Le ricerche di immunoistochimica effettuate mediante l’uso di anticorpi monoclonali hanno permesso di scoprire la esistenza di adenomi forniti di cellule secernenti ormoni plurimi.
In letteratura sono stati identificati tre sottotipi di adenomi pluriormonali: il tipo I, il tipo II e l’adenoma silente tipo III.
L’adenoma pluriormonale tipo I evidenzia i caratteri istopatologici ed ultrastrutturali dell’adenoma GH a granuli densi con una popolazione cellulare monomorfa o plurimorfa.
fig.53 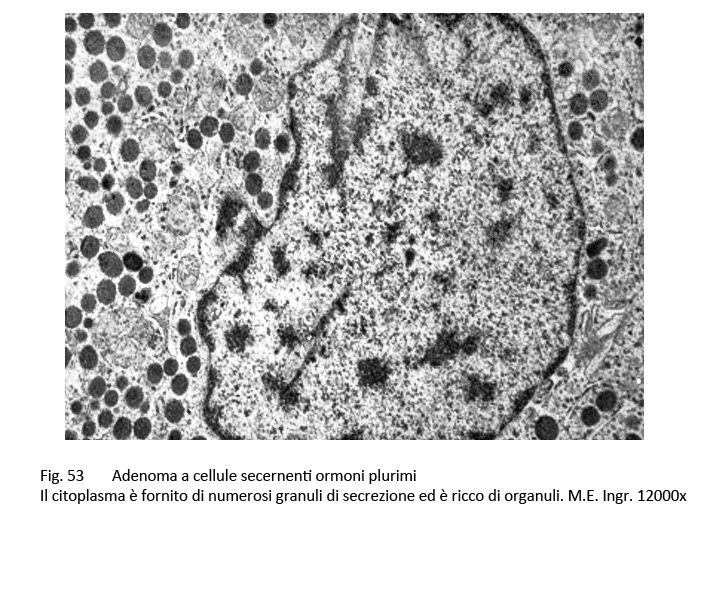 fig.54
fig.54 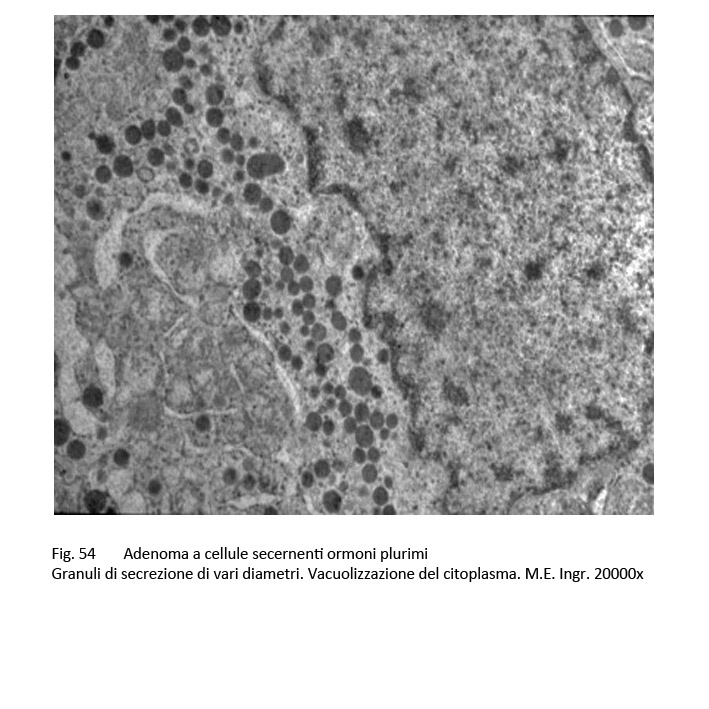 fig.55
fig.55 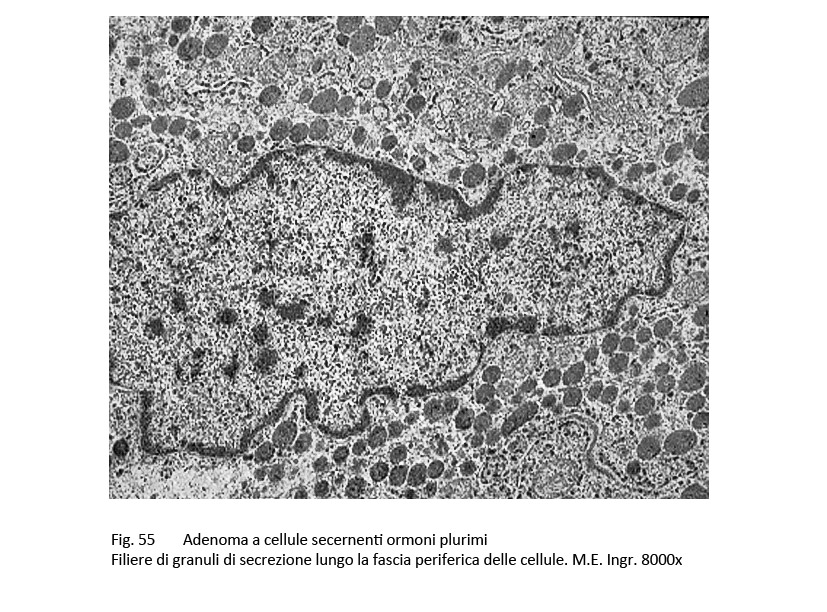
fig.56 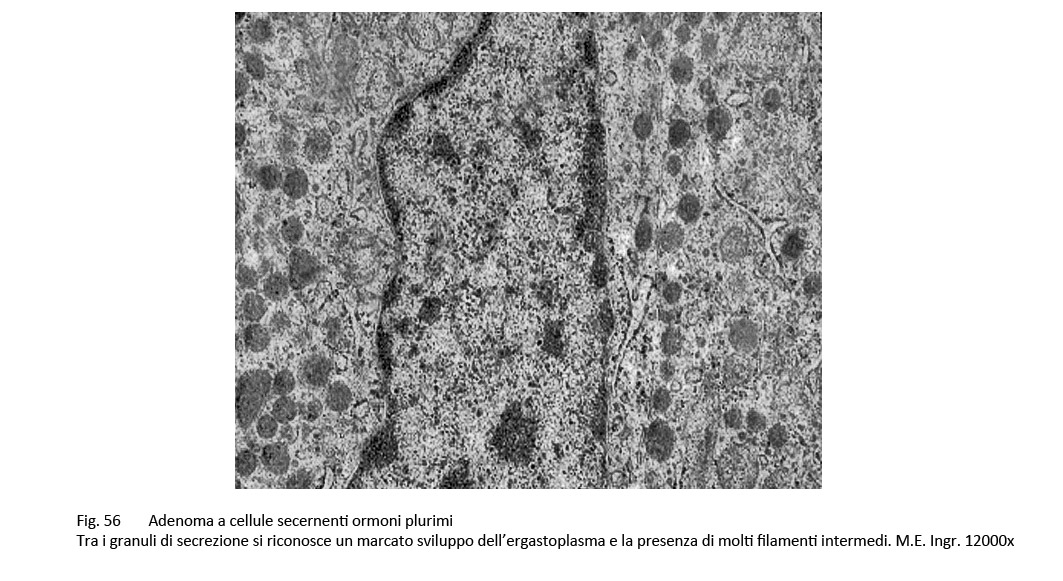 fig.57
fig.57 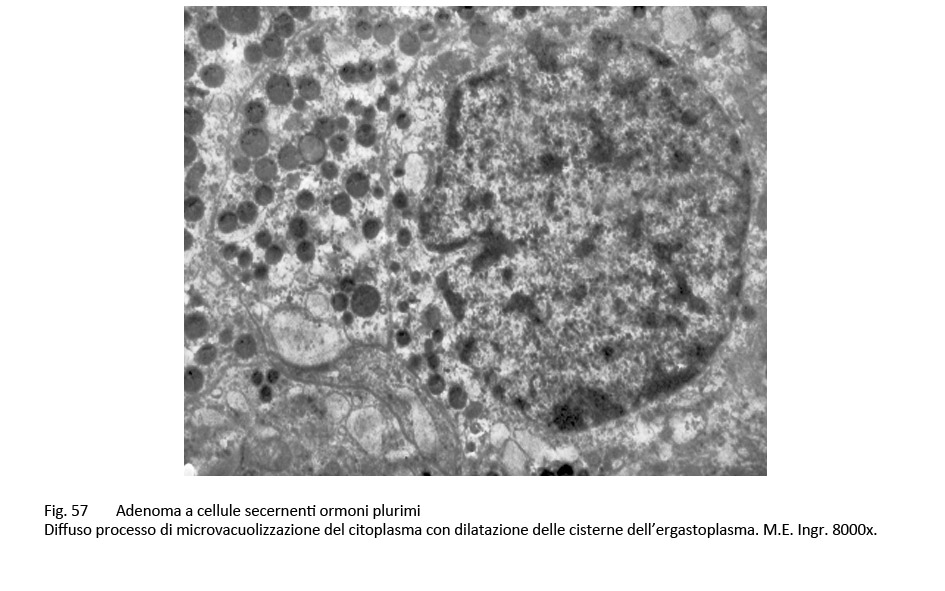
Le indagini di immunoistochimica evidenziano una immunoespressività non solo per l’ormone GH, ma anche TSH, FSH – LH, PRL.
L’adenoma pluriormonale tipo II mostra i caratteri istopatologici, citologici ed ultrastrutturale dell’adenoma gonadotropo.
Le indagini di immunoistochimica hanno svelato la esistenza di indici di immunoespressività non solo per FSH, LH, ma anche per PRL, TSH.
Questo adenoma è molto raro e viene considerato un sottotipo di adenoma pluri-ormonale (WHO). Al microscopio luce evidenzia un micro-architettura compatta, diffusa e/o sinusoidale; le cellule che lo compongono sono di media o grossa taglia e hanno un profilo allungato, polare. Il citoplasma è cospicuo, è cromofobo e il nucleo è eucromatinico, voluminoso con nucleolo preminente.
Al microscopio elettronico, il citoplasma è sede di una ricca componente di ergastoplasma e di un notevole sviluppo dell’apparato del Golgi; a questa si aggiungono granuli di secrezione di piccole dimensioni tra 100-200 nm, raccolti preferenzialmente lungo la fascia periferica del corpo cellulare. Le metodiche di immunoistochimica hanno permesso di scoprire la capacità di questa popolazione cellulare di secernere ormoni plurimi; sono possibili diverse combinazioni ormonali, ma più frequentemente si reperta una debole immunoespressività per GH, PRL, TSH. Il decorso anatomo-clinico di questo adenoma si differenzia da quello degli altri adenomi pluriormonali; questa neoformazione si accresce rapidamente con modalità di tipo infiltrativo e quasi con invasione da parte del tumore nelle strutture tissutali circostanti.
Indagini di immunoistochimica correlate a reperti istopatologici hanno permesso di tracciare delle linee di tendenza prognostica circa eventuali sviluppi di malignità potenziale. E’ stata così coniata la dizione di adenoma atipico nell’intento di identificare una lesione neoplastica che si trovi sul piano morfologico e su quello biologico come manifestazione intermedia tra l’adenoma e il carcinoma. La diagnosi richiede la convergenza di risultati ottenuti dal quadro clinico, dalla diagnostica per immagini, dalla istopatologia e dalla immunoistochimica.
Secondo il W.H.O. (2004) i criteri morfologici per una diagnosi di adenoma atipico comprendono: una elevata immunoespressività per la p53; un indice proliferativo MIB-1 molto alto, una attività mitotica cospicua e una citomorfologia atipica. La loro crescita è rapida, acquisiscono i caratteri dei macroadenomi, sono aggressivi ed infiltranti le strutture circostanti.
Questi caratteri di atipia possono essere acquisiti da tutti i tipi di adenomi, ma con maggior frequenza essi sono appannaggio degli adenomi nulli o dell’adenoma GH e dell’adenoma silente ACTH.

